Introducción
La vesícula biliar (VB) es una víscera hueca que tiene por función almacenar y liberar la bilis, contribuyendo a los procesos digestivos. La pared de la VB está conformada por la mucosa, la lámina propia, una capa muscular, el tejido conjuntivo perimuscular y la serosa (o peritoneo visceral), pero a diferencia de la mayoría de los otros órganos huecos, no posee capa submucosa. Está íntimamente adherida a parte de los segmentos IV y V del hígado, y en ella se pueden considerar dos superficies distintas, la superficie hepática que no tiene revestimiento peritoneal, y la superficie peritoneal, que está cubierta por peritoneo visceral. Esta diferencia representa una variabilidad en la biología tumoral, cuando el cáncer se origina en la cara peritoneal o en la cara hepática. La irrigación depende de la arteria cística, que proviene la mayoría de las veces de la arteria hepática derecha y el drenaje venoso se realiza a través del lecho hepático o de la vena cística, que drena hacia el sistema portal derecho 1,2.
El cáncer de la vesícula biliar (CVB), fue descrito por primera vez en 1777 por el médico austriaco Maximilian Stoll y su diagnóstico generalmente se realiza de forma incidental durante el estudio de las piezas quirúrgicas o cuando la enfermedad está avanzada y se expresa por su diseminación. A nivel mundial corresponde a la neoplasia más común de las vías biliares, y su prevalencia varía de acuerdo a la región geográfica, presentando una de las mayores incidencias en la región andina 3,4.
El 60 % se localiza en el fondo de la vesícula, el 30 % en el cuerpo y el 10 % en el cuello. Más del 90 % corresponden a adenocarcinomas y el restante 10 % a variedades como carcinoma de células escamosas, de células pequeñas, de tipo neuroendocrino, melanoma y linfoma. También se han informado neoplasias de tipo metastásico en la VB 2. En general, el pronóstico es malo, con una sobrevida a cinco años de tan solo el 10 % para los tumores avanzados 5,6. Cuando los tumores son diagnosticados en una etapa temprana, se ha observado una sobrevida hasta del 90 % 7.
Epidemiología
De acuerdo con la International Agency for Research on Cancer (IARC), la base de datos Globocan 2018 mostró que el cáncer de vesícula biliar fue responsable del 1,7 % de las muertes por cáncer a nivel mundial, y se presentaron 220.000 nuevos casos (1,3 %), ocupando el puesto número 20 en cuanto a nuevos casos y el número 17 en cuanto a mortalidad. La mayor incidencia ocurrió en la región Melanesia, seguido de sur América y de Asia oriental, y la mortalidad ocurrió con mayor frecuencia en Melanesia, Asia oriental y Sudamérica. América del Sur ocupa globalmente el tercer lugar en cuanto a incidencia, mortalidad y prevalencia a cinco años (Figura 1) 8,9.
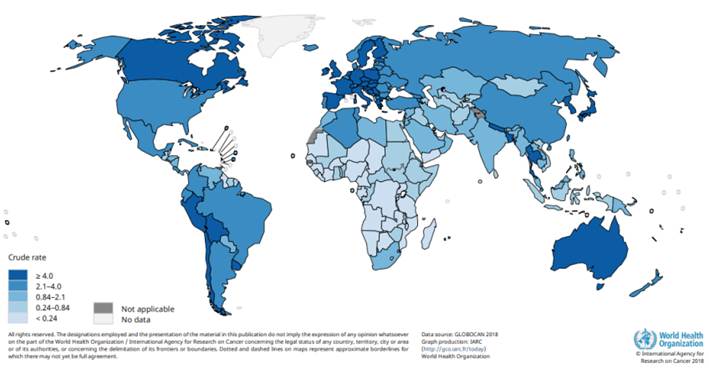
Tomado de Ferlay J, Ervik M, Lam F. Global Cancer Observatory: Cancer Today. Lyon, France: International Agency for Research on Cancer 2018. (9). Disponible en: https://gco.iarc.fr/today/home
Figura 1. Tasas crudas de incidencia de cáncer de vesícula biliar estimadas en 2018.
A nivel mundial, las tasas de incidencia estandarizada por edad más altas de CVB se observan en Bolivia, Chile, Bangladesh, Nepal, Corea del Sur y Perú. Las tasas más bajas de CVB se observan en países con altos recursos económicos y altos porcentajes de personas de ascendencia europea como Estados Unidos, Australia, Canadá, Reino Unido y Nueva Zelanda 10.
En Sudamérica, para el año 2018 se informaron 15.114 nuevos casos de CVB y 11.097 muertes relacionadas con ese diagnóstico. Las tasas estandarizadas por edad de incidencia y mortalidad presentan una variación geográfica sorprendente, siendo más altas en Bolivia (14,0 y 10,6 por 100.000 habitantes respectivamente), Chile (9,3 y 5,4 por 100.000 habitantes), en donde el CVB es la segunda causa más frecuente de muerte por cáncer en mujeres, y Perú (4,8 y 3,1 por 100.000 habitantes). Incluso, la mortalidad dentro de cada país, varia de forma importante al evaluar las diferentes regiones 11.
En diversos estudios realizados en Colombia, se ha encontrado una prevalencia de entre el 1,6-3 % de adenocarcinoma en especímenes quirúrgicos. Se encuentra más frecuentemente en las colecistectomías abiertas, en hasta un 3 %, comparado con la cirugía laparoscópica con un 0,3-1 %, independiente del diagnóstico prequirúrgico 12. Esto puede deberse a la necesidad de realizar cirugía abierta por los hallazgos ecográficos o conversión a la misma ante la dificultad técnica en casos avanzados.
Habitualmente, el mayor porcentaje de diagnósticos se realizan de forma incidental mediante el estudio histopatológico. En un estudio realizado en Colombia, se encontró un porcentaje de cáncer insospechado de vesícula biliar (CIVB) del 0,078 % en una cohorte de 2562 pacientes llevados a colecistectomía laparoscópica electiva en un periodo de 2 años 13. Otro estudio realizado sobre 40 pacientes con CVB, encontró un 37,5 % de casos no sospechados preoperatoriamente 14.
Factores de riesgo
Dentro de los múltiples factores asociados al cáncer de vesícula biliar, se han mencionado: el género, la ubicación geográfica, la etnia, anomalías congénitas del desarrollo, obesidad, antecedentes personales o familiares de cálculos biliares, infecciones crónicas y alteraciones genéticas (Tabla 1). La mayoría del CVB se diagnostica en estadios avanzados debido a su carácter asintomático inicial y a su rápida aparición de metástasis 10.
Tabla 1. Factores de riesgo para desarrollar cáncer de vesícula.
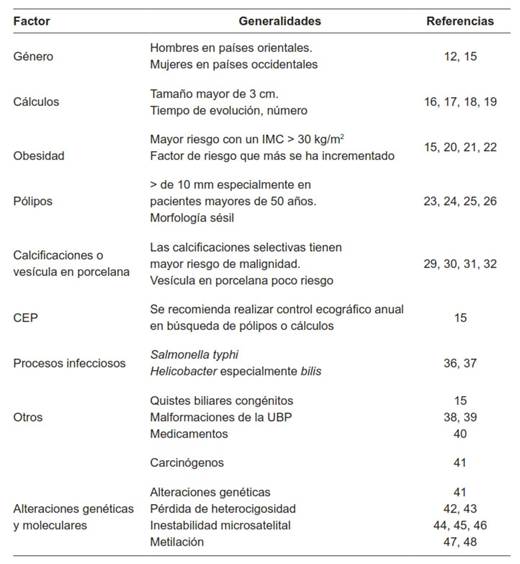
IMC: índice de masa corporal
CEP: Colangitis esclerosante primaria
UBP: Unión biliopancreática
Sexo. En los países de oriente, el cáncer de vesícula muestra un mayor compromiso en el sexo masculino, mientras que, en occidente, la relación mujer/hombre es de aproximadamente 2-6/1. Se han relacionado diversos factores, como el hecho de que la colelitiasis es más frecuente en mujeres que en hombres, y se ha implicado la multiparidad y los efectos hormonales, dado que los estrógenos favorecen la saturación de colesterol en la bilis, lo que aumenta el riesgo de formación de cálculos biliares 12,15. Aunque el papel de los receptores de estrógenos y la expresión del receptor de progesterona en el CVB no es significativamente diferente entre hombres y mujeres, la coexpresión de los dos receptores es más alta en las mujeres con CVB en comparación con la de los hombres 12.
Cálculos biliares. La colelitiasis es una enfermedad muy común, que puede estar presente hasta en el 20 % de la población. Se considera que hasta un 80 % de los pacientes pueden ser asintomáticos a lo largo de la vida, aunque anualmente entre el 2 - 3 % de los pacientes puede volverse sintomáticos y hasta el 10 % a cinco años 16. La sobresaturación del colesterol de la bilis, la nucleación acelerada de los cristales de colesterol y la alteración de la motilidad de la vesícula biliar, son factores que aumentan de forma independiente el riesgo de colelitiasis y, por lo tanto, de CVB. En diversos estudios se ha identificado la presencia de hasta el 88 % de colelitiasis en pacientes que presentaron dicha patología neoplásica. Sin embargo, de los pacientes que tienen diagnóstico de colelitiasis, solo entre el 0,3 - 3 % llegan a desarrollar cáncer 17.
En un artículo clásico de hace casi 40 años, se presentó un estudio de casos y controles, en el que se evaluaron 81 pacientes con CVB, encontrando que quienes tenían cálculos con diámetros de 2,0-2,9 cm tenían un riesgo 2,4 veces mayor de desarrollar cáncer, mientras que aquellos con cálculos de 3 cm o más, tenían un riesgo 10,1 veces mayor, por lo que recomendaban que aquellos pacientes con cálculos de más de 3 cm deberían ser llevados a colecistectomía, aunque estuvieran asintomáticos 18.
Debido a los avances tanto en los métodos diagnósticos como terapéuticos y a las mejoras en los sistemas de salud, hoy día es poco frecuente ver en nuestro país y en gran parte del mundo pacientes con cálculos de tal tamaño, de hecho, no se encuentran estudios recientes que evalúen el tamaño de los cálculos en patología vesicular. Independiente del tamaño de los cálculos, otro estudio encontró que la colelitiasis fue el factor de riesgo más fuerte para el CVB (RR 4,9, IC95% 3,3 - 7,4), 19. El CVB se ha relacionado más comúnmente con los cálculos de colesterol que con los cálculos de pigmentos, así como con el número, volumen y peso de los cálculos. Algunos autores le dan más importancia al tiempo de duración de la colelitiasis 16.
Obesidad. En un metaanálisis de 20 estudios, se encontró que las personas con un índice de masa corporal (IMC) > 30 kg/m2, tienen un mayor riesgo de desarrollar cáncer de vesícula biliar, mientras que los pacientes con sobrepeso y obesidad tienen un RR de 1,15 y 1,66, respectivamente. Como posible causa, se ha mencionado el aumento en la concentración de hormonas, como estrógeno o insulina, lo que incrementa la formación de cálculos biliares. Esta asociación es más fuerte entre las mujeres que entre los hombres, quizás porque las mujeres ya tienen un nivel más alto de estrógeno 15,20.
La IARC revisó la evidencia relacionada con la obesidad y cáncer, evaluando el riesgo para cada tipo de cáncer y la fortaleza de la evidencia. Para el cáncer de la vesícula biliar, la fuerza de la evidencia en humanos fue calificada como suficiente y el riesgo relativo de la más alta categoría del IMC comparada con el normal fue de 1,3 (IC95% 1,2-1,4), similar al riesgo para cáncer de colon y recto 21. Posiblemente la obesidad corresponde al factor de riesgo que más está aumentando en CVB y también se le atribuye la leve tendencia al aumento de la mortalidad, observado en algunos países industrializados 22.
Pólipos de vesícula biliar. Las imágenes de pólipos vesiculares pueden corresponder en su mayoría a patología benigna como pólipos de colesterol, colesterolosis, adenomiomas, adenomiomatosis o pólipos inflamatorios, y solo un pequeño porcentaje de pólipos vesiculares son adenomatosos con potencial maligno 17. En un estudio se encontró que los pólipos de menos de cinco mm tienen una probabilidad de malignidad prácticamente nula, y que los pólipos mayores de 10 mm (grado de evidencia moderado), especialmente en los pacientes mayores de 50 años (nivel de evidencia bajo), tienen más riesgo de cáncer, con una prevalencia de malignidad de hasta el 88 % 23.
Algunos autores consideran que el riesgo no depende del tamaño del pólipo por sí solo, sino además de la edad del paciente, siendo más alto en los mayores de 50 años, especialmente si además coexiste la presencia de cálculos biliares que presenten crecimiento durante el seguimiento ecográfico 24. Otros estudios han identificado como factor de riesgo independiente para desarrollar CVB, la morfología sésil del pólipo, con un aumento del riesgo entre 7,0 (IC95% 2,4-23,9) y 7,3 (IC95% 4,18-12,8) 25.
En una revisión sistemática realizada en 2015, en la que se evaluaron 54 artículos, con 8701 pacientes llevados a cirugía por pólipos vesiculares, se encontró que los pólipos benignos tenían muchas más probabilidades de tener un tamaño menor de 10 mm mientras que los adenomas y pólipos malignos fueron más frecuentemente de 10 mm de tamaño. Los pólipos solitarios fueron malignos en el 69,5 % y los pólipos sésiles fueron malignos en el 59 % de los casos 26. Por todo lo anterior, se recomienda llevar a colecistectomía a los pacientes con pólipos mayores de 10 mm.
Calcificaciones o vesícula en porcelana. Desde 1890 se ha informado la existencia de calcificaciones en la pared vesicular, que en términos generales es conocida como vesícula en porcelana, la cual se puede observar entre el 0,6-0,8 % de las colecistectomías 27. Uno de los estudios clásicos al respecto, y de los primeros en que se mencionó la vesícula en porcelana como factor de riesgo para el desarrollo de CVB, fue publicado en 1966 y en él se informó la presencia de neoplasia en 22 de 100 pacientes en quienes se encontró vesícula biliar en porcelana 28.
Las calcificaciones de la vesícula biliar se clasifican en intramurales o selectivas de la mucosa, sin encontrar relación de las primeras con casos de adenocarcinoma, mientras que las calcificaciones selectivas de la mucosa se relacionan con una tasa de malignidad del 7 %. Aunque en algunos estudios no se han encontrado casos de calcificación entre los pacientes que presentan el diagnóstico de adenocarcinoma, una revisión reciente de la literatura, encontró un riesgo del 6 % en aquellos pacientes con calcificaciones de la VB, frente al 1 % en los pacientes que no las presentaron 29,30.
Actualmente se estima que la vesícula en porcelana tiene un escaso aumento del riesgo de carcinoma, mucho menor al estimado en los estudios de décadas pasadas y se recomienda evaluar la indicación de colecistectomía de acuerdo a los síntomas, la sospecha de carcinoma y el riesgo quirúrgico del paciente 31,32.
Colangitis esclerosante primaria (CEP). Tiene una incidencia de 1-16/100.000 personas y predomina en el sexo masculino. Se cree que, en esta enfermedad autoinmune, los conductos biliares intra y extrahepáticos son atacados por el sistema inmunológico, sufriendo inflamación, cicatrización y obstrucción, que junto con la éstasis biliar, pueden favorecer la aparición de cálculos biliares y CVB 33. Se han mencionado como factores de riesgo (bajo nivel de evidencia) la presencia de colelitiasis, síndrome de poliposis gastrointestinal y pólipo único 34. Por lo tanto, en los pacientes con CEP, se recomienda realizar un control ecográfico anual en búsqueda de estas alteraciones 15.
En un estudio de 286 pacientes con CEP, se encontró mediante estudios imagenológicos que, el 6 % de los pacientes tenían masas vesiculares, de las cuales el 56 % correspondieron a CVB, por lo cual la American Association for the Study of Liver Diseases y la European Association for the Study of the Liver recomiendan la colecistectomía en los pacientes con CEP y pólipos asociados 35.
Procesos infecciosos. En un metaanálisis que incluyó 17 trabajos relacionados con CVB e infección por Salmonella typhi, la mayoría de los estudios realizados en el sur de Asia (India y China), se encontró un OR general para el estado de portador crónico de S. typhi (detección de los niveles de anticuerpos contra S. typhi) de 4,28 (IC95% 1,84-9,96). La asociación fue más evidente cuando se realizó con grupos de control que no tenían colelitiasis (OR: 5,86; IC95% 3,84-8,95; valor de p<0,01) que en aquellos con colelitiasis (OR: 2,71; IC95% 1,92-3,83; valor de p<0,01). No se encontró asociación significativa entre el solo hecho de haber tenido la infección (antecedente) y la aparición de CVB (OR: 3,33; IC95% 0,77-14,38; valor de p=0,11).
Por lo anterior, cuando se detectan grupos poblacionales con infección tifoidea crónica, se recomienda tratar a la población con antibióticos, realizar vacunación y mejoras sanitarias. Igualmente se debe realizar el seguimiento ecográfico y evaluar la opción de la colecistectomía profiláctica 36.
Mediante técnicas inmunohistoquímicas y moleculares se han detectado citotoxinas y proteínas de superficie derivadas de Helicobacter, especialmente del tipo bilis, que causan infección del epitelio biliar y que se han implicado dentro de las patogenias del CVB, en una asociación todavía no muy bien aclarada 37.
Otros factores de riesgo
Quistes biliares congénitos. Son más frecuentes en mujeres y en las poblaciones asiáticas, lo cual coincide con los grupos de mayor riesgo de cáncer de vesícula biliar. Aunque la mayoría de los casos se tratan quirúrgicamente en la infancia, alrededor del 20 % de los casos solo se diagnostican en la vida adulta mediante ecografía, tomografía computarizada (TC) o resonancia nuclear magnética (RNM). Se ha observado una incidencia de CVB en el 2,5-28 % de los pacientes con quistes biliares 15.
Malformaciones en la unión biliopancreática. Estas malformaciones pueden causar el reflujo del líquido pancreático en la vía biliar, aumentando el riesgo de malignidad del tracto biliar. En la mayoría de los pacientes, pero no en todos, se observa una marcada elevación de los niveles de amilasa, y el diagnóstico se puede realizar mediante la colangioresonancia. El CVB asociado a estas malformaciones ocurre a una edad más temprana que la observada para otras causas, pero más tardíamente que el colangiocarcinoma, y tienen una menor incidencia de colelitiasis asociada 38. Esta patología ha sido reportada con mucha mayor frecuencia en la población asiática, donde se ha estimado que aumenta hasta 200 veces el riesgo de cáncer de vesícula, por lo cual se recomienda realizar colecistectomía una vez se diagnostica esta anomalía. En Estados Unidos, un estudio multicéntrico evalúo retrospectivamente los estudios imagenológicos de pacientes con CVB, encontrando la unión biliopancreática anómala en el 8 % de los casos, sin que este hallazgo se hubiera descrito en la lectura inicial, por lo que se considera que esta anomalía, se debe buscar también en los países occidentales 39.
Medicamentos. Aunque la asociación entre los anticonceptivos orales y el CVB no es clara, se ha mencionado que las mujeres posmenopáusicas que reciben terapia hormonal con estrógeno o con estrógeno-progesterona tienen un mayor riesgo de formación de cálculos biliares y de desarrollar CVB. Algunos estudios han sugerido que la terapia de reemplazo de estrógenos transdérmicos presenta un riesgo menor que la terapia oral 40. Otros medicamentos que se han relacionado con el CVB son la metildopa y la isoniazida 15.
Carcinógenos. Se ha observado mayor riesgo de CVB en trabajadores de plantas de caucho, fábricas textiles, o personas expuestas a las nitrosaminas y aflatoxinas. En algunos estudios, también se ha relacionado el tabaquismo y la ingesta elevada de alcohol con el CVB 41
Alteraciones genéticas y moleculares. Como otras neoplasias, el cáncer de vesícula biliar tiene un origen multifactorial, en cuya etiología se han implicado diversas alteraciones genéticas. Algunas de las investigaciones han logrado determinar anomalías en los genes supresores de tumores, oncogenes y genes de reparación del ADN, así como la presencia de inestabilidad microsatelital y alteraciones epigenéticas causadas principalmente por metilación aberrante del promotor de áreas de genes 41.
Alteraciones genéticas: Por métodos de bajo rendimiento, se ha logrado detectar mutaciones en el codón 12 de los genes KRAS en pacientes de India, Chile y Japón, mutación y deleción en el gen INK4A en pacientes de Japón y Chile, mutación en el gen ADNmt D310 en pacientes de Chile y mutación y sobrexpresión en el gen TP53 de muestras obtenidas en Grecia, Japón y Chile. Mediante métodos de alto rendimiento se han detectado alteraciones principalmente de tipo mutación, fusión y amplificación de genes como PIK3CA, KRAS, CTNNB1, TP53, FGF10, EGFR, ERBB2, ERBB3, PTEN, ARID2 y MLL2 41.
Pérdida de heterocigosidad: Algunos estudios han demostrado perdida de la heterocigosidad (LOH, por sus siglas en inglés) en los pacientes con CVB, debido a pérdidas alélicas heterocigóticas que comprometen hasta 18 regiones cromosómicas diferentes. La LOH es una alteración genética común en el genoma del cáncer y se relaciona con la pérdida de un alelo, deleción heterocigótica de uno de los dos alelos o duplicación de un cromosoma o región cromosómica materna o paterna 42. En CVB se han detectado alteraciones relacionadas con múltiples pérdidas alélicas en algunas regiones de los cromosomas 3p, 8p, 9q y 22q que contienen los genes supresores de tumores 43.
Inestabilidad microsatelital: La deficiencia en la reparación de errores de emparejamiento del ADN (MMR por sus siglas en inglés) es una causa importante de inestabilidad genómica relacionada con el cáncer, que lleva a la acumulación de numerosas mutaciones predominantemente en secuencias inestables de microsatélites, un fenotipo conocido como inestabilidad microsatelital (MSI por sus siglas en ingles). Con mayor frecuencia, el CVB muestra fenotipos de adenocarcinoma, y la frecuencia de MSI inducida por deficiencia de MMR en el cáncer de vesícula biliar en el mundo occidental es baja, pero teniendo en cuenta que los tumores con MSI generalmente responden bien a algunos tipos de inmunoterapia, se debe considerar el análisis de MSI en este tipo de tumores 44. La MSI se ha observado hasta en el 10 % de CVB. En un estudio chileno buscaron las áreas contiguas a los tumores con MSI y encontraron la alteración en el 33 % de áreas con metaplasia intestinal y en el 83 % de áreas con displasias, por lo que se considera que la MSI está presente desde las primeras etapas del proceso carcinogénico, aunque solo se observó un subgrupo de pacientes 45,46.
Metilación: Las alteraciones epigenéticas incluyen la metilación del ADN, la modificación de histonas, la remodelación de la cromatina y la recientemente descubierta interferencia del ARN (involucrada en el silenciamiento postranscripcional), la expresión génica aberrante, puede causar una represión transcripcional que se ha visto relacionada con la carcinogénesis 47.
La hipermetilación en las regiones promotoras de genes, es un mecanismo epigenético común en la inactivación de genes supresores de tumores. Los patrones de metilación del ADN de los pacientes con CVB pueden servir como biomarcadores para el diagnóstico y pronóstico de estos pacientes. En un estudio se encontró que la metilación de los genesp73, MGMT y DCL1se asoció significativamente con la supervivencia de los pacientes con cáncer de vesícula biliar. El análisis multivariado identificó al genMGMTcomo un factor pronóstico independiente para la supervivencia 48.
Otro estudio reciente demostró que la metilación del promotor de genes específicos comoCDH1, CDKN2A-p16, REPRIMO y UCHL1(o PGP9,5) tiene un papel importante en la carcinogénesis de la vesícula biliar. Otros trabajos han mostrado un patrón de metilación variable de varios genes relacionados con carcinoma de vesícula biliar. Basados en estas publicaciones, se ha considerado que el estudio de la metilación de genes puede ser utilizado como marcadores de respuesta a la quimioterapia o la terapia hormonal, y puede en un futuro ayudar en la realización de un diagnóstico precoz, debido a que el cambio de metilación precede frecuentemente a la aparición de tumores 47.
Diagnóstico
El diagnóstico del CVB se puede hacer en cuatro escenarios: sospecha preoperatoria en las imágenes de la vesícula biliar (ecografía, TC o RNM); diagnóstico intraoperatorio (hallazgos sugestivos o conclusivos); diagnóstico posoperatorio (en el reporte de patología de una colecistectomía por colelitiasis); o en los casos avanzados por diseminación (ictericia por invasión a la vía biliar, ascitis por carcinomatosis, metástasis hepáticas) 30.
El diagnóstico preoperatorio del CVB es infrecuente, y generalmente se realiza en casos avanzados. No existe un hallazgo clínico patognomónico ni alteraciones en exámenes de laboratorio o imagenológicos que hagan sospechar de forma inequívoca el CVB. La aparición de ictericia junto con el hallazgo escanográfico de masas abdominales, o de engrosamiento focal o calcificaciones de la mucosa de la vesícula biliar, deben hacer sospechar una neoplasia maligna subyacente y, por lo tanto, obligan a realizar estudios imagenológicos de alta resolución, además de un hemograma completo, pruebas de función hepática, Ca 19-9 y antígeno carcinoembrionario (CEA), igualmente se debe evaluar la posibilidad de realizar una laparoscopia de estadificación de acuerdo con los resultados de los exámenes previamente mencionados 30.
La ecografía abdominal debe hacer sospechar un CVB cuando hay engrosamiento focal e irregular de la pared de la vesícula o cuando el espesor es mayor de 10 mm. La TC y la RNM son más útiles para evaluar la extensión de la enfermedad o cuando hay masas vesiculares de buen tamaño 49 (Figuras 2 y 3). Cuando el diagnóstico se sospecha de forma intraoperatoria, el cirujano se enfrenta a una situación compleja en la que tenía programada solo una colecistectomía, y que debe ser analizada caso a caso, debido a las implicaciones de una cirugía mayor en un paciente no informado de la misma y con riesgo de morbilidad y mortalidad. Si la patología confirma el diagnóstico, se realizará la estadificación y toma de decisiones según la misma 50.
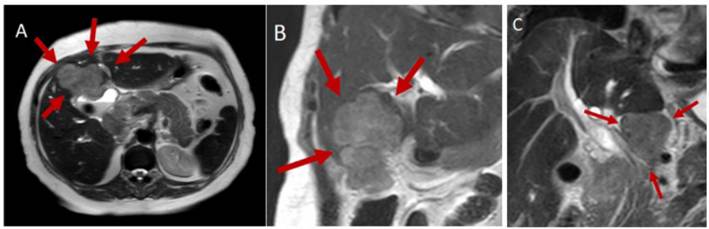
Figura 2. Resonancia magnética que muestra gran masa en la vesícula biliar con infiltración al hígado (A y B) y conglomerado ganglionar celíaco (C).
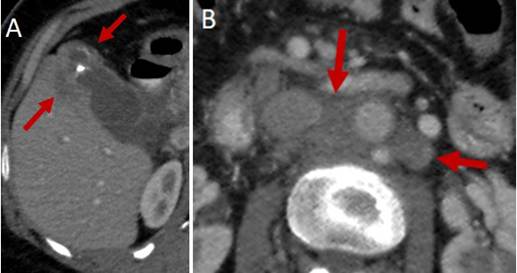
Figura 3. Tomografía axial que muestra masa en el fondo de la vesícula (A) y compromiso ganglionar para aórtico (B).
Se considera que existe un submuestreo histopatológico de los especímenes quirúrgicos, que ha llevado a un subdiagnóstico y una subestadificación, puesto que a nivel mundial no hay consenso para la realización de análisis patológicos uniformes. Incluso, en muchos países no están estandarizados los exámenes microscópicos de rutina 50,51.
Un consenso de expertos en CVB realizado en 2015 recomendó que, particularmente en áreas de alta incidencia, todas las muestras deben ser analizadas haciendo el estudio histológico de por lo menos tres secciones aleatorias y del margen del conducto cístico. Ante el hallazgo inicial de displasia de alto grado, colecistitis hialinizante o pólipos neoplásicos, se debe realizar el mapeo completo de la vesícula biliar para estadificar con precisión cualquier neoplasia invasiva asociada. Cuando se ha comprobado la presencia de cáncer, se deben tomar muestras extensas para determinar los factores pronósticos como la profundidad microscópica de la invasión tumoral, el compromiso del margen del conducto cístico, y el compromiso de la serosa o del tejido hepático 52.
Estadificación
La pared de la vesícula biliar está conformada por la mucosa, una capa de músculo liso, tejido conectivo perimuscular y serosa. La placa cística se caracteriza por carecer de serosa, de forma tal que la vesícula se adhiere al tejido conectivo del hígado, mediante el tejido conectivo perimuscular. La estadificación del tumor (T), depende de la profundidad de la invasión, es decir de la penetración del tumor en la pared vesicular, la invasión al hígado, el compromiso de los órganos adyacentes, de la arteria hepática o la vena porta 30.
Cuando el compromiso neoplásico afecta la lámina propia, respetando la capa muscular, corresponde a un estadio T1a y no requiere intervenciones adicionales a la simple colecistectomía. Ante la presencia de estadios T1b o más, se deben realizar estudios imagenológicos de estadificación clínica, que deben incluir imágenes de alta resolución de tórax, abdomen y pelvis, en busca de linfadenopatías regionales o metástasis a distancia (Figuras 2, 3 y 4), además se debe considerar la realización de una laparoscopia (Figura 5) 30. La estadificación del CVB se muestra en la Tabla 2 53.
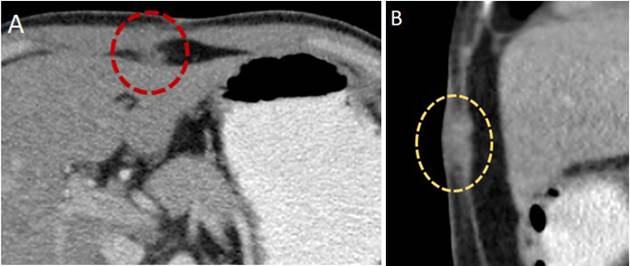
Figura 4. Tomografía axial que muestra siembras tumorales en la pared abdominal y en el trayecto de los puertos, en paciente con antecedente de colecistectomía vía laparoscópica y hallazgo de CIVB. Siembra en el ligamento redondo, corte axial (A). Siembra en los músculos de pared abdominal, corte sagital (B).
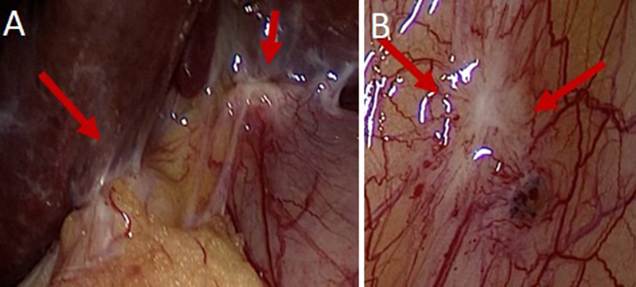
Figura 5. Hallazgos laparoscópicos de compromiso peritoneal por cáncer de vesícula, dos meses después de colecistectomía vía laparoscópica por colelitiasis, con hallazgo inicial de CIVB. Siembras en el lecho quirúrgico (A) y siembra en el peritoneo parietal (B).
Tabla 2. Estadificación del American Joint Committee on Cancer Tumor-Ganglio-Metástasis (TNM por sus siglas en inglés) para carcinoma de vesícula biliar.

Imágenes
De acuerdo al consenso para el manejo de tumores de las vías biliares del grupo brasileño de tumores gastrointestinales, se considera que la RNM contrastada de abdomen y la CR son los principales exámenes para la estadificación de las neoplasias malignas del tracto biliar (nivel de evidencia II, recomendación fuerte a favor). De no ser posible, se debe contar por lo menos con una TC de abdomen (nivel de evidencia II, recomendación fuerte a favor). Se recomienda realizar además una tomografía torácica, y en casos seleccionados se puede utilizar la ultrasonografía endoscópica (USE), para la estadificación del tumor primario y la evaluación de los ganglios linfáticos regionales. Otro examen a realizar en casos seleccionados es el PET-TC, especialmente para evaluar la posibilidad de enfermedad a distancia 54.
Ultrasonografía endoscópica. Una revisión sistemática encontró que la USE tiene una mayor sensibilidad (67-86 %) y especificidad (84-91 %) para el diagnóstico de pólipos malignos que la ecografía convencional 55. Otros estudios no han encontrado buenos resultados cuando se trata de pólipos de 10 mm de diámetro o menores (80 % vs. 72 %), por lo que se considera un método diagnóstico útil en pólipos de más de 1 cm 56. La evaluación del flujo Doppler en la USE se ha empleado para intentar mejorar la precisión diagnóstica. En un estudio de 115 pacientes sometidos a colecistectomía se encontró que la presencia de un fuerte flujo Doppler color en los pólipos, puede ayudar a predecir la presencia de neoplasia 57.
Tratamiento
En CVB, la mayoría de los casos son avanzados al momento del diagnóstico. Se ha observado que el 25 % de los pacientes se someten a tratamientos potencialmente curativos como la cirugía y solo el 16 % sobreviven por más de cinco años, dependiendo del estadio tumoral. Como el CVB es poco común en muchos países, algunos estudios lo incluyen junto con las neoplasias malignas de las vías biliares (colangiocarcinoma), sin embargo, la evidencia actual muestra que los abordajes quirúrgicos, la resección sin márgenes y la supervivencia a largo plazo, difieren completamente entre estos tipos de tumor, por lo que se considera que el CVB se debe evaluar y tratar como una entidad separada 52.
Para los tumores in situ o aquellos que comprometen solo hasta la lámina propia (T1a) es claro que no se requieren estudios adicionales o reintervención quirúrgica y la sobrevida llega a ser del 95 % a cinco años. Aunque algunos autores consideran que los estudios adicionales y la reintervención se debe realizar desde el estadio T1b en adelante, debido a un compromiso linfático del 16 % y una sobrevida cercana al 70 %, otros concluyen que, la simple colecistectomía es suficiente como terapia definitiva para este estadio, ya que no se observa una marcada diferencia en la sobrevida al realizar una reintervención quirúrgica (segmentectomía hepática 4b y 5 más linfadenectomía hiliar) en estos pacientes 58-60. Este es un punto en discusión en la literatura actual 61.
El termino de resección radical fue usado por primera vez en 1954 y se refiere a la combinación de resección hepática y disección de ganglios linfáticos 62. Un Consenso de expertos y las guías de la “National Comprehensive Cancer Network” recomiendan la resección oncológica extendida (ampliada) en los pacientes con estadios T1b, T2 y T3 que no tengan enfermedad diseminada. Esta cirugía incluye la resección de la fosa de la vesícula biliar (figura 6), la disección de los ganglios linfáticos regionales y la resección del colédoco en algunos pacientes seleccionados. Su objetivo es permitir la estadificación y, en el caso de reintervenciones (CIVB), tratar el cáncer residual, el cual se puede encontrar entre el 38,7-61 % de los pacientes sometidos a reintervención que, de no ser tratado, causa una diminución en la supervivencia semejante al de los estadios IV. En los pacientes que son llevados a reintervención sin hallazgos de cáncer residual, la tasa de supervivencia a cinco años es de hasta el 85 % 63.
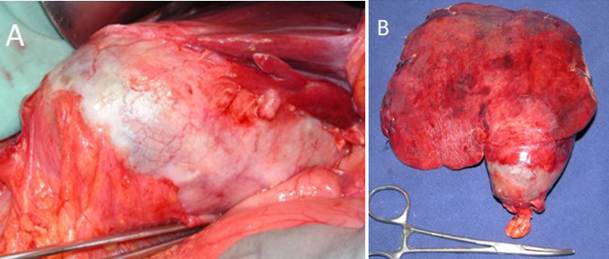
Figura 6. Carcinoma de vesícula biliar (A). Pieza quirúrgica incluyendo la vesícula y los segmentos 4b y 5 (B).
Los pacientes con CIVB deben ser evaluados para la realización de una cirugía radical. En los últimos años, se ha propuesto la vía laparoscópica para realizar las reintervenciones, con la obtención de resultados adecuados. Los pacientes clasificados como T4 generalmente se consideran irresecables 64. En los pacientes con hallazgo de CIVB, la extensión de la cirugía, debe incluir una resección parcial de los segmentos 4b y 5, con un margen de al menos tres cm a cada lado del lecho vesicular y la linfadenectomía, con resección de los ganglios del hilio hepático y de la arteria hepática (Figura 7), 65,66. Existe controversia, respecto a una resección más amplia, muchos autores incluyen los ganglios retropancreáticos y un muestreo ganglionar inter aortocavo, si algún ganglio en esta zona es positivo, se considera M1. Se deben resecar al menos seis ganglios linfáticos, aunque algunos estudios mencionan solo cuatro 67.
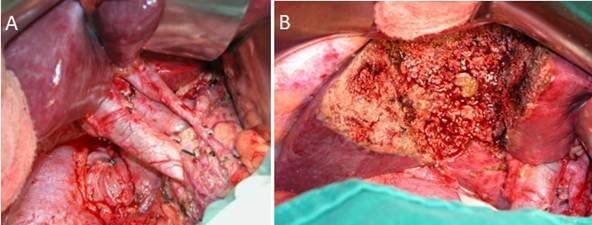
Figura 7. Resección radical por cáncer de vesícula biliar. Linfadenectomía hiliar (A) y resección hepática de los segmentos 4b y 5 (B).
La resección de la pared abdominal en los sitios de los puertos de la cirugía previa no se recomienda actualmente de forma rutinaria 68. Las experiencias a corto y mediano plazo, indican que los resultados pueden ser similares desde el punto de vista oncológico, con la resección laparoscópica o robótica, con un menor tiempo de hospitalización 69,70,71.
El tratamiento de pacientes con CVB en estadio avanzado sigue siendo controvertido. Se considera que la resección quirúrgica radical es el único tratamiento curativo posible, pero la misma se ve limitada, debido a la baja supervivencia, por esta razón, se ha explorado la aplicación y combinación de tratamientos, incluidos la radioterapia y la quimioterapia, con el fin de mejorar el pronóstico. Durante los últimos años, la cirugía radical en CVB ha progresado bastante, logrando una mejoría significativa de la tasa de supervivencia a largo plazo. En un grupo de 33 pacientes a quienes se les realizó cirugía radical extendida, se observó una tasa de supervivencia a 1 y 3 años del 46 % y del 23 % respectivamente, mientras que la tasa de supervivencia a un año en 20 pacientes a quienes no se le realizó resección fue sólo del 15 % 72. Otro estudio informó un tiempo medio de supervivencia de 26 meses, en 15 pacientes sometidos a resección radical, mientras que el de los pacientes que no se sometieron a resección fue de solo 10 meses 73.
En un estudio publicado en 2020, en el que se revisó la base de datos del programa de vigilancia, epidemiología y resultados finales (SEER, por sus siglas en inglés) de Estados Unidos entre 2004 y 2015, se evaluaron cuatro tipos diferentes de tratamientos para pacientes con CVB avanzado: cirugía, quimioterapia, cirugía más quimioterapia y sin cirugía/sin quimioterapia. Sobre un total de 288 pacientes en estadio III y 4239 pacientes en estadio IV del AJCC, se encontró que el tipo de tratamiento fue un factor de riesgo independiente para los pacientes con CVB avanzado. En ambos estadios, el tratamiento con cirugía y quimioterapia mejoró la sobrevida general y la sobrevida específica, observando además una mayor disminución después de realizar el emparejamiento por puntaje de propensión (PSM, por sus siglas en inglés), esto, teniendo en cuenta que la cirugía y quimioterapia no se utilizó en todos los casos 74. Sin embargo, es un estudio de base de datos, donde no hay información detallada sobre la extensión de la enfermedad y se requieren más estudios para aclarar las posibles indicaciones de cirugía en estados avanzados. Resultados adecuados con el uso de quimioterapia han sido informados, aunque con bajo número de pacientes 75.
Agentes terapéuticos dirigidos en el cáncer de vesícula biliar. El único tratamiento aprobado después de un ensayo clínico aleatorizado fase 3, es el esquema Gemcitabina-Cisplatino en casos de metástasis o localmente avanzados 76. No hay evidencia suficiente para otros tratamientos médicos, pero hay estudios en curso buscando evaluar otras moléculas, así como el papel de la terapia neoadyuvante y adyuvante en CVB. Actualmente hay un ensayo clínico aleatorizado en curso (NCT04559139), que busca evaluar el papel de la neoadyuvancia en pacientes que van a ser sometidos a cirugía de re-resección después de colecistectomía simple. Por otra parte, se ha identificado un subconjunto de pacientes con amplificación o mutación de HER2/neu (asociada también a neoplasias gástricas y de mama), en quienes se logra mejoría hasta en el 50 % de los casos, al darles tratamiento dirigido contra estas alteraciones 77.
Otros estudios indican que los pacientes sometidos a resección oncológica ampliada deben recibir una terapia adyuvante adecuada, para lograr una mejor supervivencia. Datos retrospectivos del Centro Nacional de Cáncer de Estados Unidos han evidenciado que la colecistectomía ampliada, asociada a la terapia adyuvante, mejora la supervivencia media en más del 50 % en comparación con la realización de solo la cirugía. La terapia adyuvante empleada más comúnmente se basa en el uso de gemcitabina o una fluoropirimidina (5-fluorouracilo o capecitabina) en combinación con un agente de platino (cisplatino u oxaliplatino), 78-80.
Se han presentado informes de análisis inmunológico, basados en la expresión de CD8 + TIL y PD-L1 considerándose como un factor predictor independiente de riesgo de CVB, por lo que se considera que, a futuro, la inmunoterapia puede jugar un importante papel en el tratamiento de estos pacientes 75.
Supervivencia en el cáncer de vesícula biliar
El estadio tumoral es considerado el factor más importante para predecir la supervivencia del paciente. Desafortunadamente, la mayoría de los pacientes con CVB son diagnosticados en etapas tardías, e incluso pueden desarrollar metástasis aun después de cirugías radicales. La supervivencia a cinco años reportada por Estados Unidos en estadio I fue de 65-85 %, estadio II 50 %, estadio III 20-25 % y estadio IV 6-15 % 81.
Con excepción del carcinoma in situ o del estado T1a, la supervivencia del cáncer de vesícula biliar es muy pobre. Datos de la Base Nacional de Datos de Cáncer y del Colegio Americano de Cirujanos muestran que incluso los cánceres en etapa temprana tienen una supervivencia limitada a 5 años (pT2 52 %). En cuanto a los pacientes con cáncer avanzado, aquellos tratados con colecistectomía radical y con terapia adyuvante en casos seleccionados apropiadamente, son quienes logran la mejor supervivencia a largo plazo 80,82.
Conclusiones
El CVB corresponde a la neoplasia más común del tracto biliar y a una de las patologías más frecuentes en nuestra región andina. A pesar del avance en los métodos diagnósticos, especialmente imagenológicos, su hallazgo continúa realizándose de forma incidental o más lamentable aún, en estadios avanzados de la enfermedad, lo que se relaciona con un alto índice de mortalidad.
Es de gran importancia realizar un seguimiento ecográfico de todos los pacientes con colelitiasis, pólipos vesiculares y de aquellos pacientes que tengan alguno de los factores de riesgo referidos en esta revisión. Siempre se debe evaluar el resultado de patología de cada paciente, teniendo en cuenta que hay una posibilidad de alrededor del 1 % de encontrar un cáncer de vesícula de manera incidental.
Consideramos relevante la estandarización de los análisis de las muestras patológicas, especialmente en lo relacionado con el mapeo por parte de los patólogos, en busca de estadios tempranos de CVB, que justifiquen la reintervención o el tratamiento complementario necesario para cada paciente.















