Introducción
Debido a que el cáncer de seno es una enfermedad asociada a una significativa tasa de morbilidad y mortalidad cuando se diagnostica en el período sintomático, se han hecho enormes esfuerzos orientados hacia la prevención primaria de esta enfermedad.
Basados en el concepto que los estrógenos son los promotores inmediatos del cáncer de seno 1, se ha desarrollado dos grandes estrategias farmacológicas endocrinas para reducir el riesgo de desarrollar cáncer de seno no hereditario. La primera estrategia mediante el bloqueo intracelular de los receptores de estrógenos a nivel mamario usando los moduladores selectivos de receptores de estrógenos, con el objetivo de evitar el efecto proliferativo de los estrógenos a nivel de las células mamarias. La segunda estrategia mediante el bloqueo de la síntesis de los estrógenos con los bloqueadores periféricos de la enzima aromatasa, con el objetivo de disminuir los niveles de estrógenos.
Los moduladores selectivos de los receptores estrogénicos (SERMs, por sus siglas en inglés) son antiestrógenos a nivel celular mamario y actúan uniéndose al receptor de estrógeno interfiriendo con la transcripción de genes inducidos por estrógeno implicados en la regulación de la proliferación celular. Algunos SERMs además de tener un efecto antiestrogénico a nivel mamario, tienen actividad estrogénica estimuladora sobre el endometrio uterino, los huesos y el hígado, como es el caso del tamoxifen.
Debido a la capacidad de los SERMs para tener efectos alternativos sobre varios tejidos regulados por estrógenos se ha utilizado el término de “moduladores selectivos de receptor de estrógenos” para describir esta clase de fármacos. Los moduladores selectivos de estrógenos son el tamoxifeno, raloxifeno, lasofoxifeno y el arzoxifeno.
La segunda gran estrategia farmacológica endocrina para reducir el riesgo de desarrollar cáncer de seno es el bloqueo de la síntesis de los estrógenos a nivel de la etapa terminal, mediante la enzima aromatasa. La aromatasa es una enzima que cataliza la etapa limitante en la biosíntesis de estrógenos, es decir, la conversión de andrógenos a estrógenos. Dos andrógenos mayores, la androstenediona y la testosterona, sirven de sustratos activos para la enzima aromatasa 2.
Hay dos tipos de agentes que bloquean a la enzima aromatasa: compuestos esteroideos inactivadores de la aromatasa, cuyo prototipo es el exemestano, y compuestos no esteroideos inhibidores de la aromatasa, cuyo prototipo son el anastrozol y el letrozol 3.
La presente revisión sistemática y metaanálisis tiene dos objetivos primarios. El primero es evaluar la eficacia de la terapia endocrina sobre la incidencia global de cáncer de seno (invasivo más carcinoma in situ), carcinoma de seno invasivo receptor de estrógeno positivo, carcinoma de seno invasivo receptor de estrógeno negativo y carcinoma ductal in situ. El segundo objetivo es evaluar los efectos secundarios de la terapia endocrina, como el cáncer de endometrio, los eventos tromboembólicos y las fracturas óseas.
Metodos
Criterios de selección
De acuerdo con la llamada lista de verificación PICOST 4,5, los criterios de elegibilidad fueron los siguientes: 1) Población: mujeres pre y postmenopáusicas sin cáncer de seno previo, con riesgo normal o aumentado de desarrollar cáncer mamario; 2) Intervención: terapia endocrina con actividad genuina para la reducción del riesgo de desarrollar cáncer de seno; 3) Control: placebo; 4) Resultados: casos incidentes de cáncer de seno y eventos adversos graves; 5) Tipo de estudio: solo fueron elegibles los experimentos clínicos fase III, aleatorizados, controlados, doble ciego y cuyos resultados expresaran el principio de intención a tratar al evaluar la TERCS versus placebo; 6) Seguimiento: las mujeres debían ser tratadas con TERCS y seguidas a lo largo del tiempo para registrar la aparición de cáncer de seno y eventos adversos. Por otra parte, en caso de encontrar un experimento clínico publicado varias veces, se seleccionó aquel que tuviera el período de seguimiento más largo.
Criterios de exclusión
Los experimentos clínicos que comparaban una terapia endocrina con otra terapia endocrina fueron excluidos. Igualmente, se excluyeron los experimentos clínicos que utilizaban otros compuestos farmacológicos diferentes a la terapia endocrina para la reducción del riesgo de desarrollar cáncer de seno. Además, se excluyeron los experimentos clínicos que comparaban compuestos vitamínicos con este mismo objetivo.
Los experimentos clínicos primarios duplicados se excluyeron, al igual que los experimentos clínicos aleatorizados con diseño 2 ˣ 2 y aquellos de diseño factorial.
Fuentes de información
Para la búsqueda fueron incluidas las bases de datos de Medline (Pubmed) y Embase. Además, la búsqueda se intensificó utilizando la lista de referencias en los artículos seleccionados.
Búsqueda
Los autores de la revisión buscaron los estudios publicados hasta el 1 de julio del 2021. La búsqueda para la realización de este metaanálisis fue hecha entre el 1° abril del 2021 al 1° de julio del 2021.
Se usaron como criterios de búsqueda adicionado el filtro de búsqueda propuesto por Cochrane para ensayos clínicos: (“breast neoplasms”[MeSH Terms] OR (“breast”[All Fields] AND “neoplasms”[All Fields]) OR “breast neoplasms”[All Fields] OR (“breast”[All Fields] AND “cancer”[All Fields]) OR “breast cancer”[All Fields]) AND (“chemoprevention”[MeSH Terms] OR “chemoprevention”[All Fields]) AND (“clinical trial”[All Fields] OR “clinical trials as topic”[MeSH Terms] OR “clinical trials”[All Fields]). No se realizaron restricciones ni de tiempo ni de idioma.
Tamizaje de estudios
Los títulos y los resúmenes fueron examinados de forma independiente por dos revisores (ET y JPT) para seleccionar los estudios potencialmente relevantes según los criterios de elegibilidad antes mencionados. Después de excluir los estudios duplicados y no relevantes, los artículos restantes fueron leídos en texto completo. Cualquier desacuerdo se resolvió mediante discusión y consenso (ET y JPT).
Extracción de la información
Se desarrollaron y utilizaron formularios de datos para extraer la información de cada experimento clínico identificado que cumplió con los criterios de inclusión. Dos revisores resumieron de forma independiente los datos para cada artículo. Se extrajeron los datos principales y medidas de resultado para la eficacia de la terapia endocrina y los de eventos adversos.
Análisis de la información y análisis estadístico
Para cada uno de los estudios se tabuló la frecuencia de aparición de cualquier tipo de carcinoma mamario, es decir, carcinoma de seno invasivo más carcinoma in situ, tanto para el grupo de tratamiento activo como para el grupo de tratamiento control. Además, se tabuló por separado la frecuencia de cáncer de seno invasivo receptor estrógeno positivo, cáncer de seno invasivo receptor estrógeno negativo y carcinoma ductal in situ, tanto para el grupo de tratamiento activo como para el grupo control.
En cuanto a resultados de efectos adversos graves, para cada uno de los estudios se tabuló por separado la frecuencia del cáncer de endometrio, los eventos tromboembólicos y fracturas vertebrales y no vertebrales, tomadas en conjunto tanto para el grupo de tratamiento activo como para el grupo de control.
Se calculó el porcentaje para los parámetros en cada grupo de tratamiento. La medida epidemiológica para expresar el efecto de la terapia endocrina sobre la incidencia de cáncer de seno fue el riesgo relativo (RR), que es la relación entre la incidencia de cáncer de seno en el brazo experimental y en el brazo de control. De igual manera, se utilizó el riesgo relativo (RR) para expresar el efecto de la terapia endocrina sobre los efectos adversos de cada clase de ellos.
En primer lugar, se evaluó el impacto global de todos los medicamentos utilizados como terapia endocrina en los estudios primarios sobre la incidencia del cáncer de seno (carcinoma de seno invasivo y carcinoma ductal in situ). En segundo lugar, se realizó un análisis de subgrupos acorde al tipo de terapia endocrina empleada en los estudios primarios, para evaluar el impacto de cada uno de estos grupos de medicamentos sobre la incidencia de cáncer de seno (cáncer de seno invasivo y carcinoma ductal in situ). En tercer lugar, se evaluó el impacto de la terapia endocrina sobre los principales efectos adversos de cada clase de ellos.
Evaluación de la calidad metodológica de los estudios
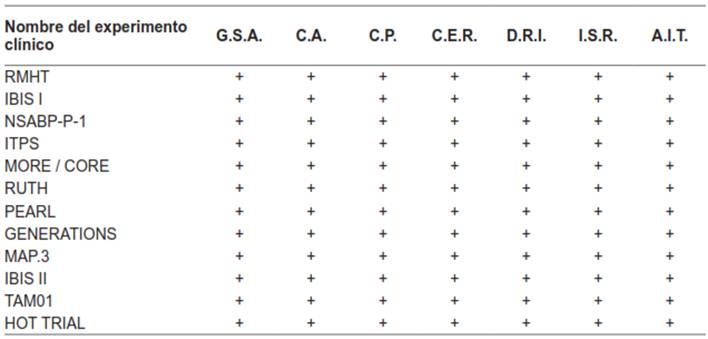
La calidad metodológica de los experimentos clínicos seleccionados fue evaluada utilizando “la herramienta de la Colaboración Cochrane para evaluar el riesgo de sesgo en ensayos aleatorizados” 6. La herramienta se compone de siete dominios: generación de secuencia aleatoria G.S.A (sesgo de selección), ocultación de la asignación O.A. (sesgo de selección), cegamiento de los participantes y del personal C.P. (sesgo de realización), cegamiento de la evaluación de resultado C.E.R. (sesgo de detección), datos de resultado incompletos D.R.I. (sesgo de deserción), informe selectivo de resultados I.S.R. (sesgo de informe) y otras fuentes de sesgo A.I.T. (p.ej. análisis por protocolo en lugar de análisis por intención de tratar). Según los resultados obtenidos con esta herramienta, los estudios incluidos se clasificaron en una de las siguientes categorías: riesgo de sesgo bajo (-), alto (+) o incierto (¿)
Dos revisores evaluaron la calidad metodológica de los estudios en forma independiente (ET y JPT). Cualquier desacuerdo se resolvió mediante iteración, discusión y consenso
Evaluación de la heterogeneidad de los estudios
Se calculó la heterogeneidad de los estudios primarios utilizando los estadísticos T², I², H² 7. El estadístico I² examina el porcentaje de variación total entre estudios debido a la heterogeneidad más que al azar 7. Se previó que valores de I² superior al 70 % daría a lugar a no combinar los resultados de los experimentos clínicos primarios y realizar solo la revisión sistemática. De manera análoga, se previó que, en ausencia de heterogeneidad, dado por valores de I² igual a cero, se escogería un modelo de efectos fijos para combinar los resultados de los experimentos clínicos primarios.
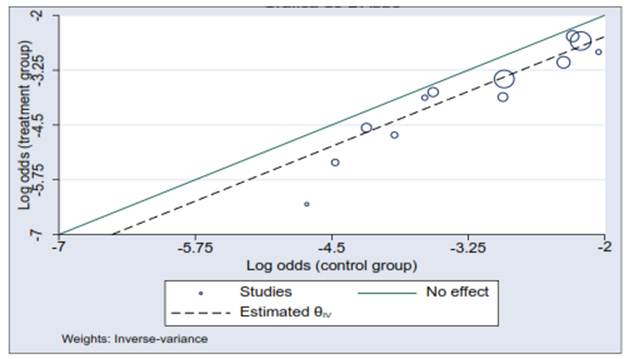
Se previó utilizar el modelo de efectos aleatorios de DerSimonian-Laird para combinar los resultados de los experimentos clínicos primarios en caso de valores de I² entre el 51 % y el 70 %, y utilizar el modelo de efecto común de Mantel-Haenszel para combinar los resultados de los experimentos clínicos primarios en caso de valores de I² entre el 1 % hasta el 50 %. Adicionalmente, se evaluó la heterogeneidad de los estudios, utilizando la gráfica de Galbraith 8 y la gráfica de L’Abbé 9.
Evaluación del sesgo de publicación
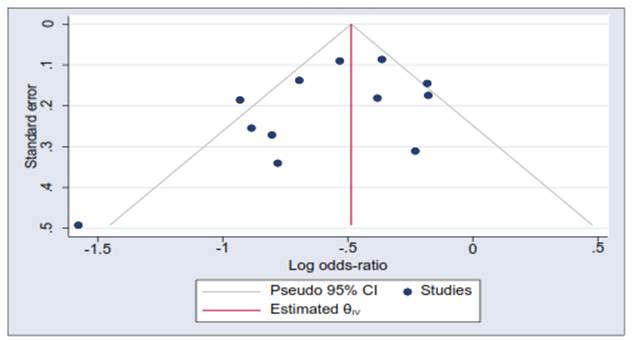
El sesgo de publicación fue evaluado mediante la prueba de Harbord 10 y mediante la gráfica del funnel plot11,12.
Programa estadístico utilizado en el Metaanálisis
Se utilizó el programa estadístico de STATA 17.0, BE-Basic Edition (Copyright 1985-2021 StataCorp LLC / StataCorp / 4905 Lakeway Drive / College Station, Texas 77845 USA) con el metacomando para realizar el análisis estadístico. Igualmente se utilizó STATA 17.0 para realizar todos los gráficos requeridos para esta revisión.
Resultados
Selección de estudios
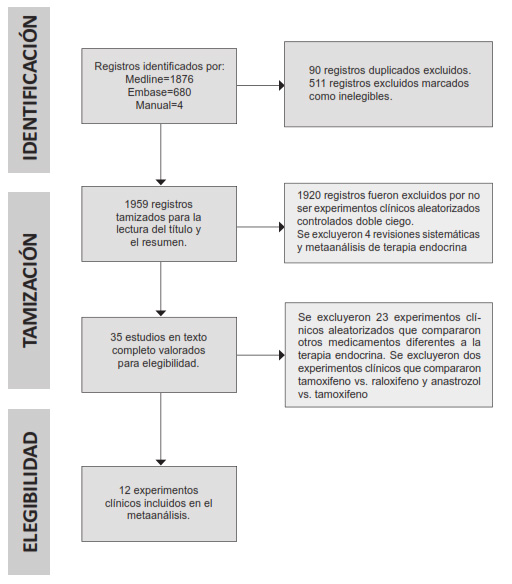
La figura 1 resume nuestro proceso de selección de estudios conforme al diagrama de flujo PRISMA (Preferred Reporting Items for Systematic reviews and Meta-Analyses) 13. Se obtuvieron 1876 registros de la base de datos Medline y 680 registros de Embase, además de 4 registros utilizando la lista de referencias en los artículos seleccionados.
Luego de verificar el título y el resumen se excluyeron cuatro revisiones sistemáticas de prevención primaria en cáncer de seno 14-17. En total se excluyeron 23 experimentos clínicos para la prevención primaria del cáncer de mama debidos a las razones siguientes: un experimento clínico denominado “Study of Tamoxifen and Raloxifeno” (STAR) 18,19 que comparó tamoxifen versus raloxifen en mujeres postmenopáusicas y un experimento clínico que comparó tamoxifen versus fenretidine 20; tres experimentos clínicos que compararon alendronato, zolendronato, tibolona versus placebo 21-23; dos experimentos clínicos que compararon aspirina versus placebo 24,25; 8 experimentos clínicos que compararon algún tipo de suplemento vitamínico versus placebo 26-33; 7 experimentos clínicos que compararon algún tipo de estatina versus placebo 34-40, y un experimento clínico que evaluó anastrozole versus tamoxifen en mujeres con carcinoma ductal in situ, el estudio IBIS II DCIS 41.
Finalmente, se seleccionaron e incluyeron doce experimentos clínicos aleatorizados doble ciego y cuyos resultados expresaron el principio de intención a tratar para el presente estudio 42-53. Se puntualiza que algunos experimentos clínicos aleatorizados incluidos fueron publicados varias veces con diferentes períodos de seguimiento, sin embargo, se seleccionaron para el análisis solo aquellos estudios con el período de seguimiento más largo.
Los doce experimentos clínicos incluidos analizados reclutaron un total de 68.180 mujeres, con una incidencia total de cáncer de seno invasivo más carcinoma in situ del 3,2 %, y abarcaron un período de tiempo que va desde el año de 1998 (el primer experimento clínico de prevención realizado con terapia endocrina) hasta el año 2019 (el último experimento).
Características de los experimentos clínicos primarios incluidos en el análisis para la prevención primaria del cáncer de seno
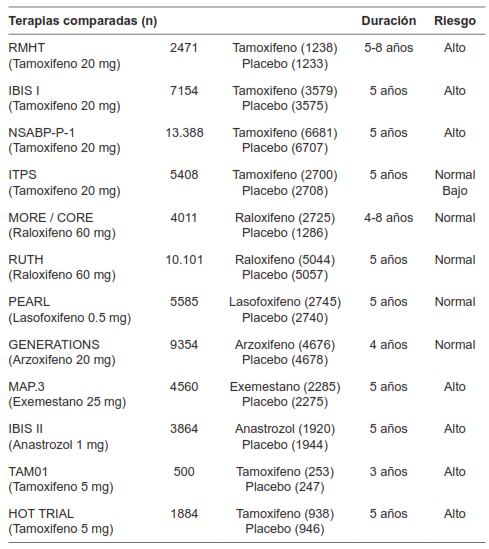
Cuatro experimentos clínicos aleatorizados compararon tamoxifeno a dosis de 20 mg al día versus placebo para la reducción del riesgo de desarrollar cáncer de seno 42-45. Dos experimentos clínicos aleatorizados compararon raloxifeno a dosis de 60 mg al día versus placebo con el mismo fin 46,47 y otros dos experimentos clínicos aleatorizados compararon lasofoxifeno, arzoxifeno versus placebo 48,49.
Dos experimentos clínicos aleatorizados compararon exemestano, anastrozol versus placebo en mujeres con alto riesgo para desarrollar cáncer de seno para la prevención primaria del cáncer de seno 50,51. Dos experimentos clínicos aleatorizados compararon tamoxifeno a dosis de 5 mg versus placebo en mujeres con neoplasia intraepitelial de la mama y en mujeres que tomaron terapia de reemplazo hormonal para la reducción del riesgo de desarrollar cáncer de seno 52,53.
Los detalles de las características de los experimentos clínicos aleatorizados incluidos se presentan en la tabla 1.
Evaluación de la calidad metodológica de los estudios primarios
Según “la herramienta de la Colaboración Cochrane para evaluar el riesgo de sesgo en ensayos aleatorizados” el riesgo de sesgo para los 12 experimentos clínicos aleatorizados doble ciego fue bajo (tabla 2).
Evaluación de la heterogeneidad de los experimentos clínicos primarios
Los valores de heterogeneidad de los estudios utilizando los estadísticos T², I², H² fueron 0,04, 61,14 % y 2,57, respectivamente. La evaluación de la heterogeneidad de los estudios, utilizando las gráficas de Galbraith y de L’Abbé son ilustradas en las figuras 2 y 3.
Evaluación del sesgo de publicación
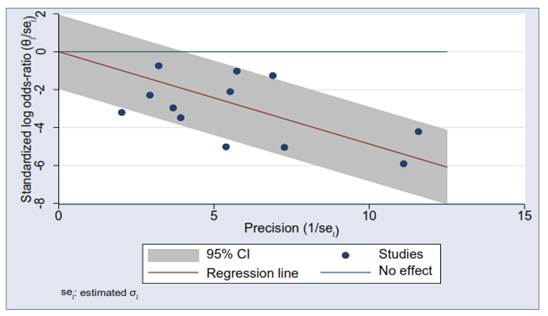
No hubo sesgo de publicación en la presente revisión conforme a la prueba de Harbord, con resultado de p=0,09. El gráfico de embudo invertido para evaluar el sesgo de publicación se muestra en la figura 4.
Eficacia global de la terapia endocrina para la prevención primaria del cáncer de mama
La terapia endocrina en conjunto redujo el riesgo proporcional de cáncer de seno (invasivo más in situ) en un 42 %, resultado estadísticamente significativo, con un valor RR de 0,58 (IC95% 0,50 - 0,69; p= 0,00). El número necesario a tratar (NNT) con la terapia endocrina para la prevención primaria del cáncer de mama es 66; es decir, se necesita tratar con un agente de terapia endocrina a 66 mujeres sanas en riesgo de desarrollar cáncer de mama para prevenir un cáncer mamario.
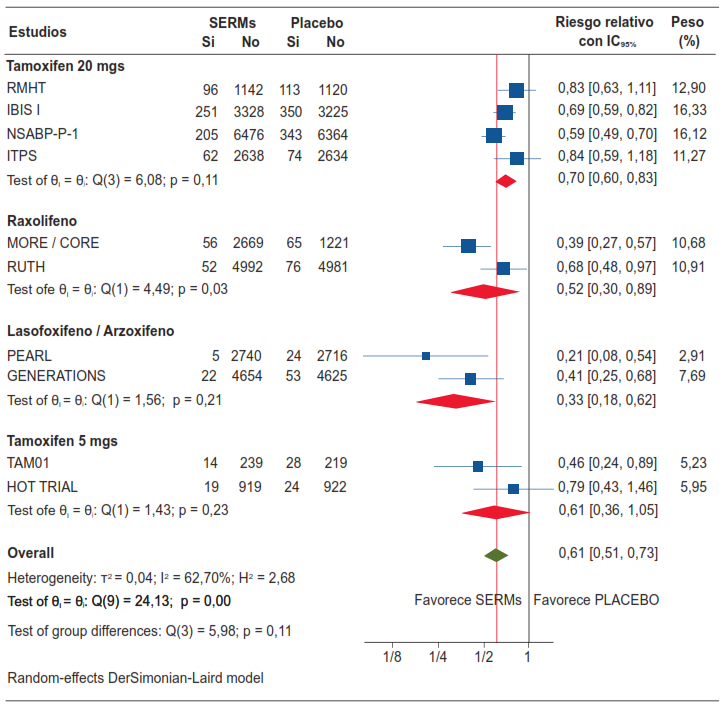
El forest plot de la figura 5 muestra dos hallazgos importantes de destacar: el estudio italiano ITPS no demostró un efecto preventivo de la terapia endocrina con tamoxifeno a dosis de 20 mg/día en mujeres sometidas a ooforectomía. En el mismo sentido, el estudio HOT TRIAL, no demostró un efecto preventivo de la terapia endocrina con tamoxifeno a dosis de 5 mg/día en mujeres quienes toman terapia de remplazo hormonal de forma concomitante.
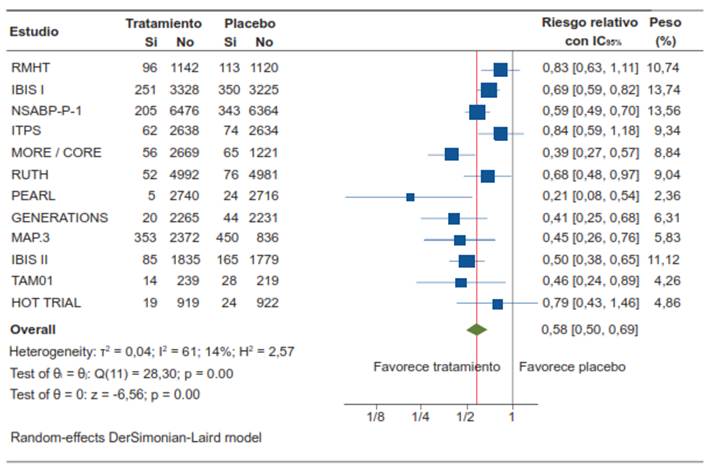
Figura 5. Eficacia de la terapia endocrina para la prevención primaria del cáncer de seno no hereditario.
La terapia endocrina redujo el riesgo proporcional de cáncer de seno invasivo receptor de estrógeno positivo en un 56 %, con una diferencia estadísticamente significativa (RR 0,44; IC95% 0,34-0,56). Sin embargo, la terapia endocrina no redujo significativamente el riesgo proporcional de cáncer de seno invasivo receptor de estrógeno negativo (RR 1,11; IC95% 0,91-1,36).
Eficacia de los moduladores selectivos de receptores de estrógenos para la prevención primaria del cáncer de mama
Los SERMs tomados en conjunto reducen el riesgo proporcional de cáncer de seno (invasivo más in situ) en un 39 %, con una diferencia estadísticamente significativa (RR 0,61; IC95% 0,51-0,73; p=0,001) (figura 6). El número necesario a tratar (NNT) con los SERMs para la prevención primaria del cáncer de seno es 72; es decir, se necesita tratar con un agente de los SERMs a 72 mujeres sanas en riesgo de desarrollar cáncer de seno para prevenir un cáncer mamario.
El tamoxifeno a dosis de 20 mg reduce el riesgo proporcional de cáncer de seno en un 30 % (RR 0,70; IC95% 0,60-0,83), mientras el raloxifeno reduce el riesgo proporcional de cáncer de seno en un 48 % (RR 0,52; IC95% 0,30-0,89), y los medicamentos lasofoxifene / arzoxifene tomados en conjunto reducen el riesgo proporcional de cáncer de seno en un 67 % (RR 0,33; IC95% 0,18-0,62), todos con resultados estadísticamente significativos.
Se puntualiza que el estudio TAM01 encontró que el tamoxifeno a dosis de 5 mg al día previene el riesgo de desarrollar cáncer de seno en un 54 % en mujeres con neoplasia intraepitelial del seno (RR 0,46; IC95% 0,24-0,89), sin embargo, el estudio HOT TRIAL pone en evidencia que el tamoxifen a dosis de 5 mg no tiene eficacia para reducir el riesgo de desarrollar cáncer de seno en mujeres que toman terapia de reemplazo hormonal concomitantemente (RR 0,79; IC95% 0,43-1,46).
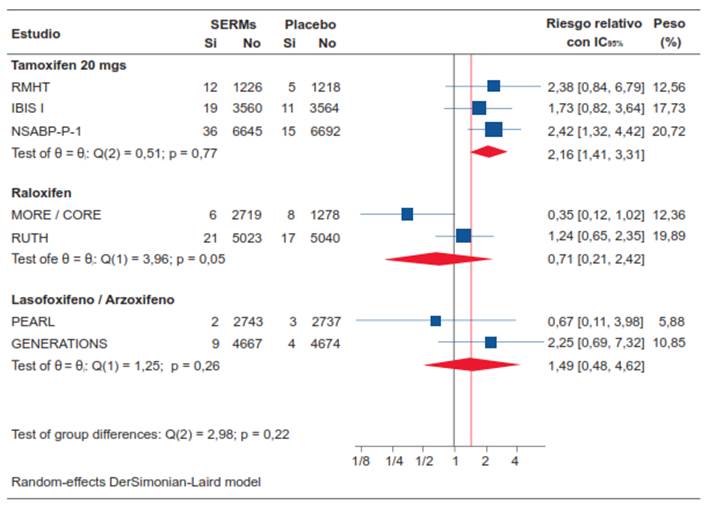
Estimación del efecto de los SERMs sobre el riesgo de desarrollar cáncer de endometrio
El tamoxifeno a dosis de 20 mg al día aumentó significativamente el riesgo proporcional de desarrollar cáncer de endometrio en un 53,7 % (RR 2,16; IC95% 1,41-3,31) (Figura 7). Por el contrario, ni el raloxifen (RR 0,71; IC95% 0,21-2,42), el lasofoxifene o el arzoxifene (RR 1,49; IC95% 0,48-4,62) aumentaron significativamente el riesgo proporcional de desarrollar cáncer de endometrio.
Estimación del efecto de los SERMs sobre el riesgo de producir eventos tromboembólicos
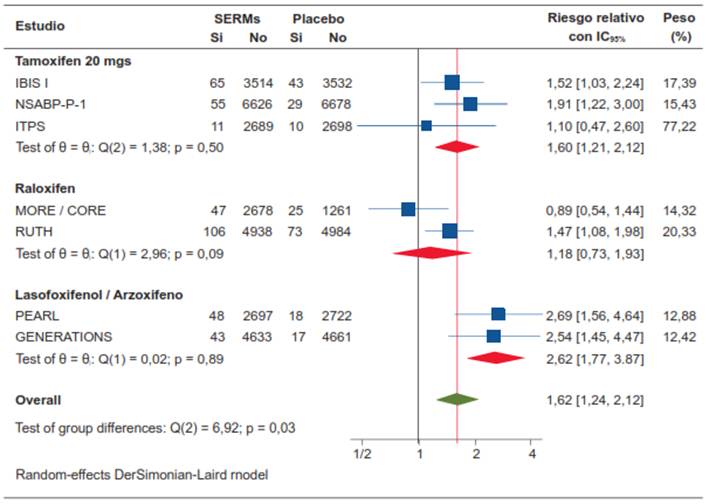
Tomados en conjunto, los moduladores selectivos de los receptores de estrógenos aumentaron el riesgo proporcional de eventos tromboembólicos en un 38 %, con un resultado estadísticamente significativo (RR 1,62; IC95% 1,24-2,12; p=0,03) (figura 8).
El tamoxifeno aumentó el riesgo proporcional de eventos tromboembólicos en un 37,5 % (RR 1,60; IC95% 1,21-2,12). De manera similar, el lasofoxifen y el arzoxifen aumentaron el riesgo proporcional de eventos tromboembólicos en un 61,8 % (RR 2,62; IC95% 1,77-3,87). El raloxifen, aumentó el riesgo proporcional de producir eventos tromboembólicos en un 15,2 %, pero no alcanzó a ser un resultado estadísticamente significativo (RR 1,18; IC95% 0,73-1,93).
Eficacia de los SERMs en la reducción del riesgo de fracturas
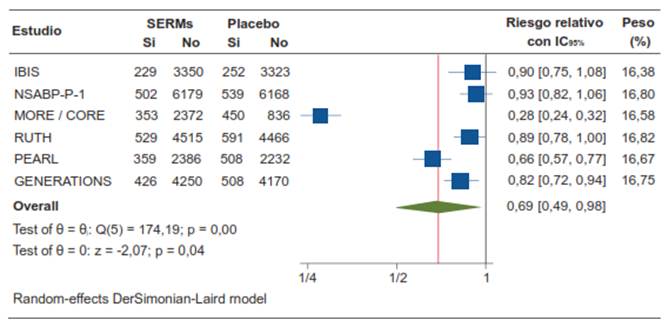
Los SERMs disminuyeron el riesgo proporcional de fracturas en un 31 %, con un resultado estadísticamente significativo (RR 0,69; IC95% 0,49-0,98; p=0,04) (figura 9).
Eficacia de los bloqueadores de aromatasa sobre la incidencia global del cáncer de seno (cáncer de seno invasivo más in situ)
Los bloqueadores de aromatasa tomados en conjunto reducen el riesgo proporcional de cáncer de seno (invasivo más in situ) en un 51 %, con una diferencia estadísticamente significativa (RR 0,49; IC95% 0,38-0,62; p=0,001). El NNT con los bloqueadores de aromatasa para la prevención primaria del cáncer de seno es 41; es decir, se necesita tratar con un bloqueador de aromatasa a 41 mujeres sanas en riesgo de desarrollar cáncer de seno para prevenir un cáncer mamario.
Discusión
El único medicamento de la terapia hormonal que se puede dar tanto en mujeres pre y post-menopausia es el tamoxifeno. El raloxifeno, lasofoxifeno, arzoxifeno, exemestano y anastrozol se usan solo en mujeres post-menopausia. La terapia endocrina con tamoxifen no está indicada en mujeres con ooforectomía previa ni en mujeres quienes usan terapia de reemplazo hormonal concomitantemente.
Los SERMs redujeron la incidencia de cáncer de seno debido principalmente a la reducción de incidencia de cáncer de seno invasivo receptor de estrógeno positivo. El tamoxifen a dosis de 20 mg al día por 5 años o a dosis de 5 mg al día por 3 años es el medicamento de escogencia para reducir el riesgo de desarrollar cáncer de seno en mujeres pre y post-menopaúsicas con diagnóstico de neoplasia intraepitelial del seno.
El raloxifen es el medicamento de escogencia para reducir el riesgo de desarrollar cáncer de seno en mujeres post-menopáusicas con útero intacto y sin antecedentes de eventos trombóticos. El raloxifen es el único SERM que puede ser utilizado hasta por 8 años de forma continua para tratar la osteoporosis y, por lo tanto, estas mujeres se beneficiaran secundariamente de esta estrategia en la reducción del riesgo para desarrollar cáncer de seno. Las mujeres con osteoporosis tratadas con SERMs de tercera generación con propiedades similares al lasofoxifen o arzoxifen también reducirán el riesgo de desarrollar cáncer de seno como ganancia secundaria.
Ningún SERM está indicado como terapia de prevención en cáncer de seno en mujeres quienes toman activamente terapia de reemplazo hormonal.
El exemestane a dosis de 25 mg al día por 5 años y el anastrozole a dosis de 1 mg al día por 5 años pueden ser considerados como una terapia eficaz para reducir el riesgo de cáncer de seno en mujeres post-menopaúsicas sanas con riesgo elevado de desarrollarlo. El exemestane y el anastrozole son los medicamentos de escogencia para reducir el riesgo de desarrollar cáncer de seno en mujeres post-menopáusicas con antecedentes de eventos trombóticos, en quienes están contraindicados el tamoxifen y el raloxifen.
El anastrozole y el exemestane, al lado del tamoxifen y el raloxifen, son los medicamentos de escogencia para reducir el riesgo de desarrollar cáncer de seno en mujeres post-menopaúsicas con diagnóstico de neoplasia intraepitelial del seno. Ni el anastrozole ni el exemestane están indicados como terapia de prevención primaria en mujeres pre-menopaúsicas.
Todas las mujeres post-menopáusicas que tomen bloqueadores de aromatasa deben recibir suplemento de calcio y vitamina D, dado que estos producen pérdida de mineralización ósea. Los bloqueadores de aromatasa al igual que los moduladores selectivos de receptores de estrógenos, no están indicados como terapia de prevención primaria en cáncer de seno en mujeres quienes toman activamente terapia de reemplazo hormonal.
Conclusión
La terapia endocrina es el manejo estándar de prevención en mujeres sanas con riesgo de desarrollar cáncer de seno no hereditario, explícitamente mujeres que cumplan con las siguientes condiciones:
1. Mujeres entre los 35 y 59 años de edad con riesgo previsto de desarrollar cáncer de seno mayor a 1,66 % a 5 años, determinado por el modelo de Gail
Mujeres con diagnóstico previo de hiperplasia ductal atípica
Mujeres con diagnóstico previo de hiperplasia lobular atípica
Mujeres con diagnóstico previo de carcinoma lobular in situ
Mujeres con carcinoma ductal in situ tratadas con mastectomía
Mujeres mayores a 60 años con cualquiera de los factores de riesgo enunciados previamente.