Introducción
La pancreatitis aguda es una condición inflamatoria del páncreas, con una importante incidencia en nuestro medio, una alta carga de enfermedad y potencial de complicaciones graves derivadas de injuria local, respuesta inflamatoria sistémica y falla orgánica 1-3. En Colombia su principal etiología es la litiasis biliar, seguido de la ingesta excesiva de alcohol 4. En la mayoría de los pacientes la enfermedad tiene un curso leve, en el que la resucitación temprana con fluidos, el manejo del dolor y la restricción de la vía oral con restauración temprana de la dieta impactan de manera favorable en el desenlace del paciente. Sin embargo, cerca del 20-30 % de los pacientes presentan la forma severa de la enfermedad, la cual tiene tasas de mortalidad que alcanzan hasta el 35 % 5.
En los últimos años, nuevas tendencias en el manejo de la pancreatitis aguda han cambiado la práctica clínica en cuanto al inicio precoz de la vía oral, el rol selectivo de los antibióticos, el desuso de intervenciones quirúrgicas en las necrosis estériles y un abordaje más conservador en las necrosis sobre infectadas. El personal médico de los servicios de urgencias y los equipos de cirugía general a cargo de estos pacientes deben disponer de conocimiento actualizado de los puntos clave de esta entidad, necesidad que nos impulsó a realizar este artículo mediante una revisión amplia del estado del arte.
Epidemiología
A nivel mundial la pancreatitis aguda (PA) es una condición gastrointestinal relativamente común, que se asocia a una importante morbilidad, carga de enfermedad y costo al sistema de salud. Se estima que su incidencia es de 34 por 100.000 habitantes. En los Estados Unidos más de 275.000 pacientes son hospitalizados por PA al año, siendo esta la tercera causa gastrointestinal más común de hospitalización en ese país, con un costo agregado al sistema de salud de cerca de 2,6 billones de dólares 6. Se estima que un 35 % de los pacientes que consultan a urgencias con PA son dados de alta para manejo ambulatorio, lo cual afecta la verdadera incidencia de la enfermedad.
El riesgo de padecer PA es mayor en hombres, aunque su prevalencia es más elevada en las mujeres. La mortalidad general se ubica alrededor del 5 %, pero la mortalidad en la PA severa alcanza el 15 % y, en los pacientes con falla orgánica y necrosis infectada, se encuentra cerca al 35 % 1,7,8. En cuanto a la edad, se presenta con más frecuencia en los pacientes de 60-65 años. En la población pediátrica se estima una incidencia de 6 - 12 por 100.000 habitantes, siendo la etiología medicamentosa tan importante como la biliar en este grupo etario 7.
Anatomía y fisiopatología
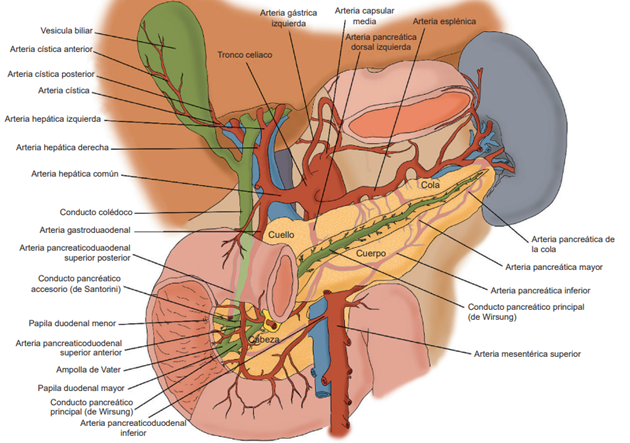
El páncreas es un órgano totalmente retroperitoneal, que pesa alrededor de 100 g, se encuentra en estrecha relación con todas las porciones del duodeno, la pared posterior del estómago y el hilio esplénico. Anatómicamente puede dividirse en cabeza, cuello, cuerpo y cola. Tiene un conducto pancreático principal o de Wirsung, que a nivel de la cabeza pancreática confluye con el conducto colédoco formando una dilatación conocida como la ampolla de Vater, que desemboca en la segunda porción duodenal, a nivel de la papila duodenal mayor, atravesando un musculo con función esfinteriana, el esfínter de Oddi 9. La Figura 1 ilustra la anatomía del páncreas y sus principales relaciones.
El páncreas cumple complejas funciones exocrinas y endocrinas, que incluyen la neutralización del ácido gástrico que ingresa al duodeno mediante la secreción de bicarbonato, la síntesis de enzimas digestivas y la liberación de hormonas con diversas funciones metabólicas.
Las unidades estructurales para las funciones exocrinas son los acinos pancreáticos, que aproximadamente corresponden a un 80 % de la glándula y producen una secreción rica en agua y bicarbonato y otra rica en enzimas digestivas. El acino pancreático está compuesto por 20 a 50 células acinares, que sintetizan diversas enzimas digestivas (proteasas, lipasas, amilasa, elastasas, peptidasas), las cuales se almacenan en polisomas como zimógenos, una forma inactiva de las mismas, posteriormente secretados por exocitosis para su activación en el duodeno. Esta secreción se controla de manera neurohormonal; tiene una producción continua, con un pico dado una vez el bolo alimentario alcanza el duodeno y se produce la enzima colecistoquinina (CCK) por las células duodenales, como respuesta a ciertos aminoácidos y ácidos grasos 10.
Sólo entre el 2 y el 5 % de la glándula cumple las funciones endocrinas, siendo la unidad funcional el islote de Langerhans.
De manera fisiológica, los zimógenos adquieren su forma activa en el duodeno, pero existen condiciones patológicas que pueden ocasionar la activación anormal de los mismos en el parénquima o los conductos pancreáticos, desencadenando el cuadro de PA. Las dos principales causas son obstrucción mecánica de la ampolla de váter o los conductos pancreáticos y toxicidad directa por estímulos nocivos que provocan que los zimógenos intracelulares hagan contacto con las vacuolas citoplasmáticas y enzimas como la catepsina B, las cuales ocasionan una activación intracelular de las enzimas pancreáticas, con una subsecuente ruptura de organelas y daño acinar, que favorece la liberación de citoquinas y quimiocinas, desencadenando una infiltración leucocitaria que perpetúa la inflamación y conlleva las complicaciones a nivel sistémico 10,11.
Etiología y factores de riesgo
Los cálculos biliares son la principal causa de pancreatitis, ocasionando el 40-70 % de los casos 2,12, aunque por el contrario, solo 3 a 7 % de los pacientes con colelitiasis desarrollan pancreatitis. Tres factores fisiopatológicos se han sugerido como los eventos iniciales en la pancreatitis de origen biliar: el reflujo biliar en el ducto pancreático debido a una obstrucción a nivel de la ampolla de Váter por un lito, el edema ampular debido al paso de cálculos y la incompetencia del esfínter de Oddi secundaria al paso crónico de cálculos 11. La colecistectomía y la extracción de cálculos del conducto colédoco previenen las recurrencias, lo que confirma una relación causa-efecto.
La ingesta de alcohol es la segunda causa más común de pancreatitis, siendo responsable del 25 a 35 % de los casos. Aproximadamente 10 % de los alcohólicos crónicos desarrollan episodios clínicos de pancreatitis aguda. El mecanismo exacto de injuria pancreática no se conoce, pero se cree que el alcohol puede incrementar la síntesis de enzimas digestivas y lisosomales en los acinos pancreáticos o producir una hipersensibilización a la acción de la colecistoquinina 13.
Otras causas menos comunes deben sospecharse luego de descartadas las dos anteriores. La pancreatitis aguda de origen idiopático designa los casos en los que no se logra identificar una etiología mediante la historia clínica, exámenes de laboratorios e imágenes diagnósticas. La Tabla 1 resume las causas de pancreatitis aguda y presenta otras causas menos comunes 1,2,12.
Manifestaciones clínicas
La mayoría de los pacientes con PA tienen una instauración aguda de dolor epigástrico, de intensidad severa y persistente. En algunos pacientes el dolor puede ubicarse en el cuadrante superior derecho del abdomen y, en menor medida, se ubica en el lado izquierdo. Típicamente se irradia en banda a la región interescapular, el tórax y, con menor frecuencia a los flancos. Se ha demostrado que la intensidad y localización del dolor no se correlaciona con la severidad del cuadro 2. El dolor suele persistir por un periodo de horas a días y característicamente puede mejorar si el paciente se sienta o inclina el torso hacia adelante, lo que se conoce como posición de plegaria mahometana y tiene su explicación en que hay una liberación de la presión que ejercen los órganos intraperitoneales sobre la transcavidad de los epiplones y por ende, sobre el páncreas 9.
Aproximadamente el 90 % de los pacientes presentan náuseas y vómitos asociados. En los casos de PA severa los pacientes pueden presentar disnea, debido a inflamación secundaria del diafragma, derrames pleurales o distrés respiratorio agudo 4,12. A nivel nacional, un estudio concluyó que el dolor abdominal continúa siendo el síntoma cardinal al presentarse en 97 % de los pacientes, seguido por náuseas y vómitos asociados en el 73 % de los casos 4.
Los hallazgos al examen físico incluyen dolor a la palpación del epigastrio, que varía de leve y localizado a intenso y difuso en los casos de PA severa, constituyendo un franco abdomen agudo. Se puede presentar distensión abdominal, con disminución de los ruidos hidroaéreos por íleo secundario a la inflamación, en un 60 % de los pacientes. Puede existir además tinte ictérico en piel y escleras, debido a ictericia obstructiva secundaria a coledocolitiasis o edema de la cabeza del páncreas, hasta en un 15 % de los pacientes con pancreatitis.
Los pacientes con PA severa también suelen desarrollar fiebre con relativa frecuencia, taquipnea, hipoxemia e hipotensión. En el 3 % de los pacientes con PA aparece una coloración equimótica en la región periumbilical (signo de Cullen) o en los flancos (signo de Grey Turner). Estos hallazgos, aunque no son específicos, sugieren sangrado retroperitoneal en el contexto de necrosis pancreática 2.
Definiciones y clasificación
La clasificación revisada de Atlanta para pancreatitis aguda es la más utilizada a nivel global ya que determina los tipos de pancreatitis aguda, la severidad de la enfermedad y define las complicaciones locales y sistémicas.
La PA puede subdividirse en dos tipos, según sus características histopatológicas: pancreatitis edematosa intersticial y pancreatitis necrosante 14. La pancreatitis edematosa intersticial (PEI) se caracteriza por edema inflamatorio de la glándula, la cual muestra una captación de contraste uniforme en los estudios tomográficos, además de inflamación de la grasa peripancreática o fluido peripancreático 14,15.
La pancreatitis necrosante (PN) se presenta en cerca del 5-10 % de los pacientes y se caracteriza por necrosis del parénquima pancreático, el tejido peripancreático o ambos 14. En los estudios tomográficos el realce del contraste es heterogéneo y se hace más evidente luego de las 72 horas 15. La historia natural de la necrosis pancreática y peripancreática varía, ya que puede permanecer sólida o presentar licuefacción, permanecer estéril o sobreinfectarse, o desaparecer con el transcurso del tiempo 14. La sobreinfección de la necrosis ocurre en el 20-40 % de los pacientes con pancreatitis aguda severa y se asocia con empeoramiento de la disfunción orgánica y aumento de la mortalidad, que alcanza hasta un 35,2 % en estos individuos, como se demostró en una revisión sistemática y metaanálisis del 2016 que contó con un total de 6970 pacientes 16.
De acuerdo con su severidad, la enfermedad se clasifica en leve, moderada (moderadamente severa) o severa. La PA leve normalmente se corresponde con la pancreatitis edematosa intersticial, no tiene insuficiencia orgánica, complicaciones locales o sistémicas y generalmente resuelve en la primera semana. Se habla de PA moderada si existe falla orgánica transitoria (menos de 48 horas) y complicaciones locales o sistémicas. Los pacientes con insuficiencia orgánica persistente (más de 48 horas) se diagnostican como PA severa 1,14.
Las complicaciones de la PA incluyen la falla orgánica, las complicaciones locales y las complicaciones sistémicas 14. La falla orgánica (FO) se define evaluando tres sistemas: respiratorio, cardiovascular y renal, para lo cual se utiliza el puntaje de Marshall modificado, que estipula un puntaje igual o mayor a 2 para su diagnóstico. Tiene la ventaja de poder ser usado al ingreso y múltiples veces durante la estancia del paciente 17.
Las complicaciones locales son la colección peripancreática, una colección no asociada a necrosis, identificada en las primeras 4 semanas; el pseudoquiste pancreático, una colección encapsulada con una pared inflamatoria bien definida, que ocurre luego de las primeras 4 semanas; la colección necrótica aguda, una colección heterogénea asociada a pancreatitis necrosante, evidenciada en las primeras 4 semanas, y la necrosis “amurallada”, del inglés walled-off, que implica una colección necrótica madura y encapsulada, y ocurre luego de las primeras 4 semanas. Las complicaciones locales deben sospecharse ante la persistencia del dolor abdominal, la aparición de falla orgánica y signos clínicos de sepsis 2,14.
Las complicaciones sistémicas se definen por la exacerbación de comorbilidades preexistentes, como enfermedad pulmonar obstructiva crónica o falla cardiaca precipitadas por la PA 14.
La mayoría de los pacientes (80-85 %) desarrollarán PA leve, que es autolimitada y con una mortalidad menor del 1-3 %, pero alrededor del 20 % tendrá un episodio de PA moderada o severa, con una tasa de mortalidad del 13 al 35 %. Por lo tanto, es importante diagnosticar los casos de PA severa e identificar a los pacientes con alto riesgo de desarrollar complicaciones 1. Johnson en 2004 18, demostró que la insuficiencia orgánica persistente por más de 48 horas en la primera semana está fuertemente asociada con el riesgo de muerte o complicaciones locales. En general, los pacientes con insuficiencia orgánica, definidos con precisión utilizando el puntaje de Marshall, deben ser llevados de manera prioritaria a una unidad de cuidados intensivos (UCI), para monitoreo invasivo y continuo 1.
Enfoque diagnóstico: criterios, imágenes y estudios de laboratorio
El diagnóstico de PA requiere la presencia de al menos dos de los tres siguientes criterios: 1. dolor abdominal consistente con la enfermedad, como se describieron anteriormente, 2. evidencia bioquímica de pancreatitis (amilasa y / o lipasa sérica mayor de tres veces el límite superior normal), y 3. hallazgos característicos en estudios de imagen abdominal 14.
Una vez el paciente es admitido en la institución, se debe determinar la etiología de la PA para proyectar la necesidad de un tratamiento definitivo y planear el seguimiento del paciente. Para esto es necesario la realización de estudios imagenológicos. La ecografía abdominal al ingreso o en las primeras 48 horas permite evidenciar aumento del tamaño del páncreas, cambios inflamatorios peripancreáticos, colecistolitiasis, coledocolitiasis o dilatación de la vía biliar 1,2,19.
En la mayoría de los pacientes con PA, no es necesario la tomografía computarizada (TC), sin embargo, en los pacientes que se tienen dudas respecto del diagnóstico, en el contexto de pancreatitis severa o en pacientes sin mejoría clínica durante las primeras 48-72 horas, dado por persistencia de dolor, fiebre o imposibilidad de iniciar vía oral, se debe considerar la realización de una TC, que además permite descartar complicaciones como peritonitis secundaria a perforación o isquemia mesentérica 2.
La presencia de necrosis peripancreática y su extensión pueden detectarse con una tomografía computarizada con contraste después a las 72 horas del inicio del cuadro; antes de este tiempo la TC no evidencia áreas necróticas/isquémicas, y no modifica el manejo clínico durante la primera semana de la enfermedad 1,20. La necrosis pancreática o peripancreática sobreinfectada puede sospecharse por la presencia de gas en las imágenes 20. Balthazar y col. establecieron el índice de severidad por TC que evalúa la pancreatitis según el grado de inflamación, la presencia de colecciones de líquidos y el grado de necrosis. Una mayor puntuación se asocia con una mayor morbilidad y mortalidad 21.
La resonancia magnética nuclear (RMN) es una buena alternativa en casos de alergia al contraste yodado o insuficiencia renal (RMN no contrastada), en pacientes jóvenes o en embarazadas para minimizar la exposición a la radiación 1,20.
Si la etiología de la PA no ha podido ser establecida y la ecografía abdominal no evidencia cálculos biliares, barro biliar u obstrucción biliar, en ausencia de colangitis o pruebas anormales de la función hepática que sugieran obstrucción biliar, para descartar coledocolitiasis oculta se pueden utilizar la colangiopancreatografía por resonancia magnética nuclear (CPRMN) o el ultrasonido endoscópico (USE), las cuales se prefieren en lugar de la colangiopancreatografía retrógrada endoscópica diagnóstica (CPRE), por las características invasivas y el riesgo de complicaciones de este estudio 15,20.
En cuanto a estudios de laboratorio, la medición de las enzimas pancreáticas en suero es el “estándar de oro” para el diagnóstico de la enfermedad. En un episodio de PA, la amilasa, la lipasa, la elastasa y la tripsina se liberan al torrente sanguíneo al mismo tiempo, pero el aclaramiento sérico varía según el momento en que se tome la muestra 1.
La amilasa es una enzima secretada por el páncreas, las glándulas salivales, el intestino delgado, los ovarios, el tejido adiposo y el músculo esquelético. En PA, los niveles séricos de amilasa generalmente aumentan en las primeras 6 a 24 horas, alcanzan su punto máximo a las 48 horas y disminuyen a niveles normales o casi normales en los próximos 3 a 7 días 22.
La PA es la razón principal de elevación en la lipasa sérica, pero puede encontrarse elevada también en otras patologías como enfermedad renal, apendicitis, colecistitis aguda, pancreatitis crónica y obstrucción intestinal. En PA, la lipasa sérica permanece elevada durante un período más prolongado que la amilasa sérica. Se eleva en las primeras 4 a 8 horas, alcanza su punto máximo a las 24 horas y disminuye a niveles normales o casi normales en los próximos 8 a 14 días 2,22.
Una revisión de Cochrane con el objetivo de comparar la precisión de diferentes enzimas pancreáticas en el diagnóstico de PA mostró una sensibilidad de 72 % y una especificidad de 93 % para la amilasa sérica, y una sensibilidad de 79 % y una especificidad de 89 % para la lipasa sérica. Aunque ninguna prueba individual muestra una precisión diagnóstica óptima, la mayoría de las guías y recomendaciones actuales indican que la lipasa debe preferirse a la amilasa 1.
En ausencia de cálculos biliares o antecedentes significativos de consumo de alcohol, el nivel de triglicéridos séricos debe medirse y considerarse como la causa de la PA si el valor es mayor de 1000 mg/dl (11,3 mmol/l) 2.
Se han estudiado numerosos biomarcadores como posibles predictores tempranos de severidad en PA para adaptar el tratamiento de manera óptima y prevenir complicaciones 22. Actualmente, ninguna prueba de laboratorio es consistentemente precisa para predecir la gravedad en pacientes con PA, sin embargo, muchos estudios resaltan el valor de la proteína C reactiva (PCR) para la evaluación de la gravedad de la enfermedad. Con un valor de corte de 110 a 150 mg/l en el momento del ingreso al hospital, la sensibilidad osciló entre el 38 y el 61 % y la especificidad entre el 89 y el 90 %. El principal inconveniente de la PCR es que los niveles máximos se alcanzan solo después de 48 a 72 horas 22.
Otros estudios de laboratorio utilizados para predecir un curso severo de la enfermedad son el nitrógeno ureico (BUN) mayor de 20 mg/dl (> 7,14 mmol/l) o en aumento, el hematocrito (HCT) mayor de 44 % o en aumento, el lactato deshidrogenasa (LDH) y la procalcitonina, que puede predecir necrosis sobreinfectada en pacientes con necrosis pancreática confirmada 23. Un valor de procalcitonina de 3,8 ng/ml o más dentro de las 96 horas posteriores al inicio de los síntomas indica sobreinfección de un area necrotica con una sensibilidad del 93% y una especificidad del 79 % 22. También se ha demostrado que niveles elevados de lactato sérico al ingreso pueden predecir PA severa, muerte e ingreso en la UCI, pero deben considerarse subóptimos como marcadores únicos 1.
Escalas de predicción de severidad y mortalidad
Determinar la severidad del paciente con PA de manera precoz es trascendental para definir la necesidad de monitoreo continuo o avanzado en unidades de cuidados intermedios o intensivos, del inicio de terapia y de una evaluación completa del riesgo de morbimortalidad 24.
Como se ha descrito, un paciente con PA puede ser clasificado como severo de acuerdo a los postulados de Atlanta o el índice de severidad por TC, además de múltiples sistemas de puntuación, con evidencia variable sobre su rendimiento para predecir la PA severa 24. Estos puntajes de predicción se centran en la muerte como desenlace y la mayoría tardan más de 24 horas en estadificar a los pacientes, lo cual puede representar la pérdida de tiempo valioso en el paciente crítico 1. En general, se basan en la demografía del paciente, las características clínicas, los parámetros de laboratorio o hallazgos en imágenes diagnósticas, y se evalúan al ingreso o dentro de las primeras 48 horas 25.
Un estudio de 161 pacientes comparó la capacidad de predicción temprana de los puntajes más ampliamente utilizados en PA. Se encontró que los valores de corte significativos para la predicción de PA grave fueron Ranson ≥ 3, BISAP ≥ 3, APACHE-II ≥ 8, CTSI ≥ 3 y PCR a las 24 horas ≥ 210 mg/l. Además, evaluó el área bajo la curva (AUC) de cada uno y de manera significativa el resultado para los criterios de Ranson fue AUC 0,69 (S 85,7 %, E 44,3 %, VPP 18,8 %, VPN 95,3 %); para el BISAP fue AUC 0,74 (S 61,9 %, E 72,1 %, VPP 25 %, VPN 92,7 %), y para el APACHE-II fue AUC 0,78 (S 81 %, E 65,7 %, VPP 26,2 %, VPN 95,8 %). Se concluyó que aunque los diferentes sistemas de puntuación tienen una precisión predictiva similar para la severidad en PA, el APACHE-II es el más preciso, seguido de cerca por el BISAP 26.
El APACHE-II no es específico para PA, pero cuenta con la ventaja de ser un instrumento ampliamente validado, que se puede aplicar en cualquier momento del curso de la enfermedad. La desventaja es que incluye parámetros que pueden ser considerados engorrosos y no recopilados de forma rutinaria 1. El BISAP, un sistema de puntuación pronóstico desarrollado en años recientes, ha sido acogido como un método simple para la predicción de PA severa en comparación con los sistemas de puntuación tradicionales. Se diseñó utilizando datos de una población de 17.992 pacientes y fue validado en una población de 18.256 pacientes en los Estados Unidos 26. Tiene la ventaja de ser un sistema de puntuación sencillo, que se aplica fácilmente en las primeras fases de la enfermedad, con una precisión similar al APACHE-II para predecir mortalidad. Uno de los puntos clave de este estudio es que fue capaz de identificar a los pacientes con mayor riesgo de mortalidad antes del inicio de la insuficiencia orgánica 24. Un análisis retrospectivo de 303 pacientes también reveló que el BISAP predice la gravedad, la mortalidad y especialmente, la falla orgánica en PA, con el mismo rendimiento del APACHE-II, y mejor que los criterios de Ranson, el índice de gravedad de CT, la PCR y el hematocrito. La puntuación BISAP de 2 fue el corte estadísticamente significativo para el diagnóstico de pancreatitis aguda grave, insuficiencia orgánica y mortalidad 27.
Tratamiento
Líquidos endovenosos
La terapia con líquidos para prevenir o tratar la hipovolemia y la hipoperfusión tisular es la piedra angular del tratamiento inicial de la PA. Los estudios en humanos con PA que evaluaron la hidratación temprana (dentro de las primeras 24 horas) demostraron una disminución tanto en la morbilidad como en la mortalidad 2,26. También se evidenció que el volumen total de hidratación a las 48 horas después del ingreso parece tener poco o ningún impacto en el resultado del paciente. La hidratación intravenosa agresiva temprana (250-500 ml por hora), durante las primeras 6 a 24 horas, con una estrecha vigilancia, es de suma importancia 2.
La terapia con líquidos dirigida por metas se define como la titulación de fluidos intravenosos de acuerdo con parámetros de perfusión clínicos y bioquímicos (por ejemplo, frecuencia cardíaca, presión arterial media, presión venosa central, gasto urinario, BUN, lactato, base exceso y hematocrito). Se ha demostrado que su uso reduce la mortalidad en la sepsis, una condición con similitudes fisiológicas a la PA. Es importante tener en cuenta que la hidratación temprana agresiva requiere precaución en ciertos grupos de pacientes, como ancianos y aquellos con antecedentes de enfermedad cardíaca o renal, para evitar complicaciones como sobrecarga de volumen, edema pulmonar y síndrome de compartimiento abdominal 2,3.
Analgesia
Como se mencionó, el dolor es el síntoma cardinal de la pancreatitis aguda y su alivio es una prioridad clínica. Todos los pacientes con pancreatitis aguda deben recibir algún tipo de analgesia en las primeras 24 horas de hospitalización para no comprometer su calidad de vida. En la mayoría de las instituciones, se prefieren los opioides sobre los AINES, y de estos la hidromorfona sobre la morfina o el fentanilo en el paciente no intubado. A pesar de algunos estudios clínicos aleatorizados, sigue habiendo incertidumbre sobre el analgésico preferido y el mejor método de administración 1,8.
Nutrición
El dogma tradicional en el tratamiento de la PA prescribía el “reposo intestinal”, en un intento de evitar una mayor estimulación del páncreas inflamado. Sin embargo, la evidencia actual demuestra beneficio en el enfoque opuesto, es decir, la alimentación temprana. Se ha comprobado que mantener la nutrición enteral ayuda a proteger la mucosa intestinal y a reducir la translocación bacteriana, disminuyendo así el riesgo de sobreinfección de necrosis peripancreática y otros desenlaces adversos de la PA 28.
Los resultados combinados de 11 ensayos clínicos aleatorizados (ECA) que abordaron el papel de la alimentación temprana (primeras 24 horas) versus tardía no demostraron diferencias en la mortalidad. Sin embargo, hubo un riesgo 2,5 veces mayor de intervenciones quirúrgicas por necrosis asociada con la alimentación tardía versus temprana (OR 2,47; IC95% 1,41-4,35), así como tasas más altas de necrosis peripancreática sobreinfectada (OR 2,69; IC95% 0,80-3,60), insuficiencia orgánica múltiple (OR 2,00; IC95% 0,49-8,22) y pancreatitis necrosante total (OR1,84; IC95% 0,88-3,86) con la alimentación tardía 3.
La nutrición enteral en comparación con la nutrición parenteral total disminuye las complicaciones infecciosas, la insuficiencia orgánica y la mortalidad. En 12 ECA que compararon el uso de nutrición parenteral total versus alimentación enteral (vía oral o sonda enteral) en pacientes con PA se encontró evidencia suficiente para apoyar el beneficio de la nutrición enteral sobre la nutrición parenteral total con respecto al riesgo reducido de necrosis peripancreática sobreinfectada (OR 0,28; IC95% 0,15-0,51), falla orgánica única (OR 0,25; IC95% 0,10-0,62) y falla orgánica múltiple (OR 0,41; IC95% 0,27-0,63) 3.
En cuanto al traslado a unidad de cuidado intensivo, la mayoría de las guías a nivel mundial concuerdan en que los pacientes con pancreatitis aguda severa o falla orgánica instaurada deben ser ingresados para garantizar un adecuado tratamiento y monitoria avanzada continua de las variables vitales, lo cual es crucial en el escenario de administración agresiva de líquidos, el manejo adecuado del dolor con estrategias potencialmente dañinas y la evaluación de la función orgánica 1,2,3,19.
Colangio pancreatografía retrógrada endoscópica
En cuanto al uso rutinario de CPRE en paciente con PA de origen biliar, una revisión sistemática de siete ECA que incluyó a 757 participantes no encontró evidencia para apoyar esta conducta. Además, entre los ECA que incluyeron pacientes con colangitis sin obstrucción de la vía biliar, la CPRE temprana rutinaria aumento significativamente la mortalidad, así como las complicaciones locales y sistémicas 29. Por el contrario, en pacientes con obstrucción biliar demostrada, la CPRE temprana rutinaria se asoció con una reducción significativa de las complicaciones locales y una tendencia no significativa hacia la reducción de las complicaciones sistémicas 29. Por lo anterior la CPRE tiene indicación únicamente en PA con obstrucción de la vía biliar comprobada.
Manejo antibiótico
La evidencia reciente ha demostrado que los antibióticos profilácticos en pacientes con pancreatitis aguda no están asociados a una disminución significativa de la mortalidad o la morbilidad, por lo que no se recomiendan 30.
La antibioticoterapia está indicada en el manejo de la pancreatitis aguda sobreinfectada. El diagnóstico de la infección de los focos de necrosis pancreática es desafiante debido a que el cuadro clínico en ocasiones no se puede distinguir de otras complicaciones infecciosas o del estado inflamatorio causado por la enfermedad misma 1. Se puede sospechar clínicamente en un paciente con PA severa, con necrosis pancreática previamente evidenciada por imágenes (generalmente TC) y un curso tórpido pese al adecuado manejo. Varios estudios han demostrado que las mediciones séricas de procalcitonina pueden ser valiosas para el diagnóstico de la sobreinfección 23,31. La presencia de gas en el retroperitoneo también sugiere el compromiso infeccioso en el escenario de PA severa, pero solo se presenta en un número limitado de pacientes 31.
La patogenia de la infección bacteriana secundaria de la necrosis pancreática todavía se debate. Los patógenos pueden llegar al páncreas por vía hematógena, por vía ascendente desde el duodeno a través del conducto pancreático principal, o mediante la migración transmural por translocación de las bacterias desde el colon. La mayoría de los patógenos en la necrosis pancreática infectada son bacterias Gram negativas gastrointestinales 1,32.
Bajo una fuerte sospecha clínica y paraclínica de PA sobreinfectada, se indica el inicio de antibioticoterapia empírica. Los antibióticos seleccionados deben tener una adecuada penetración en el tejido pancreático. Entre los comúnmente indicados se incluyen piperacilina/tazobactam, quinolonas (ciprofloxacino o moxifloxacino), metronidazol y carbapenémicos 1.
Posteriormente se debe realizar la comprobación microbiológica, para la cual el estudio de elección es la punción de las áreas necróticas pancreáticas, guiada por imágenes, generalmente ultrasonido endoscópico. Se obtienen muestras para tinción de Gram y cultivo que sirve de guía para elegir un régimen antibiótico individualizado apropiado 33,34.
Manejo percutáneo y endoscópico
La publicación del estudio PANTER ha solidificado las intervenciones escalonadas como el estándar de tratamiento en la PA 35. En general, los pacientes con PA no requieren intervenciones invasivas, sin embargo, existen escenarios puntuales en los cuales el paciente se puede beneficiar de las mismas. Siempre procurarse realizar en primera instancia el procedimiento menos invasivo efectivo 1.
En cuanto a las complicaciones locales, la mayoría de los pacientes pueden tratarse sin intervenciones invasivas. Las colecciones peripancreáticas agudas resuelven casi en su totalidad en los primeros 7-10 días. Solo un 6 % de las colecciones peripancreáticas se convierten en pseudoquistes pancreáticos, los cuales tienden a resolver espontáneamente hasta en el 70 % de los casos, por lo que pueden ser manejados con observación e imágenes de control. Tienen indicación de drenaje si durante el seguimiento a 6 meses el paciente desarrolla síntomas como dolor abdominal, ictericia, saciedad temprana o fiebre, o se logra demostrar un crecimiento del pseudoquiste en el control imagenológico 36.
Las colecciones necróticas agudas y las colecciones necróticas “amuralladas” son en un principio estériles y tienden a resolver espontáneamente con el manejo de soporte para la PA. Sin embargo, en presencia de deterioro clínico, toxicidad sistémica o ante la sospecha por imágenes de sobreinfección, se debe obtener una punción-aspiración con aguja fina guiada por imágenes para confirmar la infección. Las indicaciones para intervención sin signos que hagan sospechar infección incluyen la presencia de obstrucción mecánica (gástrica, intestinal o biliar) y los síntomas persistentes por más de 8 semanas posterior al diagnóstico de PA 5.
El drenaje de las colecciones suele ser individualizado y se basa en múltiples características que incluyen la localización, extensión y comunicación con ductos pancreáticos y estado clínico del paciente. Debido a que las colecciones suelen encontrarse en estrecho contacto con las paredes gástricas o duodenales, el procedimiento de elección suele ser un drenaje transmural guiado por ecoendoscopia, donde se crea un tracto entre la colección y el lumen gástrico o duodenal mediante la colocación de stents metálicos de hasta 10 F o 20 mm de diámetro. En ocasiones también se hace desbridamiento directo del material necrótico mediante visión e instrumental endoscópico 5.
Una revisión sistemática de 11 estudios y 384 pacientes que evaluó el drenaje percutáneo con catéter como tratamiento primario para la pancreatitis necrosante, encontró necrosis sobreinfectada en el 71 % de los pacientes y el 56 % no requirió cirugía después del drenaje percutáneo 37. Adicionalmente, el drenaje percutáneo permite retrasar una posible intervención quirúrgica subsecuente para un momento más favorable.
Manejo quirúrgico
Cuando el manejo conservador y las estrategias percutáneas o endoscópicas fallan en mejorar la condición del paciente, se debe considerar necrosectomía por cirugía vía laparoscópica, cirugía abierta o una combinación de ambas. Como se demostró en un metaanálisis del 2014, estas intervenciones mayores provocan una mayor respuesta inflamatoria que puede comprometer a un paciente críticamente enfermo y con reservas fisiológicas depletadas, por lo que deben utilizarse solo ante la imposibilidad o fallo de las estrategias mínimamente invasivas mencionadas 34.
La colecistectomía es otro punto importante en el manejo de la PA de origen biliar. Dos revisiones sistemáticas diferentes indican que la colecistectomía temprana (primeras 72 horas) para PA leve es segura 38,39. Un ECA multicéntrico con 266 pacientes concluyó que la colecistectomía realizada luego del egreso del paciente resultó en un mayor número de complicaciones, especialmente pancreatitis recurrente y cólico biliar 39.
El síndrome de compartimiento abdominal, una entidad con mortalidad de hasta el 60 % que ocurre en pacientes con PA severa, es otra indicación de manejo quirúrgico. Se debe considerar la descompresión quirúrgica por laparotomía cuando los métodos conservadores son insuficientes 40. Las complicaciones hemorrágicas en la PA severa, como la trombosis venosa esplénica o los pseudoaneurismas, pueden justificar intervenciones quirúrgicas si el abordaje endovascular no tiene éxito. Las complicaciones intestinales y otras complicaciones extrapancreáticas son relativamente raras, pero pueden requerir cirugía 1.
Conclusiones
La pancreatitis aguda es una condición inflamatoria del páncreas que posee alta carga de enfermedad y una morbimortalidad considerable una vez toma un curso severo. La mayoría de los pacientes presentan un cuadro de dolor agudo en el abdomen superior como manifestación principal. La elevación de las enzimas pancreáticas es la mejor herramienta para su diagnóstico, especialmente la lipasa pancreática. Junto con el diagnóstico, es fundamental clasificar la enfermedad de acuerdo con su severidad y riesgo de mortalidad, ya que esto permite enfocar el tratamiento y definir la necesidad de monitoreo y reanimación especializada. A la fecha, el tratamiento continúa siendo principalmente de soporte, con indicaciones puntuales para el manejo antibiótico y el uso de maniobras mínimamente invasivas o quirúrgicas, que deben irse escalonando de menos a más.