Introducción
El trasplante renal es la mejor opción en los pacientes con enfermedad renal crónica (ERC) en estados avanzados 1,2. Según el informe de la red de donación de trasplantes, para el 2022 en Colombia se encontraban 3328 pacientes en lista de espera para trasplante renal y se realizaron 822 de estos procedimientos, es decir que solo un 24 % de pacientes fueron beneficiados, demostrando una brecha entre la cantidad de órganos disponibles para trasplante y la demanda por un órgano. Por otro lado, más del 70 % de trasplantes renales en Colombia son con donante cadavérico y menos del 30 % con donante vivo 3. La asignación de órganos de donantes fallecidos implica que se evalúen los pacientes en la lista de espera y se otorguen puntos basados en factores como la edad, el tiempo en la lista, la compatibilidad de grupo sanguíneo y los antígenos leucocitarios humanos (HLA) DR, B y A 4.
Los antígenos leucocitarios humanos (HLA) son un grupo de proteínas que se encuentran en las superficies celulares y están codificadas por los genes del complejo de histocompatibilidad (MHC) 5. Son fundamentales para la vigilancia inmunológica, permitiendo reconocer las células propias, patógenas o tumorales 6. Los HLA se dividen en clase I, II y III según sus propiedades químicas y biológicas, pero solo lo de clase I (HLA-A, B y C) y II (HLA-DR, DQ y DP) juegan un rol relevante en la inmunología de los trasplantes 7. Estos son especialmente significativos en el desarrollo de anticuerpos específicos para los antígenos de HLA, dado que la generación de este tipo de anticuerpos puede llevar a un rápido rechazo del órgano 6.
Estudios previos demuestran que la compatibilidad o incompatibilidad (mismatch) del HLA son factores relevantes para los desenlaces del injerto renal a largo plazo. Dentro de los más distinguidos se encuentran los publicados por el estudio colaborativo en trasplante (CTS, por sus siglas en inglés), en donde se demostró la utilidad e importancia del HLA en el trasplante renal de pacientes adultos 8,9o pediátricos 10,11, con donante cadavérico 11-13o con donante vivo 11,14,15. Inicialmente, sistemas de salud como el de los Estados Unidos consideraban estos factores en la asignación de órganos, pero descubrieron una dificultad significativa para encontrar compatibilidades perfectas, que se empeoraba en las minorías étnicas 16. Además, la evidencia reciente de que la compatibilidad en los HLA A y B no está asociada significativamente con la pérdida del injerto 16,17llevó a retirar estos factores del modelo de asignación de órganos en el país y dejar únicamente la compatibilidad del HLA DR 18,19.
Dada la importancia del trasplante renal por donante cadavérico en Colombia, la brecha entre oferta y demanda de órganos y los cambios en la evidencia sobre compatibilidad del HLA y los desenlaces del trasplante, el objetivo principal de este estudio fue evaluar por medio de un propensity score matching la asociación entre la compatibilidad del HLA A, B y DR y la sobrevida del injerto de pacientes trasplantados renales con donante cadavérico, ajustando las covariables edad, sexo, IMC, etiología de la ERC, tipo de diálisis previa, tiempo de isquemia fría, donante cadavérico con criterios extendidos y tipo de inducción.
Métodos
Estudio de una cohorte retrospectiva de pacientes trasplantados renales en Colombiana de Trasplantes, con donante cadavérico, desde julio de 2008 hasta mayo de 2023. El muestreo fue consecutivo a conveniencia. Se excluyeron pacientes menores de edad y los pacientes en quienes no se pudo recuperar la información sobre la compatibilidad del HLA. Se agruparon los pacientes con compatibilidad parcial o total del HLA DR, B y A.
El desenlace principal fue la pérdida del injerto, definida como el regreso a diálisis de forma definitiva posterior al trasplante. Se incluyeron variables de caracterización clínica pretrasplante como comorbilidades (hipertensión arterial, diabetes, enfermedad pulmonar crónica y antecedente quirúrgico), edad, sexo, índice de masa corporal (IMC), tipo de diálisis previa (hemodiálisis, peritoneal o pre-diálisis), etiología de la enfermedad renal crónica (congénita, desconocida, diabetes, glomerular, hipertensión arterial, obstructiva y otra). Adicionalmente, se evaluaron las variables relacionadas con el trasplante, como el tipo de inducción (Alemtuzumab, Basiliximab, Globulina antitimocítica y otros), el número de trasplante, el tiempo de isquemia fría, la compatibilidad del HLA A-B-DR y el resultado cualitativo del PRA para HLA I y II.
Aunque los estudios observacionales son relevantes por la gran cantidad de datos históricos que se pueden recolectar, corren el riesgo de presentar diferencias sistemáticas en las características de los grupos de comparación, lo cual puede sesgar los resultados obtenidos 20-22. Por lo tanto, para el análisis estadístico se consideró utilizar un propensity score matching (PSM), el cual por medio de un puntaje (propensity score-PS) agrupa y estratifica los grupos de comparación para que tengan covariables similares, reduciendo el sesgo de confusión en los resultados 22.
El PSM se utilizó para ajustar los grupos de comparación, con compatibilidad parcial o total y sin compatibilidad del HLA DR, B y A, siguiendo la metodología de pasos descrita por Zhao QY, et al. 22. Primero se realizó una imputación múltiple por medio del paquete MICE 23. En segundo lugar, se ajustaron los grupos en el PSM por variables estadísticas y clínicamente significativas. Las variables estadísticamente significativas fueron obtenidas por medio de una regresión logística con selección automática por AIC (criterio de información de Akaike) para cada grupo de exposición (Compatibilidad parcial o total HLA DR). Las variables clínicamente significativas incluían aspectos inmunológicos y clínicos que están asociados con la sobrevida del injerto (edad, sexo, donante con criterios expandidos, PRA I-II e isquemia fría).
En el tercer paso, se probaron los métodos de agrupamiento del “vecino más cercano” y “optimo”. Luego se verificó la robustez y el balance del agrupamiento por medio de una diferencia promedio estandarizada (SMD) menor de 0,25, un radio de varianza (VR) entre 0,5-2 y una evaluación gráfica; se eligió el método de agrupamiento con el mejor balance 22,24,25. Finalmente, se obtuvieron los grupos ajustados por PSM, a los cuales se les aplicó estadística descriptiva y bivariada, comparando los pacientes con y sin compatibilidad por HLA A, B y DR.
Según la distribución de las variables, se utilizó la prueba t de Student y la U de Mann Whitney para las numéricas, y la prueba de chi cuadrado y Fisher para las categóricas. Se realizó un análisis de supervivencia por Kaplan-Meier para pérdida del injerto y por medio de la prueba de log rank se comparó la supervivencia del riñón en pacientes con y sin compatibilidad. Adicionalmente, se creó un modelo de Cox para cuantificar la asociación de la compatibilidad en el desenlace principal, describiendo los hazard ratios (HR) con su respectivo intervalo de confianza y valor p. La significancia estadística se definió con un valor p menor a 0,05. Todos los análisis se realizaron en el programa estadístico de R Studio versión 4.2.2.
Resultados
En el tiempo de observación se realizaron 1455 trasplantes renales con donante cadavérico, 1337 receptores fueron incluidos en el análisis y 118 pacientes fueron excluidos al no poder recuperar la información de compatibilidad del HLA. Los pacientes incluidos eran en un 38,7 % femeninos, con una mediana de edad de 47 años y un IMC de 23,8 kg/m2 (Tabla 1). Entre los antecedentes fueron prevalentes la hipertensión arterial (71 %), la diabetes mellitus (17,9 %) y el antecedente quirúrgico (91,6 %). La etiología de la ERC era desconocida en un 46,2 % y el tipo de diálisis más frecuente fue la hemodiálisis (59,2 %) comparado con la peritoneal (35,8 %). Los pacientes presentaron un Panel Reactivo de Anticuerpos (PRA) I y II positivo en el 60 % y el 20,9 % fueron donantes de criterios expandidos, con una mediana de isquemia fría de 15 horas e inducción con globulina antitimocítica en el 58 % de casos.
Tabla 1. Análisis descriptivo y bivariado de la población total y los grupos ajustados por propensity score matching para compatibilidad/incompatibilidad según HLA A, B y DR.
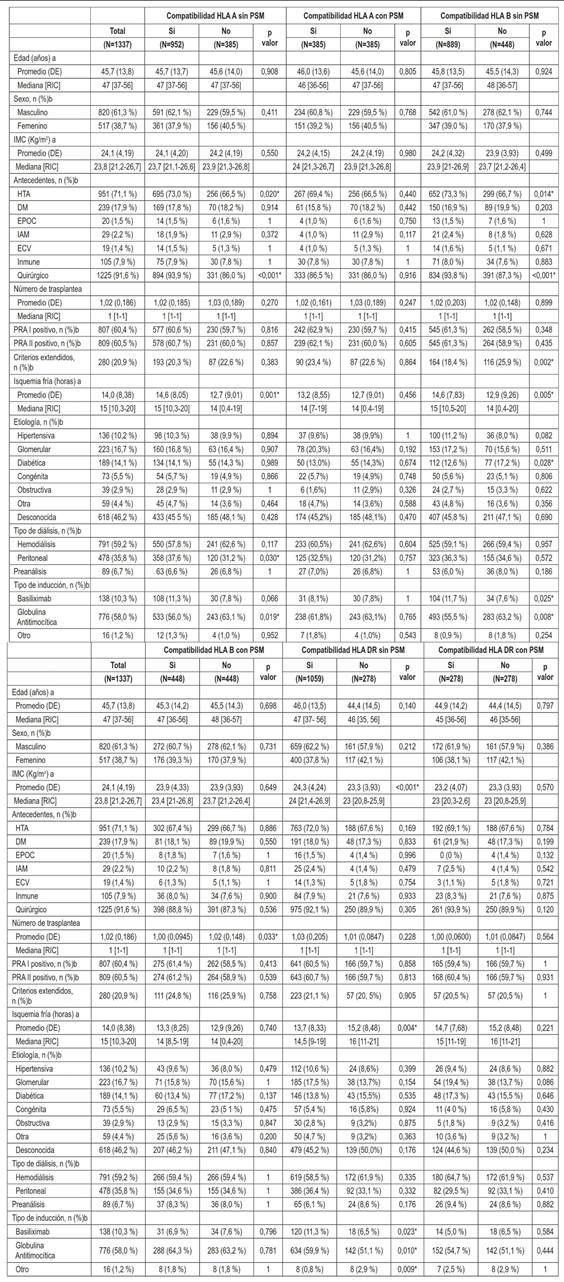
DE: Desviación estándar; RIC: Rango inter cuartílico; IMC: Índice de masa corporal; HTA: Hipertensión arterial; DM: Diabetes Mellitus; EPOC: Enfermedad pulmonar obstructiva crónica; IAM: Infarto agudo de miocardio; ECV: Enfermedad cerebrovascular. a: Prueba de la U de Mann Whitney b: Prueba de chi cuadrado *Resultado estadísticamente significativo con una p<0.05.
Compatibilidad del HLA A
Al comparar los pacientes con compatibilidad parcial o total del HLA A y los que tenían una incompatibilidad completa se encontraron diferencias significativas en la prevalencia de hipertensión arterial (p=0,02), antecedentes quirúrgicos (p<0,001), tiempo de isquemia fría (p=0,001), tipo de diálisis peritoneal (p=0,03) y tipo de inducción con globulina antitimocítica (p=0,01). Al realizar el agrupamiento por PSM se crearon dos grupos de 385 pacientes cada uno, con todas las variables balanceadas y sin diferencias significativas en el análisis bivariado.
Al comparar la sobrevida del injerto renal de los pacientes, se calculó una tasa de supervivencia a un año del 84,6 % (IC95% 81-88,4 %) y a cinco años del 78 % (IC95% 73,1-83,4 %) para los pacientes con compatibilidad y del 85,5 % (IC95% 82-89,2 %) y del 75,3 % (IC95% 69,9-81,2 %) respectivamente para los pacientes con incompatibilidad de HLA A (Figura 1). Al realizar la prueba de log rank no se encontraron diferencias estadísticamente significativas (p=0,9) y en la regresión de Cox se estimó un HR de 0,99 (IC95% 0,71-1,37; p=0,95).
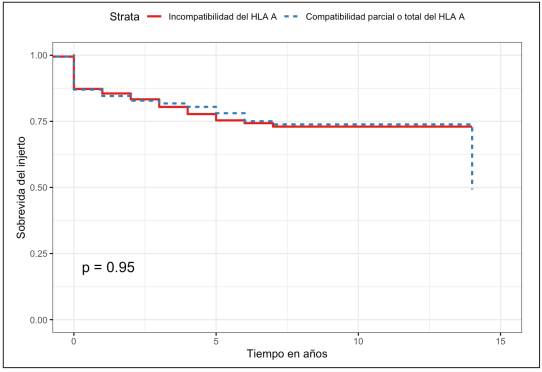
Figura 1. Curva de Kaplan Meier para sobrevida del injerto en pacientes con compatibilidad/incompatibilidad del HLA A.
Compatibilidad del HLA B
Se encontraron diferencias estadísticamente significativas al comparar los pacientes con compatibilidad (parcial o total) e incompatibilidad del HLA B en la prevalencia de hipertensión arterial (p=0,01), antecedentes quirúrgicos (p<0,001), frecuencia de trasplantes con criterios expandidos (p=0,002), tiempo de isquemia fría (p=0,005), etiología diabética (p=0,02), tipo de inducción con globulina antitimocítica (p=0,008) y con basiliximab (p=0,02). Después de aplicar la técnica del PSM se formaron dos grupos de 448 pacientes, la única variable que no se logró balancear y tuvo diferencias significativas en el análisis bivariado fue el número de trasplante (p=0,03).
En el análisis de supervivencia se encontró una sobrevida del injerto en pacientes con compatibilidad HLA B a un año de 87 % (IC95% 84,9-91,1 %) y a 5 años de 79,6 % (IC95% 74,9-84,6 %) (Figura 2), mientras que en los pacientes con incompatibilidad se evidenció una sobrevida a un año del 82 % (IC95% 78,3-85,8 %) y a cinco años del 73 % (IC95% 68-78,5 %). Pero la diferencia no fue estadísticamente significativa al aplicar la prueba de log rank (p=0,065). Dado que no se logró balancear el número de trasplantes por PSM, se incluyó en la regresión de Cox evidenciando un HR para compatibilidad del HLA B de 0,75 (IC95% 0,55-1,02; p=0,072).
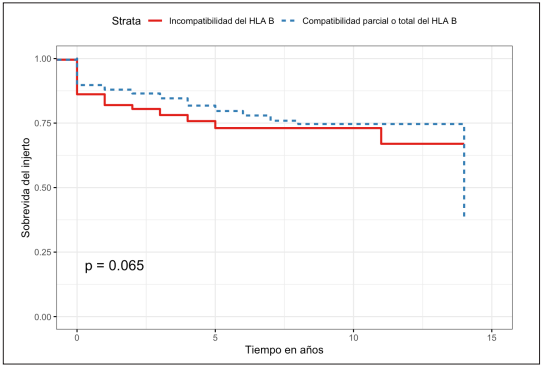
Figura 2. Curva de Kaplan Meier para sobrevida del injerto en pacientes con compatibilidad/incompatibilidad del HLA B.
Compatibilidad del HLA DR
Las variables con diferencias estadísticamente significativas entre los pacientes con y sin compatibilidad del HLA DR fueron el IMC (p<0,001), la isquemia fría (p=0,004) y los tipos de inducción con basiliximab (p=0,02), globulina antitimocítica (p=0,01) y otro esquema (p=0,009). Posterior a la aplicación del PSM se crearon dos grupos de 278 pacientes cada uno, sin diferencias significativas en el análisis bivariado y con todas las variables balanceadas.
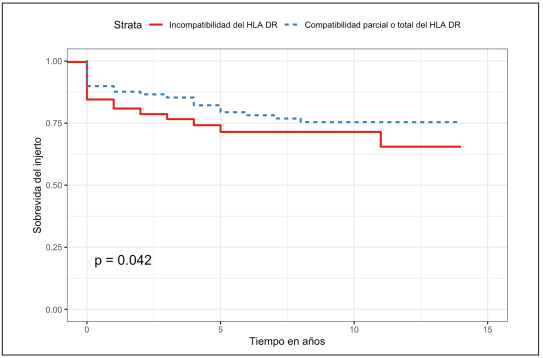
Al comparar la sobrevida del injerto renal se encontró una tasa de supervivencia a un año del 87,6 % (IC95% 83,7-91,7 %) y a cinco años del 79,4 % (IC95% 73,6-85,5 %) para los pacientes con compatibilidad y de 80,9 % (IC95% 76,2-85,8 %) y 71,4 % (IC95% 65,2-78,2 %) para los pacientes con incompatibilidad de HLA DR (Figura 3). Al realizar la prueba de log rank se observó una diferencia estadísticamente significativa (p=0,042) y en la regresión de Cox un HR de 0,67 (IC95% 0,46-0,98; p=0,04).
Discusión
Dentro de los hallazgos más relevantes de esta investigación se encontró que al ajustar los grupos de comparación por PSM, solo la compatibilidad del HLA DR tuvo asociación estadísticamente significativa con la sobrevida del injerto. Al ajustar las covariables, la compatibilidad por HLA A y B no tuvó una asociación significativa con la pérdida del injerto en trasplantados de donante cadavérico. Este mismo fenómeno fue descrito en 2018 en un metaanálisis 17 de 23 estudios y 486.000 receptores de trasplante renal, en donde se incluyeron cuatro estudios y 146.000 pacientes que evaluaron la relación del HLA B con la pérdida del injerto, encontrando un HR no significativo de 1,01 (IC95% 0,9-1,15; p=0,83). De igual manera, para estudiar la asociación del HLA A incluyeron tres estudios con más de 40.000 receptores, reportando de nuevo un HR no significativo de 1,06 (IC95% 0,9-1,15; p=0,83). Los resultados del HLA A y B fueron confirmados en análisis de sensibilidad posteriores.
Algunos autores sugieren que la disminución de la relevancia del HLA en los desenlaces del trasplante renal puede deberse a los avances en la inmunosupresión, así como a la priorización de otros factores como la edad del donante y el trasplante por donante vivo 26,27. Las cohortes multicéntricas internacionales, como las del estudio colaborativo de trasplantes, han demostrado en múltiples ocasiones y poblaciones que los pacientes con incompatibilidad del HLA A-B-DR tienen menor sobrevida del injerto 10-12,15. Otros estudios recientemente publicados demostraron la relevancia de la compatibilidad del HLA en trasplante con donante cadavérico y criterios expandidos 13. Lim WH, et al. 27 en una cohorte de 8036 trasplantes renales estudiaron la incompatibilidad del HLA A-B-DR en un subgrupo de donantes cadavéricos, reportando un HR ajustado de 1,58 (IC95% 1,07-2,34). Adicionalmente, reportaron un HR de 1,41 (IC95% 1,11-1,79) para los pacientes con incompatibilidades del HLA A y B, y de 1,22 (IC95% 1,05-1,42) para la incompatibilidad completa del HLA DR.
Visto este fenómeno desde una perspectiva de salud pública, la asociación del HLA con los desenlaces del trasplante renal ha determinado la asignación de órganos en distintos países del mundo. En países como Estados Unidos, el HLA A y B ya no son tenidos en cuenta dentro del puntaje de asignación, al considerar una relevancia menor en los desenlaces del trasplante y una elevada dificultad para su compatibilidad en las minorías étnicas 18,19. De forma similar, en Reino Unido se estudió una cohorte de 7350 receptores de trasplante renal encontrando que el HLA A no tenía efecto en los desenlaces del trasplante, pero que el B y el DR sí impactaban la pérdida del injerto 28,29, por lo cual, en el sistema de asignación de órganos del Reino Unido para trasplante renal de donante cadavérico se eliminó el criterio de compatibilidad del HLA A 29.
Por el contrario, países y asociaciones como Australia, Nueva Zelanda, Canadá, EuroTransplant (Austria, Bélgica, Alemania, Luxemburgo, Holanda y Eslovenia) y ScandiaTransplant (Dinamarca, Finlandia, Noruega, Suecia e Islandia) continúan considerando el HLA A-B-DR dentro de sus sistemas de asignación de órganos 30-33. Es importante resaltar que estas políticas de asignación de órganos en su mayoría están soportadas con datos de cohortes nacionales que permiten entender los factores asociados a los desenlaces del trasplante renal y las particularidades del funcionamiento del sistema.
Entendiendo la brecha entre la oferta y demanda de órganos en Colombia, especialmente en el trasplante renal, en donde un 76 % de pacientes en lista de espera no recibieron un trasplante en 2022 3, algunos autores han propuesto expandir la presunción legal de la donación de órganos, así como la creación de un programa de intercambio de riñones 34. De igual manera, se hace relevante el entendimiento y estudio del rol del HLA, especialmente los A y B, en el proceso de asignación de órganos del país.
En Colombia, el sistema de asignación de órganos en trasplante renal se realiza por medio de un puntaje que contempla ocho aspectos 4:
1 El nivel geográfico, en donde se prioriza una asignación local, si no se encuentra, se pasa a un receptor regional y por último Nacional.
2 El grupo sanguíneo, el cual confiere entre 0-15 puntos en caso de compatibilidad.
3 La relación del grupo etario del receptor y del donante: si el donante es menor de 30 años y el receptor de 60 se suman 2 puntos, si el donante y el receptor son mayores de 60 años se otorgan 2 puntos y si son menores de 18 años 4 puntos.
4 Los pacientes pediátricos con donantes menores de 35 años pueden recibir entre 6-9 puntos.
5 El antecedente de donante vivo suma 4 puntos o el de haber manifestado una voluntad positiva en el registro nacional de donantes 1 punto.
6 El tiempo en lista de espera suma un punto por cada año enlistado.
7 El estado compasivo que aplica a nivel local para pacientes con riesgo de pérdida del acceso vascular o sin posibilidad de diálisis peritoneal.
8 La compatibilidad del HLA, en donde el HLA DR totalmente compatible genera 12 puntos y parcialmente 6 puntos, la compatibilidad completa por A y B generan 4 puntos y la compatibilidad completa de HLA A-B-DR aporta 10 puntos más. En total un paciente con compatibilidad completa de HLA DR tendría 12 puntos, un paciente con compatibilidad completa de HLA A-B tendría 4 puntos y un paciente con compatibilidad completa de HLA A-B-DR tendría 26 puntos.
Por lo tanto, en nuestro país la compatibilidad del HLA A y B puede marcar la diferencia para que un paciente reciba o no un trasplante renal, lo cual debería ser estudiado a la luz de la evidencia actual presentada sobre el rol del HLA A y B en la pérdida del injerto.
Los resultados aquí presentados tienen que entenderse dentro de las limitaciones de la investigación. Primero, el carácter retrospectivo del estudio disminuye la calidad de la información recolectada. Segundo, al ser un estudio observacional tiene un riesgo aumentado de sesgos y factores de confusión, los cuales se redujeron por medio de utilización del propensity score matching. Tercero, el PSM consideró principalmente factores del receptor y del trasplante, haciendo falta la estratificación por condiciones del donante. Cuarto, los resultados presentados, aunque cuentan con un tamaño muestral considerable, son de un solo centro, por lo cual se limita la generalización de los resultados a nivel nacional.
Conclusiones
En conclusión, este estudio reportó que la compatibilidad del HLA A y B no tiene una relación significativa con la pérdida del injerto al ajustar las covariables por propensity score matching, mientras que la compatibilidad del HLA DR mejora la sobrevida del injerto renal de manera estadísticamente significativa. Estos resultados podrían ser un fundamento para la evaluación por parte de los tomadores de decisiones en la pertinencia y puntuación dentro de la asignación de órganos. Se hace énfasis en que se requieren estudios multicéntricos, con una mayor muestra en el país, para validar estos resultados a nivel nacional.