Introducción
El trasplante hepático es el último eslabón en el tratamiento de la enfermedad hepática terminal, la falla hepática aguda y algunas neoplasias hepáticas primarias 1. Actualmente, el tacrolimus, un medicamento inmunosupresor que inhibe la calcineurina, es el medicamento de elección para prevenir el rechazo del injerto 2,3. Su mecanismo de acción consiste en inhibir la producción de interleucina 2 en el linfocito T CD4+ 4. Se considera que tiene una ventana terapéutica estrecha y una gran variación farmacocinética inter e intraindividual, lo que dificulta la implementación de un protocolo de dosis empírica e implica la medición constante de sus niveles para garantizar el efecto terapéutico y disminuir la incidencia de efectos adversos como la nefrotoxicidad, neurotoxicidad y la hiperglucemia. 5
El tacrolimus se absorbe en el intestino delgado mediante la glicoproteína P o MDR-1, que es codificada por el gen ABCB1, un transportador de eflujo ubicado en la membrana del enterocito, que regula negativamente la absorción del medicamento 4. Dentro de la célula intestinal, las isoenzimas gastrointestinales CYP3A4 y CYP3A5 hacen un metabolismo inicial y los metabolitos secundarios a este proceso son eliminados a través de la materia fecal. Esto asociado al metabolismo hepático de primer orden, explican que posterior a la administración oral haya una pobre biodisponibilidad, cercana al 25 % 6. El metabolismo del tacrolimus es hepático y es llevado a cabo por los citocromos CYP3A4 y CYP3A5, que generan aproximadamente 15 metabolitos, algunos en menor medida, con una actividad inmunosupresora similar al fármaco original. El 95 % de sus metabolitos son eliminados vía biliar y el 2 % vía urinaria 7.
Las interacciones farmacológicas y alimentarias y la variabilidad interindividual de la dosis del medicamento, están influenciadas por la actividad de la citocromo P450-3A5 4. El polimorfismo de un único nucleótido (SNP, por sus siglas en inglés) dentro del intrón 3 de CYP3A5 ha sido un tema de estudio. Los portadores homocigotos (denominados metabolizadores rápidos) o heterocigotos (metabolizadores intermedios) para el alelo CYP3A5*1 wild-type (silvestre) producen niveles más altos de la proteína funcional, lo que se ha asociado a aumento de los requerimientos de dosis de medicamento, al compararlos con los pacientes que portan dos copias del alelo variante CYP3A5*3 (metabolizadores lentos), en los cuales el resultado es una enzima truncada con pobre función 8.
Aproximadamente el 80 % de los caucásicos son homocigotos para el alelo variante CYP3A5*3 y la mayoría de los pacientes de raza negra son homocigotos para el alelo wild-type4. Los polimorfismos 3435C>T en el exón 26 y el 2677G>T/A en el exón 21 del gen ABCB1, que codifica la glicoproteína P, se asocian de forma directa con mecanismos que generan baja expresión de MDR-1 intestinal o inducen de forma indirecta a disminución en la especificidad del sustrato del transportador. A pesar de ser materia de controversia, se ha sugerido que la presencia de estas mutaciones aumentan la biodisponibilidad del medicamento y con esto disminuyen las dosis requeridas al comparar con los portadores del gen silvestre 9. Se ha propuesto que la implementación de protocolos de inmunosupresión individualizados a partir de la genotipificación del donante y receptor pudiera ser una estrategia que ayude a reducir la variabilidad en los niveles del medicamento y, de la misma forma, las tasas de eventos adversos, como el rechazo agudo y la nefrotoxicidad 10,11.
En Colombia no identificamos estudios en la actualidad que describan la frecuencia de estos polimorfismos en nuestra población, su impacto en la inmunosupresión y los desenlaces clínicos de los pacientes sometidos a trasplante hepático. El objetivo de este trabajo fue describir la presencia de los polimorfismos genéticos del gen MDR1 (rs1045642 y rs2032582) y del alelo CYP3A5*3 en el gen CYP3A5 en los pacientes sometidos a trasplante hepático en el Hospital San Vicente Fundación Rionegro, evaluar su relación con el rechazo agudo clínico y la incidencia de eventos adversos.
Métodos
Estudio observacional prospectivo y analítico, en el que se incluyeron los pacientes mayores de 18 años llevados a trasplante hepático ortotópico en el Hospital San Vicente Fundación Rionegro, Colombia, entre los años 2020 y 2022, que recibieron tacrolimus durante al menos un mes, con seguimiento por más de 30 días, independiente de si recibieron o no esteroides o micofenolato mofetilo. Se excluyeron pacientes con diagnóstico de infección por virus de la inmunodeficiencia humana, mujeres embarazadas, en lactancia o que consumieran anticonceptivos, y pacientes sometidos a trasplante de múltiples órganos.
Inmunosupresión
De acuerdo al protocolo hospitalario, la inmunosupresión en su fase de inducción se inició en el intraoperatorio con la administración de metilprednisolona 1 gr IV previo a la reperfusión. Inmediatamente después del trasplante se inició tacrolimus a dosis de 0,1 mg/kg/día cada 12 horas y micofenolato mofetilo 1 gr/12 horas. El esteroide IV se desmontó progresivamente hasta el cuarto día, cuando se pasó a prednisolona vía oral 20 mg/día en dosis única. De acuerdo al criterio del hepatólogo tratante, en algunos casos se realizó esquema de introducción progresiva de tacrolimus con dosis de inicio de 0,04 a 0,06 mg/kg/día, con el fin de disminuir la incidencia de lesión renal aguda postrasplante 12,13.
Monitoreo de niveles plasmáticos y desenlaces
El monitoreo plasmático del medicamento se hizo de forma seriada durante la estancia intrahospitalaria. La primera medición se realizó entre el cuarto y quinto día posterior al inicio y luego hasta lograr niveles terapéuticos entre 6-10 ng/mL 3. Los pacientes que requirieron ajustes en la formulación tuvieron mediciones adicionales, así como los pacientes con disfunción orgánica persistente o infecciones no controladas, que según el criterio del hepatólogo las requirieron. El protocolo institucional de seguimiento ambulatorio incluyó mediciones semanales en el primer mes, quincenales hasta el tercer mes y posteriormente de forma mensual. Si los niveles no estaban dentro de la ventana terapéutica o en caso de alteración del perfil hepático, se realizaron pruebas adicionales.
Variables del estudio
A partir de la historia clínica se recolectaron datos sociodemográficos tanto del donante como del receptor (fecha de nacimiento, sexo, peso y altura), la indicación del transplante, la técnica empleada (hígado entero, partición o reducción), el tiempo de estancia en la Unidad de Cuidados Intensivos (UCI) y las complicaciones durante el seguimiento. Además, información farmacológica como la posología del tacrolimus, el uso de inmunosupresores concomitantes o de medicamentos adicionales previamente reportados en la literatura con interacciones fuertes y moderadas. Se realizó seguimiento a parámetros de laboratorio como hemograma, perfil hepático (aminotransferasas, bilirrubinas, fosfatasa alcalina y gamma glutamil transferasa), función renal, albúmina e INR.
El desenlace principal fue la presencia de rechazo agudo o temprano del injerto como indicador de la eficacia de la terapia inmunosupresora. Este se definió como la elevación de enzimas canaliculares o aminotransferasas entre el día 5-30 postrasplante, en ausencia de otras causas vasculares o biliares documentadas que explicaran el cuadro 14. Se evaluaron los niveles del medicamento en relación con el pico enzimático asociado al rechazo y en pacientes que no presentaron rechazo se documentaron los niveles entre el día 6-10 después del trasplante. Acorde a los niveles objetivos previamente mencionados se clasificaron como infra terapéuticos (<6 ng/mL), terapéuticos (6-10 ng/mL) o supra terapéuticos (>10 ng/mL), y adicionalmente se correlacionaron con la dosis del medicamento correspondiente.
Como desenlaces secundarios se monitorearon los siguientes eventos adversos durante cualquier momento del seguimiento:
Nefrotoxicidad: se definió la presencia de lesión renal aguda acorde a criterios AKIN 15. Dentro de este escenario se hizo una evaluación diferencial de la lesión renal aguda perioperatoria, la cual cursa con una fisiopatología y factores de riesgo diferentes a la toxicidad por medicamentos (sepsis, inestabilidad hemodinámica, síndrome de reperfusión, politransfusión) y se definió como la presencia de lesión renal aguda en los primeros siete días postoperatorios 16.
Hepatotoxicidad: también denominada lesión hepática inducida por medicamentos, se definió como la presencia de elevación de aminotransferasas igual o más de cinco veces por encima del límite superior normal, fosfatasa alcalina dos o más veces por encima del límite superior normal o bilirrubina total dos o más veces por encima del límite superior normal 17.
Neurotoxicidad: se definió como la presencia de temblor, neuralgia, neuropatía periférica, psicosis, alucinaciones, alteraciones de la agudeza visual, ataxia cerebelar o paresia 18.
Se identificó una asociación de causalidad con el tratamiento, para lo cual se empleó la evaluación de la OMS-UMC, que clasifica la asociación como certera, posible, probable, improbable, condicional o no clasificada y no clasificable. Se consideraron asociaciones positivas aquellas clasificadas como certeras, posibles y probables 19.
Extracción de ADN y genotipificación de CYP3A5*3 y MDR1-C3435T y MDR1- G2677T
Toma de muestras en parafina y extracción de DNA: La toma de muestras de tejido parafinado se realizó de cuatro cortes de biopsias de hígado de receptores de 10 micrómetros de espesor. Estas biopsias de hígado fueron embebidas en parafina formaldehído para posteriormente ser almacenadas. Para la extracción de ADN genómico de estas muestras se utilizó el kit MagMAX® FFPE DNA/RNA Ultra Kit (CAT A31881, Thermofisher). Para verificar la calidad e integridad del DNA extraído, se usaron geles de agarosa al 1 %. El DNA se almacenó a -80°C hasta el proceso de genotipificación o secuenciación.
Secuenciación Sanger: La concentración de ADN fue medida usando un espectrofotómetro NanoDrop. Inicialmente, las variantes alélicas en el gen MDR1 tales como C3435T (rs1045642) y G2677T (rs2032582) y el alelo CYP3A5*3 en el gen CYP3A5 se detectaron mediante la PCR, confirmando así la presencia de la porción del ADN de interés de cada uno de los polimorfismos analizados. Estos se amplificaron usando primers diseñados por Macrogene. Posteriormente se secuenciaron las ampliaciones mediante la plataforma de secuenciación Sanger en un Applied Biosystems 3500. El llamado de bases, alineamiento y ensamblaje de las secuencias consenso y la edición de estas se llevó a cabo con el programa Sequencher acompañado de FinchTV V.1.4 y Bioedit V.7.2. Los pacientes con el genotipo CYP3A5*1/*1 o CYP3A5*1/*3 se clasificaron como “expresivos”, mientras aquellos con tipificación CYP3A5*3/*3, se clasificaron como “no expresivos”. Con respecto al gen ABCB1-A (rs2032582) los homocigotos para TT y los heterocigotos (TG) se clasificaron como “expresivos”, mientras que los homocigotos para GG se denominaron “no expresivos”. Finalmente, para la evaluación del gen ABCB1-B (rs1045642), los homocigotos para CC y los heterocigotos (TC) se clasificaron como “expresivos”, mientras que los homocigotos para TT se definieron como “no expresivos”.
Análisis estadístico
Análisis exploratorio: Las variables clínicas, bioquímicas, genéticas y sociodemográficas se expresaron empleando proporciones para las variables nominales, media y desviación estándar para las variables continuas. Las variables continuas sin distribución normal se expresaron en mediana y rango.
Fase analítica: Se analizaron las variables cualitativas y cuantitativas. Por ser una muestra pequeña y no cumplir criterios de normalidad, para el análisis inferencial se utilizaron pruebas no paramétricas, para las variables cuantitativas prueba de Wilcoxon y para las cualitativas la prueba de Fisher, ambas con un nivel de significancia de 0,05. El análisis estadístico se realizó con el programa R versión 3.5.0.
Resultados
Entre los años 2020 y 2022 se realizaron 34 trasplantes hepáticos; se excluyeron del estudio ocho pacientes que fallecieron en los primeros seis meses y que nunca recibieron tacrolimus y un paciente con seguimiento a dos años que fue tratado con ciclosporina. Posteriormente se excluyeron ocho pacientes con muestras insuficientes para el estudio genético de integridad del DNA, por lo que finalmente se incluyeron en el estudio 17 pacientes (Tabla 1).
Tabla 1. Aspectos sociodemográficos y desenlaces clínicos de los pacientes inmunosuprimidos con tacrolimus que participaron en el estudio (n=17).

*MELD:Model for End-stage Liver Disease; UCI: Unidad de Cuidados intensivos; NASH: nonalcoholic steatohepatitis.
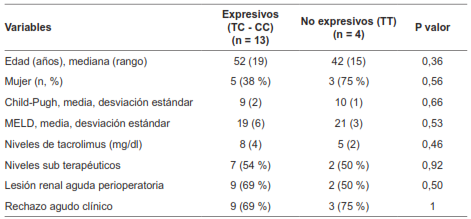
No se encontró diferencia estadísticamente significativa entre los factores sociodemográficos basales, la severidad de la enfermedad hepática previa al trasplante, los niveles de tacrolimus durante el momento del rechazo o durante el día 6-10 en los pacientes sin rechazo agudo clínico o en la incidencia de lesión renal aguda perioperatoria. Se presentó rechazo agudo clínico con mayor frecuencia en pacientes “expresivos” (100 % vs 44 %, p=0,05) (Tabla 2).
Tabla 2. Factores sociodemográficos, desenlaces clínicos de importancia y análisis comparativo univariado entre los grupos denominados como “expresivos” y “no expresivos” acorde a la genotipificación de CYP3A5 (rs776746).
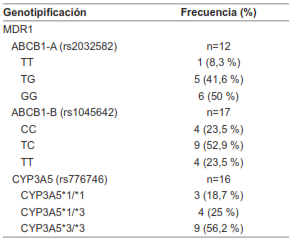
Se logró amplificar y secuenciar el SNP denominado como ABCB1-A (rs2032582) en 12 pacientes, el SNP ABCB1-B (rs1045642) en 17 y SNP CYP3A5 (rs776746) en 16, teniendo en cuenta que en ABCB1-A el genotipo silvestre es homocigoto para timina, en ABCB1-B es homocigoto para citosina y, como se describió anteriormente, el genotipo normal que codifica CYP3A5 corresponde a dos copias del gen wild-type o CYP3A5*1/*1 (Tabla 3).
Los resultados del análisis comparativo univariado entre los grupos denominados como “expresivos” y “no expresivos” acorde a la genotipificación de ABCB1-B (rs1045642), es decir, uno de los polimorfismos de estudio de la glicoproteina P, se presentan en la Tabla 4. No se encontraron diferencias en cuanto a la edad, el sexo, el puntaje Child-Pugh o MELD, los niveles de tacrolimus en los primeros 10 días, la presencia de niveles sub terapéuticos asociados a rechazo, la lesión renal aguda perioperatoria o el rechazo agudo clínico. Para el gen ABCB1-A, solo se contaron con 12 muestras, lo que se consideró un tamaño de muestra insuficiente para realizar un análisis inferencial.
Discusión
Según los datos del Programa Carga Global de Enfermedad en 2019, la enfermedad hepática ocupa el puesto once como causa de mortalidad global, con 2,4 millones de muertes durante dicho año 20. El trasplante hepático corresponde a la última posibilidad terapéutica en el manejo de la enfermedad hepática crónica terminal, la falla hepática aguda y algunas neoplasias hepáticas primarias. En Colombia, según datos del Instituto Nacional de Salud, en 2021 se realizaron 155 trasplantes hepáticos, cifra que viene en ascenso después de la pandemia por SARS-CoV-2, cuando hubo una marcada disminución de este tipo de procedimientos 21,22.
El rechazo agudo es una causa importante de disfunción, pérdida del aloinjerto y muerte en pacientes sometidos a trasplante de órgano sólido. Ocurre en el 25-46 % de los pacientes, con una incidencia más alta durante los primeros 6-10 días. Los esquemas de inmunosupresión no solo previenen la aparición de rechazo, sino que son la base del tratamiento en aquellos casos en los que se genera este evento 23. El tacrolimus es un medicamento inmunosupresor que fue desarrollado como una alternativa al uso de ciclosporina por su mejor biodisponibilidad 24, con una mortalidad 15 % menor a un año, aumento en las tasas de supervivencia del injerto al año, tasas de adherencia al medicamento, disminución de las tasas de rechazo agudo y de rechazo resistente a esteroides al comparar con pacientes sometidos a esquemas basados en ciclosporina 25.
El CYP3A5 es la enzima principal en el metabolismo del tacrolimus y tiene representación hepática e intestinal. La glicoproteína P es un transportador de eflujo del medicamento a nivel intestinal 4. Los polimorfismos en los genes que codifican ambas proteínas se han considerado una causa probable de la variabilidad farmacocinética interindividual del medicamento y se han contemplado como la base de posibles modelos de medicina personalizada en trasplante hepático 8-10. Se considera que durante las cinco primeras semanas luego del trasplante la farmacocinética de este medicamento está influenciada principalmente por la genotipificación del receptor 26,27.
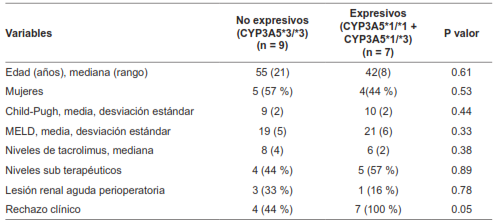
Este estudio describe una cohorte de receptores de trasplante hepático en Colombia, la frecuencia de presentación de polimorfismos de importancia en estos genes y hace una aproximación a su asociación con desenlaces como la toxicidad farmacológica y el rechazo agudo. Se conoce que el genotipo de CYP3A5 varía acorde a factores raciales y poblacionales; aproximadamente un 10-20 % de los caucásicos, 20-80 % de los asiáticos y 55-65 % de los afroamericanos expresan algún alelo para CYP3A5*1 5. En nuestra población de estudio, el 18 % de los pacientes eran homocigotos para el gen silvestre CYP3A5 *1/*1, un 25 % heterocigotos y 56 % homocigotos para CYP3A5*3; con un 43 % de “expresivos”, probablemente como una población intermedia entre la caucásica y la asiática, similar a lo publicado por Buendía 28.
Se ha observado que los pacientes con el genotipo “no expresivo” (CYP3A5*3/*3) requieren dosis menores del medicamento y tienen un mayor riesgo de toxicidad farmacológica. Además, los pacientes con el genotipo “expresivo” han sido asociados con tasas más altas de rechazo agudo 29,30. El grupo liderado por Gómez-Bravo y colaboradores documentó una incidencia del 10,2 % de rechazo confirmado histológicamente en una población española, encontrando que los pacientes “expresivos” tenían tasas de rechazo aproximadamente 1,5 veces mayores en los primeros tres meses en comparación con los “no expresivos” 5.
Por otro lado, Uesugi y colaboradores 27 llevaron a cabo un estudio en población japonesa, en el que descubrieron que la presencia del alelo CYP3A5*1 en el hígado trasplantado se asociaba con una mayor incidencia de rechazo agudo entre el día 10 y 23 postrasplante. No se encontraron diferencias en los niveles de tacrolimus entre los que experimentaron rechazo y los que no lo hicieron.
En nuestra serie de pacientes, se encontró una tasa global de rechazo agudo clínico del 76 %, lo cual es considerablemente más alto que el rango del 25-46 % reportado en la literatura 22. El 44 % de los pacientes “no expresivos” tuvieron un episodio de rechazo agudo clínico versus el 100 % de los “expresivos”, alcanzando significancia estadística en el análisis univariado. Sin embargo, se observó una tasa de niveles sub terapéuticos del 88 % hasta el día 10, y esto se debió a que el 59 % de los pacientes estaban recibiendo dosis menores de 0,1 mg/kg/día, en el contexto de un esquema de introducción progresiva de anticalcineurínicos.
Aunque esto plantea interrogantes sobre el inicio de nuestra inmunosupresión de mantenimiento, los hallazgos sugieren que los pacientes con algún alelo silvestre tienen tasas más altas de rechazo agudo clínico, lo cual es valioso, biológicamente plausible y se correlaciona con los hallazgos descritos en otros trabajos 5,26. Todos los pacientes que experimentaron rechazo clínico en nuestro estudio mejoraron sus parámetros bioquímicos mediante el ajuste de la inmunosupresión y no se reportaron casos de retrasplante relacionados con el rechazo durante el seguimiento.
Se ha estudiado la presencia de eventos adversos secundarios a la administración de tacrolimus en relación con la genotipificación de CYP3A45. Los niveles supra terapéuticos del tacrolimus se han asociado al desarrollo de nefrotoxicidad 4. Coller y colaboradores 11 evaluaron, como desenlace secundario en su estudio, el desarrollo de nefrotoxicidad en relación con la presencia de polimorfismos de CYP3A5 en 29 pacientes; se presentó toxicidad renal en el 14 % de los pacientes, sin diferencia estadísticamente significativa entre los grupos. De manera similar, en nuestro estudio se identificaron tres pacientes con nefrotoxicidad (17 %). No se encontró diferencia estadísticamente significativa entre “expresivos” y “no expresivos” con respecto a este u otros tipos de toxicidad en nuestro estudio, ni en la tasa de lesión renal aguda perioperatoria.
Con respecto a los polimorfismos del gen ABCB1, se ha descrito que la presencia del genotipo homocigoto para ambas mutaciones está aproximadamente en un 32 % de los caucásicos, 62 % de los americanos con ascendencia europea, 27 % de los americanos con ascendencia asiática y 35 % de los americanos con ascendencia mexicana 9. En nuestra cohorte se presentó un 50 % de homocigotos para GG en ABCB1-A y 23 % de homocigotos para el alelo mutado TT en ABCB1-B.
Se conoce que estas mutaciones generan una disminución en la expresión de la glicoproteína P intestinal y su impacto en la farmacocinética de tacrolimus está mejor descrito en pacientes con trasplante renal, en quienes la presencia del alelo mutado se asocia con tasas C0/dosis más bajas, principalmente en ABCB1-B 31. Sin embargo, su impacto en la farmacocinética del tacrolimus en trasplantados hepáticos aun es tema de discusión. Provenzani y colaboradores 9 no encontraron diferencias en las dosis del medicamento o incidencia de rechazo del injerto en pacientes sometidos a trasplante hepático acorde a la genotipificación de ABCB1. En nuestro estudio no encontramos diferencias estadísticamente significativas en la presencia de rechazo agudo clínico o en los desenlaces secundarios acorde a la genotipificación de MDR-1.
Como limitaciones de este estudio se considera el bajo número de pacientes incluidos, debido a que el periodo de estudio coincidió con el tiempo de pandemia, al fallecimiento de ocho pacientes que no recibieron inmunosupresión con tacrolimus y a que la calidad del espécimen en algunas muestras no permitió el estudio genético. Las altas tasas de niveles infra terapéuticos asociados a los eventos de rechazo agudo clínico puede ser un factor confusor, por lo que se sugiere una optimización eficiente de los niveles del medicamento en el postrasplante temprano. Se recomienda la formulación de estudios multicéntricos que permitan un conocimiento más amplio de la distribución poblacional de estos genes y sean la base para plantear esquemas de inmunosupresión personalizada de acuerdo con la genotipificación.
Conclusiones
Este estudio describe la frecuencia de polimorfismos de único nucleótido en proteínas clave para el metabolismo de tacrolimus en trasplantados hepáticos. La presencia del genotipo “expresivo” se asoció con tasas más altas de rechazo agudo clínico, documentándose la gran mayoría de eventos en los primeros 14 días postrasplante. No se encontró asociación con eventos adversos al medicamento u otros eventos como lesión renal aguda perioperatoria. No se encontraron diferencias en rechazo agudo clínico y toxicidad en los diferentes polimorfismos de MDR-1.