Introducción
El carcinoma de células claras del riñón (CCR) es el tipo más común de tumor primario del riñón en adultos; entre los tumores de vías urinarias, el CCR corresponde a un 75-90 % de todas las neoplasias renales malignas 1,2 y el 2 - 3 % de todos los cánceres a nivel mundial 3. Según cifras del observatorio mundial del cáncer, en México corresponde a la undécima neoplasia más frecuente y se diagnosticaron 5925 casos en el 2020, lo que representó el 3 % de todas las neoplasias de ese año 4, mientras que según datos del Sistema Nacional de Información en Salud (SINAIS), de un total de 106.238 neoplasias registradas en México en 2006, se diagnosticaron 1973 casos, para una incidencia del 1,8 % 5.
Generalmente surgen como tumores sólidos del parénquima renal y el potencial metastásico de este cáncer es generalizado e impredecible 6. Aproximadamente, el 16-30 % de los carcinomas renales se presentan con metástasis a distancia al momento de su diagnóstico 7. Con respecto a la enfermedad metastásica, por orden de frecuencia se localizan en pulmón (60 %), hueso (40 %), hígado (30 - 40 %), glándula suprarrenal (5,5 %) y cerebro (5 %) 8.
La diseminación hematógena puede resultar en un patrón metastásico inusual e impredecible, con una tendencia a mostrar recidivas tardías y hacer metástasis en casi todos los sistemas del cuerpo, incluyendo musculo y piel. En series de autopsias, se detectaron metástasis del músculo esquelético en aproximadamente el 0,4 % de los pacientes con CCR 9. Si bien la metástasis a tejido celular subcutáneo y músculo esqueléticos se considera inusual (entre 1 a 5 %), el CCR se encuentra entre los tumores primarios más comunes que hacen metástasis a estos tejidos y se localizan típicamente en la región de la cabeza y el cuello 8. Esto es debido a que el músculo esquelético tiene ciertas características que explican una baja incidencia, como la presencia de inhibidores de proteasas en la matriz extracelular del músculo que resisten la invasión de las enzimas tumorales, metabolitos y factores peptídicos, un pH más ácido que puede interferir con el crecimiento metastásico, las contracciones musculares que pueden desalojar las células tumorales y la ausencia de receptores específicos que impiden el crecimiento y desarrollo de metástasis 7,8.
Caso clínico
Femenina de 64 años de edad, originaria y residente de la ciudad de México, quien llegó referida al servicio de coloproctología por enfermedad pilonidal, siendo su sintomatología principal dolor y aumento de volumen en región sacra; durante su anamnesis refirió ser diabética de 15 años de evolución manejada con hipoglucemiantes orales y el antecedente quirúrgico de nefrectomía izquierda por carcinoma renal de células claras, en otra unidad médica en el año 2011, que fue dada de alta después de cinco años de seguimiento ambulatorio.
Durante su exploración física se observó a nivel sacro, lateralizada a la izquierda de la línea media, una masa tumoral bien delimitada de 4 x 3 cm, dependiente de tejidos blandos, ligeramente móvil, sin dolor a la palpación, con lo que se descartó enfermedad pilonidal (Figura 1). Por falta de disponibilidad de estudio ultrasonográfico y resonador, se indicó una tomografía computarizada (TC) donde se observó una imagen hipodensa, de pared gruesa, septada, en la región sacra izquierda (Figura 2).
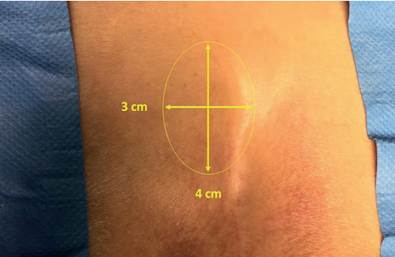
Figura 1. Vista de región sacra, donde se delimita el tamaño del tumor, ligeramente lateralizado a la izquierda.
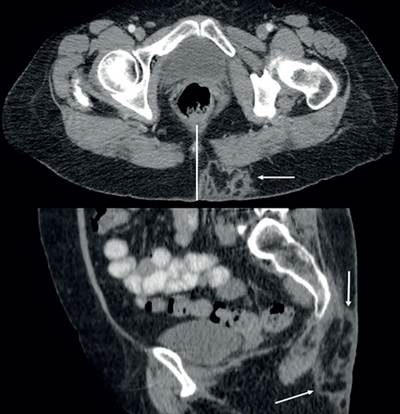
Figura 2. Imagen de la tomografía computarizada en proyección axial y sagital donde se muestra con las flechas la metástasis por arriba del plano muscular de aspecto septado.
Ante hallazgos clínicos y radiológicos de un tumor bien delimitado, no se planteó de primera instancia una biopsia incisional diagnóstica, por la posibilidad de requerir un segundo tiempo operatorio y las molestias asociadas a la toma de biopsia. Fue llevada a manejo quirúrgico de exéresis de lesión bajo anestesia regional, con extirpación completa. En el transoperatorio se observó un tumor bien delimitado, de consistencia dura, aspecto ovalado, localizado sobre el tejido celular subcutáneo, adherido a la fascia sacra y la aponeurosis del glúteo mayor (Figura 3).
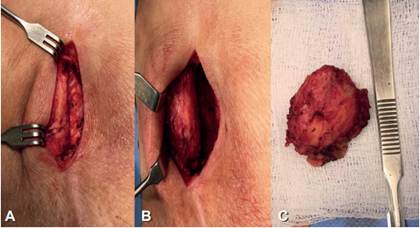
Figura 3. Se observa durante la intervención quirúrgica (A y B) el tumor de apariencia sólida, encapsulada y sin dificultad técnica para la disección durante su extirpación. En C se muestra el tumor totalmente resecado.
El reporte de patología documentó, a la revisión macroscópica (Figura 4), áreas de hemorragia y lesión delimitada, y en la microscopía con imagen panorámica, células con citoplasma claro rico en lípidos con afección nuclear (Figura 5). El estudio de inmunohistoquímica con anticuerpo CD-10 fue positivo frente a proteínas de membrana del epitelio urinario (Figura 6), por lo que se integró el diagnostico de CCR metástasico a región sacra después de 8 años de la resección del tumor primario en riñón izquierdo.
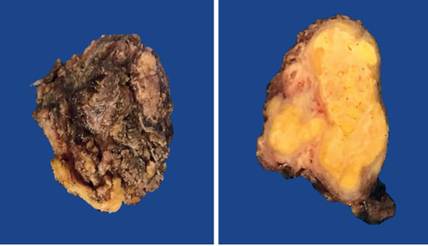
Figura 4. Tumor de aspecto ovoide, que mide 4 x 2,5 x 1 cm, superficie externa con cápsula fibrosa, consistencia firme y color café violáceo. Al corte con áreas sólidas y otras reblandecidas amarillo claro y hemorragia central.
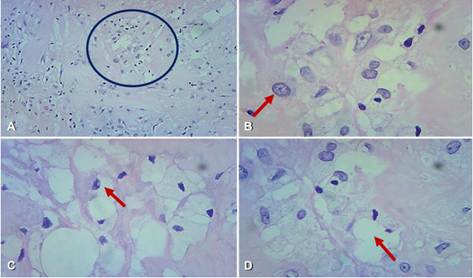
Figura 5. Imagen panorámica con tinción de hematoxilina eosina. La microfotografía A muestra imagen con ampliación a 10x, donde se observan células con citoplasma claro inmersas en estroma desmoplásico (círculo). En las microfotografías B a D se aprecia transparencia celular por citoplasma rico en lípidos, núcleos poliédricos, irregulares con cromatina abierta y nucleolos visibles (flechas).
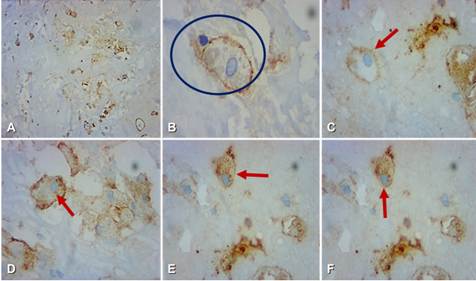
Figura 6. Inmunohistoquímica con aumento de objetivo de 40x (A - F). Se observan células neoplásicas que evidencian positividad a inmunomarcaje con anticuerpo CD-10. Se muestra en (B) la reacción frente a proteínas del túbulo contorneado proximal (círculo), La positividad de membrana se muestra con flechas en todos los cortes del tumor (A - F).
En el posoperatorio tuvo evolución clínica sin complicaciones; se retiró el dren tipo Penrose a los 7 días y los puntos a los 10 días. En la última cita de seguimiento, sin datos clínicos de actividad tumoral.
Discusión
Los pacientes con metástasis a tejidos blandos y tejido músculo esquelético (MME) no tienen síntomas en la etapa inicial y generalmente se encuentran sólo cuando las lesiones aumentan de tamaño 10. Debido a esto, el diagnóstico de MME puede ser bastante desafiante 11. En nuestro caso, la lesión de la paciente no despertó sospecha por aproximadamente 8 años, hasta que se agregó dolor a su sintomatología.
En un análisis retrospectivo de 21 pacientes de un mismo centro, la mayoría de las MME eran asintomáticas y se detectaron mediante TC, siendo el tronco el sitio de mayor aparición (83,3 %) 6. En general, las metástasis a tejido músculo esquelético son muy sutiles en la TC sin contraste intravenoso (atenúan la musculatura circundante) y por tanto difíciles de detectar, por lo que se recomiendan estudios con contraste intravenoso, donde existe un realce periférico hasta en un 47,1 % 6. El CCR metastásico a tejidos blandos debe diferenciarse de los tumores primarios de tejidos blandos, los cuales presentan un comportamiento y tratamiento diferentes.
Además de la TC, el abordaje de los tumores de tejidos blandos también se puede realizar mediante ultrasonido (US), el cual mostrará una masa hipoecoica con márgenes bien definidos en el caso de que se trate de un tumor benigno de partes blandas. Por otro lado, la mayoría de los carcinomas de células claras son inherentemente hipervasculares 12, por lo tanto, la presencia de abundantes señales de flujo sanguíneo en un ultrasonido de partes blandas, en paciente con antecedente de CCR, es un dato sospechoso de metástasis.
Sin embargo, para el abordaje de tumores de tejidos blandos el estudio de imagen de elección sigue siendo la resonancia magnética (RM). El hallazgo de una hiperintensidad alta en T1 y T2 en el músculo circundante es característico de MME, a diferencia de los tumores primarios que presentan imágenes de baja intensidad e isoseñal relativa al músculo esquelético en imágenes en T1 9.
A pesar de que las imágenes diagnósticas pueden guiar el estudio y sospechar la etiología maligna del tumor, el estudio histopatológico sigue siendo el estándar de oro. Según una revisión por Bai M, et. al., de 41 casos con diagnóstico de MME, en el 61 % se realizó biopsia tumoral para establecer el diagnóstico 12. En consecuencia, para las lesiones de tejidos blandos en pacientes con antecedente de CCR, se prefiere la biopsia para el diagnóstico definitivo 12,13. En caso de que la biopsia con aguja confirme enfermedad metastásica, el tracto de punción debe extirparse debido al riesgo de siembra tumoral 14.
Dentro del tratamiento, las guías del National Comprehensive Cancer Network (NCCN) 11 recomiendan que los pacientes con un sitio metastásico resecable y solitario sean considerados candidatos para resección quirúrgica completa, como se realizó en nuestra paciente por ser una lesión única de fácil acceso. Sin embargo, la resección amplia puede resultar difícil según el sitio quirúrgico o el estado del paciente 15. Varias series de casos sugieren un buen control local después de la resección de metástasis óseas solitarias y de tejidos blandos de carcinoma de células renales 1.
Los datos son limitados con respecto al pronóstico en pacientes con estos sitios de afección. En la mayoría de los casos el tratamiento de la metástasis es paliativo, tomando en consideración que ni la radioterapia, ni la quimioterapia e inmunoterapia han demostrado ser eficaces 7. Naito, et. al. 3, informaron en una serie que incluyó a un grupo de 1463 pacientes con CCR metastásico, que el tiempo medio de supervivencia de los pacientes que se sometieron a resección quirúrgica del CCR metastásico aumentó significativamente en comparación con los pacientes que no se sometieron a metastasectomía (44,3 frente a 16,4 meses). Por lo tanto, ante la presencia de una metástasis por CCR única y accesible se prefiere realizar la resección de la metástasis.
El mayor riesgo de metástasis a distancia después de la resección del CCR existe en los primeros cinco años. Como resultado, los esfuerzos de vigilancia primaria se centran en este período 11.
El momento óptimo para interrumpir la vigilancia no está claro, ya que hay reportes de pacientes con metástasis a distancia hasta 27 y 45 años posterior a tratamiento quirúrgico 16,17. De acuerdo con las pautas del NCCN 11, se recomienda un seguimiento individualizado por al menos 5 años posterior a una nefrectomía y de acuerdo a la etapa clínica (EC) del paciente. Para pacientes en EC I (T1,N0,M0) se recomienda un seguimiento anual con exploración física (EF) y estudios de laboratorio generales; un estudio índice de abdomen, ya sea con TC o RM, a los 3 a 12 meses posterior a nefrectomía y seguimiento anual con estudio de imagen por 5 años. En EC II (T2,N0,M0) se modifica la frecuencia de los estudios de imagen (TC o RM), a cada 6 meses por un periodo de dos años y posteriormente anual por 5 años más, además de considerar una telerradiografía de tórax o TC anual por 5 años. En el caso de los pacientes en EC III (T1-2,N1,M0 / T3,N0-1,M1), quienes cuentan con un riesgo de enfermedad metastásica de hasta un 10 % versus 1,4 % en tumores en estadio I o II, se justifica un seguimiento más frecuente 18; el panel recomienda una EF y laboratorios cada 3 a 6 meses por 3 años y posterior anual por 5 años más, además de un estudio índice de imagen dentro de los 3 a 6 meses posterior a la nefrectomía y seguimiento con TC, RM o US cada 3 a 6 meses por 3 años, seguido de estudio con imagen cada año hasta completar otros 5 años. Finalmente, el seguimiento en EC IV (M1 con cualquier T o N) se debe realizar con un TC o RM de abdomen previo a tratamiento sistémico u observación, aunado a estudio de imagen abdominal cada 6 a 16 semanas, según criterio medico basado en clínica y esquema de tratamiento; la frecuencia de intervalo de imagen estará guiada por los sitios de enfermedad activa detectados 11.
En nuestro caso la paciente presentó lesión metastásica única, evolución del posoperatorio adecuado, con alta temprana, encontrándose al momento libre de enfermedad residual. Según datos de Bhirud, et. al. 9, se espera una tasa de supervivencia a 5 años del 35 % al 50 % para pacientes con metástasis única.
Conclusiones
El carcinoma de células renales metastásico a tejidos blandos es una entidad con ocurrencia rara, especialmente como metástasis tardía. Además de su tratamiento quirúrgico inicial, es indispensable una estrecha vigilancia con antecedentes, examen físico e imágenes transversales para detectar la presencia de metástasis y con ello evitar tratamientos tardíos.















