Introducción
La proporción sexual, se define como la razón entre el número de machos y hembras en una población, es aceptado, que en muchos ensamblajes de invertebrados se presente igual número de individuos en ambos sexos (OMOLOYE, 2006; TABADKANI et al., 2012). Los postulados de FISHER (1930) explican que la proporción sexual de la mayoría de las especies tiende a ser uno a uno, sin embargo, se ha observado que algunas especies se desvían de esta proporción, para aumentar al máximo el potencial evolutivo y las perspectivas a largo plazo de una población dada (HJERNQUIST et al., 2009; TABADKANI et al., 2012; WEDEKIND, 2012). En este sentido, diferencias en el comportamiento de los individuos, en el tamaño o la morfología, se consideran, factores que pueden estar sesgando la proporción sexual en aquellas especies que presentan determinación a nivel genético (BUNNEFELD et al., 2009; TRYJANOWSKI et al., 2009; WEDEKIND, 2012).
Los pseudoescorpiones, son arácnidos mesodiversos que habitan todos los ecosistemas terrestres, siendo diversos en los trópicos y subtrópicos (WEYGOLDT, 1969; JUDSON, 1994; DEL-CLARO y TIZO-PEDROSO, 2009; HARVEY, 2013). Son vivíparos y presentan variados grados de cuidados para sus crías (WEYGOLDT, 1969; DEL-CLARO y TIZO-PEDROSO, 2009). Varios géneros, se han reportado exclusivos de ambientes marinos y de la vegetación de costa (HOFF, 1959; GABBUTT, 1962; WEYGOLDT, 1969; MAHNERT y SCHUSTER, 1981; LEE, 1979; HARVEY, 2009; MAHNERT, 2014). Sin embargo, los datos ecológicos son muy escasos, a pesar de investigaciones realizadas en zonas litorales (GABBUTT, 1962; 1970; LEE, 1979; MAHNERT y SCHUSTER, 1981; HARVEY, 2009).
Entre los arácnidos, las arañas de la familia Araneidae y Theridiidae exhiben una proporción sexual sesgada hacia las hembras, mientras que Pholcidae presenta una proporción 1:1; la mayoría de Opiliones presentan ciclos de vida anuales comportamiento similar se ha observado en los escorpiones que exhiben igual proporción de hembras y machos al nacimiento y extendida entre todos los arácnidos (FOELIX, 2011; BELOZEROV, 2013). A pesar de lo anterior, poco se conoce acerca de la proporción sexual de estos arácnidos en ambientes marinos, y solo se conocen datos sobre fenología de varias regiones de Europa y en bosques de la Amazonia (SCHUSTER, 1962; GABBUTT, 1966; GABBUTT,1970; KENSLER, 1967; WEYGOLDT, 1969; ADIS y MAHNERT, 1985; ADIS et al., 1988; ADIS y MAHNERT, 1993; MORÁIS y ADIS, 1997; ADIS y JUNK, 2002; RANIUS y DOUWES, 2002; VANIN y TURCHETTO, 2007; BELOZEROV, 2013).
Artrópodos que habitan bosques inundables, han desarrollados estrategias para compensar la pérdida periódica de su hábitat terrestre, asimismo, algunas poblaciones pueden haber sufrido cambios por el aislamiento de los bosques y los cambios en las épocas climáticas; como se ha indicado para los pseudoescorpiones, que presentan ciclos de vida muy particulares, influenciados por diferentes factores que generan estacionalidad en las etapas de desarrollo post-embrionarias y solapamiento de generaciones e influyendo indirectamente en la proporción sexual de las poblaciones, debido que, algunas especies exhiben proporciones sexuales, ajustadas a las épocas climáticas (GABBUTT; 1970; ADIS et al., 1988; ZEH 1987a; 1987b ; ZEH y ZEH, 1990; 1997; BELOZEROV, 2013).
Por tanto, se consideró fundamental conocer y establecer, la estructura, el dimorfismo sexual y la proporción sexual de estos arácnidos en ambientes marinos; en este sentido, la proporción sexual de la comunidad de pseudoescorpiones, el dimorfismo sexual y los periodos de reproducción en los fragmentos de bosque de manglar del departamento de Córdoba, Caribe Colombiano, son presentados en el siguiente estudio.
Materiales y métodos
Área de estudio. El municipio de San Antero, se encuentra ubicado en el costado suroeste del golfo de Morrosquillo, entre los 9.7º24’34.29” N y 75º45’20.95” W; con una temperatura promedio de 28°C, una precipitación promedio de 1.337 mm anuales y un ciclo unimodal-biestacional dominante en la zona (CVS-INVEMAR, 2010; CORTÉS y RANGEL, 2011). Se escogieron cinco fragmentos, ubicados en la línea de costa. La selección de los sitios, obedece a características relacionadas con su estado de conservación, la estructura vegetal y fácil acceso (Fig. 1).
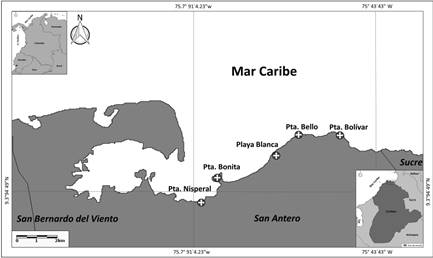
Figura 1 Área de estudio y localización de los fragmentos de bosque de manglar en la línea de costa del municipio de San Antero.
Colecta de los individuos. Para la colecta de los pseudoescorpiones, se adaptaron y fueron aplicadas las metodologías descritas por GABBUTT (1970), MAHNERT y ADIS (2002) y las recomendaciones realizadas por ADIS et al. (1988). Entre marzo y octubre de 2014, se realizó el muestreo abarcando los periodos climáticos. Como unidad de muestreo se utilizó un cuadrante de 1 m2, ubicados perpendicularmente a la línea de costa y replicado tres veces por fragmento para un total de 15 unidades; la hojarasca colectada se depositó en bolsas selladas para evitar perdida de humedad (ROJAS, 1989). Los pseudoescorpiones fueron extraídos utilizando el procesamiento por embudo de Berlese. A través de la colecta manual, se examinó la corteza de 20 troncos por sector, para un total de 800 troncos examinados, por un tiempo efectivo de 60 min./colector, los especímenes fueron depositados en frascos que contenían alcohol al 70% como preservante para su posterior revisión en laboratorio.
Fase de laboratorio. Previamente a someter los especímenes a un proceso de aclaramiento por difusión lenta utilizando ácido láctico 70%, se diseccionaron una pata I y otra IV, un quelícero y un pedipalpo, de éste se le ha separado la pinza (JUDSON, 1992). Los artejos sueltos se han guardado en un microvial y conservados en alcohol 70% en el mismo vial que el resto de cada ejemplar. Para la identificación, se han empleado montajes no permanentes en glicerina, proceso realizado en el Laboratorio de Entomología de la Universidad de Córdoba, con la ayuda de un microscopio Carl Zeiss, plus Axiostar, Alemania. Posteriormente, la medición de los especímenes se realizó en las instalaciones del laboratorio de microscopia de la Universidad de Córdoba, utilizando un micrómetro incorporado al microscopio (Carl Zeiss, Axiostar, Alemania) y con la ayuda del programa Axio visión 4.8.2. SP3 (CARL ZEISS, 2013).
El material hace parte de la colección del Instituto de Ciencias Naturales-ICN de la Universidad Nacional de Colombia-sede Bogotá con código ICN-APs-391 e ICN-APs-392 y la colección del laboratorio de Entomología de la Universidad de Córdoba con códigos desde Ps-001 a Ps-006.
Proporción sexual. Los pseudoescorpiones colectados en cada sector de estudio, durante toda la investigación, se clasificaron como ninfas (protoninfa, deutoninfa y tritoninfa) o adulto (ADIS et al., 1988), teniendo en cuenta la nomenclatura de los tricobotrios propuesta por CHAMBERLIN (1931) para cada estadio y las categorías de hembra y macho teniendo en cuenta la forma de la placa genital, de acuerdo con LEGG (1974; 1975) y las claves fotográficas de BUDDLE (2010).
Análisis de datos.La proporción sexual fue calculada utilizando la ecuación [H/H+M] (SMITH, 1999). Para el análisis de la proporción sexual, para cada una de las especies, se calculó Chi-cuadrado (X2) con sus respectivas tablas de contingencia, para observar si presentaban diferencias entre el número de machos y hembras. Adicional a esto, se utilizaron las pruebas t-Student y W de man-Withney, para comparar la longitud corporal y evidenciar, dimorfismo sexual entre machos y hembras.
Resultados
Se colectó un total de 1.037 individuos, distribuidos en cinco familias y seis del orden Pseudoscorpiones, Olpiidae fue la familia más abundante con 775 individuos, seguida de la familia Lechytiidae con 188 individuos y Garypinidae con 66 individuos, mientras que las familias menos abundantes fueron Chthoniidae y Chernetidae con seis y cinco individuos respectivamente.
Proporción sexual de la comunidad de pseudoescorpiones. Se colectaron 583 adultos, de los cuales, se categorizaron 294 machos y 289 hembras (Tabla 1). De igual forma, se colectaron 454 ninfas, de los cuales, 181 fueron protoninfas (39,8 %), 109 deutoninfas (24 %) y 164 tritoninfas (36,1 %) (Tabla 2). El fragmento de bosque de manglar de Playa Blanca, registró el mayor porcentaje de ninfas (50%), seguido del fragmento de Punta Bolívar (24%), Punta Bello (13,3%) y Punta Bonita (12,3%); en contraste, el fragmento de Punta Nisperal registró el menor porcentaje de ninfas con (0,2%).
Tabla 1 Estructura-edad de los pseudoescorpiones colectados.
| Especies | Protoninfas | Deutoninfas | Tritoninfas | ||||
|---|---|---|---|---|---|---|---|
| Abundancia | Promedio | Abundancia | Promedio | Abundancia | Promedio | ||
| Epactiochernes sp. | 0 | 0 | 0 | 0 | 1 | 0.12 | |
| Lechytia chthoniiformis | 0 | 0 | 0 | 0 | 10 | 1.25 | |
| Pachyolpium isolatum | 142 | 17,7 | 96 | 12 | 139 | 17.3 | |
| Paraliochthonius quirosi | 0 | 0 | 0 | 0 | 0 | 0 | |
| Planctolpium arboreum | 2 | 0.25 | 8 | 1 | 6 | 0.75 | |
| Serianus aff. carolinensis | 0 | 0 | 1 | 0.12 | 1 | 0.12 | |
Tabla 2 Longitud corporal (medidas en mm) de las especies de pseudoescorpion, indicando sexo y especie
| Sexos | Abundancia | Promedio | Desviación Estándar | Mínimo | Máximo |
|---|---|---|---|---|---|
| Pachyolpium isolatum (Olpiidae) | |||||
| Machos | 173 | 2,08 | 0,19 | 1,7 | 2,9 |
| Hembras | 131 | 2,69 | 0,29 | 1,9 | 3,1 |
| Lechytia chthoniiformis (Lechytiidae) | |||||
| Machos | 77 | 0,85 | 0,06 | 0,7 | 1 |
| Hembras | 67 | 1,03 | 0,11 | 0,7 | 1,3 |
| Serianus aff. carolinensis (Garypinidae) | |||||
| Machos | 23 | 1,7 | 0,24 | 1,3 | 2,1 |
| Hembras | 20 | 2,3 | 0,36 | 1,9 | 2,9 |
| Planctolpium arboreum (Olpiidae) | |||||
| Machos | 19 | 1,6 | 0,25 | 1,2 | 2,0 |
| Hembras | 16 | 1,9 | 0,26 | 1,5 | 2,5 |
| Paraliochthonius quirosi (Chthoniidae) | |||||
| Machos | 2 | 1,1 | 0,14 | 1,0 | 1,2 |
| Hembras | 4 | 1,25 | 0,1 | 1,1 | 1, 3 |
Pachyolpium isolatum Beier (1931). registró el mayor número de machos 173 y de hembras 131, en promedio la longitud corporal de las hembras fue de (2,69 ± 0,29 mm) y los machos (2,08 ± 0,18 mm) (Tabla 2). Se presentaron diferencias en la longitud corporal (W= 21269,0; α= 0,05; P<0,05) evidenciando dimorfismo sexual entre los individuos (Tabla 2). La proporción de sexos observada durante todo el estudio, fue de 1:1, no se presentaron diferencias significativas entre el número de machos y hembras (X2=12,3; Gl=7; P=0,093); sin embargo, se registraron fluctuaciones entre el número de individuos durante los meses de estudio, a pesar de esto, la proporción entre sexos se mantuvo (Figura 2A).
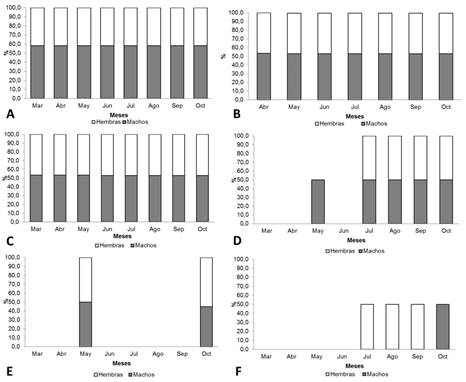
Figura 2 Proporción sexual de las especies de pseudoescorpiones: A, Pachyolpium isolatum. B, Lechytia chthoniiformis. C, Serianus aff. carolinensis. D, Planctolpium arboreum. E, Paraliochthonius quirosi. F, Epactiochernes sp.
Lechytia chthoniiformis Balzan (1890): se categorizaron 67 hembras y 77 machos; en promedio, las hembras midieron (1,0 ± 0,11 mm) y los machos (0,85 ± 0,06 mm) y presentaron diferencias significativas en la longitud corporal (W= 4690,5; α=0,05; P<0,05), evidenciando dimorfismo sexual (Tabla 2). La proporción de sexos observada durante todo el estudio, fue de 1:1, no se presentaron diferencias significativas entre el número de machos y hembras (X2=12,5; Gl=6; P=0,93) (Figura 2B).
Serianus aff. carolinensis Muchmore (1968): registró 23 hembras y 20 machos, las hembras midieron en promedio (2,35 ± 0,36 mm) y los machos (1,77 ± 0,24 mm), se presentó diferencias en la longitud corporal (W= 426,0; α=0,05; P<0,001), lo cual, evidencia un verdadero dimorfismo sexual (Tabla 2). La proporción de sexos observada durante todo el estudio, fue de 1:1, no se presentaron diferencias entre el número de machos y hembras (X2=14.1; Gl=7; P=0.57). Esta especie, a diferencia de las otras, exhibe un comportamiento particular (Fig. 2C).
Planctolpium arboreum Hoff (1964): registró 19 machos y 16 hembras, las hembras midieron en promedio (1,92 ± 0,26 mm) y los machos (1,56 ± 0,25 mm), presentando diferencias en la longitud corporal (t= -4,08; P<0,01), evidenciando dimorfismo sexual significativo con base en las medidas corporales (Tabla 2). La proporción de sexos observada durante todo el estudio, fue de 1:1 (Fig. 2D), no se presentaron diferencias entre el número de machos y hembras (X2=9,48; Gl=4; P=0,765).
Paraliochthonius quirosi Bedoya (2015): registró solo dos machos y cuatro hembras, siendo una de las especies que presentó el menor número de hembras y machos, la longitud corporal de las hembras midió en promedio (1,25 ± 0,1 mm) y los machos (1,1 ± 0,14), sin presentarse diferencias en la longitud corporal (W= 7.0; α=0.05; P= 0.22) (Tabla 2). La proporción de sexos observada durante todo el estudio, fue de 1:1, no se presentaron diferencias en el número de machos y hembras (X2= 3,841; Gl =1; P=0,43) (Fig. 2E).
Epactiochernes sp: presentó una proporción de sexos observada durante todo el estudio de 3:1 (Fig. 2F), a pesar de lo anterior, no se presentaron diferencias en el número de machos y hembras (X2=7.815, Gl=3, P=0.261). La especie Epactiochernes sp., registró solo un macho y tres hembras, la longitud corporal de las hembras midió en promedio (1,9 ± 0,35 mm) y el macho 1,5 mm, no se presentaron diferencias en la longitud corporal (W = 9.0; α=0.05; P = 0.06); sin embargo, debido al bajo número de individuos registrados, no se puede descartar que se presente un dimorfismo sexual marcado.
Periodos de reproducción: Se comparó el número de hembras y machos (adultos) con el número de ninfas, encontrándose una variación muy marcada para todas las especies como sigue:
En la especie P. isolatum, el mayor número de ninfas se registró desde marzo hasta junio con un promedio de 67 ± 3,6 ind./mes, en contraste, en estos meses el número de adultos (hembras y machos) presentó los valores más bajos de abundancia, con un promedio de 35 ± 12,9 ind./mes; al parecer, estos meses pueden corresponder con el último periodo de desarrollo postembrionario. El número de ninfas, tuvo un descenso muy marcado en el mes de junio y un incremento considerable de los individuos adultos, desde agosto hasta octubre con un promedio de 47 ± 13,2 ind./mes; lo cual, permite asegurar que durante estos meses se puede presentar el pico de reproducción de la especie, siendo septiembre el mes con el mayor número de adultos, exhibiendo un comportamiento univoltino (Figura 3A).
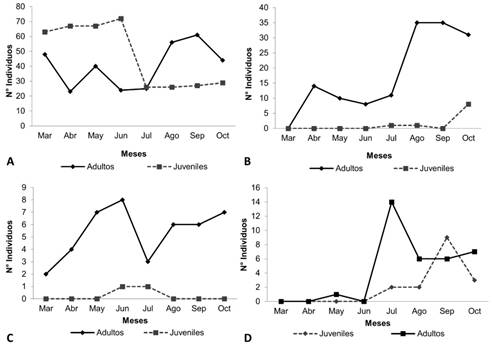
Figura 3 Fluctuación del número de adultos (hembras y machos) y de ninfas: A, Pachyolpium isolatum. B, Lechytia chthoniiformis. C, Serianus aff. carolinensis. D, Planctolpium arboretum
La especie L. chthoniiformis, durante todo el estudio registró mayor número de machos y hembras (adultos) que el presentado por las ninfas, con un promedio de 35 ± 12,3 ind./mes (Figura 2B). Entre abril y junio, no se registraron ninfas, meses en los que se presentaron los menores valores de abundancia para los adultos, lo cual sugiere, que la tendencia es encontrar más adultos que ninfas. Asimismo, los mayores valores de abundancia se registraron entre agosto y octubre, con un promedio de 30 ± 3,1 ind./mes, considerando estos meses como el pico de reproducción de esta especie, lo cual indica, que presenta un comportamiento univoltino (Figura 3B).
Se registraron dos periodos de máxima abundancia para hembras y machos (adultos) para la especie Serianus aff. carolinensis (Figura 3C). Entre marzo y mayo no se registraron ninfas, la primera deutoninfa se colectó en junio y en el mes de julio se colectó una tritoninfa. El primer pico de reproducción, fue identificado entre abril y mayo con un promedio de 8±1 ind./mes, cabe resaltar, que en estos meses hasta junio se registraron hembras con sacos ovígeros (Figura 3C). En el mes de julio se registró un descenso en el número de ninfas; sin embargo, entre julio y agosto se incrementó nuevamente los valores de abundancia de los adultos, con un promedio de 4 ± 1,2 ind./mes (Figura 3C). En el mes de octubre aumentó considerablemente la abundancia, con un promedio de 6 ± 0,9 ind./mes, donde se volvió a registrar hembras con sacos ovígeros, siendo septiembre y octubre el segundo pico de reproducción; este comportamiento, demuestra que Serianus aff. carolinensis es bivoltino (Figura 3C).
La especie P. arboreum, en el mes de mayo se presentó el valor más bajo de abundancia y para el mes de junio solo se registraron ninfas (Figura 3D). La tendencia, sugiere que se puede encontrar igual número de machos y de hembras. El mes de Julio registró el mayor número de machos y hembras (adultos), con un promedio de 7 ± 4,9 ind./mes (Figura 3D). En este periodo, se registraron hembras ovadas y en cámaras de seda y coincidió con el registro de ninfas y un aumento en su abundancia, con un promedio de 4 ± 2,8 ind./mes; este comportamiento, sugiere que esta especie es univoltina (Figura 3D).
Se registró poca actividad para la especie P. quirosi, debido a esto, los valores más altos de machos y hembras se registraron en mayo y octubre, no se registraron ninfas y hembras con sacos ovígeros, por tanto, se hizo difícil el registro de los respectivos instar, así como, identificar su periodo de reproducción. A pesar de que se registraron pocos individuos y la particular actividad de Epactiochernes sp., la tendencia, muestra que se pueden encontrar mayor número de hembras que de machos, siendo octubre el mes donde se registró el único macho exhibiendo un comportamiento críptico, debido a esto, no se puede asegurar con certeza, el periodo de reproducción de esta especie.
Discusión
En los cinco fragmentos de bosque de manglar evaluados, la mayoría de las especies registradas exhibieron una proporción sexual 1:1; autores como GABBUTT (1970) y POLIS (1990), consideran que esta proporción se encuentra bien extendida entre los arácnidos. Sin embargo, se han reportado marcadas variaciones entre las arañas, Anelosimus eximius Keyserling, 1884 (Theridiidae) presenta una proporción sexual que favorece a las hembras de 5:1; mientras que Larinioides cornutus (Clerk, 1757) (Araneidae) y especies de la familia Pholcidae (Carapoia ocaina Huber, 2000 y Mesabolivar aurantiacus Mello-Leitao, 1930) exhiben una proporción 1:1; mientras que, Metagonia taruma Huber, 2000 presenta diferencias que se atribuyen a variaciones estocásticas (VOLLRATH, 1986; YSNEL, 1991; MACHADO et al., 2007; CARVALHO et al., 2010; FOELIX, 2011). De igual forma, algunas especies de escorpiones presentan una proporción sexual que favorece a las hembras de 1:3 y de opiliones Megabunus diadema (Fabricius, 1799) (Phalangiidae) se considera partenogénica, sin embargo, especies de Prionostemma (Opilionida) presentan una proporción 1:1 (MERINO-SÁINZ et al., 2013; GRETHER et al., 2014; KASSIRI et al., 2015). A pesar de esto, la proporción de sexos presente en la naturaleza, tiende a ser siempre 1:1 e indica roles de igual importancia entre machos y hembras, dado que, la selección podría minimizar al sexo menos productivo, por tanto, la proporción sexual 1:1 sugiere, que el costo de criar con éxito las ninfas, es más o menos el mismo independientemente de su sexo (FISHER, 1930; SMITH, 1999; WADE et al., 2003; TABADKANI et al., 2012; WEDEKIND, 2012).
En este sentido, Epactiochernes sp., fue la única especie que presentó una proporción sexual de 3:1, lo cual sugiere, por la tendencia mostrada, que presenta una proporción sesgada hacia las hembras; ahora bien, el bajo número machos registrados, se atribuye al habito críptico de especie, comportamiento observado en otros artrópodos, donde, los machos construyen sitios profundos de anidación en el sustrato, y concuerda con lo registrado para algunas especies de pseudoescorpiones, como Paratemnoides nidificator (Atemnidae) que exhibe una proporción sexual sesgada hacia las hembras de 2:3 y Allochernes dubius (Chernetidae) de 1:3 en época de invierno y de 1:9 en época de cría; de igual forma, hay excepciones en aquellas especies que presentan competencia por compañeros para generar descendencia y se ha observado, que la combinación de hábitat y la sesgada proporción sexual operacional, podría generar intensa competencia de los machos (HAMILTON 1967; GABBUTT, 1970; ZEH 1987a; 1987b; ZEH y ZEH, 1990; WADE et al., 2003; TIZO-PEDROSO y DEL-CLARO, 2007).
En muchas especies de pseudoescorpiones, los machos y las hembras son fácilmente distinguibles por su longitud corporal, siendo, los machos más pequeños que las hembras evidenciando un dimorfismo sexual y otros caracteres sexuales secundarios (WEYGOLDT, 1969; ZEH y ZEH, 1997). Sin embargo, especies como L. chthoniiformis (Lechytiidae) y P. quirosi (Chthoniidae), en los fragmentos de bosque de manglar evaluados no presentaron diferencias significativas en la longitud corporal y no evidencian un verdadero dimorfismo sexual, lo cual se atribuye al microhábitat que ocupan, L. chthoniiformis presente en el suelo del manglar y P. quirosi críptico, asociado al cascajo de coral y la mayor parte del día sumergido por agua del mar. Por tanto, en aquellas especies de pseudoescorpiones que no presentan competencias por las hembras, la selección actúa favoreciendo el rápido desarrollo de la atapa adulta y el tamaño corporal para tener acceso a las hembras (WEYGOLDT, 1969; ZEH y ZEH, 1990; 1992; 1997).
De igual forma, P. isolatum, P. arboreum, Serianus aff. carolinensis, en los fragmentos de bosque de manglar evaluados, exhiben un verdadero dimorfismo sexual basado en las diferencias significativas de la longitud corporal, atribuido a los microhábitat que ocupan, P. isolatum en la hojarasca, P. arboreum en la corteza de troncos en descomposición y la especie Serianus aff. carolinensis se encuentra separada por tiempo y espacio (siendo exclusiva de corteza de árboles de zonas inundables), sin generar, competencia con otras especies de pseudoescorpiones por los recursos, exhiben una conducta intermedia, de acuerdo, a la utilización del hábitat permiten la deposición de miles de espermatóforos en compensación por el bajo éxito de fertilización de la hembra y se ve reflejado en alcanzar un esfuerzo reproductor temprano, como producto una rápida etapa adulta y un menor tamaño por parte de los machos (WEYGOLDT, 1969; ZEH y ZEH, 1990; 1992; 1997).
En general, las especies presentaron un comportamiento univoltino en los fragmentos de bosque de manglar con mayor periodo reproductivo, entre los meses de julio/agosto y agosto/septiembre, tanto en la hojarasca como en el suelo, al comienzo de la época de lluvia, utilizando la corteza de los arboles como sitios de anidación y refugio para las ninfas. Algunos autores, sugieren, que los pseudoescorpiones ajustan su ciclo de vida, como su periodo de reproducción, de acuerdo a las épocas y/o estaciones climáticas (como GABBUTT y VACHON, 1965; WEYGOLDT, 1969; ADIS y MAHNERT, 1985; ADIS et al., 1988; ADIS y MAHNERT, 1990; ADIS y MAHNERT, 1993; MORÁIS y ADIS, 1997; ADIS y JUNK, 2002; AGUIAR y BÜHRNHEIM, 2003; AGUIAR et al., 2006; BELOZEROV, 2013).
Sin embargo, Serianus aff. carolinensis exhibió un comportamiento bivoltino con mayor periodo de reproductivo en la corteza de árboles de zonas inundables entre los meses de junio/julio durante la época de transición y un segundo periodo menor entre los meses de octubre/noviembre durante la época seca. Autores como ADIS et al. (1988), sugieren que algunas poblaciones de pseudoescorpiones que habitan áreas inundables, presentan estrategias que compensan sus periodos perdidos de hábitos terrestres, en este caso, Serianus aff. carolinensis se encuentra adaptado morfológica y fisiológicamente para habitar las zonas inundables del manglar y concuerda, con lo registrado en bosques de la Amazonia y de Europa donde se ha encontrado que las poblaciones de pseudoescorpiones se encentran adaptados para ocupar estos microhábitats (WEYGOLDT, 1969; ADIS et al., 1988; BELOZEROV, 2013).
Los fragmentos de bosque de manglar evaluados, se caracterizan por presentar una estructura vegetal heterogénea, el sector conocido como Playa Blanca registró los mayores valores de abundancia de adultos y ninfas para todas las especies, lo cual, sugiere una estrecha relación de la abundancia de los pseudoescorpiones con la estructura vegetal de la zona; es decir, el número de adultos (machos y hembras) y ninfas registrados para cada una de las especies, sugiere que los microhábitat donde se encuentran establecidos, ofrecen, todas las condiciones necesarias tanto de refugio como de alimento, tanto para adultos como para ninfas, así como de reproducción (WEYGOLDT, 1969; GABBUTT, 1970; MORÁIS y ADIS, 1997; AGUIAR et al., 2006). Sin embargo, los bajos valores de abundancia de ninfas registradas en las especies L. chthoniiformis, P. quirosi y Epactiochernes sp., se asocia con el comportamiento críptico y edáfico de estas especies y, por lo tanto, dificultan el registro de los respectivos instar y la identificación de su periodo de reproducción (ADIS y MAHNERT, 1990; MORÁIS y ADIS, 1997; AGUIAR et al., 2006; AGUIAR y BÜHRNHEIM, 2011). Aunque, el descenso en el número de ninfas también se asocia con la mortalidad, al ser más susceptibles a los depredadores (WEYGOLDT, 1969; MORÁIS y ADIS, 1997; BELOZEROV, 2013).
La estructura-edad registrada y los ciclos de reproducción univoltino y bivoltino, sugieren una verdadera adaptación de estos arácnidos a los cambios producidos por el ciclo unimodal-biestacional dominante en la zona. La proporción sexual exhibida por la mayoría de las especies, parece indicar, que los recursos que ofrece el bosque de manglar son suficientes para obtener un éxito reproductivo, y que el dimorfismo sexual representado en el pequeño tamaño de los machos, sugiere que existe una competencia indirecta por tener acceso a las hembras. No obstante, la proporción sesgada hacia las hembras de Epactiochernes sp., parece indicar un comportamiento particular, en la que algunas especies de la familia, registran una fuerte competencia entre los machos por las hembras, generando implicaciones sobre la descendencia; sin embargo, la proporción sexual sesgada, exhibida necesita de un mayor estudio, debido a que, su hábito críptico hace difícil registrar eventos reproductivos.














