INTRODUCCIÓN
La leptospirosis es una enfermedad zoonótica, está se puede contraer cuando la bacteria que se encuentra en el suelo entra en contacto con el huésped al penetrar la piel lesionada o mucosas, y con aguas contaminadas con leptospiruria, que se define como la orina contaminada con Leptospira spp. En el año 1883 Louis Landouzy registró por primera vez la leptospirosis humana como una entidad clínica disímil a las ya conocidas para la época y en 1836 Adolf Weil observó signos propios de leptospirosis como fiebre, ictericia, hemorragia, insuficiencia hepática y renal en trabajadores agrícolas; para el año 1888 se le llamó Enfermedad de Weil en honor al estudioso que describió la enfermedad de curso grave y alta mortalidad 1. Habitualmente esta enfermedad se presenta de manera leve en 90 a 95 % de los casos, y de forma grave en 5 a 10 %. Algunos de los signos y síntomas son fiebre, cefalea, mialgias, náuseas, vómito, ictericia y enrojecimiento de los ojos. Las principales dificultades en el curso grave son el daño renal agudo, el compromiso pulmonar y la falla hepática 2 incluidos los países de Latinoamérica, donde es 100 veces más frecuente que en otras regiones del mundo. En los cuadros graves de la enfermedad, su mortalidad alcanza el 10 %. Su diagnóstico es un reto debido a que las manifestaciones clínicas en la fase inicial son inespecíficas y a la poca disponibilidad de pruebas diagnósticas. Objetivo. Describir las características sociodemográficas y clínicas, y el desenlace de la enfermedad en pacientes hospitalizados con leptospirosis. Materiales y métodos. Es un estudio retrospectivo que incluyó pacientes atendidos en cuatro instituciones de Medellín, entre enero de 2009 y diciembre de 2013, con un cuadro clínico sugestivo e IgM positiva para Leptospira spp. Resultados. Se incluyeron 119 pacientes, 80 % hombres y 58 % de procedencia rural. La duración promedio de los síntomas fue de 9,6 días (DE=9,6).
Este microorganismo hace parte del orden Spirochaetales, a la familia Leptospiraceae y al género Leptospira3. Algunas especies silvestres como los roedores son considerados reservorios naturales de Leptospira spp. los cuales juegan un destacado papel en el mantenimiento endémico de la infección en un área determinada, mientras que mamíferos domésticos como los bovinos, porcinos, equinos y caninos actúan como hospederos definitivos, en donde se reconocen diferentes tipos de serovares, algunos de ellos específicos en algunas especies 4.
La bacteria se restringe principalmente en los túbulos renales de los animales portadores, habitando persistentemente este sitio para luego ser eliminados por la orina, presenta una gran variedad de signos y síntomas por lo que existen varios diagnósticos diferenciales 5. Para efectuar un buen diagnóstico, la Organización Mundial de Sanidad Animal (OIE) recomienda como prueba de oro la Aglutinación Microscópica o Microaglutinación (MAT) 6.
En todo el mundo se han documentado más de 500.000 casos de leptospirosis grave por año, con una presentación de la enfermedad de 0,1 a 1 caso por cada 100.000 personas en climas templados y de 10 a 100 caos por cada 100.000 habitantes en climas tropicales. En Colombia, la incidencia reportada en el 2014 fue de 1,7 por 100.000 personas y la seroprevalencia en zonas de alto riesgo es de 12,5 a 47% según diferentes estudios 2 incluidos los países de Latinoamérica, donde es 100 veces más frecuente que en otras regiones del mundo. En los cuadros graves de la enfermedad, su mortalidad alcanza el 10 %. Su diagnóstico es un reto debido a que las manifestaciones clínicas en la fase inicial son inespecíficas y a la poca disponibilidad de pruebas diagnósticas. Objetivo. Describir las características sociodemográficas y clínicas, y el desenlace de la enfermedad en pacientes hospitalizados con leptospirosis. Materiales y métodos. Es un estudio retrospectivo que incluyó pacientes atendidos en cuatro instituciones de Medellín, entre enero de 2009 y diciembre de 2013, con un cuadro clínico sugestivo e IgM positiva para Leptospira spp. Resultados. Se incluyeron 119 pacientes, 80 % hombres y 58 % de procedencia rural. La duración promedio de los síntomas fue de 9,6 días (DE=9,6. Por tal razón se ha planteado como objetivo conocer la importancia de la leptospirosis en la salud pública teniendo en cuenta que son algunos animales los reservorios y otros, los hospederos definitivos de esta enfermedad.
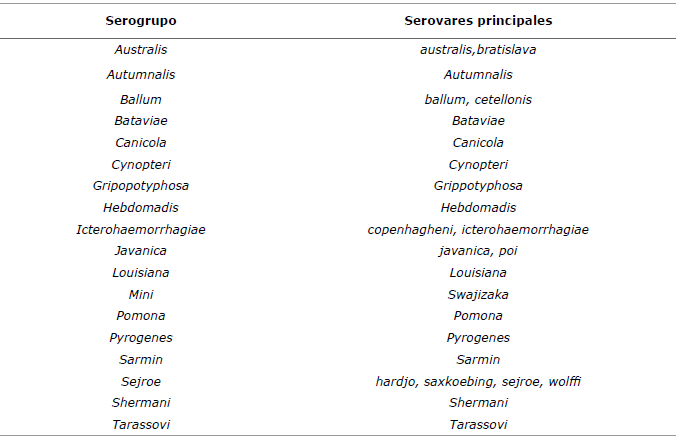
Caracterización. La Leptospira es una bacteria gramnegativa, aerobia estricta. Su forma generalmente es helicoidal, están enrolladas en dirección a las manecillas del reloj y presentan en uno o ambos extremos una leve curvatura, característica de las leptospiras patógenas 7. Está conformada por un cilindro protoplasmático que le facilita su motilidad por el organismo infectado, posee un antígeno somático común responsable de la inmunidad protectora. Crecen a una temperatura óptima entre 28-30°C y en un medio con pH que oscila entre 7.2 y 7.6 8. Recientemente mediante análisis filogenético se determinó que Leptospira spp. se divide en tres linajes: saprofítico, intermedio y patogénico que se correlacionan con el nivel de patogenicidad 9 conocen muchos serovares de los cuales se encuentran principalmente 28 serovares y 25 serogrupos más representativos en la tabla 1.
Tabla 1 Resumen de los principales serogrupos y serovares más representativos de la especie L. interogans10.
Este microorganismo generalmente penetra al organismo por las mucosas, conjuntivas, cortes pequeños, abrasiones, piel húmeda o directamente por vía oral ingiriendo inconscientemente la bacteria y pasa por vía sanguínea a órganos parenquimatosos como hígado, bazo o riñón, permanece en lugares donde la actividad de anticuerpos es baja como humores oculares, útero y túbulos renales que se convierten en la principal vía de infección. En humanos la infección ocurre de manera accidental por trabajo, salidas recreativas o por desastres naturales donde las aguas estancadas y contaminadas son un foco altamente contagioso 4,11.
Leptospira permanece viva e infectiva en medios variados como suelo húmedo, ríos, lagos, agua estancada, pantanos y lodo. De igual manera se han encontrado en leche, carnes frías y algunas vísceras. En contraste, son sensibles a la acidez, desecación, congelamiento, variaciones en el pH (desactivándose en menores de seis o mayores de ocho) y a la pasteurización, del mismo modo la orina ácida, antisépticos y desinfectantes no permiten su sobrevivencia y son sensibles a varios antibióticos, incluyendo la penicilina 7.
Epidemiología. Esta enfermedad es considerada una antropozoonosis, esto quiere decir que afecta tanto a los animales ya sea mamíferos domésticos, animales salvajes, animales de sangre fría y a humanos. La casuística de leptospirosis hace evidente las brechas en la prevención primaria de la enfermedad, tanto en lo que respecta a su implementación, como a su control 11,12. La leptospirosis es una enfermedad reemergentes en el mundo con altas prevalencias en diferentes especies y con alto riesgo de infección, por tal razón clasifica entre las 35 primeras causas de muertes a nivel mundial, resaltando su especial cuidado en el ámbito de salud pública, ya que si este problema no se controla puede llegar a generar mortalidades humanas y anímales, junto con cuantiosas pérdidas económicas 13, las cuales se pueden deber al incremento de la incidencia de esta enfermedad, tanto en países desarrollados como en los subdesarrollados, sin ninguna relación específica, ya que se han encontrado altas y similares prevalencias a menos de 3800 msnm y más de 4000 msnm 3,14.
Se han obtenido mayores prevalencias en el serovar icterohaemorragiae, que tiene a los roedores como hospederos definitivos. Las prevalencias encontradas en las diferentes poblaciones estudiadas son muy variables, en el hombre van del 6% al 47%, en perros del 12% al 41%, en roedores del 12.5 % al 82%, en bovinos del 41 al 60 %, en cerdos del 10.3% al 25.7% y en animales silvestres como los primates no humanos se encontró una prevalencia del 23% 15, adicional a esto a nivel mundial se han observado en los últimos años una ampliación de casos de leptospirosis en humanos, especialmente en zonas de riesgo, tal es el caso de Ayacucho, Perú que registró un aumento de 4 a 29 reportes en los últimos 5 años, sin embargo a los centros de salud llegan muchas personas con enfermedades e infecciones similares sin que se llegue a determinar de manera concluyente los agentes etiológicos que las causen 16.
Lo anterior se justifica en un estudio en la región tropical de Perú donde se evidenció que esta región es un área hiperendémica de leptospirosis con elevada prevalencia de 64.6% con cuadros asintomáticos, donde la exposición ambiental a esta bacteria es frecuente y hay diversa cantidad de serovares circulantes y en algunos casos en el mismo individuo, lo que se conoce como reinfecciones, dejando abierta la posibilidad de protección contra serovares y explicarían la elevada prevalencia de infección asintomática, a través de mecanismos de inmunidad protectora adquirida 17. Cerca del 15% de los casos sospechosos por leptospirosis son clasificados como falsos positivos por el sistema de vigilancia, los cuales son captados como tales por el laboratorio, situación que puede deberse a varios factores posiblemente relacionados a la poca información de esta zoonosis por parte del personal médico 18.
El riesgo de adquirir infecciones por Leptospira spp. se observa en los trabajadores de limpieza pública y en aquellos que manejan residuos, debido a su mayor exposición a desechos que pueden contener excretas, secreciones de animales y productos de origen animal 19, de igual manera en los trabajadores de producciones pecuarias, especialmente en mayores de 20 años y en producciones de leche debido a que el ganado bovino lechero generalmente está en sistemas intensivos o semiextensivos lo cual favorece la transmisión 20. Asimismo, la región Amazonas también se relaciona con la enfermedad ya que esta zona cuenta con las condiciones agroecológicas necesarias para su replicación y transmisión 11.
Un estudio reportó que no se encontró relación entre el personal médico tratante de pacientes enfermos de Leptospira y la enfermedad 21; Los dueños de caninos domicilarios sobresale como parte de la población suceptible a contraer la enfermedad ya que se han encontrado altas prevalencias en caninos domésticos, por ejemplo en Campeche, México se realizó un estudio en caninos donde el 100% presentó anticuerpos IgG a Leptospira spp. indicando la infección con leptospirosis en algún momento de su vida, lo cual fue relacionado con contacto en el medio ambiente con la bacteria, ya que no se indicó la vacunación en estos casos, por lo que la convivencia con estos animales podría ser un factor de riesgo importante. También se reportó que en perros callejeros los serovares Leptospira icterohaemorrhagiae y Leptospira pomona son los más prevalentes en esta población 22.
Cabe señalar que los caninos son susceptibles a todos los serovares, y debido a la elevada población canina, así como las condiciones en las que viven algunos, favorece la transmisión de Leptospira intraespecie, y del canino portador pasa a los humanos 23. También en investigaciones sobre leptospirosis se reportan un mayor número de casos en niños entre 10 y 14 años cuyo grupo de edad coincide con la escolarización de la población infantil y su asistencia a instituciones educativas, en donde podrían presentarse otros comportamientos de riesgo 24.
Debido a la gran población capaz de contraer esta enfermedad se hace importante realizar ágiles diagnósticos ya que en algunos casos se puede presentar la muerte precozmente, teniendo en cuenta un reporte de caso en donde se refiere la rápida evolución que pueden tener algunos casos, en los cuales, aunque sospecharon la enfermedad e iniciaron un tratamiento antibiótico el paciente falleció antes de recibir un diagnóstico confirmado 25. Debido a que la epidemiología de la leptospirosis y sus reservorios es variable, es posible, no sólo que cambie el patrón de leptospiras circulantes en el tiempo y espacio, sino también que surjan nuevas variedades 26.
Los resultados de algunas investigaciones reflejan la presencia de Leptospira de las especies patógenas en el ambiente, principalmente en ríos, lo que podría estar relacionado el aumento de casos en humanos que fueron registrados por el Ministerio de Salud de Nicaragua 27. Adicionalmente se ha relacionado la época de lluvias con el aumento de casos de leptospirosis, especialmente en poblaciones animales ovinas de la Sabana de Bogotá 28. Adicional a esto en Colombia se ha demostrado la circulación de 17 serogrupos, algunos específicos por departamentos, ya que las diferencias ecológicas y ambientales en diferentes ubicaciones geográficas fomentan diferentes medios para la proliferación y desarrollo de algunos serovares específicos 29.
Patogenia y curso de la enfermedad. Los roedores tienen gran capacidad de desplazarse por diferentes lugares considerándose los vectores más importantes para la Leptospira, estos animales representan un problema para la salud pública en diferentes regiones geográficas 30, la eliminación de bacterias al ambiente se da por orina generalmente después de cumplir un período promedio de cinco a catorce días. Cada uno de los serovares se encuentra relacionado con patologías secundarias producto del daño generado a nivel sistémico en el organismo 1.
L. icterohaemorrhagiae se asocia a una lesión primaria en hígado, en tanto que canicola produce frecuentemente una lesión renal. Serovares como pomona y grippotyphosa han sido relacionados con patologías como insuficiencia renal aguda, y los serovares bratislava, hardjo y bataviae se relacionan en enfermedad hepática al igual que en enfermedad renal 31. Varios hallazgos sugieren que la modulación de la respuesta inmunitaria está determinando la presentación de signos clínicos y por consiguiente, la evolución final de la enfermedad 32.
La enfermedad febril empieza con sintomatología inespecífica: cefalea, escalofrío, vómito, mialgias severas, conjuntivitis que puede durar de 5 a 10 días 33, dada su sintomatología inespecífica se puede confundir con otras enfermedades como dengue, hepatitis viral o meningoencefalitis 34 y también se pueden presentar varios casos de coinfecciones zoonóticas, por ejemplo asociaciones de brucelosis y leptospirosis por lo que se debe confirmar bien cada diagnóstico antes de iniciar un tratamiento específico 35. También se han hecho reportes de coinfecciones entre dengue y Leptospira, se encontró que el 7% correspondiente de las muestras positivas a dengue también serían positivas para Leptospira36, lo cual sugiere que si en el año 2017 se notificaron 483.208 casos de leptospirosis podría haber aproximadamente 33.824 casos de pacientes con diagnóstico probable de dengue, que además puede desencadenar la muerte si no es diagnosticado y tratado oportunamente 37.
Después de la sintomatología inespecífica se puede mostrar una de las dos formas de presentación de esta enfermedad, la principal que es la menos crónica se llama forma anictérica donde ocurre una fase leptospirémica; inicia con fiebre elevada de 39 a 40°C, cefalea frontal o retro orbitaria, fotofobia, mialgias espontáneas o provocadas localizadas, artralgias, escalofríos, anorexia, síntomas gastrointestinales como náuseas, vómitos, diarreas, síntomas respiratorios. Se conoce también la forma ictérica que puede representar graves problemas e incluso puede llevar a la muerte, la primera parte similar a la forma anictérica pero al quinto día aparece ictericia, insuficiencia renal aguda, hemorragias, anemia, miocarditis, hepatomegalia y esplenomegalia, y menos frecuente la pancreatitis, si no se da un tratamiento puede llegar a una fase grave presentando pericarditis, rabdomiólisis, hemólisis y coagulación intravascular diseminada, shock séptico y fallo multiórganico 1.
Sin embargo, en los últimos estudios se ha referido un síntoma diferente a los descritos tradicionalmente como lo es la falla a nivel pulmonar, requiriendo un tratamiento de los pacientes infectados con vasodilatadores y cuidados intensivos debido al compromiso pulmonar, no se ha referido la relación de un serovar específico con este tipo de sintomatología de la leptospirosis 2. También en casos que han desencadenado en la muerte del paciente se ha observado herniación de amígdalas cerebelares que consiste en el desplazamiento de las amígdalas de cerebelo, a través del foramen magnum, por un aumento de la presión en la fosa posterior, causando una compresión de la unión bulbo-medular, secundario a edema cerebral y hemorragia pulmonar como signos poco reportados tradicionalmente 37.
Diagnóstico. Esta zoonosis no es siempre diagnosticada, debido a la falta de conocimiento de la enfermedad o dificultad de acceso a las herramientas diagnósticos 38. Debido a la amplia variedad de serovares que pueden infectar a un organismo se emplean técnicas de diagnóstico altamente específicas para el caso como lo son la detección de anticuerpos fluorescentes, Ensayo por Inmunoabsorción Ligado a Enzimas (ELISA), Reacción en Cadena de la Polimerasa (PCR) y Microaglutinación con Antígenos Vivos (MAT) 6,39,40. Para confirmar la enfermedad se deben tomar muestras de sangre, orina o líquido cefalorraquídeo y enviarlas al laboratorio para su análisis y determinación del diagnóstico 15.
A pesar de que existen una variedad de técnicas no todas son empleadas, la más usada es la de Microaglutinación con Antígenos Vivos (MAT) ya que es catalogada la prueba de oro por la OIE. Sin embargo, la prueba de MAT tiene limitaciones en el diagnóstico de la infección crónica en animales, en el diagnóstico de abortos y en la identificación de portadores renales o genitales dado que MAT no es efectiva antes del séptimo día de la enfermedad ya que no detecta la IgG 41.
La técnica de PCR en los últimos años ha tomado importancia ya que permite hacer la detección de Leptospira, se han estandarizado protocolos de PCR en tiempo real con sondas TaqMan que permite detectar cepas patógenas del género Leptospira en orina de canes domésticos, permitiendo detectar hasta 10 leptospiras/ml 42. Por otro lado, también se ha estudiado el uso de las pruebas rápidas de sistema de inmunocromatografía de flujo lateral que ha obtenido muy buenos resultados al momento de diagnosticar, arrojando una sensibilidad del 96% y una especificidad del 97.1% 43.
La IF-IgM aparece como una herramienta útil para el diagnóstico temprano (etapa aguda, menos de diez días tras el inicio de los síntomas) de pacientes con leptospirosis, sobre todo en aquellos con primera prueba de MAT negativa. Esta prueba se puede realizar con infraestructura básica de laboratorio, que cuente con microscopio de luz ultravioleta, láminas sensibilizadas que se pueden conservar hasta tres meses y el resultado está listo en tres a cuatro horas 44.
Control, prevención y tratamiento. Un aspecto importante que demanda atención es el problema con roedores, principales reservorios, generando costos en el control de estos ya sean domésticos o salvajes. Los estudios refieren situaciones en las que incluso después de realizar los programas para el control de roedores no se han percibido alteraciones en las prevalencias debido a que este es un factor con amplia variabilidad 37. Estos animales son difíciles de eliminar sin las medidas sanitarias adecuadas, tienen una tasa de reproducción elevada y están siempre en contacto con los alimentos y agua ofrecidos a los animales domésticos, que pueden contaminarse fácilmente con las leptospiras que las ratas eliminan intermitentemente con la orina 45. Estudios han permitido saber que Scapteromys aquaticus, conocido comúnmente como ratón de pantano es una especie de roedor reservorio de leptospiras patógenas en las zonas que habita 46. Adicionalmente en Colombia se realizó un reporte de la presencia de Leptospira interrogans en el ratón casero Mus musculus y se determinó que este estaría participando en la transmisión de la bacteria 47.
Otros factores de riesgo reportados, son los sistemas de producción lecheros que incluyen una elevada densidad animal, aún durante cortos periodos de tiempo, y defectos en la integridad de las instalaciones que facilitan la acumulación de excretas, contribuyendo en la diseminación y mantenimiento de la infección, haciendo ineficientes la vacunación y uso de antibióticos 47, por esta razón se deben realizar buenas prácticas en las producciones animales para evitar el contagio y diseminación de esta enfermedad que puede ocasionar grandes problemas en la salud pública.
En aras de controlar la diseminación de esta enfermedad se han desarrollado vacunas antileptospirósicas de células enteras generalmente eficaces en la protección contra la infección letal, aunque esta protección tiene una limitada duración y es restringida a la serovariedad componente y aquellas antigénicamente relacionadas. Sin embargo, la eficacia de una vacuna antileptospirósica se debe distinguir entre la protección contra la infección letal (muerte) y la protección contra el establecimiento del estado de portador (infección de órganos y leptospiruria) 48.
La enfermedad, ha disminuido considerablemente en la prevalencia con el desarrollo de vacunas comerciales que contienen antígenos de estos serovares. Sin embargo, los casos clínicos notificados asociados con otros serovares patógenos como pomona, grippotyphosa y bratislava no incluidos en estas vacunas han experimentado un aumento exagerado en los animales para los últimos años 30.
En humanos la inmunización se realiza con la vacuna trivalente de pomona, canícola e icterohaemorrhagiae en dos dosis, su uso se recomienda a partir de los 15 años de edad, en personas que por su trabajo tienen riesgo de adquirir la enfermedad 1. Generalmente la vacuna es muy segura, las principales reacciones adversas reportadas son fiebre (19%), cefalea (15%), dolor local (14%) y malestar general (9%) y recientemente se informó un caso en Cuba que presentó neuralgia amiotrófica 49.
El tratamiento de la leptospirosis depende de varios factores entre ellos, la gravedad del paciente y la edad, y los antibióticos de elección son las penicilinas y las tetraciclinas, que se pueden administrar de manera monovalente o en combinación, otros antibióticos que pueden emplearse son amoxilina, doxiciclina, cefalosporina y eritromicina 15. Adicionalmente se han hecho estudios para usar otros medicamentos alternativos, producto de esto es el Intacglobín, medicamento genérico de origen sanguíneo, contiene inmunoglobulinas polivalentes de las clases IgA, IgM e IgG que es capaz de generar inmunidad ante los anticuerpos de Leptospira y además proporcionar un tratamiento para disminuir o eliminar los signos y síntomas de esta enfermedad 50.
CONCLUSIONES
La leptospirosis es una enfermedad reemergente e importante en la medicina veterinaria y salud pública ya que afecta a todo tipo de animales y a humanos, propagándose rápidamente y generando grandes pérdidas en producción animal y disminuyendo la calidad de vida de las personas, debido al poco conocimiento de esta zoonosis en la población, por esta razón muchas veces es subdiagnosticada y los pacientes no reciben los cuidados necesarios cobrando vidas. Esto, hace necesario ampliar la percepción de esta enfermedad y encender las alarmas para establecer programas que colaboren con la prevención y control de la leptospirosis desde el campo de la salud pública en primer lugar y de igual manera en la medicina veterinaria para colaborar con la eliminación de la leptospirosis tanto de la población humana como de la población animal.














