INTRODUÇÃO
Nas últimas décadas a aquicultura cresceu de forma expressiva 1. Segundo dados da Organização das Nações Unidas para Alimentação e Agricultura (FAO), em 2016 a produção aquícola global ultrapassou 110 milhões de toneladas. As projeções produtivas estabelecem um crescimento de 18%, contabilizando índices superiores a 200 milhões de toneladas para 2030, sendo a maior parte da produção representada por espécies cultivadas em água doce 2.
A taxa de produção piscícola, entretanto, apresentou decréscimos anuais a partir de 2010, fator esse relacionado aos altos custos da farinha de peixe e demais ingredientes utilizados na fabricação de rações, à pouca disponibilidade de locais ideais para a produção e aspectos relacionados à qualidade da água 3, sendo este último um dos fatores mais importantes para o sucesso da produção de organismos aquáticos 4.
A qualidade da água destinada ao cultivo de organismos aquáticos deve estar dentro dos parâmetros microbiológicos, físicos e químicos preconizados em lei. No Brasil, o Conselho Nacional do Meio Ambiente (CONAMA) dispõe sobre a classificação e diretrizes ambientais para o enquadramento dos corpos de águas superficiais, bem como estabelece as condições e padrões de qualidade da água para o cultivo de organismos aquáticos 5. Os parâmetros físico-químicos e microbiológicos da água, quando não encontrados em níveis ideais, afetam a sobrevivência, a reprodução, o crescimento, o manejo das espécies cultivadas e a qualidade do produto final 6.
Um grupo de micro-organismos amplamente distribuído na natureza, inclusive na água, é o dos coliformes. Nesse grupo estão incluídos os coliformes termotolerantes (CTT), micro-organismos caracterizados pela atividade da enzima P-galactosidase, podendo se desenvolver em meios contendo agentes tensoativos, além de fermentar a lactose à temperatura de 45°C, com produção de ácido, gás e aldeído 6,7. No Brasil, de acordo com a legislação vigente, a Resolução CONAMA n° 357 de 17 de março de 2005 5, os CTT são utilizados como padrão para qualidade microbiológica de águas superficiais destinadas ao abastecimento, à recreação, à irrigação e à piscicultura. Escherichia coli é um CTT encontrado naturalmente no intestino de homeotérmicos. Entretanto, não faz parte da microbiota intestinal dos peixes, a não ser em função da poluição das águas pelo lançamento de esgotos e outros meios de contaminação 7. Assim, a presença de CTT ou Escherichia coli na água aponta a contaminação de origem fecal, sendo, portanto, indicador de qualidade higiênico-sanitária.
Neste contexto, a determinação desses parâmetros em águas de cultivo de animais aquáticos é de grande importância, uma vez que o estado de Rondônia é o maior produtor de peixes nativos em cativeiro do Brasil. Desta forma, o trabalho teve como objetivo avaliar a qualidade microbiológica da água da represa, viveiros escavados e efluente da base de piscicultura Carlos Eduardo Matiazze, localizada em Presidente Médici, Rondônia, Brasil.
MATERIAL E MÉTODOS
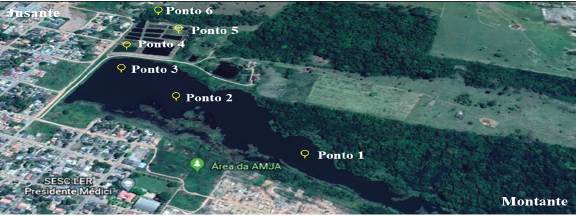
Área de estudo. O estudo foi realizado em Presidente Médici, na base de piscicultura Carlos Eduardo Matiazze. A estação pertence à Universidade Federal de Rondônia - UNIR, sendo constituída por uma represa alimentada por vários igarapés de primeira e segunda ordens. A água estocada serve como fonte de abastecimento para os viveiros da unidade experimental, onde são desenvolvidas atividades de pesquisas relativas à criação de peixes (e.g pirarucu e tambaqui) em viveiros escavados e tanques-rede, de acompanhamento limnológico, de melhoramento genético e de estudos com as comunidades planctônicas 8,9.
A represa está localizada em uma zona de transição entre a área urbana e a área rural. À margem direita existe uma pequena reserva de mata ciliar e uma área de propriedade particular que utiliza da água para irrigação do solo, plantação e pastagens. À margem esquerda está diretamente inserida e interligada à área urbana, apresentando diversas moradias. A base de piscicultura não possui viveiros de decantação onde possam ser depositados seus efluentes, sendo os resíduos e a matéria orgânica lançados diretamente a um pequeno efluente.
O ponto 1 (11°10'82"S-61°53'35"O) está localizado na gênese da represa, próximo à entrada das águas dos igarapés que a abastece; o ponto 2 (11210'57"S-61°53'46,9"O) está localizado próximo às margens com a presença de residências; o ponto 3 (11°10'52"S-61°53'44"O) se localiza próximo à saída de água da represa. O ponto 4 (11°9,54'14"S-61°53,5'63"O) se trata de um viveiro onde foram à época foram realizados experimentos com tambaqui (Colossoma macrompomum) 8; e o ponto 5 (11°9,57'38"S-61°53,52'87"O) é um viveiro onde foram realizados experimentos com pirarucu (Arapaima gigas) 9. Já o ponto 6 (11°10'26"S-61°53'65"O) está localizado a jusante dos demais, no efluente (Figura 1). As coordenadas geográficas foram obtidas com o auxílio de Global Position System (GPS) da marca Garmin modelo etrex.
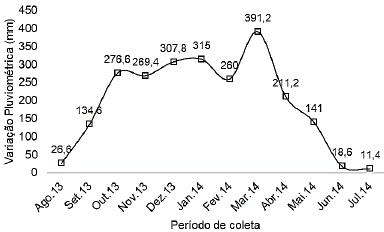
Clima. O clima da região é caracterizado por temperaturas que variam entre 19 e 332C e precipitação anual em torno de 2500 mm 10. O período chuvoso ocorre nos meses de outubro a abril, e o período de junho a agosto corresponde à época seca, maio e setembro são considerados meses de transição 10. Os dados referentes à pluviosidade para o período de desenvolvimento do trabalho foram adquiridos da Empresa Brasileira de Pesquisa Agropecuária (EMBRAPA) de Presidente Médici e são presentados na Figura 2.
Coleta das amostras. As amostras de água foram coletadas mensalmente entre agosto de 2013 e julho de 2014 nos seis pontos amostrais (72 coletas), abrangendo a estação de chuva e seca. Foram utilizados frascos de vidro com capacidade para 250 mL, com tampa esmerilhada, esterilizados em autoclave (15 min a 121 °C). O frasco foi mergulhado à profundidade de 15 a 30 cm e aberto apenas dentro da água, com a abertura posicionada para baixo. Após a coleta, as amostras foram transportadas em bolsa térmica com gelo para o Instituto Federal de Ciência e Tecnologia de Rondônia (IFRO), Campus de Ji-Paraná, onde foram analisadas no Laboratório de Química.
Preparação do local de trabalho. Os frascos contendo a água foram manipulados assepticamente em área de trabalho previamente desinfetada com etanol 70%. Todos os utensílios e instrumentos usados foram previamente esterilizados em autoclave, estufa de esterilização ou flambados no momento do uso, conforme o caso.
Análises microbiológicas. O método empregado para a determinação de coliformes totais (CT) e termotolerantes (CTT) foi o do Número Mais Provável (NMP). Esta técnica foi proposta por McCrady e estima a quantidade de microrganismos presentes na amostra 11. Pelo número de tubos positivos em cada uma das diluições empregadas determina-se o Número Mais Provável por grama ou mL de produto, tendo como base a tabela estatística de Hoskins para três, cinco ou dez tubos. Por esta técnica pode-se obter informações sobre a população presuntiva de coliformes (teste presuntivo), sobre a população real de coliformes (teste confirmativo) e sobre a população de coliformes termotolerantes.
Preparação dos meios de cultura. Foram empregados três caldos, sendo cada um dissolvido em água conforme orientação da embalagem. Após a dissolução, alíquotas de 9 mL de cada caldo foram distribuídas em tubos de ensaio com rosca contendo tubos de Durham invertidos. Os tubos com meio de cultura foram esterilizados em autoclave a 121°C, durante 15 min. O ar contido nos tubos de Durham foi removido.
Teste presuntivo. Para cada ponto de coleta foram feitas seis diluições em triplicata, de modo que a água coletada foi diluída no caldo lactosado. A primeira diluição (10-1) consistiu na transferência de um mL da água para um tubo contendo 9 mL do meio de cultura. Em seguida, foi realizada homogeneização e, posteriormente, a segunda diluição (10-2), que consistiu na transferência de um mL da diluição 10-1 para outro tubo com 9 mL de caldo lactosado. Esse procedimento seguiu até a sexta diluição (10-6). O teste é dito presuntivo porque além de coliformes, outras bactérias não pertencentes a esse grupo podem fermentar a lactose e produzir gás.
Incubação. Após a inoculação os tubos foram incubados em estufa à 37±0,5°C por 48 horas. Após esse período, os tubos que apresentaram turbidez do meio e presença de gás nos tubos de Durhan foram considerados positivos.
Teste confirmativo para coliformes totais (CT). Para este teste utilizou-se o caldo verde bile brilhante (VB), que contém dois inibidores (bile e o corante verde brilhante, derivado do trifenilmetano) do crescimento da microflora acompanhante, especialmente bactérias gram-positivas. A incubação foi em banho-maria a 35°C durante 48 horas. A lactose é a fonte de carboidrato deste meio. Assim, a produção de gás nos tubos de Durhan, nas condições do teste, indica que houve desenvolvimento de bactérias gram-negativas que fermentam lactose, característica do grupo coliforme. Dos tubos que apresentaram formação de gás no caldo lactosado foram retiradas alíquotas com alça de platina e transferidas para tubos contendo 9 mL de caldo VB, com tubos de Durhan invertidos.
Teste confirmativo para coliformes termotolerantes (CTT). Para o teste confirmativo da presença de CTT utilizou-se o caldo Escherichia coli. Assim, tomou-se uma alçada do meio de cultura dos tubos positivos para o teste presuntivo e a transferiu para tubos contendo o caldo EC. A incubação foi em banho-maria a 44,5 - 45°C durante 48 horas. A positividade do teste foi observada pela produção de gás no interior dos tubos de Durhan. A partir do número de tubos positivos, com base na tabela de cálculo de Hoskins, foi obtido o Número Mais Provável (NMP) de coliformes totais e termotolerantes, expresso em NMP por 100 mL. Esse número, baseado em fórmulas probabilísticas, é uma estimativa da densidade média de coliformes na amostra 12.
Análise estatística. Todas as análises foram realizadas em triplicata e os resultados foram apresentados como média. Coliformes totais e termotolerantes foram avaliados por ANOVA, buscando demonstrar a contaminação apenas entre os pontos e meses de coleta. Homocedasticidade e normalidade dos resíduos foram avaliadas (tesde de Bartlett e Shapiro-Wilk, respectivamente) e os dados transformados quando necessário, para ajuste aos pressupostos da análise. Foi considerado um nível de significância de 5% e as análises estatísticas foram realizadas no software R (https://www.r-project.org/).
RESULTADOS
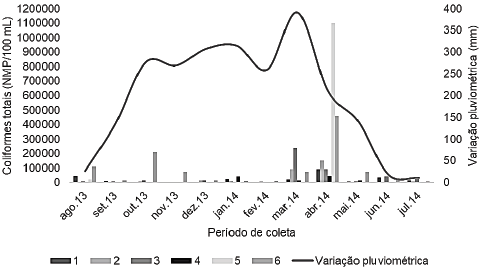
Os valores para coliformes totais variaram de 300 a 1100000 NMP/100 mL e de 360 a 110000 NMP/100 mL para o período chuvoso e seco, respectivamente. Diferenças significativas foram observadas entre os pontos e entre os meses avaliados (p<0,05). O ponto 6 (efluente) apresentou a maior contaminação de NMP/100 mL, seguido pelos pontos localizados na represa (1, 2 e 3) e os pontos localizados nos tanques (4 e 5). Estatisticamente os meses de março e abril apresentaram os maiores valores de NMP/100 mL para todos os pontos (Tabela 1).
Tabela 1 Coliformes totais (NMP/100 mL) na água da base de piscicultura Carlos Eduardo Matiazze.
| Período | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Ponto | 2013 | 2014 | ||||||||||
| ago.abc | set.bc | out.abc | nov.bc | dez.bc | jan.abc | fev.c | mar.ab | abr.a | mai.abc | jun.bc | jul.bc | |
| 1AB | 4,6x104 | 1,1x104 | 4,3x103 | 3,6x102 | 2,3 x103 | 2,4x104 | 2,3x103 | 2,1x104 | 9,3x104 | 7,4x103 | 3,6x104 | 1,5x104 |
| 2AB | 3,6x103 | 4,3x103 | 7,4x103 | 1,5x103 | 1,5x104 | 9,3x103 | 7,4x103 | 9,3x104 | 150000 | 1,5x103 | 3,6x102 | 7,4x103 |
| 3AB | 7,5x103 | 7,4x103 | 1,5x104 | 3,6x102 | 1,5x104 | 4,3x103 | 4,3x103 | 240000 | 9,3x104 | 7,4x103 | 4,3x104 | 2,4x104 |
| 4B | 1,5x103 | 3,6x102 | 9,2x102 | 3,0x102 | 7,4x102 | 4,3x104 | * | 1,5x104 | 4,6x104 | 1,5x104 | 3,0x102 | 3,6x102 |
| 5B | 2,1x104 | 4,3x103 | 2,3x103 | 4,3x103 | 3,6x102 | 4,3x103 | * | 4,3x103 | 1,1 x106 | 9,2x102 | 1,5x103 | 1,5x103 |
| 6a | 1,1x105 | 1,5x104 | 2,1x105 | 7,4x104 | 1,5x104 | 9,3x103 | 9,3x103 | 7,4x104 | 4,6x105 | 7,4x104 | 2,1x104 | 7,4x103 |
Valores na mesma linha (meses) seguidos por letras minúsculas idênticas não diferem entre si ao nível de 5 % entre os meses pelo teste de Tukey, enquanto valores na mesma coluna (pontos), seguidos por letras maiúsculas idênticas não diferem entre si ao nível de 5 % entre os pontos pelo teste de Tukey. *Impossibilidade de coleta - calagem.
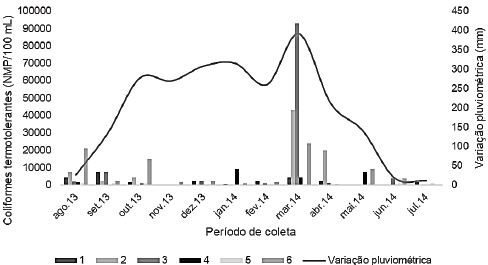
Para os coliformes termotolerantes, os valores variaram de 300 a 93000 NMP/100 mL e de 300 a 21000 NMP/100 mL para o período chuvoso e seco, respectivamente. Diferenças significativas foram observadas apenas entre os meses (p<0,05) de julho, novembro e fevereiro, que apresentaram menores valores de NMP/100 mL. Os demais meses não diferem estatisticamente entre si, apresentando valores de NMP/100 mL elevados (Tabela 2).
Tabela 2 - Coliformes termotolerantes (NMP/100 mL) na água da base de piscicultura Carlos Eduardo Matiazze.
Tabela 2 Coliformes termotolerantes (NMP/100 mL) na água da base de piscicultura Carlos Eduardo Matiazze.
| Período | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Ponto | 2013 | 2014 | ||||||||||
| ago.ab | set.ab | out.ab | nov.b | dez.ab | jan.ab | fev.b | mar.a | abr.ab | mai.ab | jun.ab | jul.b | |
| 1A | 4,3x103 | 7,4x103 | 1,5x103 | 3,0x102 | 2,3x103 | 7,4x102 | 2,3x103 | 4,3x103 | 2,1x103 | 3,0x102 | 3,0x102 | 1,5x103 |
| 2A | 7,5x103 | 2,3x103 | 4,3x103 | 3,6x102 | 3,6x102 | 3,0x102 | 3,6x102 | 4,3x104 | 2,0x104 | 3,0x102 | 3,0x102 | 3,6x102 |
| 3A | 2,0x103 | 7,4x103 | 3,6x102 | 3,6x102 | 2,3x103 | 3,6x102 | 9,2x102 | 9,3x104 | 1,1x103 | 3,6x102 | 3,6x103 | 3,0x102 |
| 4A | 1,5x103 | 3,6x102 | 9,2x102 | 3,0x102 | 3,6x102 | 9,3x103 | * | 4,3x103 | 3,6x102 | 7,4x103 | 3,0x102 | 3,0x102 |
| 5A | 1,1x103 | 9,2x102 | 9,2x102 | 3,6x102 | 3,0x102 | 3,0x102 | * | 3,6x102 | 7,4x102 | 9,2x102 | 3,6x103 | 9,2x102 |
| 6A | 2,1x104 | 2,3x103 | 1,5x104 | 1,5x103 | 2,1x103 | 9,2x102 | 1,5x103 | 2,4x104 | 3,6x102 | 9,2x103 | 3,6x103 | 3,6x102 |
Valores na mesma linha (meses) seguidos por letras minúsculas idênticas não diferem entre si ao nível de 5 % entre os meses pelo teste de Tukey, enquanto valores em uma mesma coluna (pontos), seguidos por letras maiúsculas idênticas não diferem entre si ao nível de 5 % entre os pontos pelo teste de Tukey. *Impossibilidade de coleta - calagem.
Ao avaliar os dados estatisticamente, verifica-se que os maiores valores de coliformes totais e termotolerantes para todos os pontos ocorreram nos meses de março e abril, coincidindo com as maiores variações pluviométricas. Além disso, pode ser observado um aumento da contaminação tanto de CT como de CTT de montante à jusante para os pontos 1, 2, 3 e 6 na medida em que aumentou a precipitação pluviométrica. Esse fato pode ser visualizado quando os dados de contaminação e pluviosidade são plotados num mesmo gráfico (Figuras 3 e 4).
DISCUSSÃO
A avaliação da microbiota da água é necessária para estabelecer, determinar e monitorar a presença de microrganismos indicadores de contaminação e veículos de intoxicações e doenças que possam acometer o homem e as populações de organismos aquáticos 13. Desta forma, as concentrações de coliformes totais e termotolerantes apresentam-se como parâmetros de referência para avaliar a qualidade sanitária de um ambiente aquático, principalmente aqueles destinados à aquicultura 14.
No Brasil, o Artigo 15 da Resolução CONAMA N° 357/2005 estabelece as condições e padrões para águas de Classe 2, que são as destinadas, entre outras atividades, à aquicultura 5. Esta resolução não estabelece valores máximos permissíveis para CT. Entretanto, estabelece um limite máximo de 1000 NMP/100 mL para CTT Das amostras analisadas para CTT, 47,7% apresentaram valores superiores ao limite máximo estabelecido, principalmente no período chuvoso.
A relação existente entre a precipitação pluviométrica e a presença de coliformes pode ser atribuída ao aporte de nutrientes alóctones carreados pelas chuvas (e. g. nitrogênio e fósforo) para o ambiente aquático, oriundos da ocupação urbana desordenada (e.g. fossas e esgotos) e práticas rurais (e. g pecuária extensiva) ao longo da região limítrofe da área de estudo. Essa relação também foi observada por Vasconcelos e Souza 15 ao avaliar os parâmetros físicos, químicos e biológicos da água de lagoas do Complexo Hídrico Estadual do Utinga próxima à região metropolitana de Belém, no estado do Pará. Os autores observaram alterações importantes nas variáveis físicas, químicas e biológicas e constataram que as alterações estão diretamente relacionadas ao crescimento populacional e o aumento da produção de esgoto não tratado lançado nos corpos d'água no período de chuvas. Essa mesma relação também foi observada, inclusive no cultivo de peixes, onde os maiores valores de NMP/100 mL foram verificados para o período chuvoso, sendo a presença dos coliformes atribuída à entrada de enxurrada nos tanques de cultivo 16,17.
A contaminação por coliformes também pode sofrer interferência e estar diretamente relacionada à geologia e às características morfológicas da bacia hidrográfica 18. Desta forma, o processo de carreamento da matéria orgânica pode ter influenciado diretamente nos maiores valores de NMP/100 mL no ponto 6, uma vez que está a jusante e, recebe toda água dos pontos a montante devido ao fluxo de escoamento. O aumento da contaminação de coliformes de montante a jusante foi avaliado por Martins e Silva 19 em um efluente do Rio Pomba, Zona da Mata do estado de Minas Gerais, e constataram diferença significativa (p<0,0001) relacionadas ao local de coleta e a contaminação por CT e CTT, esse processo foi atribuído ao fluxo de escoamento das águas e à poluição urbana. Entretanto, essa relação não se aplica aos pontos 4 e 5 deste trabalho, uma vez que apresentavam sistema fechado de recirculação de água.
Porém, independente de a concentração sofrer variações de montante para jusante, ou ser menor nos pontos sem renovação contínua de água, a presença desses contaminantes, mesmo que em níveis baixos, representa riscos às espécies aquáticas. A microbiota do peixe vivo, apesar de ser relativamente uniforme, está diretamente relacionada à microbiota da água onde o animal está inserido 20.
Desta forma, a presença de coliformes pode causar impacto negativo no desempenho zootécnico das espécies nos pontos 4 e 5. Para esses pontos, a contaminação por coliformes totais apresentou valores inferiores aos demais. Entretanto, os valores ultrapassam os estabelecidos na legislação para coliformes termotolerantes 5, principalmente no período de chuva. Macedo, Amaral e Sipaúba-Tavares 21 reportaram essa mesma relação e enfatizaram que os índices sanitários indesejáveis e em desacordo com a legislação, podem ocasionar vários efeitos aos animais e também para o homem.
Embora os coliformes termotolerantes pertencentes aos gêneros Escherichia, Enterobacter e Klebsiella não sejam relatados como causadores de enfermidades em peixes, esses podem influenciar de forma indireta as funções fisiológicas dos animais. A presença destes micro-organismos pode interferir de forma negativa na absorção de nutrientes, reduzir sua capacidade imunitária, favorecendo a colonização de micro-organismos patogênicos prejudiciais para o desenvolvimento da atividade piscícola, principalmente de alevinos, que são mais frágeis 16. Além disso, vale ressaltar que micro-organismos pertencentes ao grupo dos coliformes podem apresentar transferência horizontal de genes e, como consequência, exibir estirpes patogênicas que se destacam como potencial zoonótico emergente 22.
Como exemplo, tem-se a Escherichia coli shigatoxigênica (STEC) e enteropatogênica (EPEC), fatais ao homem 23. Essas estirpes foram isoladas de Oreochromis niloticus cultivadas em diferentes pisciculturas 24, e também na água e em espécies de peixes utilizadas em pesque-pague, no estado de São Paulo 25. A presença dessas estirpes também é relatada em peixes e moluscos cultivados em Kolkata, Índia 26. As estirpes de Escherichia coli podem não apresentar patogenicidade ou produção de enterotoxinas que possam acometer os peixes 27,28, entretanto, quando presentes em alimentos (e. g pescados), caso sejam consumidos, ligam-se às microvilosidades dos enterócitos acarretando uma disfunção da absorção intestinal, provocando diarreia 29. Segundo estimativas da Organização Mundial da Saúde (OMS), 1,5 milhões de crianças morrem a cada ano vítimas de doenças diarreicas, sobretudo em países em desenvolvimento 30.
Assim, produtos oriundos do processamento de peixes cultivados em ambientes com a presença de coliformes, como os filés, podem, portanto, veicular a transmissão de agentes patogênicos ocasionando intoxicações em humanos, constituindo-se em riscos sanitários à saúde pública 31. Desta forma, o sistema avaliado é considerado impróprio para o desenvolvimento de atividades destinadas à aquicultura, pois 47% das amostras avaliadas para CTT os valores de NMP/100 mL eram superiores ao limite estabelecido polo Artigo 15 da Resolução CONAMA, n.° 357/2005.