INTRODUCCIÓN
En la actualidad existen diversas técnicas para evaluar los parámetros seminales, desde lo más simple a lo más complejo, los métodos de análisis básicos incluyen el estudio del volumen seminal, concentración espermática, motilidad, viabilidad y morfología espermática, sin embargo, en la práctica se ha comprobado que eyaculados con valores aceptables en los parámetros citados presentan importantes variaciones en los resultados de fertilidad individual 1.
El estudio de la motilidad espermática se puede realizar por dos métodos el más utilizado es la valoración subjetiva que consiste en evaluar el porcentaje de espermatozoides móviles, así como, el tipo de movimiento que presentan de forma inmediata 2. Es de gran valor cuando lo realizan personas experimentadas, sin embargo, la exactitud y precisión están limitadas en función de las condiciones del sistema de medida y de la destreza del observador. El otro método, se basa en el uso de sistemas informatizados de digitalización de imágenes denominados C.A.S.A (Computer Assisted Motility Analysis) 3. Capturan el movimiento espermático y permite analizar valores cinéticos de velocidad espermática aportando un gran volumen de información, siendo mucho más preciso al momento de la evaluación 4.
Estudio recienten han demostrado que uno de los factores asociados a una mala calidad seminal pudiera estar relacionado con altos porcentajes de fragmentación ADN espermático, ya que si bien espermatozoides con el ADN dañado son capaces de fecundar un ovocito y lograr una preñez a término, las consecuencias de esta concepción pueden ser observadas a largo plazo, tales como crecimiento anómalo, envejecimiento prematuro, tumores y abortos, este tiene un efecto negativo en la fertilización in vivo como in vitro. Niveles de fragmentación del ADN superior al 20% son incompatibles con la concepción y el mantenimiento de la preñez 5. Para que el proceso reproductivo se desarrolle con éxito es necesario que la molécula de ADN del espermatozoide permanezca íntegra, sin la presencia de roturas en la doble hebra ocasionados aparentemente por la presencia de radicales libres de oxígeno, errores en la sustitución de histonas por protaminas, deficiencias en la recombinación, o la exposición a ciertos fármacos, contaminación atmosférica, fiebre alta 6.
La evaluación de los parámetros básicos de calidad espermática no aporta información completa sobre la calidad del espermatozoide. Así pues, resulta prudente determinar si existe daño en el ADN, especialmente en los casos en los que los parámetros sistemáticos de rutina no hayan evidenciado ninguna anomalía obvia, se puede decir a ciencia cierta que mientras mayor sea el grado de fragmentación de ADN transmitido al embrión por el genoma del espermatozoide, más temprano se observará en el proceso de desarrollo embrionario y viceversa; en cambio, cuando menor sea el daño de ADN, más tarde se va a manifestar en el desarrollo embrionario y fetal
La presente investigación tiene como objetivo evaluar el efecto de la criopreservación en la fragmentación del ADN, la viabilidad y cinética espermática, en toros donadores de semen de la raza Brown Swiss, todas las evaluaciones se realizaron en un sistema computarizado de análisis seminal (C.A.S.A).
MATERIALES Y MÉTODOS
Lugar de ejecución y duración. El presente estudio se realizó en las instalaciones del Banco Nacional de Semen de la Universidad Nacional Agraria La Molina (UNALM), ubicado en el distrito de la Molina, Lima, Perú durante el transcurso de 3 meses (enero a marzo del 2019). Durante este tiempo se obtuvo temperaturas promedio mínima de 21°C y máxima de 26°C, y una humedad relativa promedio del 51%.
Animales del experimento. Se trabajó con cinco toros de la raza Brown Swiss, entre 2 a 6 años, estos se encontraban sujetos a un régimen de colecciones de una vez por semana. Todos los toros, fueron certificado por el Laboratorio de virología de la facultad de medicina veterinaria UNMSM que se encontraban libres de enfermedades.
Dilución seminal. Se utilizó el Dilutor Andromed® (Minitub Germany) Obtenido el eyaculado, se realizó la predilución (1/1) agregando el dilutor en la misma proporción del semen en el tubo graduado y se colocó en el baño María a 34°C. El dilutor restante se agregó en un solo paso, previamente atemperado en baño María a una temperatura de 34°C. para evitar el choque térmico de los espermatozoides, posterior a esto se vertió el semen prediluido lentamente por las paredes del matraz, y se homogenizó suavemente, Se esperó un tiempo aproximado de 10 minutos a fin de que la solución se estabilice, posterior a esto se examinó en el microscopio para comprobar la motilidad, viabilidad y la fragmentación ADN espermática previo a la criopreservación.
Concentración espermática. Para el análisis de la concentración se utilizó el Fotómetro SD1M bovino (marca Leaflet, minitube). Se tomó una alícuota de 10ul de semen fresco y se colocó en una microcubeta la cual fue fijada en la posición correcta para su medición y lectura.
Motilidad espermática. La evaluación de la motilidad espermática se realizó con el Sistema Computarizado de Análisis Seminal (C.A.S.A) software (Minitube AndroVision) versión 1.7.
El sistema está compuesto de un microscopio de fluorescencia (Axio Scope.A2 - Carl Zeiss Microscope Fluoresence) conectado a una cámara de vídeo digital (Basler A302 fs), esta envía la imagen desde el microscopio a un monitor LED en tiempo real a través del objetivo de contraste de fases 20x, en donde un analizador digital de imagen captura varios fotogramas seguidos de cada campo.
El software discrimina a los espermatozoides de otras partículas que puedan aparecer en la imagen por su tamaño, y analiza la trayectoria recorrida por cada espermatozoide individual, la velocidad de las células, el movimiento rectilíneo, circular o lateral.
Los parámetros evaluados fueron los siguientes tomando en consideración el análisis de tres campos para obtener un promedio de estos en los siguientes valores por eyaculado 7 los parámetros evaluados en el Sistema C.A.S.A se definen de la siguiente manera
De acuerdo con Amann et al 8, el sistema permite evaluar:
La motilidad espermática:
Motilidad Progresiva (MP): porcentaje de espermatozoides que presentan movimiento con un índice de rectitud (STR) ≥ 75% dentro de la muestra.
Motilidad Rápida (MR): de los espermatozoides analizados (espermatozoides móviles por mililitro velocidad (VCL) superior al >80 µm/sg)
Motilidad Lenta (ML): de los espermatozoides analizados espermatozoides velocidad (VCL) menor a <80 µm/sg pero superior al >10 µm/sg)
Motilidad Circular (MC): de los espermatozoides analizados que presentan un Radio >10.0 µm y <80.0 µm con una rotación >0.70 µm/sg
Motilidad Local (MLc): de los espermatozoides analizados VSL <10.0 µm/s y VCL <48.0 µm/s
Espermatozoides inmóviles (I): analizados el porcentaje de espermatozoides que presentan una velocidad curvilínea (VCL) < 24.0 µm/s y ALH < 1.0 µm/s
Los parámetros Cinéticos espermáticos:
Velocidad Curvilínea (VCL), µm/s: se obtiene por extrapolación de los puntos que determinan la VCL. Nos muestra la distancia recorrida por el espermatozoide a lo largo de su trayectoria media en función del tiempo.
Velocidad Rectilínea (VSL), µm/s: se obtiene a partir de la unión entre el primer y el último punto durante el tiempo de adquisición de la imagen. Indica la distancia recorrida por el espermatozoide entre estos dos puntos de su trayectoria en función el tiempo.
Velocidad media (VAP), µm/s: se obtiene a partir de la unión de los puntos donde se localiza el centroide de la cabeza del espermatozoide en cada frame durante el tiempo de adquisición de la imagen. Nos aporta información sobre la distancia recorrida por el espermatozoide a lo largo de su trayectoria real en función del tiempo.
El movimiento de cabeceo o desvío de su trayectoria se cuantificó a través de tres parámetros:
Amplitud media del desplazamiento lateral de la cabeza (ALH), µm/s: Es la magnitud del desplazamiento lateral de la cabeza mide el máximo desplazamiento efectuado por la cabeza del espermatozoide en su trayectoria curvilínea, de un lado a otro de la trayectoria media o lineal.
Frecuencia de entrecruzamiento (BCF), Hz: frecuencia de corte de los movimientos laterales de la cabeza del espermatozoide, expresada en Hertz (Hz).
Actividad de la cabeza (HAC): Actividad cabeza espermática, frecuencia de orientación promedio del cambio de movimiento de la cabeza.
La dirección de la trayectoria espermática se midió a través de tres cocientes Linealidad (LIN), la Rectilineidad (STR) y el índice de oscilación (WOB).
La linealidad (LIN): es una expresión de la relación entre la proyección bidimensional de la trayectoria de un espermatozoide y el espacio ganado, calculado como VSL/ VCL
La rectilineidad (STR): da la indicación de la relación entre el espacio ganado y la trayectoria general del espermatozoide, calculado como VSL/ VAP.
Índice de oscilación (WOB): Mide la oscilación de la trayectoria real con respecto a la trayectoria promedio, calculado como el cociente VAP/ VCL.
Viabilidad. La evaluación de la viabilidad espermática se utilizó el Kit de fluorescencia Hoechst 33342/PI según las indicaciones del protocolo se tomó una alícuota de semen diluido de 35ul y se mezclaron 2ul de tinción Hoeschst 333242/ PI (minitube) en un tubo eppendorf y se incubó por 5 minutos, luego se colocó 10ul de la muestra en un portaobjeto para su evaluación utilizando el módulo de análisis de fluorescencia viabilidad espermática del C.A.S.A
Fragmentación del ADN espermático. La evaluación se realizó con el Kit Sperm-Halomax® (Halotech S.L., Madrid, España), se utilizaron cuatro kits de fragmentación de ADN cada uno para 40 determinaciones.
El protocolo sperm - halomax indica que cada muestra de semen se diluya a una concentración de 10 millones de espermatozoides/ml y se mezcló con agarosa liquida (0.7%) de bajo punto de fusión atemperada a 37°C. Sobre un portaobjetos previamente recubierto de una película de agarosa estándar al 0.65%, se depositó 2ul de la mezcla (agarosa y espermatozoides), se cubrió con un cubreobjetos de 20x20mm y se llevó a refrigeración para su solidificación a 4°C durante 5 minutos.
Los cubreobjetos se retiraron cuidadosamente y los portaobjetos se introdujeron horizontalmente en una bandeja con solución de lisis (Sperm-Sus-Halomax, Chromacell, SL) durante 5 minutos a temperatura ambiente para extraer membranas y proteínas. Tras un lavado de 5 minutos en abundante agua destilada, las preparaciones se deshidrataron en baños de etanol al 70, 90 y 100% (v/v) de 2 minutos cada uno y se dejaron secar al aire para su posterior análisis. Las muestras preparadas se tiñeron con el kit de fluorescencia Fluored® HT-RFS100 (marca Halotech S.L., Madrid, España) colocando 2ul del colorante sobre la lámina preparada para su evaluación en el módulo de análisis de fragmentación espermática del C.A.S.A utilizando microscopio de fluorescencia (Axio Scope.A2 - Carl Zeiss Microscope Fluoresence)
Análisis estadístico. Con el objetivo de evaluar el efecto de la criopreservación en la fragmentación del ADN, la viabilidad y cinética espermática, se calculó si existió un cambio significativo entre los valores antes y después de la criopreservación para cada parámetro seminal usando la prueba T de muestras relacionadas, previa verificación de normalidad con la prueba de Shapiro-Wilk. En caso los datos no fueran normales, se utilizó la prueba de rangos con signo de Wilcoxon (prueba no paramétrica). Se aplicó ajuste de Bonferroni para las comparaciones antes mencionadas, para todos los datos evaluados se realizaron correlaciones utilizando la prueba de Pearson. Todos los análisis se realizaron considerando 5 réplicas biológicas (5 toros) en el paquete estadístico SPSS v.23 con un 95% de confiabilidad.
RESULTADOS
Dentro de los resultados obtenidos se presentan los estadísticos descriptivos de la investigación donde se puede visual los parámetros evaluados antes y después de la criopreservación seminal (Tabla 1). en la tabla 2, se muestra los resultados de la Prueba T para muestras relacionadas de los parámetros seminales antes y después de la criopreservación y en la tabla, se observa la prueba de rangos con signo de Wilcoxon de los parámetros seminales que no presentaron normalidad.
Tabla 2 Prueba T para muestras relacionadas de los parámetros seminales antes y después de la criopreservación. El ajuste de Bonferroni determinó un valor de significancia de p<0.002. En negrita se resaltan los parámetros significativos.
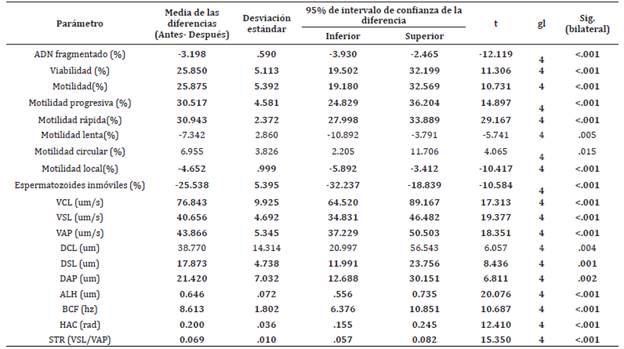
t = estadístico t. gl = grados de libertad. Sig = significancia.
Tabla 3 Prueba de rangos con signo de Wilcoxon de los parámetros seminales que no presentaron normalidad.
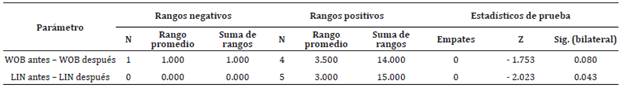
El ajuste de Bonferroni determinó un valor de significancia de p<0.025. Z = estadístico Z. Sig = significancia.
En la figura 1 se evidencia el análisis de Fragmentación de ADN utilizando módulo Androvision Sistema (C.A.S.A) y en la figura 2, se observa el análisis de viabilidad espermática utilizando módulo Androvision Sistema (C.A.S.A).

Figura 1 A. Análisis de Espermatozoides vista simple contraste de fase vista 250X. B. Espermatozoides sometidos al tratamiento con el Kit Sperm-Halomax® y teñidos con el kit de fluorescencia Fluored® HT-RFS100 vista 250X C. Espermatozoides detectados con el módulo fragmentación, presencia de halo indicador de fragmentación de ADN espermática, espermatozoides sin halo normales, vista microscopio de fluorescencia (Axio Scope.A2 - Carl Zeiss Microscope Fluoresence) objetivo fluorita vista 250X longitud de onda excitación a 300nm, emisión 595nm.
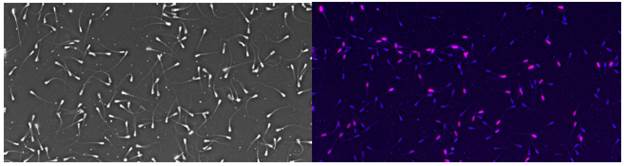
Figura 2 A. Análisis de Espermatozoides vista simple contraste de fase. B. Espermatozoides sometidos a la tinción Kit Hoechst 33342/PI Double Stain Apoptosis Detection detectados en el módulo análisis viabilidad AndroVision en microscopio de fluorescencia, espermatozoides teñidos violeta (Muertos) ya que el colorante solo es permeable en células muertas, Espermatozoides azules (Vivos) vista microscopio de fluorescencia (Axio Scope.A2 - Carl Zeiss Microscope Fluoresence) objetivo fluorita vista 250X, longitud de onda para el colorante Hoescht 33342 fluorescencia azul longitud de onda excitación a 350nm, emisión 461nm, y Yoduro de propidio (PI) fluorescencia roja longitud de onda excitación a 535nm, emisión 617nm.
DISCUSIÓN
El parámetro de fragmentación de ADN espermático evidenció un aumento en los valores en un 3.19% estos resultados obtenidos han sido similares a los descritos por Khalil et al 9 en su investigación obtuvo valores de fragmentación de 4.6±2.29% para la diferencia de valores antes y después del congelamiento del 3.8±1.36% y 8.4 ± 3.22%.
El valor de fragmentación espermático previo al congelamiento en esta investigación fue del 4.81% esto fue similar a lo encontrado por Ntemka et al 7 con niveles de fragmentación del ADN del 4.7±1.3% en toros Brown Swiss, estos resultados han sido también estudiados en otras razas, Addad et al 10 analizaron 46 toros de la raza Nelore, obteniendo una media de espermatozoides fragmentados del 8.8±3.8% en semen fresco, Enciso et al 6 mediante el test SCD de 11.35% ± 2.81% para toros de la raza Holstein. Posado et al 11 para semen fresco de toros de lidia obtuvo 6.86 ± 4.88% respectivamente.
Los siguientes estudios han contribuido a proponer la existencia de un umbral de daño del ADN espermático. Duran et al 12 encontró asociaciones entre niveles superiores al 12% de fragmentación de ADN con bajas tasas de concepción donde no se alcanzó preñez. Al igual que Evenson et al 13 y Larson et al 14 que indican que los niveles de fragmentación del ADN superior al 30% son incompatibles con la concepción y el mantenimiento de la preñez.
De acuerdo Karabinus et al 5 en el caso de espermatozoides de toros, se ha visto que medidas del índice de fragmentación por encima del 20% están asociadas con bajas tasas de fertilidad. Estos datos en correlación con los valores obtenidos para semen nativo de 6.01±2.8% y semen congelado de 9.21± 3.0%. podrían indicarían que se encuentran con una buena calidad del ADN espermático y posiblemente una buena fertilidad.
El parámetro de viabilidad espermática manifestó una disminución significativa de sus valores por el efecto del congelamiento seminal, posiblemente ocasionado por el estrés osmótico, shock térmico y la formación de hielo intracelular estos causan daños en la membrana plasmática y organelos de la célula 15 los datos obtenidos fueron similares a los de Ntemka et al 7 en su investigación evaluó pajillas de semen congelado de la raza Brown Swiss y obtuvo valores de viabilidad espermática de 69.6 ± 1.7;
Viñan et al 16 en toros de raza Holstein obtuvo valores para semen fresco de 89.01±0.91% y posterior al congelamiento de 63.26 ± 0.68, Januskauskas et al 17 obtuvo para semen descongelado valores de 68.1±4.9%, al igual que Addad et al 10 para semen congelado con valores de 68.1±4.88, este ha sido uno de los parámetros seminales más estudiados debido a que juega un papel clave en la fecundación, gracias a que solo los espermatozoides que son viables podrán realizar la reacción acrosomal de manera sincronizada con la fase de penetración del ovocito y, como consecuencia, fusionarse con éste para formar un embrión Januskauskas 17.
La motilidad total también se vio afectada por el congelamiento seminal, en diferentes razas otros autores han obtenido valores similares a nuestra investigación Viñan et al 16 obtuvo para su tratamiento control valores de Motilidad total antes de 92.65±0.84% y posterior de 67.73±0.7%, al igual que Veloz 18 con valores antes de 75.56±1.25% y después de 59.64±1.07.
Los valores de motilidad progresiva fueron semejantes a los obtenidos por Viñan et al 16 89.74±0.91% y 54.73±0.72% y superiores a los de Sunderaraman et al 19 con valores antes de congelamiento de 65.9% y después 30.8% e inferiores a los de Veloz 18 antes 63.20±1.62% y después 55.65±1.54%.
La motilidad rápida también se vio afectada por la criopreservación seminal, estos valores fueron similares a lo obtenido en la investigación de Morte et al 20 el cual utilizando un congelador programable obtuvo que los valores antes y después del congelamiento para este parámetro fueron significativamente diferentes p<0.05. Muiño 21 para toros de la raza frisona y rubia gallega obtuvo valores para semen fresco de 50.9±14.3 y 53.4±12.4 respectivamente.
Para los valores de motilidad lenta no se encontró un cambio significativo, estos resultados fueron similares a lo encontrado en la investigación de Morte et al 20, donde tampoco encontró diferencias por el efecto del congelamiento, esto quiere decir que la congelación no tuvo un efecto directo sobre este parámetro seminal y otros factores podrían estar influyendo en el aumento de la motilidad lenta.
La motilidad local o como su nombre lo indica espermatozoides que se mueven en su mismo sitio, pero no presentan un desplazamiento, se vio influenciada por el efecto del congelamiento, obteniendo valores de significancia similares a los obtenidos en la investigación de Morte et al 20 en donde concluyo que el aumento de este parámetro se encuentra influenciado por el congelamiento.
Los espermatozoides inmóviles que no presentaban ningún tipo de desplazamiento ni movimiento local, aumento de manera significativa, estos valores fueron similares a los obtenidos en la investigación de Morte et al 20 en donde obtuvo que el congelamiento estuvo estrechamente ligado al aumento de los valores de este parámetro seminal., en distintas investigaciones se ha podido apreciar el aumento de estos valores, Viñan et al 16 también observo este aumento con valores antes de 7.35±0.84% y posterior de 32.27±0.7% al congelamiento, al igual que Veloz 18 donde obtuvo valores antes de 29.12±1.62% y posterior de 44.35±1.20% respectivamente y finalmente Sunderaraman et al 19 encontró un aumento de 5.7% al 37% de espermatozoides inmóviles.
La motilidad circular fue otro parámetro que tampoco se vio influenciado por la congelación seminal, estos resultados los corrobora Morte et al 20, en su investigación donde concluye que este parámetro es influenciado por factores antagónicos al congelamiento.
El parámetro cinético de velocidad curvilínea (VCL) experimento una disminución significativa similar a lo obtenido en la investigación de Morte et al 20, este parámetro indicador de fertilidad como lo señala Hirano et al 22 en muestras con un VCL>86.2±16.5 en semen fresco presentaron tasas de fertilización >50%, Ormachea et al 23 evaluó toros de la raza Brown Swiss americanos y obtuvo valores para VCL de 152.07±15.13% muy similares a los obtenidos en esta investigación, Ancco 24 en pajillas de semen congelado de toros nacionales obtuvo valores de VCL de 80.97±13.69, Mora et al 25 obtuvo valores superiores a los obtenidos en esta investigación en semen fresco VCL 216.3±10.2%
La velocidad Rectilínea (VSL), disminuyo significadamente por el efecto del congelamiento, esto fue corroborado en la investigación de Morte et al 20 donde encontró valores similares, Hirano et al 22 indica que valores superiores de VSL>49.1±9.2 para semen fresco presentan tasas de fertilización >50%. Ancco 24 en pajillas de semen congelado de toros nacionales obtuvo valores de VSL de 70.79±5.6, Ormachea et al 23 evaluó toros de la raza Brown Swiss americanos y obtuvo valores para VSL de 70.79±5.6% muy similares a los obtenidos en esta investigación. En otras razas de toros también se ha analizado este parámetro, Mora et al 25 obtuvo valores superiores a los obtenidos en esta investigación en semen fresco VSL 106.8±7.8%.
La velocidad media (VAP), tuvo una disminución significativa similar a lo obtenido en la investigación de Morte et al 20, este parámetro indicador de fertilidad como lo señala Hirano et al 22 en muestras con un VAP>64.0±5.2 en semen fresco presentaron tasas de fertilización >50%, Ormachea et al 23 evaluó toros de la raza Brown Swiss americanos y obtuvo valores para VAP de 82.50±7.6% muy similares a los obtenidos en esta investigación, Ancco 24 en pajillas de semen congelado de toros nacionales obtuvo valores de VAP de 44.82±7.22. Mora et al 25 obtuvo valores superiores a los obtenidos en esta investigación en semen fresco VAP 106.8±7.8%
La amplitud media del desplazamiento lateral de la cabeza (ALH), experimento una disminución en sus valores por el efecto del congelamiento con una clara significancia, similar a lo obtenido por Quintín et al 26 en toros Brown swiss para muestras de semen fresco con valores superiores a los obtenidos de ALH 3.3±0.37. La importancia de este parámetro según indica Shanis et al 27 este parámetro se encuentra asociado a la penetración del espermatozoide con el ovocito, ellos observaron que, en el moco cervical, el ALH disminuye para ayudar a la penetración de la célula espermática y afirman que si el ALH es abnormal quiere decir que el movimiento de la cabeza es pequeño, lo que quiere decir que la cabeza no rotara, lo que reducirá el éxito en la fertilización, esto es corroborado por Bravo et al 28 lo define como una variable relacionadas a la velocidad y progresividad de la motilidad de los espermatozoides, esencial para la penetración del moco cervical, aspecto indispensable del comportamiento celular que depende casi enteramente de las fuerzas físicas generadas por el golpe del flagelo, en distintas investigación se ha analizado este parámetro Ormachea et al 23 en toros Brown Swiss americanos ALH de 4.12±1.2%, Ancco 24 en pajillas de semen congelado de toros nacionales obtuvo valores de ALH de 3.84±0.11. Mora et al 25 valores para semen fresco ALH 1.5±0.52%.
La Frecuencia de entrecruzamiento (BCF), este parámetro ligado a la penetración de la célula espermática durante el desplazamiento por el moco cervical Shanis y Bravo et al 27,28, presento una disminución significativa en sus valores, diversas investigaciones han evaluado este parámetro Ormachea et al 23 en toros Brown Swiss americanos BCF de 19.96±9.5%, Mora et al 25 valores para semen fresco BCF 3.26±2.5%.
El efecto que tiene la criopreservación en 16 de los 21 parámetros seminales evaluados en esta investigación es significante. Esto es analizado por Holt 29 que afirma que la tasa de congelación debe ser lo suficientemente lenta para permitir la salida por osmosis de agua del interior de la célula, previniendo así la formación de hielo intracelular, pero también lo suficientemente rápida para minimizar el efecto dañino de la exposición prolongada a concentraciones altas de solutos con el fin de evitar procesos de recristalización que afectan la integridad de la membrana plasmática.
Watson 30 en su investigación demuestra que la disminución de la calidad seminal por el proceso de congelación y descongelación, es provocado por un daño irreversible en aproximadamente el 50% de los espermatozoides de cada dosis, este estrés ocasionado por el congelamiento seminal produce una contracción celular que puede causar la pérdida irreversible de la membrana y la alteración del citoesqueleto y de los organelos, la célula puede verse afectada por las altas concentraciones de solutos en las partes no congeladas del espacio extracelular que dañan la membrana, por cambios en el pH y desnaturalización de proteínas.
En conclusión, se encontró diferencias significativas en 16 de los 21 parámetros evaluados para los toros donadores de semen de la raza Brown Swiss evaluados en el sistema C.A.S.A.
Se evidencio un aumento de la fragmentación del ADN del 3% por el efecto de la criopreservación seminal, todos los valores de este parámetro se encontraron dentro de los rangos considerados normales.
Se demostró el efecto de la criopreservación seminal sobre el parámetro de viabilidad espermática manifestándose diferencias significativas en la disminución de los valores analizados.
Se observó la disminución de los valores con diferencias significativas en los siguientes parámetros seminales motilidad, motilidad progresiva, motilidad rápida, al igual que los parámetros cinéticos VCL, VSL, VAP, DSL, DAP, ALH, BCF, HAC, STR, y un incremento en los valores de motilidad local y espermatozoides inmóviles, atribuidos al efecto de la criopreservación seminal.
Se recomienda implementar las pruebas de fragmentación de ADN y el análisis de la cinética espermática mediante el sistema C.A.S.A, dentro de los protocolos establecidos en los centros de colección, procesamiento e inseminación de semen, ya que esto permitirá obtener más información respecto a la calidad espermática y poder realizar una correcta selección de los reproductores, para la difusión de pajillas de semen de óptima calidad.