INTRODUCCIÓN
Se agrupan dentro del término antiinflamatorios no esteroideos (AINEs) a un conjunto de fármacos químicamente heterogéneos que comparten acciones terapéuticas y efectos adversos. Estos fármacos se utilizan para el manejo de la inflamación, el dolor y la fiebre 1,2. El mecanismo de acción de los AINEs consiste en reducir la producción de prostaglandinas (PG) a través de la inhibición de la enzima ciclooxigenasa (COX) 3.
Actualmente, se dispone de una gran diversidad de AINEs para el tratamiento analgésico y antiinflamatorio, en pacientes que presentan dolor agudo como consecuencia de una intervención quirúrgica u otras causas, o en dolor crónico (como es el caso de la osteoartritis) 4,5. Este grupo de fármacos son de los más recomendados para el manejo de diferentes condiciones, es por ello que su correcto manejo y el conocimiento adecuado de sus posibles efectos secundarios e interacciones medicamentosas resultan de interés en la práctica clínica, para un adecuado abordaje de los pacientes 6. En los años 2012 y 2013 el reporte de efectos adversos asociados a AINES para uso veterinario obtuvo el tercer lugar en frecuencia en Suiza 7,8. El objetivo de esta revisión fue describir los principales efectos adversos relacionados al uso de AINEs en felinos y caninos, y lograr identificar los más seguros para el manejo de la osteoartritis (OA) en estas especies.
Generalidades de la Ciclooxigenasa y su papel en el funcionamiento de los AINES
La ciclooxigenasa (COX) es una enzima que cataliza la conversión del ácido araquidónico en PG y prostanoides. Principalmente, se conocen dos isoenzimas ancladas a la membrana, COX-1 y COX-2. La COX-1 es una enzima constitutiva que se encuentra en la mayoría de los tejidos corporales normales; mientras que la COX-2 es altamente inducible por mediadores proinflamatorios en entornos de inflamación, lesión y dolor, esta se expresa en tejidos normales a niveles bajos 9. La COX-2 también es inducible con ciertas formas de cáncer como carcinomas celulares, carcinomas de células escamosas, carcinomas mamarios y carcinomas pancreáticos 3,10.
Existen diferencias importantes entre estas isoenzimas; la COX-1 produce una amplia gama de prostaglandinas y tromboxanos mientras COX-2 solo produce prostaglandina E2 (PGE2) y prostaciclina (PGI2) ambos mediadores de la inflamación. Las rutas fisiológicas como la homeostasis vascular, gastroprotección, desarrollo renal, coagulación sanguínea, reproducción, metabolismo óseo, respuestas inmunitarias y, desarrollo y crecimiento óseo, están reguladas por las PG, principalmente las producidas por COX-1 3,11,12,13.
Actualmente los AINEs se pueden clasificar según su selectividad (sea hacia COX-1 o hacia COX-2), sin que esta selectividad sea total. La especificidad de la ciclooxigenasa depende mucho de la especie que se esté tratando 13. Para evaluar la especificidad de COX, es común el uso de la medida de la concentración inhibitoria media (IC50), esta es una medida de la mitad de la concentración de fármaco que se necesita para inhibir cada una de las enzimas COX. Por ejemplo, el robenacoxib se considera un AINE selectivo COX-2; el IC50COX-1: IC50COX-2 es de aproximadamente 1:140 en perros y 1:500 en gatos, lo que demuestra la diferencia específica de especie 3.
La relación COX-1: COX-2 va a depender de la especie. Por ejemplo, en el hombre y el perro, el carprofeno es COX-2 preferencial o selectivo, mientras que en gato es únicamente selectivo a dosis bajas, no a dosis recomendadas. En los gatos, la inhibición de COX-1 por el carprofeno es del 5% mientras que la inhibición de COX-2 es del 80%; por el contrario, en esta misma especie la COX-1 es inhibida en un 40% por meloxicam mientras que la COX-2 está inhibida en un 80% 14.
La isoenzima COX-3, se encuentra en el cerebro del animal adulto y es posible que también se encuentre en monocitos y células endoteliales; se considera una proteína asociada a la diferenciación conservada, ya que no se expresa en tejido fetal. En los caninos la COX-3 tiene actividad de ciclooxigenasa dependiente de la glicosilación 15. La inhibición de la COX-3 puede explicar el mecanismo por el cual AINEs sin actividad antiinflamatoria disminuyen el dolor y la fiebre, ya que la comparación de la actividad canina de la COX-3 con respecto a COX-1 y COX-2 demuestra que esta enzima es inhibida selectivamente por acetaminofén y dipirona 16.
Diferencias farmacocinéticas entre perros y gatos
Los caninos y felinos poseen características fisiológicas similares por lo que los regímenes de dosificación de algunos medicamentos para perros pueden extrapolarse a los gatos. No obstante, existen diferencias importantes en la disposición del fármaco en ambas especies que pueden tener influencia en las recomendaciones de dosificación; tal es el caso de los AINEs, donde hay una marcada diferencia farmacocinética y farmacodinámica entre caninos y felinos. La mayoría, de las diferencias farmacocinéticas entre perros y gatos corresponden a diferencias en el metabolismo 14.
No se pueden hacer suposiciones sobre la farmacocinética de cualquier AINE en ambas especies: la duración del efecto se va a prolongar con algunos medicamentos en los felinos, pero otros AINEs tendrán una duración similar o incluso menor en los gatos en comparación con los perros 14. Muchos de los AINEs son metabolizados por glucuronidación en el hígado. Debido a que los gatos presentan una deficiencia de glucuronil transferasa, estos medicamentos puede tener efecto prolongado, por lo que debe tenerse en cuenta el tiempo y la frecuencia de la dosis para reducir riesgo de efectos adversos. Medicamentos como piroxicam y meloxicam son metabolizados por oxidación, por lo que no se ven afectados por la deficiencia de glucuronil transferasa 17. Aspirina y carprofeno se metabolizan más lento en gatos que en perros, donde las vidas medias se vuelven más largas, aproximadamente 20 horas para ambos medicamentos. La aspirina se administra a una dosis de 10 mg/kg cada 48-72 horas en gatos; el carprofeno se ha utilizado empíricamente en gatos en dosis de 2 mg/kg cada 72 horas 14. El meloxicam (0,3mg/kg) y robenacoxib (1 mg/kg) tienen vidas medias de 24 y 2h, respectivamente en gatos 17. En algunos países existe aprobación para el uso de carprofeno como parte de la terapia para el manejo del dolor perioperatorio (4 mg/kg SC o IV en dosis única). Así mismo también existen sitios donde se ha aprobado el uso de ácido tolfenámico (4mg/kg SC o VO) y este ha mostrado ser útil en terapias de 3 a 5 días 18.
Manejo de osteoartritis Canina con AINEs
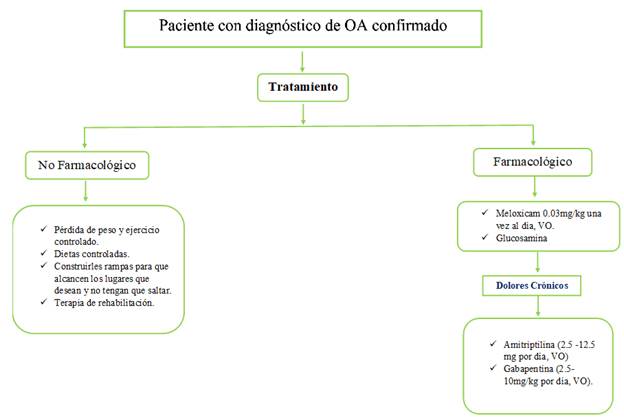
Los principales objetivos del tratamiento de la OA canina incluyen el aliviar el dolor, reducir la inflamación, prevenir la degeneración y mejorar el uso de las articulaciones 19. El uso de AINEs representa un dilema clínico, debido a la mala calidad de vida de los pacientes con osteoartritis, y los posibles efectos adversos asociado a estos fármacos. Dentro de los AINES aprobados por FDA para uso en perros están el etodolaco, carprofeno, meloxicam, deracoxib, firocoxib y tepoxalin 2. El manejo del dolor asociado a OA puede ameritar el tratamiento a largo plazo con AINEs, particularmente en perros, a pesar de que existen pocos estudios de seguridad a largo plazo 20,21,22,23.
Sanderson et al 24 analizó la eficacia de los AINEs en el tratamiento de OA en perros; la eficacia de carprofeno fue respaldada por la mayor cantidad de estudios, seguido por meloxicam y firocoxib 24. Firocoxib y carprofeno son ampliamente utilizados en OA como antiinflamatorios y analgésicos. Al ser selectivos por COX-2 se encuentran menos asociados a los efectos adversos comunes de los AINEs como la irritación y ulceración gastrointestinal, toxicidad hepática y trastornos de la coagulación; sin embargo, no están completamente exentos de presentarlos 19. El mavacoxib es un nuevo inhibidor selectivo de COX-2, que según diferentes estudios a una dosis de 2 mg/kg tiene un buen perfil de eficacia y seguridad en el manejo de OA 25.
En la Figura 1 se presenta un esquema de tratamiento para OA canina, siendo la primera línea de tratamiento la no farmacológica. Respecto al tratamiento farmacológico carprofeno, firocoxib y meloxicam son los AINEs más utilizados y con mayor respaldo literario.
Manejo de osteoartritis felina con AINEs
La terapia con medicamentos para la OA en la mayoría de las especies es un AINE. Sin embargo, estas drogas representan un desafío en los gatos debido a la susceptibilidad de estos a la toxicosis, especialmente con la dosificación a largo plazo. La mayoría de estos medicamentos tienen una vida media relativamente larga en los gatos, y las dosis repetidas deben administrarse y controlarse cuidadosamente para evitar la toxicosis 26,27.
El meloxicam es un inhibidor selectivo COX-2 que está aprobado por FDA para dolor postoperatorio en gatos (0,3 mg/ kg SC una vez al día) 2. Este fármaco también es utilizado para tratar el dolor y la inflamación asociados a OA en gatos 26. Como observó Robertson 26 en su estudio prospectivo, donde utilizó 28 gatos, muchos de ellos con osteoartritis, mejoraron en un mes con la intervención de meloxicam. De estos el 61% mostró una mejoría marcada, y el 25% mostró una leve mejoría 26. En muchos países existen formulaciones orales de meloxicam etiquetada para uso a largo plazo en gatos que presentan enfermedades musculoesqueléticas; la dosis registrada es de 0.05 mg/kg una vez al día 26.
Un estudio publicado por Lascelles et al 28 describió uso de AINEs a corto plazo para el dolor musculoesquelético en gatos. Sesenta y nueve gatos con trastornos locomotores agudos o crónicos fueron asignados aleatoriamente para recibir meloxicam oral o ketoprofeno oral. Ambas drogas fueron igualmente eficaces en función de la actitud general, el apetito, el peso, la cojera y el dolor en la manipulación, pero el meloxicam era más agradable y fácil de administrar 26,28. Gatos diagnosticados con OA pueden ser manejados mediante tratamiento farmacológico o tratamiento no farmacológico tal y como se observa en la Figura 2.
Efectos adversos relacionados con el uso de AINEs en felinos y caninos
Los principales efectos adversos relacionados con AINEs para felinos y caninos se muestran en la Figura 3. El grupo de pacientes más propenso a los efectos secundarios son los pacientes de edades avanzadas, debido a la reducción del metabolismo y la excreción del fármaco, niveles más bajos de proteínas plasmáticas y cambios en el volumen de distribución. Además, los pacientes mayores son frecuentemente los que utilizan AINEs a largo plazo, ya que esta población suele padecer enfermedades locomotoras crónicas y enfermedades que provocan dolor crónico 3. Hunt 29 indicó como los principales efectos adversos reportados al uso de AINEs en Reino Unido la emesis, la muerte, anorexia, letargia y diarrea. Siendo estos efectos más frecuentes cuando se utiliza un fármaco no selectivo de COX-2 29.
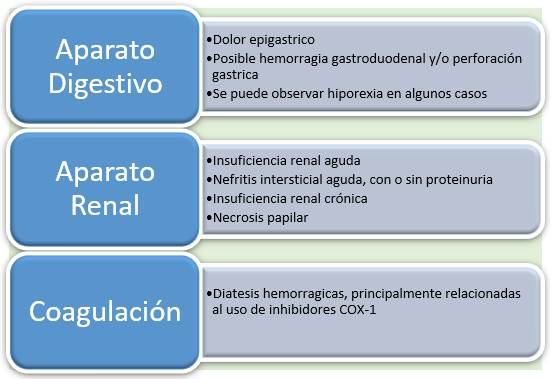
Fuente: Elaborado por los autores
Figura 3 Principales efectos adversos de AINEs en felinos y caninos.
Por lo general, se recomienda no administrar AINEs a pacientes hipovolémicos, deshidratados o hipotensos, y se debe tener especial cuidado en pacientes con disfunción cardíaca, renal, hepática, gastrointestinal y hemostática. En el caso de los pacientes que utilizan otros medicamentos a largo plazo se deben someter a exámenes veterinarios periódicos 3.
Efectos adversos en caninos
Los AINEs han sido ampliamente utilizados en el tratamiento a largo plazo del dolor, principalmente el asociado a la artritis en perros. También son utilizados en la prevención y terapia del dolor postoperatorio, pero esto no los deja exentos de una serie de efectos secundarios que deben ser reconocidos y evaluados según cada caso, por el clínico tratante 30,31.
Efectos gastrointestinales. Los principales efectos adversos del uso agudo y crónico de los AINEs se relacionan con el sistema gastrointestinal. La PGE2 tiene una función en el mantenimiento del flujo sanguíneo de la mucosa gástrica, es necesaria en la reparación de las células de la mucosa y la liberación de ácido gástrico neutralizante de bicarbonato. En resumen, la COX-1, que produce la PGE2, es fundamental en la función gastrointestinal y está relacionada con la protección de la mucosa en la ulceración gástrica y duodenal 3,32.
El uso de inhibidores de la ciclooxigenasa poco selectivos hacía COX-2 son más asociados al daño de la mucosa del tracto digestivo que con el uso de inhibidores selectivos de la COX-2 (5). Como ejemplo de esto, tenemos caso del carprofeno (poco selectivo) que se asocia con mayor frecuencia al daño gastrointestinal que el tratamiento con robenacoxib (selectivo COX-2) 31,33. Una de las principales alteraciones gastrointestinales observadas con el uso de AINEs, es la aparición de úlceras y/o perforaciones, que pueden afectar a todos los segmentos del tracto gastrointestinal. Por lo que es común que se indiquen protectores gástricos como antagonistas H2 e inhibidores de bomba de H+ en conjunto con el AINE. 14,34.
El Hospital Clínico Veterinario de la Universidad Complutense de Madrid, reporta el caso de una perra labradora de 8 años que tras la administración de meloxicam, el cual es un inhibidor selectivo de la COX-2, sufrió una perforación gastrointestinal. La utilización de este tipo de AINE está menos relacionada con el riesgo a nivel gastrointestinal. Sin embargo, con todos los tipos de AINEs existe la posibilidad de que se manifieste una alteración gastrointestinal en menor o mayor grado 5.
El ibuprofeno es un ácido fenilalónico que por lo general no se recomienda en perros, ya que puede ocasionar ulceraciones gástricas y perforaciones cuando se utiliza terapéuticamente. La mayoría de perros muestran vómitos, hematemesis y gastroenteritis hemorrágica severa después de la ingestión de ibuprofeno 35. Esta toxicosis también se puede tratar con ayuda de protectores gástricos, antagonistas H2, inhibidores de bomba de protones, fluidos y electrolitos intravenosos, hemostasis y un buen cuidado de soporte 34,36.
Efectos renales. A nivel renal, los prostanoides producidos por COX-1 y COX-2, mantienen el flujo sanguíneo renal y el transporte de iones. Este aspecto se debe tener presente en el caso de pacientes geriátricos que padecen de otras enfermedades, en pacientes deshidratados o hipovolémicos y los que se encuentren bajo terapia con medicamentos que influyan en la función renal 3. En los riñones las PG ejercen una acción vasodilatadora que ayuda a mantener el flujo sanguíneo renal y la filtración glomerular. Luego de la activación del sistema renina-angiotensina-aldosterona (SRAA), la producción elevada de PG vasodilatadoras se vuelve crítica en el riñón para compensar los efectos vasoconstrictores de la norepinefrina, la angiotensina II y la vasopresina. Los AINEs tienen el potencial de disminuir el flujo sanguíneo renal y la tasa de filtración glomerular a través de la inhibición de la COX, sobre todo frente a la activación del sistema renina-angiotensina-aldosterona (SRAA) 22.
Los riñones de perros sanos poseen COX-1 y COX-2, pero la expresión basal de COX-2 es mayor en perros que en otras especies. La COX-1 es más abundante y se expresa en la vasculatura renal, células intersticiales papilares y conductos colectores. La enzima COX-2 se expresa en la rama ascendente del asa de Henle, la mácula densa y las células intersticiales renales en perros. Cuando es activado el SRAA, las enzimas COX-2 toman mayor importancia en el mantenimiento del flujo sanguíneo renal. Dentro de los eventos adversos de AINEs, los efectos a nivel renal son los segundos más reportados. Las manifestaciones generalmente son cambios funcionales; pero en ocasiones se han observado cambios estructurales como la necrosis papilar renal 23.
Se debe tener presente que la administración concomitante de medicamentos también puede alterar la hemodinámica renal; como es el caso de los inhibidores de la conversión de angiotensina (IECA), estos no solo inhiben la generación de angiotensina, también disminuyen la degradación de cininas. Las cininas poseen efectos vasodilatadores a través de las PG; por lo que, si se administran IECA en conjunto con AINEs, el efecto vasodilatador mediado por cinina-PG del IECA puede estar comprometido 23,37.
El uso de diuréticos potentes como la furosemida puede disminuir los eventos adversos en perros a los que se les administra AINEs. Hay evidencia de que el ibuprofeno y carprofeno causan una disminución similar en la tasa de filtración glomerular en perros que han recibido furosemida, lo que muestra que tanto los AINEs selectivos y no selectivos son capaces de provocar insuficiencia renal hemodinámica en casos de depleción de volumen 23,38.
Efectos en hígado. El hígado también se encuentra susceptible al daño inducido por AINEs en perros. Sin embargo, no se ha demostrado que esto se asocie propiamente al mecanismo de acción básico de AINEs; es probable que ocurra como consecuencia de las transformaciones metabólicas del fármaco en el hígado, y se desconoce si la toxicidad hepática inducida por AINE es dependiente de la dosis del fármaco 31,39. Diversos estudios como actividades de fosfatasa alcalina, alanina aminotransferasa o aspartato aminotransferasa y exámenes histopatológicos permiten conocer el impacto de los AINEs en el hígado de perros. Sin embargo, se ha planteado que los efectos dañinos sobre el hígado probablemente se deban a una exacerbación de un daño crónico preexistente, lo cual se detectó en el 1.6% de perros con enfermedad articular degenerativa que se encontraban en un estudio que comparaba el tratamiento con robenacoxib y carprofeno 31,40.
El estudio realizado por Szweda et al 31 en el que se comparó la posible toxicidad hepática de carprofeno y robenacoxib en perros, demostró que el uso de AINEs en perros se asocia con lesiones microscópicas en el hígado. La lesión predominante que observaron en el hígado fue la degeneración parenquimatosa y vacuolar de los hepatocitos. El carprofeno sufre metabolismo hepático, y presenta riesgo de reacción idiosincrásica en el hígado, al igual que otros AINEs. Se han reportado efectos hepatotóxicos del carprofeno en perros, incluso se describe un caso fatal de toxicidad hepática inducida por carprofeno en un Husky Siberiano joven 31,41.
En el caso del uso de robenacoxib en perros, los ensayos clínicos a largo plazo han demostrado un incremento de las actividades de las enzimas hepáticas. Pero en la mayoría de los casos, no se observaron síntomas clínicos, y los niveles de enzimas hepáticas se estabilizaron o disminuyeron 31.
Efectos adversos en felinos
Efectos gastrointestinales. Todos los AINEs pueden causar ulceración gástrica ya que inhiben la producción de PGE y PGI. La única excepción parece ser el acetaminofén (que no es antiinflamatorio). Sin embargo, el uso de acetaminofén está contraindicado en gatos ya que los productos de su metabolismo soy muy tóxicos 13,42. En el caso de los gatos existe controversia respecto a los posibles beneficios de usar ranitidina u omeprazol para el control de la acidez asociada a los AINEs, ya que existe evidencia de que la ranitidina (1.5 - 2.3 mg/kg cada 12 horas) a dosis convencionales no provee una disminución de la acidez, mientras que omeprazol (1.1 a 1.3 mg/kg) administrado una vez al día tampoco; este último debe darse al menos dos veces por día para ver efectos adecuados 43. Según lo describe Parkinson 44 el uso de omeprazol oral es superior a la famotidina dada por esta misma vía 44.
Toxicidad renal. Los AINEs y sus efectos a nivel renal también sobresalen; estos son el resultado del flujo renal reducido y al igual que la tasa de filtración glomerular; siendo ello secundario a la inhibición de la síntesis de prostaglandinas renales en donde estas participan en el mantenimiento del flujo sanguíneo renal a través de sus acciones vasodilatadoras. La selectividad relativa de la COX-2 no reduce el riesgo de efectos secundarios renales en estas circunstancias, ya que la COX-2 es una función básica de la fisiología en la función renal 13,40,45.
Efectos sobre la coagulación. Debido a la inhibición en la producción de tromboxano plaquetario se prolongan los tiempos de hemorragia, esto ocurre con la administración de cualquier AINE. Esto es más grave con el uso de aquellos medicamentos que se unen irreversiblemente a la COX-1, como la aspirina, ya que el efecto se mantiene durante la vida de la plaqueta. Sin embargo, este efecto es favorable y es utilizado en gatos con miocardiopatía hipertrófica para reducir el riesgo de trombos 14,40.
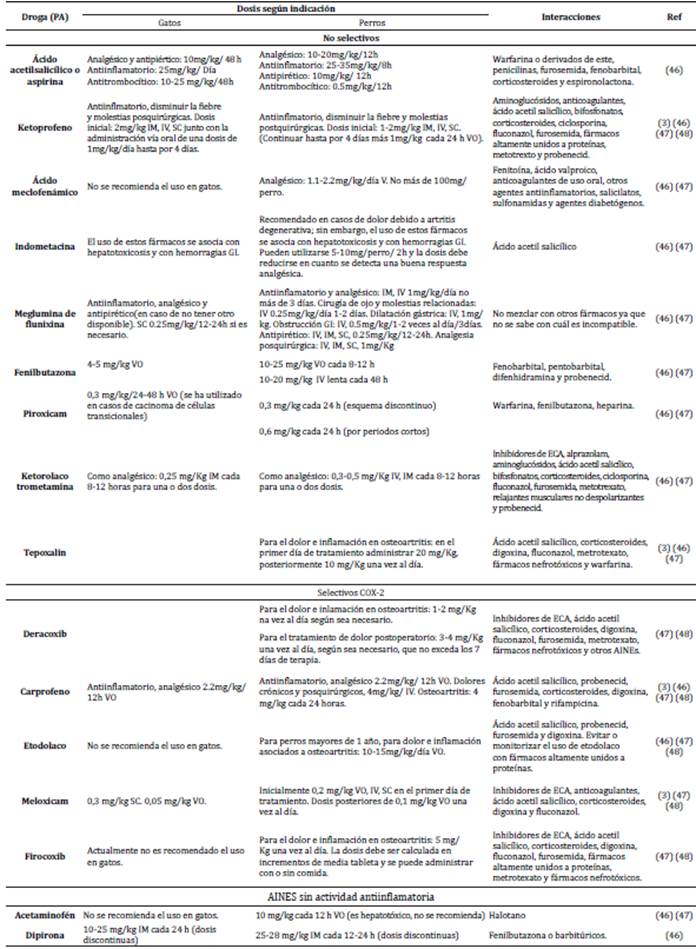
Uso a largo plazo de AINES en felinos. El uso de AINEs en gatos ha sido limitado, debido a las preocupaciones sobre posibles complicaciones y la dificultad con la administración del tratamiento. Los clínicos a menudo evitan el uso de estos medicamentos para tratar el dolor crónico en los gatos por temor a los efectos secundarios nocivos 17. Antes de iniciar el tratamiento con AINE a largo plazo, todos los gatos deben ser bien evaluados. Es necesario realizar un examen físico completo que incluya la medición de la presión arterial, y exámenes de laboratorio que incluyan un recuento completo de células sanguíneas, un perfil de química sérica y un análisis de orina. Se sugiere una evaluación de seguimiento de 5 a 7 días para detectar signos tempranos de insuficiencia renal 17. Respecto a la frecuencia de dosificación, se recomienda la terapia intermitente, por ejemplo 2-3 veces por semana en lugar de por día, es mejor que ninguna terapia en absoluto, y anecdóticamente parece ser eficaz en algunos gatos. Sin embargo, puede haber un riesgo de períodos de tiempo significativos cuando no se está logrando una terapia efectiva o una terapia subóptima. La retirada intermitente de medicamentos, una frecuencia de dosificación reducida o una reducción de la dosis pueden ayudar a los propietarios a evaluar la eficacia del fármaco 17. En el tabla 1 se presentan algunos AINEs utilizados en perros y gatos según su actividad, dosis, indicación y las principales interacciones reportadas para ellos.
CONCLUSIONES
El uso de AINEs en especies felinas y caninas es de gran beneficio en dolores postoperatorios, OA y en dolores musculoesqueléticos. El tratamiento más adecuado para tratar OA en perros son el carprofeno, meloxicam y firocoxib, ya que ellos presentan buenos efectos antinflamatorios y analgésicos. Para gatos el uso de meloxicam es el más indicado para esta enfermedad, dando un buen soporte al tratar la inflamación y el dolor.
En general los efectos adversos asociados al uso de estos fármacos se encuentran enmarcados en alteraciones de la función renal, afección gástrica y problemas hemorrágicos. La administración de acetaminofén en gatos está contraindicada pues sus metabolitos resultan ser muy tóxicos, en el caso de los perros el ibuprofeno no es recomendado ya que puede ocasionar ulceraciones gástricas y perforaciones, en donde sus principales síntomas son el vómito, hematemesis y gastroenteritis hemorrágica. En cuanto a la farmacocinética el efecto de los AINEs se puede ver prolongado en gatos en comparación con los perros, por lo que se debe tener un control y cuidado en los intervalos de dosificación.