INTRODUCCIÓN
La sobrepoblación de animales de compañía como perros (Canis lupus domesticus) y gatos (Felis catus) son uno de los principales problemas sociales a nivel mundial, diversas organizaciones han tratado de controlar este crecimiento exponencial mediante campañas de esterilizaciones quirúrgicas a bajo costo o incluso gratuitas, todo esto facilitado por clínicas veterinarias y financiadas principalmente por entes gubernamentales, con el fin de controlar en primera instancia el número de camadas de los animales callejeros (ferales) y domésticos (indoor) 1,2.
Así mismo, con este control se disminuye el riesgo a enfermedades zoonóticas o bien, difusión de enfermedades propias de las especies; además del gran número de lesiones que estos puedan ocasionarse entre sí, al disputarse territorios o por la simple acción en el acto de la reproducción 3,4. En el caso específico de los gatos domésticos, la esterilización se convierte en una alternativa para disminuir patologías asociadas al sistema reproductor como tumores de próstata o testicular, reducir las poblaciones felinas excesivas en los hogares, y disminuir los índices de agresividad en los machos 5.
En la actualidad existen diversos protocolos para lograr controlar la sobrepoblación y todos los inconvenientes que estos generan 2,3, el principal método para detener el sobre crecimiento poblacional de gatos ferales es la esterilización quirúrgica, siendo un método seguro, pero no muy accesible en muchos de los casos 6,7,8.
La esterilización en animales se lleva a cabo desde hace miles de años antes de Cristo (aC), pero siendo documentando que desde el siglo 15 9, práctica quirúrgica que ha sido realizada por profesionales, quienes han buscado alternativas para estos procedimientos, tratando de conseguir protocolos menos invasivos y de recuperación rápida 10.
La esterilización mediante la castración quirúrgica, es una técnica que consiste en extirpar los testículos del paciente, el cual es un método seguro y rápido si se realiza con todas las normas éticas y de bioseguridad 11; otra alternativa, pero menos invasiva es la vasectomía y la oclusión de los vasos sanguíneos testiculares, casi igual de eficientes que la castración.
Otras de las técnicas de esterilización es el uso de fármacos intratesticulares, también llamadas castraciones químicas 12. Han sido descritas en numerosos casos como una alternativa igual de fiable que la castración quirúrgica, siendo menos invasiva, rápida, y económicamente más accesible para toda clase social 13.
Muchas han sido las sustancias químicas utilizados en la castración química, la solución de cloruro de calcio al 20% se utilizó en 12 perros machos fértiles, esta investigación dividió a los individuos en dos grupos de estudio. Al grupo 1 se le administró 1ml de cloruro de calcio al 20%, mientras que al grupo 2 se le administró 1 ml de solución salina. Los testículos del grupo 1 se inflamaron hasta el día 7, posterior a eso al día 30 habían disminuido significativamente, el presente trabajo investigativo concluyó que el cloruro de calcio al 20% tiene un efecto potencial de degeneración testicular y es efectivo para esterilizar perros machos 14.
El empleo de CaCl2 como un método químico para esterilizar gatos machos se estudió que en una única inyección intratesticular de CaCl2 al 20% con dimetil sulfóxido al 0,5%, el cual indujo eficazmente azoospermia en gatos durante 80 días después del tratamiento; además se observó la ausencia de espículas en el pene después del tratamiento, lo que podría indicar que el tratamiento probablemente redujo la síntesis de testosterona 15.
En los últimos años el gluconato de Zinc es un químico con pocos estudios dentro de la especie felina. Si este químico se aplica en el conducto deferente o en el epidídimo, produce oclusiones fibrosas que limitan el transporte de espermatozoides hacia el exterior del glande, dando como resultado la azoospermia. 16 El zinc como mineral es esencial para el crecimiento, reproducción y, ayuda en la reparación de tejidos, es un elemento básico del semen y cumple un rol bastante importante en la motilidad espermática 17. En bajas concentraciones el zinc es importante para la producción de espermatozoides, mientras que en dosis altas inhibe la división y replicación de las células germinales. (18, 19). Si es aplicado en el parénquima testicular, el testículo se atrofia y disminuye la formación de espermatozoides, y en conjunto con la reducción sérica de andrógenos, ocasiona la disminución porcentual de incidencia de patologías prostáticas 19,20.
Otro elemento químico es el glicerol, el cual es un subproducto de los biocombustibles y forma parte de los aceites y grasas animales, al igual que es un componente de los fosfolípidos como, fosfoglicéridos o fosfoacilgliceroles, piezas integrales de la membrana celular animal 21. Estudios recientes del uso de glicerol al 70% en gatos han demostrado que con la aplicación a volúmenes diferentes de 0.5 mL - 1 mL de glicerol en gatos jóvenes de entre 1 a 2 años de edad, mostraron resultados positivos para azoospermia, niveles séricos de testosterona de 1.32±0.21 ng/mL correlacionados con la disminución de espículas peneanas, necrosis tubular, concluyendo que es una estrategia viable como alternativa a la castración quirúrgica 22.
Oliveria et al 18, afirman que una inyección única de gluconato de zinc intratesticular puede resultar eficaz como un tratamiento temporal para la castración química con una duración de 60 a 120 días, y se puede considerar una alternativa a la orquiectomía. En perros el uso de gluconato de zinc intratesticular, dio resultados positivos para azoospermia, niveles séricos bajos de testosterona después del tratamiento, siendo una alternativa a la orquiectomía, por su rapidez y costos bajos 19.
Existen diversos protocolos y químicos empleados a nivel mundial para controlar la sobrepoblación de animales, y todos los estragos que son ocasionados dentro de un aspecto social el excesivo número de animales callejeros, entre ellas las enfermedades zoonóticas, casería de los gatos a animales silvestres, enfermedades cruzadas de animales callejeros a animales domésticos, planteándonos como objetivo en el presente ensayo evaluar la eficacia en el control reproductivo mediante la aplicación intratesticular de glicerol más gluconato de zinc en gatos.
MATERIALES Y MÉTODOS
Animales y manejo. Esta investigación fue realizada en 13 gatos machos bajo criterios de inclusión racial, que sean mestizos de pelo corto con 1 a 3 años de edad y un peso entre 2.5 a 4 kg de peso vivo.
Previo al ingreso de los animales en el estudio, se procedió a revisarlos clínicamente, y fueron elegidos bajo parámetros de inclusión raciales, físicos y fisiológicos tomando en cuenta además los factores Coeundi y Generandi, los testículos fueron revisados por ecografía, todos los gatos objetos del presente estudio debían tener su calendario de vacunación y desparasitación vigentes. Todos los animales en investigación debían tener a disposición agua limpia y fresca ad libitum, alimento balanceado, y vivir en un ambiente térmico estacional que oscile entre los 12 a 15°C.
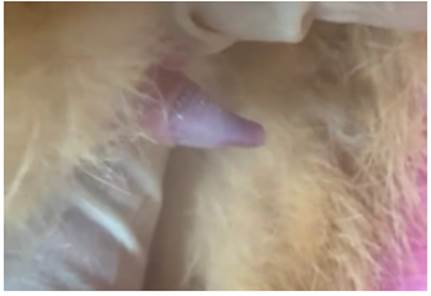
Protocolo experimental. A todos los gatos antes del estudio experimental, se revisó que presentarán descenso testicular bilateral, y que además mostraran interés sexual antes del estudio, lo cual fue determinado mediante historia clínica se corroboró si ya se reprodujeron alguna vez en su vida, también se verificó que todos aquellos gatos en investigación hayan manifestado la presencia espículas peneanas al momento de la inspección clínica como lo detalla la figura 1, y si el tamaño testicular era acorde a su edad, peso y condición corporal.
Para evaluar la condición COEUNDI, se realizó una ecografía testicular mediante una máquina ecográfica portátil Kaixin® (RKU-10 China) 7.5 MHz de frecuencia mediante transduetor lineal, para determinar que no existieran quistes, tumores, hernias, fibrosis, o alguna malformación reproductiva en los animales que podrían producir impotencia. Mientras que el factor GENERANDI, se evaluó garantizando que los ejemplares, es decir si los gatos se habían reproducidos alguna vez en su vida. 23
Los gatos fueron divididos en dos grupos de estudio. Grupo 1 (control) conformados por 6 ejemplares a los cuales se le sometió a orquiectomía bilateral convencional y grupo 2 (tratamiento) constituidos por 7 gatos a los cuales se le aplico la inyección 1mL intratestieular del producto en cada uno de los testículos conteniendo 0.7 mL de glieerol 70% y 0.3 mL de gluconato de zinc (4.5 mg).
Todos los individuos del experimento fueron evaluados cada 8 días, destacando su condición clínica hasta el día 16, donde ocurrió la última evaluación post aplicación.
Procedimiento quirúrgico (orquiectomía). El grupo 1 (control) siguió la cirugía convencional de orquiectomía bajo anestesia general con xilaeina 1mg/kg IM y ketamina 12mg/kg IM, siguiendo el procedimiento de rasurado y desinfección en la región testicular, en conjunto con la aplicación de lidocaína 2% en los conductos espermátieos, se colocó un campo estéril quirúrgico en la región testicular. La incisión fue realizada en el escroto y cada una de las túnicas que recubre el testículo hasta llegar al parénquima testicular, en donde se ligó vasos y conductos espermáticos para evitar la pérdida de espermatozoides desde el epidídimo y se retiraron los testículos. Posterior a eso se introdujeron nuevamente las túnicas dentro de la bolsa eserotal y no se cerró la bolsa para disminuir el factor inflamatorio. Se les aplicó meloxieam 0.1 mg/kg SC y enrofloxaeina 2.5 mg/kg IM 10.
Inyección testicular. El grupo 2 (tratamiento) fue sedado con xilacina en dosis de 1mg/kg intramuscular, el escroto fue rasurado y desinfectado con yodo-povidona 10%.
La inyección del producto (glicerol y gluconato de zinc) fue realizada en el polo caudal de cada testículo con una jeringa de insulina a temperatura ambiente de solución como lo representan las figuras 2, direccionando la jeringa hacia el otro polo testicular, depositando el contenido químico en la parte media de cada testículo, según la metodología de Oliveira 18.
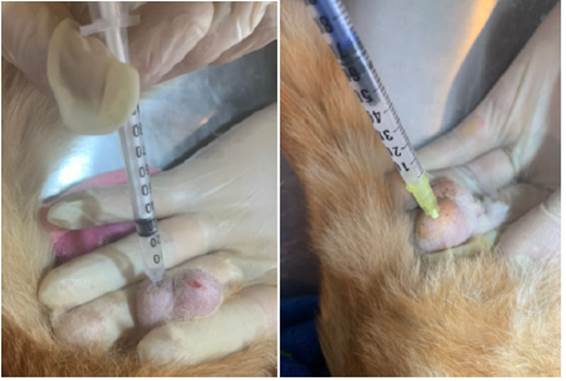
Figuras 2 Aplicación intratestieular del químico glieerol-glueonato de zinc desde el polo caudal dirigido hacia el polo craneal.
Toma de muestra del epidídimo. Posterior al mes y medio de la aplicación intratestieular de glieerol-glueonato de zinc, se realizó la orquiectomía al grupo 2, siguiendo la metodología aplicada al grupo 1 se ligó el conducto deferente para evitar pérdidas de espermatozoides durante el proceso. Los testículos fueron llevados en envases estériles con solución salina al 0.9 % (24,25) como se muestra en la figura 3a, a una temperatura que oscilaba entre los 5 a 7°C, por el tiempo que transcurre entre la orquiectomía y el procesamiento de los testículos al laboratorio, según la metodología de Goodrowe 26,27.
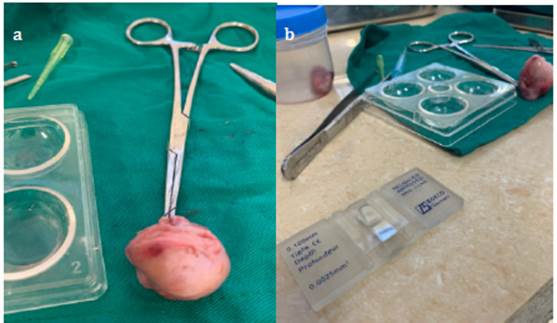
Figura 3 a. Testículo de gato para euantifieaeión de espermatozoides con el uso de la cámara de Neubauer. b. Se tomó de la cola del epidídimo la muestra espermátiea, suspendiéndola en 400 |il de solución salina buffer y después en una en una proporción 1:100 de formol, para después visualizar en la cámara de Neubauer.
Dentro del laboratorio, se mantuvieron las muestras testieulares a temperatura ambiente entre 14 a 19 °C por un lapso de 30 minutos 28. Después se separó el epidídimo del testículo y se presionaron los vasos sanguíneos que lo rodean para limpiar su contenido, esto con el fin de evitar contaminación sanguínea en relación a la muestra espermática. Después se localizó la cola del epidídimo y se realizó un corte para sumergirlo en solución fosfato buferada (PBS) durante 15 minutos para permitir la salida de los espermatozoides, al igual que se realizó una compresión de la cola del epidídimo a la solución de buffer, como se representa en la figura 3b 29.
Conteo espermático. El contenido por presión y suspensión fue tomado de la cola del epidídimo suspendiéndolo en 400 |iL de solución salina buffer por 15 minutos. Después con una pipeta se mezcló y colocó una proporción de 10 |iL de solución buffer de fosfato (PBS), con contenido del epidídimo en 1000 |iL de formol agitando constantemente. Después el contenido obtenido en la proporción 1:100 con formol se colocó sobre la cámara de Neubauer para observación de acuerdo a la técnica reportada por Jiménez Vaquero. 30
Análisis estadístico. La información obtenida en este estudio fue expresada con intervalos de confianza del 95% y analizado con ANOVA, donde se consideró la significancia estadística de p<0.05.
RESULTADOS
Análisis clínico. El grupo 2 al momento de la aplicación de glieerol al 70% más 4.5 mg de glueonato de zinc no presentó alteraciones físicas en el tamaño de los testículos, pero si una sensación de llenura en el centro del testículo al momento de inyectar el contenido químico. En el primer día tras la aplicación intratesticular los dueños comentaron que los gatos no se lamían o mordían la zona testicular, además mencionaron que disminuyó la ingesta de comida, pero no de agua en las primeras 22 horas tras la aplicación química, y su actividad física había disminuido un poco a lo habitual. Acorde al cronograma de actividades investigativas se procedió a evaluar parámetros del dolor mediante la escala Glasgow en los días posteriores a la inyección, los cuales marcaron escala de 0 a 1 en todos los pacientes del grupo 2 en los días 8, 16 y 46 post inyección.
Medición testicular promedio. Como se presenta en la figura 4 el valor biométrico testicular del grupo 2 se midió mediante la técnica de pie de rey de acuerdo a Jiang 27 como se aprecia en las figuras 5, en los 8 días tras la aplicación (1.85±0.34) no disminuyó significativamente su volumen proporcional en relación al momento de la aplicación del químico (1.8±0.29), no obstante al día 16 tras la aplicación (1.33±0.23) se encontró un cambio estadísticamente significativo (p<0.05) con relación al valor biométrico inicial; al mes y medio tras la aplicación del químico existió un mayor cambio proporcional a la medición biométrica en relación a los días 0,8 y 16 post inyección química con un valor significativo (p<0.01) (0.65±0.11), como se muestra en las figuras 6, señalando que el grupo 2 presentó una disminución estándar del 65% total del volumen testicular al día 46 tras la aplicación del químico glicerol-gluconato de zinc, en relación al tamaño promedio general entre los dos testículos al día 0, como lo representa la figura 7.
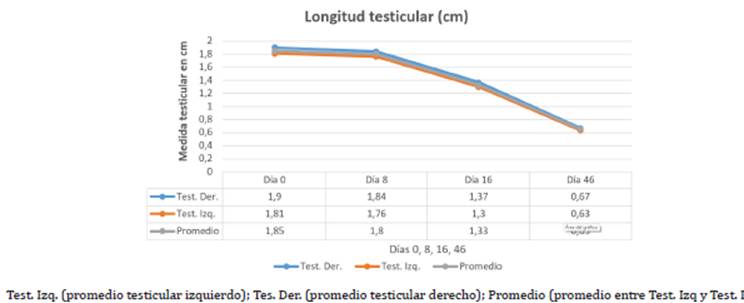
Figura 4 Los testículos del grupo tratamiento fueron medidos de manera individual los días 0, 8,16 y 46 de estudio. En promedio y de carácter individual entre cada testículo los gatos tratados tuvieron una reducción testicular (p<0.05) desde el día 16 hasta el final del estudio al día 46.
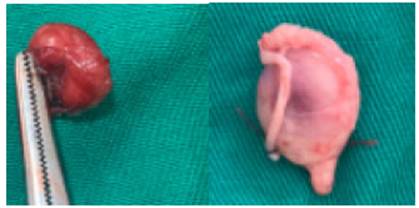
Figura 6 Testículos obtenidos de la orquieetomia en el grupo 2 a los 46 días tras la aplicación del quimieo glieerol-glueonato de zinc, en donde se ligó el conducto deferente y se colocaron los testículos en una solución salina 0.9%.
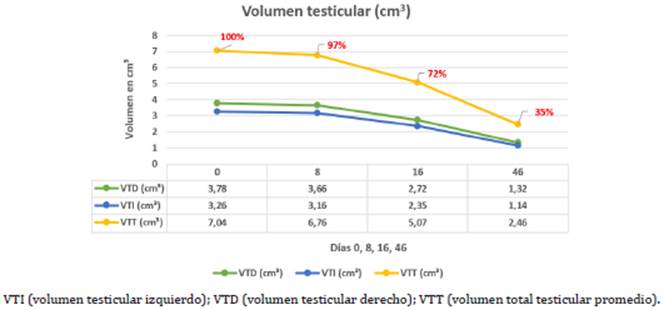
Figura 7 Volumen testicular promedio en el grupo tratamiento a los 7 gatos en estudio con la aplicación intratesticular de glicerol-gluconato de zinc. Los gatos tratados obtuvieron una reducción de volumen testicular (p<0.05) desde el día 16 hasta el final del estudio al día 46.
Presencia de espículas. Al momento de realizar la inspección clínica de selección, castración quirúrgica y química al grupo 1 y grupo 2 respectivamente del estudio se determinó que estos presenten espículas peneanas, dando como resultado que: a los 46 días tras la orquiectomía bilateral al grupo 1 de gatos de interior las espículas desaparecieron por completo. A los 46 días tras la aplicación de glicerol más gluconato de zinc las espículas peneanas en el grupo 2 disminuyeron un 76 % a comparación del día 0 de la aplicación.
Concentración espermática. Dentro del protocolo de estudio al mes y medio tras la inyección del químico glicerol más gluconato de zinc al grupo 2 de gatos indoor mestizos de pelo corto, se procedió a realizar la orquiectomía como se describe en la metodología de esta investigación, posterior a eso el mismo día de la cirugía se realizó el transporte y procesamiento de los testículos para llevarlos al laboratorio, en donde mediante la metodología descrita en este estudio se toma muestras de la cola del epidídimo en cada testículo, determinando que una inyección química única de glicerol-gluconato de zinc produjo azoospermia en todos los individuos del grupo 2, como se muestra en la figura 8.

Figura 8 Se visualiza la nulidad de espermatozoides, por lo que se determina azoospermia en la cámara de Neubauer tras los 46 días de la aplicación intratesticular del químico glicerol-gluconato de zinc.
Costos. Acordes a los resultados de esta investigación entre el protocolo experimental y el grupo control donde se realizó la orquiectomía bilateral tradicional, se pudo determinar un ahorro del 85% entre los materiales pre quirúrgicos, quirúrgicos y post quirúrgicos empleados entre el grupo control y el grupo tratamiento.
DISCUSIÓN
De acuerdo a los resultados investigativos encontrados en el grupo 2 en el primer día tras la aplicación intratesticular del químico los dueños recalcaron que la ingesta de comida se vio afectada levemente, mas no así el consumo de agua en las primeras 22 horas tras la aplicación química, y que su actividad física había disminuido brevemente a lo habitual, información y datos que se pueden cotejar con la investigación de Tataje 19. Al igual que con el análisis experimental realizado por Paranzini et al 15, en donde se aplicó CaCl2 a 6 gatos, y ninguno presentó molestias físicas, cambio de humor o decaimiento; se evaluó el dolor post inyección mediante la escala de Glasgow a los días 8, 16 y 46, dándonos un puntaje rango de 0 - 1 dentro de la escala, resultados que se corroboran por el estudio de Paranzini et al (15), en donde se pudo determinar la ausencia de molestias físicas o cambios temperamentales post aplicación del químico. No así en la investigación Silva et al 31, quienes a diferencia de nosotros encontraron un absceso unilateral en uno de sus pacientes en estudio tras la aplicación de cloruro de calcio.
En este estudio la medición testicular se realizó con la técnica descrita por Jiang (27), mediante el uso de pie de rey, en donde a los 46 días tras la aplicación del químico en estudio, el volumen testicular presentó una disminución estándar del 65% total del volumen testicular, en relación al tamaño promedio general entre los dos testículos al día 0; valor porcentual que se asemeja a estudios previos de Hager Madboul 22, en donde aplicaron 70 % de glicerol a diferentes volúmenes, denotando que a la semana tres y a 1ml de glicerol los testículos redujeron su tamaño a un 67.05% a la tercera semana tras la aplicación.
En la presente investigación y en concordancia al protocolo de estudio a los 46 días tras la orquiectomía bilateral al grupo 1 de gatos de interior (indoor) las espículas desaparecieron por completo, mientras que a los 46 días tras la aplicación de glicerol - gluconato de zinc las espículas peneanas en el grupo 2 disminuyeron un 76 % a comparación del día 0 previo a la aplicación del químico, datos que difieren con los obtenidos por Oliviera et al (18); quienes reportaron ausencia de espículas peneanas (100%) a los 60 días tras la inyección de gluconato de zinc, no obstante, se debe considera la diferencia de 15 días entre estos dos trabajos de investigación.
En este estudio tras realizarse la orquiectomía en el grupo 2 de investigación, se procedió a rescatar los testículos, los cuales mediante la metodología descrita en esta investigación se los procedió a tomar muestras desde la cola del epidídimo, dando como resultado la azoospermia a los 46 días tras la aplicación de glicerol-gluconato de zinc en todos los individuos del grupo 2. Obteniendo resultados similares a los obtenidos por Fagundes 19, en el cual los machos caninos de su estudio presentaron azoospermia, mientras que en el estudio de Oliviera 18, suprimió la espermatogénesis en 10/11 gatos (91%). A diferencia de nuestros resultados Lopes y Siva 32 en el 2014, concluyen que el glicerol no induce a azoospermia en perros, estos resultados pueden deberse a la concentración, volumen y el protocolo empleado por estos autores. No obstante en la investigación de Dayanti et al 33 en el 2021, demostraron que mediante la aplicación intratesticular de cloruro de sodio al 25% al día 30 post aplicación existió una viabilidad espermática del 36.5%, demostrando que la concentración espermática se ve ampliamente reducida, mas no es nula en su producción.
En esta investigación se pudo determinar la facilidad en el procedimiento y un ahorro económico de hasta un 85% en relación a la orquiectomía convencional, resultando una alternativa igual de eficiente a la quirúrgica, datos que corroboran en la investigación de Oliviera 18, en donde reportó que después de una inyección única de gluconato de zinc intratesticular en gatos puede resultar eficaz como un tratamiento temporal, rápido, económico y de pocos requerimientos con una duración de 60 a 120 días como un método anticonceptivo, y se puede considerar una alternativa a la orquiectomía. Incluso acorde a esta investigación Cavalieri 16, describe en su investigación que el uso de químicos para esterilizar perros machos, es una alternativa económica, permanente y rápida; pero que esos resultados van de acuerdo a la dosis, volumen y lugar donde se aplica el químico; de igual manera un estudio realizado por Aires et al 34 en el 2021, concluyeron que existe una gran base de datos investigativos concluyentes en que la castración química es un procedimiento seguro y económico para aplicar en animales machos.
Como conclusiones a esta investigación se puede mencionar que: la aplicación intratesticular de 1 mL en solución de glicerol al 70% más 4.5 mg de gluconato de zinc en gatos adultos de 1 a 3 años de edad, demuestra ser una alternativa química a la orquiectomía quirúrgica tradicional en gatos, produciendo azoospermia, atrofia testicular de hasta un 65% menos a su tamaño original, una reducción porcentual del 76% en el número de espículas peneanas, además de que resulta ser un protocolo menos traumático, mínimamente invasivo, más rápido y un 85% más económico que la orquiectomía quirúrgica convencional en gatos. Se debe ser cauteloso al momento de aplicar el químico y seguir el protocolo aséptico y bioético acorde a cada lugar donde se realice el procedimiento, para evitar efectos secundarios indeseables en cada paciente.