INTRODUCCIÓN
El síndrome de Cushing es el término aplicado al cuadro producido por elevación crónica de las hormonas adrenocorticales, independientemente de que se trate de un hiperadrenocorticismo pituitario-dependiente o que esté causado por una producción autónoma de cortisol por tumores funcionales de la glándula adrenal. La administración prolongada de glucocorticoides también puede producir un síndrome de Cushing iatrogénico. Aproximadamente en el 85% de casos de hiperadrenocorticismos que ocurren de forma natural son pituitario-dependientes y un 15% son tumores adrenales productores de cortisol 1,2.
Existen varias pruebas endocrinas que se utilizan para el diagnóstico de hiperadrenocorticismo, estas incluyen: prueba de supresión con dexametasona a dosis bajas y altas, medición de concentraciones endógenas de ACTH (no obstante la determinación de la ACTH endógena no es una prueba diagnóstica sino diferenciadora, ya que los niveles de ACTH endógena en perros sanos se solapan con los de perros con enfermedad), estimulación con ACTH, cociente cortisol/ creatinina urinario, e imagenología (en especial la ecografía y tomografía computarizada, si bien no son diagnósticas sino diferenciadoras en el plan diagnóstico). Ninguna de las pruebas son concluyentes al 100%, por lo que el diagnóstico definitivo debería apoyarse en la realización de varias pruebas con el fin de aumentar el valor predictivo de cada una de ellas 3. Además, se ha demostrado que el valor predictivo de las pruebas endocrinas que dan positivo aumenta en proporción directa al número y severidad de los signos clínicos y cambios bioquímicos de parámetros sanguíneos y urinarios 4. Por tanto, la realización de una exploración física completa, historia y exámenes paraclínicos es de vital importancia a la hora de interpretar las pruebas endocrinas del eje HPA. No se recomienda realizar pruebas en animales que no presenten signos clínicos compatibles de hiperadrencrticismo.
En general, el diagnóstico de hiperadrenocorticismo va a depender en comprobar que exista: a) elevación persistente y continuada de la producción de cortisol, o b) menor sensibilidad del eje HPA a la retroalimentación negativa por glucocorticoides 3. Cualquiera de las pruebas hormonales actuales podría arrojar resultados falso-positivos y falsos negativos. Por ello cuando se sospeche de hiperadrenocorticismo y la prueba arroje especialmente valores negativos, debería realizarse una segunda prueba; y si más de dos pruebas son negativas lo más probable es que no exista hiperadrenocorticismo. Por ejemplo, una única medición del cortisol basal podría dar tanto resultados falso-positivos como negativos debido a la secreción pulsátil de la hormona ACTH y por tanto la del cortisol. De hecho, la sensibilidad de la prueba de cortisol basal es de tan solo el 50% 2. Eso ya dificulta la primera característica del diagnóstico de hiperadrenocorticismo: la elevación persistente del cortisol. Por su parte la menor sensibilidad del eje HPA a la retroalimentación negativa con glucocorticoides se suele evaluar con la prueba de supresión a la dexametasona. La sensibilidad y especificidad de la esta prueba está entre 85-100% y 44-73%, respectivamente 3. Además, la especificidad es menor cuando hay patologías concurrentes. Por tanto, aunque pocos animales con hiperadrenocorticismo arrojarán resultados normales en la prueba (es decir, pocos falsos negativos), muchos que no tienen la enfermedad van a dar como positivos (es decir, muchos falsos positivos). Una vez se diagnostica el hiperadrenocorticismo, el siguiente paso sería diferenciar entre si el origen es pituitario o adrenal. En especial, la prueba de supresión con dosis altas de dexametasona y la medición de ACTH endógena son las indicadas para realizar dicha distinción. Por último, las pruebas de imagenología como la ultrasonografía abdominal, tomografía computarizada y la resonancia magnética abdominal y craneal pueden ser muy útiles en la determinación de la causa y sobretodo para diferenciar entre hiperadrenocorticismo de origen pituitario o adrenal 2.
A continuación, se describe un caso de síndrome de Cushing por tumores en las glándulas adrenales, que es una presentación poco habitual y refleja el interés de este caso clínico. Las pruebas diagnósticas endocrinas utilizadas se discuten en función de su sensibilidad y especificidad, y después de que los exámenes clínicos y paraclínicos sugerían un diagnostico presuntivo de hiperadrenocorticismo.
EVALUACIÓN DEL PACIENTE
Una perra de raza caniche de 11.5 años, 8.9 Kg, se presentó con una historia de 2 semanas de evolución de decaimiento, vómitos esporádicos, e incontinencia urinaria. Los dueños reportaron que el consumo de agua era elevado, al igual que la micción. La exploración clínica no mostró anormalidades relevantes aparte de obesidad con condición corporal de 7/9 (peso idóneo de 7 kg) y opacidad corneal bilateral. La perra se trató inicialmente con amoxicilina-ácido clavulanico (12.5 mg/Kg SC) y dexametasona (0.5 mg/Kg SC). Dichos tratamientos empíricos no deberían haberse realizado sin tener un diagnóstico acertado. Se le prescribieron dosis de 10 mg/Kg de amoxicilina-ácido clavulánico PO bid durante 10 días (por debajo de la recomendable) y 1 mg/Kg de prednisolona PO sid por 4 días. A los 4 días el animal se remitió por seguir muy decaído, con distensión del abdomen, y la exploración clínica mostro dolor abdominal a la palpación. El diagnóstico presuntivo incluía: urolitiasis, infección del tracto urinario, insuficiencia renal crónica, pancreatitis, colelitiasis, colecistitis, neoplasia, y síndrome de Cushing. Se obtuvieron muestras de sangre y orina para hacer perfiles hemáticos y citoquímica, respectivamente; y el animal se hospitalizó en espera de una ecografía abdominal.
Los análisis de sangre no mostraron alteraciones del hemograma excepto por un descenso del número y porcentaje de linfocitos (Tabla 1). Los resultados de química sanguínea mostraron elevación de la alanino-aminotransferasa (ALT), fosfatasa alcalina (SAP), y triglicéridos (Tabla 1). El análisis de orina mostró bacteriuria, leucocituria, pH alcalino, hipostenuria, proteinuria, y cristales de estruvita y oxalato cálcico (Tabla 2). La ecografía al día siguiente con sonda microconvex a 8.5 Mhz reveló un aumento de tamaño y presencia de masas heterogéneas de 2.5x2 cm y de 1.5x1.2 cm en las glándulas adrenales izquierda y derecha, respectivamente. El hígado mostró un aumento difuso de la ecogenicidad (hiperecoico), con bordes redondeados que sugerían una hepatomegalia. En la vejiga no se observaron cálculos y si leve presencia de sedimento. El resto de las estructuras abdominales presentaban una apariencia normal.
Tabla 1 Valores de la analítica sanguínea de la paciente.
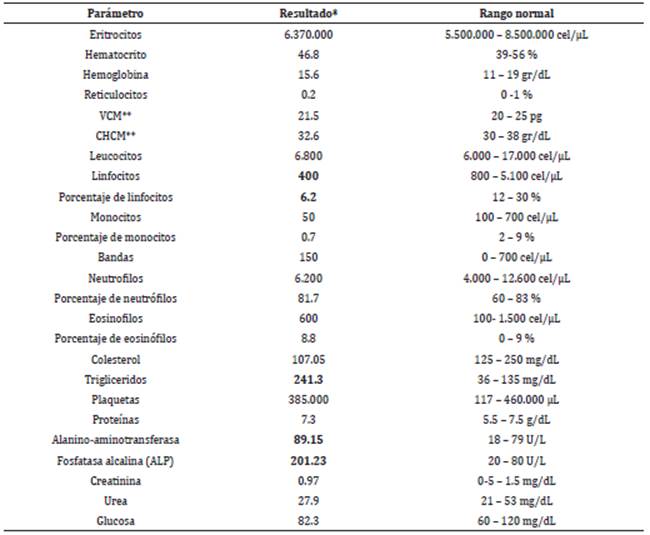
*Los valores sobresaltados en negrita están fuera del rango normal.
**VCM Volumen Corpuscular Medio, CHCM Concentración de Hemoglobina Corpuscular Media
Tabla 2 Valores del citoquímico de orina de la paciente.
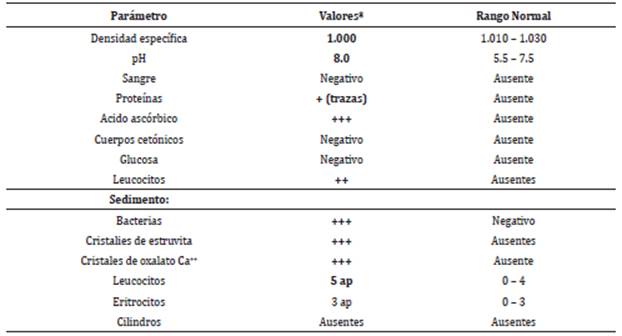
*Valores sobresaltados en negrita son anormales.
El tratamiento empírico se realizó sin haber realizado cultivo de orina. A los 25 días de la primera visita se le realizó una valoración del eje hipófisis-adrenal mediante la prueba de supresión con dexametasona a dosis bajas. El protocolo seguido fue la medición del cortisol sérico (por inmunofluorescencia cuantitativa) antes, y a las 4 y 8 horas de administrar 0.015 mg/Kg IV de fosfato sódico de dexametasona. El cortisol basal en suero estaba ligeramente elevado con respecto al rango normal con un valor de 8.52 µg/dL (normal = 1.8 - 6.0) a las primeras horas del día y en ayuno de 12 horas. Los valores de cortisol a las 4 y 8 horas post-administración de dexametasona fueron de 2.46 y 6.91 µg/dL, respectivamente. A los 3 días después de la prueba supresión con dexametasona se hizo la prueba de ACTH. La muestra se tomó, se centrifugó, y congeló en menos de 15 minutos y remitió al laboratorio para hacer radioinmunoensayo de ACTH. Los valores de ACTH estaban por debajo del rango de referencia: 10 pg/mL (15.0 - 60.0 pg/mL), lo que hizo sugerir que se trataba de un hiperadrenocorticismo de origen adrenal y no pituitario. Se le introdujo un tratamiento con trilostano a la dosis de 1 mg/ Kg bid por 1 mes. Desafortunadamente el dueño no volvió a remitir el perro para hacerle el seguimiento.
DISCUSIÓN
El diagnóstico presuntivo de hiperadrenocorticismo, también llamado síndrome de Cushing, empieza por identificar los signos clínicos, examen físico y hallazgos laboratoriales típicos. Perros con síndrome de Cushing suelen presentar varios, si no muchos, de los signos clínicos típicos descritos 5. El consenso de expertos de la American College of Veterinary Internal Medicine es que las pruebas hormonales de función del eje HPA deberían realizarse solo cuando estén presentes signos clínicos consistentes de un hiperadrenocorticismo 3. El poder identificar bien dichos signos clínicos, junto con los hallazgos paraclínicos aumenta el valor predictivo de las pruebas de detección endocrinas para el hiperadrenocorticismo 5. Los signos clínicos comunes que se suelen presentar en la primera consulta son: polidipsia/poliuria, polifagia, jadeo, distensión abdominal, alopecia endocrina, hepatomegalia, debilidad muscular, e hipertensión sistémica 3. En nuestro caso, se presentaban muchos de dichos signos clínicos y paraclínicos típicos, pero no todos. Los signos clínicos que sí estaban presentes incluían: polidipsia/poliuria, letargo, jadeo, y distensión abdominal. Los hallazgos paraclínicos típicos que presentó la paciente incluían: elevación de la ALP y ALT, linfopenia, proteinuria, hipostenuria (gravedad específica <1.008), y hepatomegalia. En este caso no se presentaban otros signos clásicos como problemas de piel (alopecia simétrica truncal, hiperpigmentación, comedones, piel lábil), polifagia, debilidad muscular; ni tampoco hallazgos paraclínicos como hipercolesterolemia, leucograma de stress (neutrofilia madura, monocitosis, eosinopenia), e hiperglucemia. Dentro de la historia también habría que incluir la edad, sexo y raza del paciente. En nuestro caso, se trataba de una hembra de 11.5 años y era de raza caniche. En un estudio en 41 perros, se vio que dicha edad, sexo, y raza, eran factores predisponentes para hiperadrenocorticismo de origen adrenal 6.
La medición de la fosfatasa alcalina (SAP) puede servir para descartar hiperadrenocorticismo en el 90% de casos ya que casi siempre va a estar elevada 5,2. De hecho, el 15% de internistas y dermatólogos no persiguen un diagnóstico de hiperadrenocorticismo cuando la SAP está normal La elevación de la fosfatasa alcalina ocurre por inducirse una enzima específica del hígado, y en parte es debida a la deposición de glucógeno hepático y vacuolización que comprime el sistema biliar. Dicha enzima habría que diferenciarla de las causadas por una enfermedad hepática primaria. No obstante, se ha visto que la enzima también puede estar elevada en numerosas otras patologías, por lo que la especificidad es de tan solo el 18% 5. La elevación de la ALT puede ser debida a necrosis hepatocelular, acumulo de glucógeno, o hinchazón de hepatocitos. Muchos perros tienen condiciones comórbidas entre las que predominan la infección del tracto urinario, otitis externa e hipertensión. En este caso, el análisis de orina era presuntivo de que existía una infección del tracto urinario, evidente por la piuria, bacteriuria, proteinuria, pH alto, e hipostenia. El cortisol interfiere con la unión de la hormona antidiurética, y eso conlleva a hipostenuria. Por su parte, si bien es corriente la hipercolesterolemia por estimulación esteroidea de la lipolisis, en este caso el colesterol era normal; sin embargo, los triglicéridos estaban aumentados.
A continuación, se discuten las pruebas selectivas que se recomiendan y las que aquí se realizaron para diagnosticar el hiperadrenocorticismo. La prueba diagnóstica más corriente es la de supresión con dexametasona a dosis bajas que tiene una sensibilidad del 85-100% por lo que se producen pocos falsos negativos 3,5. Además, es una prueba más fiable en perros con tumores adrenales que la prueba de estimulación con ACTH 6. La prueba consiste en administrar dosis de 0.010-0.015 mg/kg de dexametasona que son ligeramente supra fisiológicas y van a suprimir la liberación de ACTH (y por tanto de secreción del cortisol) por más de 12 horas en perros normales. Seguidamente se miden las concentraciones de cortisol a las 4 y 8 horas. En nuestro caso, las concentraciones de cortisol indicaron falta de supresión a las 4 horas (concentraciones > 1.4 µg/dL) y 8 horas (concentraciones > 50% del valor basal). El hecho de que a las 4 horas postadministración de dexametasona los valores estuviesen en 2.4 µg/dL, superando así el valor de 1.4 µg/dL establecido como punto de corte, ya apunta a que el hiperadrenocorticismo no era de origen pituitario y sí por tumor/es de las glándulas adrenales. No obstante, para confirmar el origen se realizó la medición de la hormona ACTH. En teoría, la medición de concentraciones endógenas de ACTH es la prueba más confiable para discriminar entre hiperadrenocorticismo de origen pituitario y adrenal 6,7. Los perros que tienen tumores adrenales productores de cortisol suelen tener la producción de ACTH reducida por el mecanismo normal de retroalimentación; por tanto, la administración de dexametasona no suprime los niveles de cortisol sérico. Perros con hiperadrenocorticismo pituitario-dependiente tienen valores normales o elevados de ACTH, mientras que aquellos con tumores adrenales funcionales tienen valores bajos o indetectables. Del punto de vista práctico, el diferenciar entre uno y otro tipo de hiperadrenocorticismo tiene importancia si el perro puede ser buen candidato para realizar una adrenalectomía que es la terapia de elección para tumores adrenales. En nuestro paciente la prueba de ACTH se realizó una vez confirmado el hiperadrenocorticismo por la prueba de administración de dexametasona, y se comprobó que la secreción de ACTH, con valores de 10 pg/mL, estaba disminuida por debajo del valor mínimo normal de 15 pg/mL 3. No obstante, valores entre 10 y 15 pg/mL se consideran una "zona gris" que no permite diferenciar si existe o no hiperadrenocorticismo adrenal 5.
Otra prueba bastante sensible (>75%) pero poco específica (20-25%) es la del cociente cortisol/creatinina urinaria 8,5. Es sensible porque permite descartar que exista hiperadrenocorticismo, pero no es específica ya que muchos perros estresados por el transporte y visita al veterinario o con patologías recurrentes pueden tener un cociente elevado y por tanto serían falsos positivos. Por ello, un valor positivo siempre debería confirmarse con una prueba de estimulación por la ACTH, o bien por supresión con la dexametasona a dosis bajas. Por el contrario, cuando el resultado es negativo se puede descartar hiperadrenocorticismo en la mayoría de los casos siempre que la muestra se recoja con el paciente no estresado (i.e., por el dueño en casa durante las primeras horas de la mañana). En nuestro caso, esta prueba no se realizó ya que no se consideró necesaria para confirmar el diagnóstico.
El diagnostico de imagenología es otra prueba sensible para identificar tumores adrenales ya que se permite visualizar agrandamientos unilaterales o bilaterales de las glándulas adrenales. En perros sanos, la glándula izquierda tiene una forma de "cacahuete" al verla en plano sagital, y la derecha tiene una forma de "V" o "coma" al observarla en plano medio lateral. El contorno debe ser lisa y el parénquima homogéneo y menos ecogénico que la corteza renal adyacente. El aspecto ultrasonográfico de los tumores adrenales puede ser muy variado. De hecho el tumor puede ser hipo-, iso-, ó hiperecoico comparada a la corteza renal, y también puede tener una ecogenicidad mixta. La sensibilidad de medir la longitud y diámetros como prueba de cribado varia del 18 y 77%. En nuestro paciente el tamaño de ambas glándulas estaba aumentado y además se presenciaban unas masas en cada glándula adrenal que se interpretaron como hiperplasia o neoplasia bilaterales. Aunque la gran mayoría de tumores adrenocorticales son unilaterales, también están descritos los que ocurren bilateralmente 9. También se ha descrito la presencia de otros tumores adrenales como feocromocitomas en concurrencia con masas corticales contralaterales productoras de cortisol. Los que ocurren unilateralmente suelen ir asociados a atrofia de la glándula contralateral ya que se produce una supresión endógena de la ACTH y el exceso de cortisol secretado por la glándula tumoral. Esto cobra especial importancia si se va a extirpar quirúrgicamente la glándula afectada porque el perro va a sufrir de hipoadrenocorticismo en el postoperatorio. El caso de hiperadrenocorticismo aquí reportado es poco habitual ya que la mayoría son de origen hipofisario.















