INTRODUCCIÓN
La producción de pollo de engorde impulsa la economía y contribuye a la nutrición. La demanda de carne de pollo ha crecido en el mundo, especialmente por ser una fuente económica de proteína animal, se percibe como saludable y por la ausencia de tabús religiosos 1. En Colombia, la avicultura representa un eslabón importante en la economía del sector agropecuario (representó el 7.50% y 32.8 % del PIB agropecuario y pecuario del 2019, respectivamente) 2. En la producción de pollos de engorde se emplean aditivos para mejorar la salud y el rendimiento de las aves 3 para contrarrestar factores externos que afectan la salud y el desempeño de los animales 4. Por otro lado, la rentabilidad en la producción de pollos de engorde se ve amenazada por los altos costos de alimentación y los brotes de enfermedades 5.
Los antibióticos promotores de crecimiento (APC) son aditivos de la dieta, que cuando se emplean en dosis sub-terapétucas (2.5 a 50 ppm) mejoran la salud y el desempeño productivo los animales 3, pero el uso de APC puede dejar resistencia y residuo en los animales 4. Por tal motivo, se ha prohibido el uso de APC 3 y se buscan alternativas para reemplazar su uso 6) y evitar residuos nocivos en carne y huevo 7. Los probióticos, prebióticos, ácidos orgánicos (y sus sales) 8, aceites esenciales 9, grasas, antioxidantes, extractos de hierbas 10, inmunoestimulantes, enzimas, aminoácidos y compuestos fitogénicos 7 son algunas alternativas a los APC en aves.
El ácido butírico es uno de los principales productos de la fermentación de los carbohidratos. Este ácido graso de cadena corta 11 se puede emplear como alternativa a los APC 10 pues controla las bacterias patógenas, mejora el desarrollo del epitelio intestinal 12, mejora la inmunidad 4 y atenúa la inflamación del intestino 13.
Se recomienda suministrar el ácido butírico en forma de butirato de sodio (BS), pues de esta manera es sólido, más estable, menos oloroso 14 y de más fácil manejo 15 que cuando se suministra el butirato de manera libre. El BS parcialmente protegido permite que el butirato actúe sobre todo el tracto gastrointestinal y evita que se absorba en la parte proximal del intestino 11. Se ha evaluado el efecto del butirato de sodio protegido en la dieta de pollos de engorde sobre el desempeño productivo 7,16,17, pero el efecto puede ser diferente según método de preparación del BS (18). El objetivo de este trabajo fue determinar el efecto de varios niveles de BS parcialmente protegido con grasa en la dieta de pollos de engorde sobre el peso, el consumo de alimento, la eficiencia alimenticia y la canal.
MATERIALES Y MÉTODOS
Localización. El trabajo se realizó en la granja de la Corporación Universitaria de Santa Rosa de Cabal (Unisarc) (Figura 1), ubicada en el municipio de Santa Rosa de Cabal (Risaralda, Colombia; 4°58'82" N y 75°37'43" O) a 1645 msnm. La temperatura media y precipitación anual de la granja son 18.6°C y 2620 mm. El trabajo se realizó entre febrero y abril de 2019.
Duración y tratamientos. El experimento duró 42 d. Los tratamientos consistieron en cuatro dietas para pollos de engorde (Ross 308) con diferente promotor de crecimiento: un control negativo sin promotor (SP); dos en donde se mezcló el concentrado del tratamiento SP con BS en concentraciones de 3.5 y 7 g kg-1 de alimento para los tratamientos B3.5 y B7, respectivamente; y otro control positivo, en el cual se adicionó bacitracina de zinc al concentrado SP (49.5 ppm de alimento; Ba). Se empleó Butimax 70® y Bacitracina de Zinc Granular Solla® como fuentes de BS y Ba, respectivamente. Para alcanzar la concentración descrita en los tratamientos, se utilizó la composición garantizada por el fabricante (70 y 15% para BS y Ba, respectivamente). El suministro diario de concentrado correspondió al consumo del día anterior más un 10%, esto con el fin de garantizar el consumo a voluntad. La composición de ingredientes de la dieta basal y la composición química de los concentrados utilizados en el experimento se indican en las Tablas 1 y 2, respectivamente.
Animales y manejo. El Comité de Bioética de Unisarc aprobó los procesos de este trabajo (Comunicado 1-210-05-83-2019-00499). Se emplearon 160 machos Ross 308 de 1d y peso vivo de 44.4±4 g (media±DE). Se utilizaron 16 corrales de 810 cm2 para alojar a las aves (10 pollos/corral). Cada corral contaba con piso de viruta de madera, 2 bebederos tipo niple y 1 comedero de tolva (capacidad de 4 kg para la primera semana y posteriormente de 12 kg). Los tratamientos se asignaron a los corrales según un diseño completamente al azar.
Tabla 2 Composición química de los concentrados utilizados en el experimento.
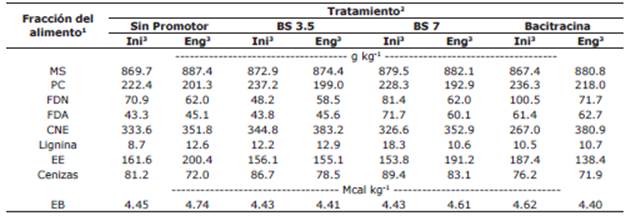
1MS: materia seca; PC: proteína cruda; FDN: fibra detergente neutro; FDA: fibra detergente ácido; CNE: carbohidratos no fibrosos (CNE = 100 - PC - FDN - EE - cenizas); EE: extracto etéreo; EB: energía bruta estimada teniendo en cuenta el valor de energía utilizado por Nik et al. (19) para la proteína (5.65 kcal g-1), grasa (9.45 kcal g-1) y los carbohidratos (4.12 kcal g-1).
2Sin promotor: control negativo, concentrado para pollos de engorde sin promotor de crecimiento (SP); BS 3.5 y BS 7: concentrado SP con butirato de sodio protegido con grasa en concentraciones de 3.5 y 7 g kg-1 de alimento, respectivamente; bacitracina: control positivo, concentrado SP con bacitracina de zinc (49.5 ppm del alimento).
3Ini y Eng: concentrados fase iniciación y engorde, respectivamente.
Se controló la temperatura del galpón durante las cuatro primeras semanas a través de criadoras a gas (1 criadora Jackwal® por cada 6 corrales) de la siguiente manera: 30°C a los días 1 y 2, 28°C al día 3, descenso gradual a para llegar a 20°C al día 27 (1°C/3d). Se vacunó vía ocular contra Newcastle La Sota (días 4 y 14) y oral contra Gumboro (día 17). Se emplearon 23 h de luz hasta el día 7 y posteriormente 18 h. Se sacrificaron 2 aves/corral el día 42 para evaluar la canal, sus partes y porciones del sistema digestivo. El sacrificio se realizó por dislocación cervical.
Recolección de la información. Se determinó el peso vivo, ganancia de peso, consumo de alimento, índice de conversión alimenticia (ICA), peso de la canal (completa y sus partes) y porciones del sistema digestivo.
Las aves fueron pesadas al inicio del experimento y cada 7 d antes de repartir el alimento (7:00 h). Se pesó la canal y sus partes a los 42 d: pechuga, muslos+contramuslos, alas, vísceras, intestino (con contenido), hígado y grasa abdominal. El peso de la canal se tomó como la suma de los pesos de la pechuga, muslos+contramuslos y alas. Se colectaron muestras del concentrado cada semana (aproximadamente 200 g), que se almacenaron a -20°C para posteriormente conformar una muestra compuesta de cada tratamiento por fase. Las muestras se molieron (criba de 1 mm) para su posterior análisis químico. Los desperdicios del concentrado se colectaron y pesaron a las 7:00 h del siguiente día, se almacenaron a -20°C para posteriormente conformar una muestra compuesta de cada corral por semana. El desperdicio se deshidrató y empleó para estimar el consumo de alimento por semana.
Análisis químicos. Se determinó materia seca (MS), proteína cruda (PC), extracto etéreo (EE), cenizas (20), fibra detergente neutro (FDN), fibra detergente ácido (FDA) y lignina (21). Se estimó la energía bruta teniendo en cuenta el valor de energía utilizado por NiK et al 19 para la proteína (5.65 kcal g-1), grasa (9.45 kcal g-1) y los carbohidratos (4.12 kcal g-1).
Análisis estadístico. Los datos se analizaron de acuerdo un diseño completamente al azar según el modelo: y ij = μ + T ¡ + ε ij , donde y ij es el valor de la observación, μ es la media de la población, T ¡ es el efecto del tratamiento y ε ij es el error experimental. Se comprobaron los supuestos del modelo [~N(0, σ 2e)]. Cuando el modelo fue significativo (p<0.05), se procedió a comparación de las medias de los tratamientos a través de la prueba LSD (p<0.05). Se utilizó el programa Statistix 8.0 para el análisis de los datos.
RESULTADOS
Se presentó un efecto del aditivo sobre el peso vivo a los 14 d de edad (p=0.0335) y sobre la ganancia de peso en la primera semana de vida (p=0.0503). Las aves el tratamiento B7 obtuvieron mayor peso vivo a los 14 d y ganancia de peso durante la primera semana en comparación con SP y Ba (p<0.05), pero no frente a las del tratamiento B3.5. La ganancia de peso de las aves durante la primera semana del tratamiento Ba fue menor comparado con aquellas que recibieron butirato de sodio (p<0.05), pero no frente a SP (Tabla 3).
Tabla 3 Efecto de suministrar diferentes niveles de butirato de sodio protegido con grasa en la dieta de pollos de engorde sobre el peso.
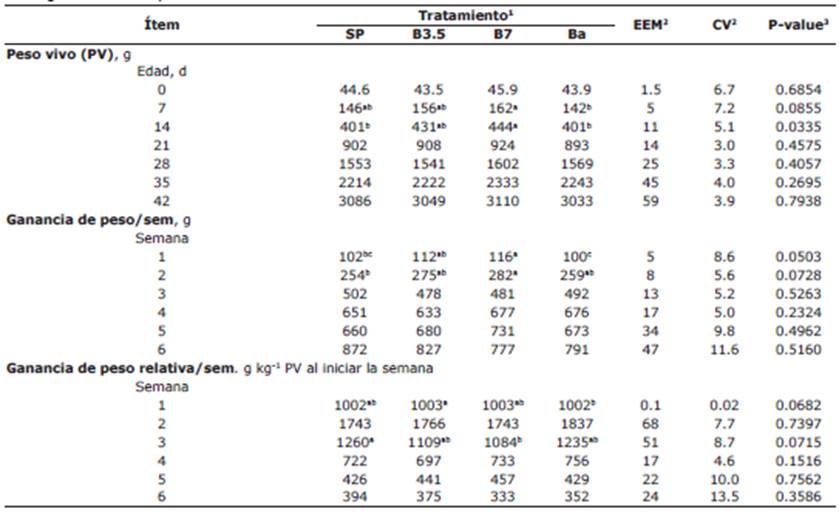
1SP: concentrado para pollos de engorde sin promotor de crecimiento (control negativo); B3.5 y B7: concentrado SP con butirato de sodio protegido con grasa en concentraciones de 3.5 y 7 g kg-1 de alimento, respectivamente; Ba: concentrado SP con bacitracina de zinc (control positivo).
2EEM: Error estándar de la media. CV: Coeficiente de variación.
3 Promedios en la misma fila con superíndices con letras diferentes indican diferencias significativas (Prueba LSD, p<0.05)
Se presentó una tendencia sobre el peso vivo a los 7 d (p=0.0855), la ganancia de peso en la segunda semana (p=0.0728), y la ganancia relativa de peso durante la primera (p=0.0682) y tercera (p=0.0715) semana. El peso vivo a los 7 d fue mayor para el tratamiento B7 en comparación con Ba (p<0.05), pero no frente a SP y B3.5. La ganancia de peso durante la segunda semana fue mayor para B7 en comparación con SP, pero no frente a B3.5 y Ba (p<0.05). La ganancia relativa de peso durante la primera semana fue mayor para B3.5 frente a Ba (p<0.05), pero no en comparación con SP y B7. La ganancia de peso relativa durante la tercera semana fue mayor para SP en comparación al tratamiento B7 (p<0.05), pero con relación a los demás tratamientos (Tabla 3).
No se presentaron efectos de los tratamientos sobre el consumo alimento, ya sea acumulado o por semana (p>0.05)(Tabla 4).
Tabla 4 Efecto de suministrar diferentes niveles de butirato de sodio protegido con grasa en la dieta de pollos de engorde sobre el consumo de alimento.
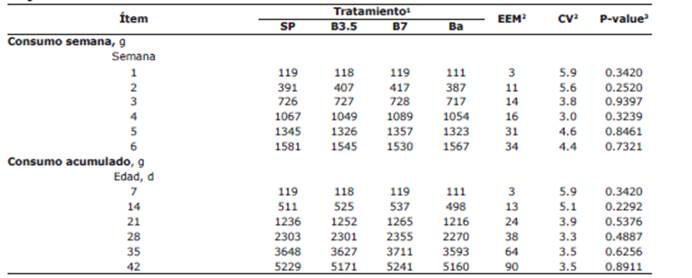
1SP: concentrado para pollos de engorde sin promotor de crecimiento (control negativo); B3.5 y B7: concentrado SP con butirato de sodio protegido con grasa en concentraciones de 3.5 y 7 g kg-1 de alimento, respectivamente; Ba: concentrado SP con bacitracina de zinc (control positivo).
2EEM: Error estándar de la media. CV: Coeficiente de variación.
3 Promedios en la misma fila con superíndices con letras diferentes indican diferencias significativas (Prueba LSD, P<0.05)
La dieta afectó el ICA en la primera semana de vida (p=0.0547). El ICA fue mayor para SP frente a B3.5 y B7 (p<0.05), pero no frente a Ba. El B7 presentó menor ICA en comparación a SP y Ba (p<0.05), pero no frente a B3.5 (Tabla 5).
Tabla 5 Efecto de suministrar diferentes niveles de butirato de sodio protegido con grasa en la dieta de pollos de engorde sobre el índice de conversión alimenticia (ICA).
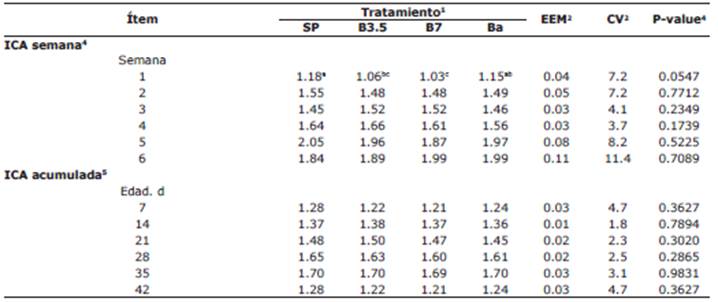
1SP: concentrado para pollos de engorde sin promotor de crecimiento (control negativo); B3.5 y B7: concentrado SP con butirato de sodio protegido con grasa en concentraciones de 3.5 y 7 g kg-1 de alimento, respectivamente; Ba: concentrado SP con bacitracina de zinc (control positivo).
2EEM: Error estándar de la media. CV: Coeficiente de variación.
3 Promedios en la misma fila con superíndices con letras diferentes indican diferencias significativas (Prueba LSD, P<0.05)
4 (consumo por semana, g) * (ganancia de peso por semana, g)-1.
5 (consumo, g) * (peso, g)-1
No se presentaron efectos de los tratamientos sobre la canal, sus partes y porciones del sistema digestivo (p>0.05)(Tabla 6).
Tabla 6 Efecto de suministrar diferentes niveles butirato de sodio protegido con grasa en la dieta de pollos de engorde sobre la canal, sus partes y porciones del sistema digestivo.
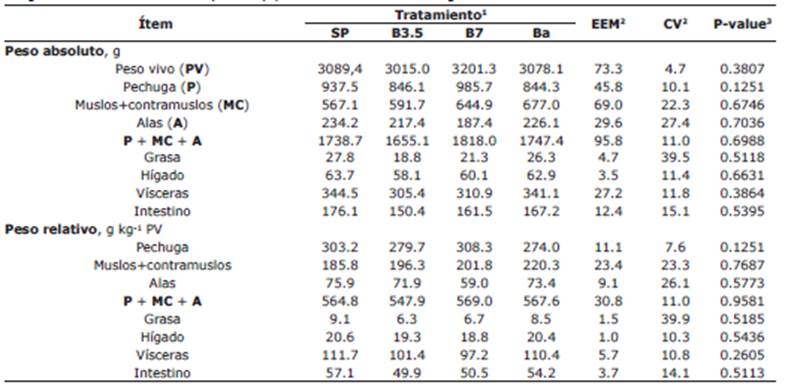
1SP: concentrado para pollos de engorde sin promotor de crecimiento (control negativo); B3.5 y B7: concentrado SP con butirato de sodio protegido con grasa en concentraciones de 3.5 y 7 g kg-1 de alimento, respectivamente; Ba: concentrado SP con bacitracina de zinc (control positivo).
2EEM: Error estándar de la media. CV: Coeficiente de variación.
3 Promedios en la misma fila con superíndices con letras diferentes indican diferencias significativas (Prueba LSD, p<0.05)
DISCUSIÓN
El uso de antibióticos es una preocupación pública debido a la resistencia y residuos antimicrobianos 22. El ácido butírico es una alternativa a los APC 10 debido a su efecto sobre las baterías patógenas, el epitelio intestinal 12, el sistema inmune 4,23 y la inflamación del intestino 13. Todo lo cual, incrementa el desempeño productivo o la capacidad de las aves para enfrentar retos inmunológicos. Este trabajo pretendía documentar el uso de BS parcialmente protegido con grasa a diferentes niveles en la dieta de pollos de engorde, esperando que se mejorara la ganancia de peso, la eficiencia de la dieta y el rendimiento en canal. Bajo las condiciones experimentales, sólo se encontró efecto del BS sobre el peso vivo y ICA durante las primeras semanas de vida.
Estos resultados indican un efecto beneficioso del BS sobre el peso durante la primera semana de vida, incluso en comparación con el antibiótico. La bacitracina de zinc es un reconocido APC 5, pero su efecto sobre el peso de las aves a los 7 y 14 d fue inferior al de las que recibieron B7. Aunque en este trabajo no se determinó la presencia de microorganismos patógenos, la acción del BS sobre los mismos no explicaría completamente el mayor peso en el tratamiento B7. La ausencia de diferencias entre Ba y SP, sugieren adecuadas condiciones de manejo en el experimento y ausencia de reto inmunológico para las aves. El BS puede jugar un papel más efectivo cuando los pollos de engorde son sometidos a desafíos de estrés 22. De tal manera, el BS puede ser más eficiente que la Ba en condiciones adecuadas de manejo y en ausencia de retos inmunológicos, debido no sólo a su actividad bactericida 24, sino a otros efectos sobre el desarrollo del sistema digestivo 16, regulación del microbiota 25 y del sistema inmune 26.
La literatura con relación al efecto BS sobre el peso de los pollos de engorde es contradictoria. Algunos trabajos presentan ausencia de efecto del consumo de BS sobre el peso 7,13; otros en cambio, reportan un incremento (22,27 o una disminución 17. Estas diferencias pueden ser debidas a la digestibilidad del alimento, a condiciones ambientales, uso de butirato libre o protegido, niveles utilizados, matriz utilizada en el recubrimiento 28, método de preparación del BS 18, estado de salud, composición del alimento y nivel de butirato 27.
El peso de las aves fue mayor con B7 a los 14 d en comparación con SP y Ba, pero no frente B3.5. Esto sugiere que el efecto durante los primeros 14 d de vida depende del nivel de inclusión del BS. Un mayor peso de las aves que recibieron BS puede ser atribuido a su efecto sobre los microorganismos 24, las vellosidades intestinales 18, el sistema inmune 26 y la inflamación intestinal 13.
El BS tiene efecto bactericida (24), lo cual podría explicar parcialmente el mayor PV encontrado a los 14 d en el tratamiento B7. La inhibición de bacterias patógenas por parte de ácidos orgánicos es por penetración (no ionizada) en la pared celular bacteriana lipofílica, disociación a pH citosólico neutro y liberación de aniones y protones que provocan una acumulación letal de aniones 14. El ácido butírico es lipofílico y puede difundirse a través de la membrana de la bacteria, mientras que su forma disociada (butirato) no 24. El BS es la sal de Na del ácido butírico, en donde un átomo de Na reemplaza el H del grupo OH. Debido al bajo pH del jugo gástrico, el BS libera el ión Na en el estómago y se convierte rápidamente en su forma no disociada y entra fácilmente al interior del microorganismo 24.
En este trabajo se utilizó BS parcialmente protegido con grasa, lo cual contribuye a explicar el efecto benéfico del tratamiento B7 sobre el peso. Como se mencionó, el efecto bactericida del butirato depende de su estado de disociación. El BS se recubre con grasa para evitar o retardar su disociación 7 y protegerlo de la absorción inmediata en el tracto digestivo superior 18. El BS protegido permite que el butirato se libere lentamente, dejando que tenga un efecto sobre todo el tracto digestivo 15 y de esta manera es más efectivo que cuando se utiliza BS libre.
El mayor PV en el tratamiento B7 puede estar asociado al efecto que tiene el BS sobre el epitelio intestinal. Diferentes trabajos en aves, corroboran que el BS en la dieta estimula el crecimiento de las vellosidades del intestino 16,27 o incrementan la relación alto-vellosidad:profundidad-cripta 17, y de esta manera se podría explicar el mayor peso a los 14 d en el tratamiento B7.
El mayor PV en el tratamiento B7 también puede ser explicado por el efecto del ácido butírico sobre el sistema inmune y el funcionamiento general del sistema digestivo. El ácido butírico modula el sistema inmune 26; cuando hay estrés inmune, el BS mantiene el consumo 29; también tiene efecto anti-inflamatorio 13. La suplementación con BS incrementa el peso relativo del timo y bazo 27. El butirato tiene un impacto directo sobre la secreción de mucina 24, estimulando la producción de moco y controlando la función de barrera del intestino 26). A pesar de que en este trabajo no se presentó reto inmune, es necesario tener en cuenta que el efecto del BS sobre el sistema digestivo y órganos del sistema inmune es crucial para la eficiencia digestiva y respuesta del sistema inmune 27.
El efecto del B7 sobre el peso se presentó durante los primeros días vida, pero no a partir de la semana 3; lo cual puede ser explicado en dos sentidos: la edad de las aves y las condiciones sanitarias del experimento. Pires et al 28 encontraron un mayor peso vivo a los 7 d en comparación con aquellas aves que recibieron el control control negativo (sin promotor de cremciento). Los efectos de BS son más evidentes en los estados tempranos de edad, de tal manera que las aves jóvenes son el mejor candidato para su uso 30. La función intestinal no está completamente desarrolladas al primer día de edad 18 y el neonato es el mejor candidato para la suplementación en la dieta del BS por su efecto bactericida y estimula el crecimiento de las vellosidades 30.
La ausencia de diferencias a partir de la tercera semana puede ser atribuida a las buenas condiciones sanitarias del experimento. La suplementación con BS no afecta el crecimiento de las aves que crecen en condiciones ambientales limpias y saludables 16, y con carga de bacterias patógenas bajas 27. Se presenta efecto cuando los animales se exponen a retos inmunológicos 16.
No se presentó efecto sobre el consumo. El butirato es volátil 4, oloroso e inestable 22, y cuando se suministra libre disminuye su consumo 15. Los derivados del butirato, como butirato de sodio, butirato de calcio y butirato glicérido 25 se preparan para disminuir el olor indeseable de este ácido 16. El BS es menos oloroso 24 y su olor se puede disminuir aún mas, cuando se recubre con grasa 16. En este trabajo se utilizó BS parcialmente protegido con grasa, lo cual podría explicar que no se presentara efecto del butirato sobre el consumo.
La disminución en el ICA en la primera semana relaciona con incremento en el PV y ausencia de efecto sobre el consumo. En diferentes trabajos se encontró una disminución en el ICA 22,26,27, en cambio en otros, no se encontró efecto sobre el ICA 7,16. Cabe resaltar, que algunos de los trabajos en donde no encontró efecto del consumo de BS sobre el ICA 16, se evaluó el butirato en aves con reto inmunológico; lo cual es benéfico, pues el BS mantiene la eficiencia de la dieta a pesar del reto inmunológico.
El BS no presentó efecto sobre la canal y tamaño del sistema digestivo. Panda et al 30 encontraron incremento en el peso relativo de la canal y disminución en la grasa abdominal, pero no sobre el peso relativo de la pechuga. Se esperaba un menor peso relativo de la grasa abdominal en este trabajo, lo cual no fue el caso. Zhao et al 25 encontraron que BS inhibe la acumulación de grasa en el abdomen e hígado, pero este efecto depende de la inclusión del BS; lo cual podría indicar la ausencia de efecto sobre el peso relativo de la grasa se deba a la concentración de BS empleada en el experimento, pero se debe profundizar al respecto. Algunos trabajos reportan que el consumo de BS en aves incrementa el peso relativo del intestino 17,22,27.
En este trabajo se evidenció que el consumo de BS parcialmente protegido con grasa mejora el desempeño de las aves durante las primeras semanas de vida en condiciones ambientales óptimas e higiene; esto permite tener animales más resistentes al momento de enfrentar retos inmunológicos.