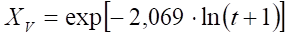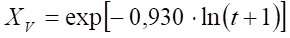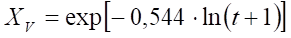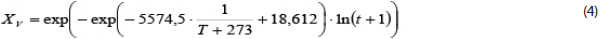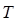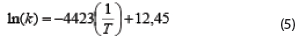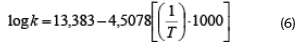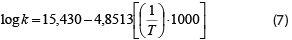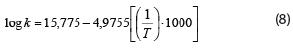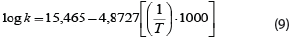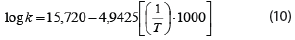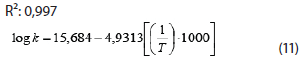1. Introducción
Se estima que las pérdidas debido a plagas en cosechas se aproximan a un 35% en los principales cultivos de interés a nivel mundial (Sarkar et al., 2021). Los nemátodos están entre los patógenos que mayor daño causan en los cultivos (Koenning et al., 1999) pues son plagas que provocan pérdidas considerables, valoradas en varios millones de dólares anualmente. El control biológico para la lucha contra plagas en la agricultura es una alternativa de grandes posibilidades, debido a su amplio espectro de acción y la seguridad que representa para el hombre y el medio ambiente (Bais et al., 2004; Dong & Zhang, 2006; Hernández, 2009).
El secado se considera generalmente como la eliminación de agua, y hasta hace poco se había prestado poca atención al estrés oxidativo que ocurre durante este proceso. Se conoce muy poco sobre el daño causado por la deshidratación debido a la acentuación del estado oxidativo a las células.
Aunque la evolución ha convertido al oxígeno en un componente vital para los organismos aeróbicos, esta sustancia en exceso puede ser perjudicial (França et al., 2007). El daño químico, en forma de radicales libres, se ha identificado como una de las principales causas que conducen a daños por desecación. El estrés hídrico incrementa la formación de radicales, lo cual provoca peroxidación de lípidos, desnaturalización de proteínas, y daños en los ácidos nucleicos con severas consecuencias en el metabolismo general. El proceso de secado por sí mismo puede provocar desnaturalización de proteínas, lo que incide en la pérdida de actividad biológica después de la rehidratación (França et al., 2007).
La preservación de microorganismos por desecación, ha sido el método más empleado para su almacenamiento por un largo período de tiempo (Morgan et al., 2006). Aunque existen diversos métodos para el secado de los microorganismos, hay ciertos factores comunes que inciden en el éxito o no de dicho proceso; y que, a la larga, de ellos dependerá la buena conservación o no de la cepa microbiana en cuestión. Entre ellos, se encuentran: la fase de crecimiento, la concentración celular, la tolerancia a la desecación, el uso de agentes protectores, la metodología de secado, los procedimientos de rehidratación, y la forma de almacenamiento (Morgan et al., 2006).
Son varios los autores que han investigado la estabilidad y viabilidad de microorganismos después de haber sido secados. En este sentido, Poddar et al. (2014), investigaron la influencia de la técnica de secado (secado por aspersión, secado por congelación, y secado por lecho fluidizado) y el contenido de humedad en la estabilidad de almacenamiento de Lactobacillus paracasei 431 en una matriz de leche entera. También en Zhang et al. (2016), se estudió la influencia del medio de secado, adaptación al calor y temperatura de salida en la sobrevivencia de Lactobacillus salivarius NRRL B-30514 después de haber sido secado por aspersión y durante el almacenamiento subsiguiente. Además, Hamsupo et al. (2005), describieron un procedimiento para desarrollar un sistema modelo basado en la ecuación de Arrhenius para predecir la estabilidad del microorganismo termotolerante Lactobacillus reuteri KUB-AC5 secado por aspersión durante su almacenamiento por largo tiempo.
En Reyes (2017), se investigó los efectos de ciertos agentes de protección en la viabilidad de Lactobacillus plantarum NRRL B-4496 y Lactobacillus acidophilus NRRL B-4495, después de haber sido secados por aspersión y durante el almacenamiento a diferentes condiciones de almacenamiento. Zhu et al. (2016), investigaron la estabilidad durante el almacenamiento de Lactobacillus plantarum BM-1 obtenido mediante secado por atomización. Asimismo, Leung et al. (2018), estudiaron dos tipos de fagos de Pseudomonas, PEV 2 (Podovirus) y PEV40 (Myovirus) para elucidar la robustez del método de secado por aspersión y el diseño de formulación en la producción de polvos de fago inhalables, evaluando además la estabilidad del fago y el rendimiento de aerosol in vitro de los polvos después de 0, 1, 3 y 12 meses de almacenamiento a 4 y 20 ºC mediante empaque bajo condiciones de vacío.
Los autores Yonekura et al. (2014), evaluaron el empleo de varios aditivos como sustancias encapsulantes durante el secado por aspersión de Lactobacillus acidophilus NCIMB 701748 mediante la valoración de su impacto en la viabilidad celular y propiedades físico-químicas de los polvos secos, la viabilidad a lo largo de 35 días de almacenamiento a 25 ºC, y la supervivencia después de la digestión estimulada. Barbosa et al. (2022), evaluaron la viabilidad de Akkermansia muciniphila después de haber sido secada por aspersión durante el almacenamiento bajo condiciones aerobias a diferentes temperaturas (4 o 22 ºC), identificando y caracterizando el producto más efectivo. Otros autores han evaluado el comportamiento de la viabilidad celular de formulaciones en polvo de microorganismos durante su almacenamiento, específicamente de Lactococcus lactis (Martins et al., 2019); Lactobacillus kefir CIDCA 8348, Lactobacillus plantarum CIDCA 83114 y Saccharomyces lipolytica CIDCA 812 (Golowczyc et al., 2010); Lactobacillus pentosus (Hernández et al., 2018); Lactobacillus acidophilus NCIMB 701748 (Behboudi-Jobbehdar et al., 2013) y Lactobacillus reuteri (Jantzen et al., 2013).
Como un método tradicional, el cultivo en placa ha sido un método ampliamente aceptado para la detección de la viabilidad bacteriana por más de 100 años. Esta técnica fue descubierta por Robert Koch en 1881 para el cultivo, detección y cuantificación de bacterias viables. Una muestra contaminada puede ser colocada en una placa agar, seguida de la incubación por varios tiempos y temperaturas en dependencia de la especie de bacteria. Después de la incubación, las bacterias viables forman colonias, mientras que las no viables no lo hacen. Diferentes tipos de bacterias pueden formar colonias con diferentes formas, tamaños y colores. Los métodos dependientes del cultivo no solo suministran información acerca de la viabilidad bacteriana, sino que además son muy útiles para identificar bacterias. La cuantificación de bacterias viables usando métodos dependientes del cultivo requiere la aplicación de pasos manuales, tales como propagación de las muestras en la placa agar y conteo de colonias. Recientemente se han desarrollado instrumentos automáticos para realizar la propagación y se encuentran disponibles en el mercado, tales como Mikrostreak( y placas de espiral comerciales (Trinh & Lee, 2022).
En el Centro de Ingeniería Genética y Biotecnología (CIGB), de Camagüey, se produce actualmente un producto ecológico con acción bionematicida, en dos presentaciones: líquida (HeberNem-L®) y sólida (HeberNem-S®) a través de un proceso de fermentación sumergida de tipo diáuxico utilizando un sustrato rico en extracto de levadura y sacarosa (González et al., 2013). El principio activo de ambos productos es la bacteria Tsukamurella paurometabola C-924, cuya efectividad en el control de nemátodos ha sido evaluada previamente, obteniendo resultados favorables, especialmente en casas de cultivo protegidos (Mena et al., 2003). Se ha comprobado también que T. paurometabola C-924 tiene potencialidades in vitro como antagonista de varios hongos fitopatógenos (Marín et al., 2013a), y como agente promotor del crecimiento vegetal (Marín et al., 2013b).
Sin embargo, desde el año 2019 el nombre del microorganismo Tsukamurella paurometabola fue cambiado por Brevibacterium celere en virtud de la nueva reclasificación de la cepa C-924, de acuerdo con un análisis exhaustivo de datos experimentales, incluyendo morfología celular, características fisiológicas y bioquímicas y secuenciación de gen 16S rRNA bajo condiciones de laboratorio.
El HeberNem-L® tiene como inconvenientes el elevado volumen y peso que ocupa a la hora de ser almacenado, además de que su estabilidad a 4 ºC solo se mantiene durante un año. La formulación en polvo (HeberNem-S®) obtenida mediante un proceso de secado por aspersión, ocupa menos del 75 % en volumen que la formulación líquida, y su estabilidad a 4 °C se extiende a 24 meses (Hernández, 2009).
El proceso de envase del HeberNem-S( no es continuo, es decir, los volúmenes de polvo son almacenados en condiciones de temperatura ambiente (25 ± 3 ºC) hasta ser envasado al vacío. Durante el tiempo de espera puede existir una disminución de la viabilidad celular, por lo que se hace necesario conocer cómo se comportará la supervivencia del microorganismo sin condiciones de vacío y a temperaturas cercanas al ambiente. El presente estudio tiene como objetivo obtener un modelo matemático que permita estimar la viabilidad de la bacteria B. celere C-924 a las temperaturas de 16, 28 y 37 ºC y sin la aplicación de condiciones de vacío. Este estudio es muy importante y novedoso ya que permite calcular la viabilidad de esta bacteria en el tiempo a una temperatura dada mediante un modelo matemático, sin necesidad de realizar análisis experimentales, lo cual no se había implementado con anterioridad.
2. Metodología
2.1 Proceso de producción del polvo de HeberNem-S conteniendo la bacteria B. celere como ingrediente activo
La bacteria Brevibacterium celere C-924 fue aislada del medio ambiente sin someterla a ningún proceso para su modificación (Mena et al., 2002). El agente activo tendrá una concentración mayor que 1x1011 UFC/g en el producto final (polvo) (CIGB, 2019). Su acción nematicida se debe al efecto antagonista de esta cepa microbiana sobre los huevos y las larvas de nemátodos (Marin et al., 2010). Este antagonismo se produce fundamentalmente por la acción sinérgica de las quitinasas y sulfuro de hidrógeno producidas por esta bacteria (Mena et al., 2002).
El proceso de fermentación para producir la biomasa de B. celere consta de tres etapas: propagación del inóculo, fermentación sumergida y cosecha de biomasa. Todo el proceso de producción completo se realiza bajo buenas prácticas de fabricación en salas limpias con monitoreo ambiental y se llevan a cabo las operaciones de higienización, limpieza y esterilización para lograr las condiciones asépticas requeridas durante el proceso y evitar así la contaminación microbiana. Las muestras se toman bajo condiciones estériles según el plan de muestreo establecido, de acuerdo con el procedimiento aprobado para la etapa. Los puntos donde se toman las muestras, así como también los envases que contendrán las muestras, se encuentran bajo condiciones estériles, con el fin de evitar la contaminación y afectación de la muestra.
Se comienza con la siembra en placas en medio sólido a partir de un vial conservado en el Banco de Células de Trabajo, en glicerol al 20% a una temperatura de -70 ºC. Las placas son incubadas a 37 ºC por 72 h, mientras que el inóculo es preparado en seis frascos. Se codifican con un número de lote y solo serán usados en los próximos 15 días (Hernández et al., 2000). La bacteria B. celere C-924 se ha cultivado utilizando diferentes medios de cultivo. Hernández et al. (1998), describen el desarrollo de un medio denominado IA, constituido básicamente por compuestos carbono-nitrogenados, mientras que se ha estudiado el crecimiento de esta cepa en medios heterogéneos, a partir de suspensiones de levadura torula (Hernández, 2009).
Una vez inoculado el fermentador, el mismo operará bajo una temperatura de 37 °C, manteniendo el pH en 6,3 con una agitación de 500 rpm durante un tiempo de entre 10 a 12 horas (Hernández et al., 1998). Se ha reportado una velocidad específica de crecimiento µmax de 0,30 h−1 al cultivar la cepa C-924 en medio IA a 30 °C, en bioreactores de 5 L y 50 L (Hernández, 2002), y rendimientos en peso húmedo entre 70-76 g/L. Esta etapa se denomina fermentación de semilla.
Terminada la fermentación de semilla el cultivo pasa hacia la escala de 200 L (fermentación industrial) con un peso húmedo mayor de 50 g/L si se encuentra puro. Una vez que se haya inoculado el fermentador, el mismo operará a una temperatura de 37 °C, con ajuste de pH a 6,3 y agitación de 500 rpm, durante 56 horas. Betancourt (2006), reporta que este microorganismo se desarrolla de una manera óptima a 36°C, en un medio denominado SD, compuesto básicamente por extracto de levadura y sacarosa. Al cultivar B. celere C-924 en medio SD, se reporta un valor de µmax de 0,35 h−1, con rendimientos en peso húmedo de hasta 400 g/L en bioreactores de 200 L de volumen efectivo.
En González (2010), se propuso la tecnología de fermentación en escalado hasta un metro cúbico. Los parámetros de operación actuales y la composición del medio de cultivo fueron establecidos por este investigador.
La cosecha se realiza centrifugando todo el cultivo en dos centrífugas tubulares (CEPA Z-80) con un flujo de alimentación de 15 L/h. Se desecha el sobrenadante y se colecta la fase sólida (biomasa). La etapa de cosecha centrífuga de disco continua y en centrífuga tubular fue propuesta por (Hernández, 2009). El proceso de cosecha fue mejorado por (López, 2014), al proponer el lavado de la biomasa cuando se utilizan centrífugas de discos continuas. La crema lavada y concentrada pasa entonces al proceso de secado.
El proceso de secado de B. celere C-924 consta de dos etapas esenciales: preparación previa del alimentado y su posterior secado. La etapa de preparación previa del alimentado consta de formulación de la crema, transporte de fluido y precalentamiento; mientras que la de secado incluye atomización de la crema, contacto aire-gota, secado y separación del aire-polvo. El equipo fundamental de este proceso es el secador por aspersión (Anhydro) con atomizador de disco rotatorio, cuyo principio básico es el contacto del líquido formulado con el medio secante (aire). El aire suministra la energía para la evaporación y posterior absorción del solvente en forma de vapor (agua).
Etapa de preparación previa del alimentado: La crema lavada y concentrada es la materia prima principal de la etapa de formulación. Se añade sacarosa como aditivo para fortalecer los orgánulos de la pared celular y disminuir los daños al microorganismo durante el posterior proceso de secado (Hernández, 2009). La formulación se realiza en un intervalo de temperaturas entre 4 y 15 °C en un tanque enchaquetado provisto de agitación. El estudio realizado por (Fillor, 2013) demostró que a esa temperatura el microorganismo logra tener una supervivencia por encima del 95 % durante 9 días, tiempo máximo que puede durar el proceso de formulación. La formulación al 20 % de materia seca es agitada lentamente durante 12 horas, tiempo requerido para que la sacarosa actúe como agente protector de la membrana celular (Hernández, 2009). Transcurrido este tiempo la crema es bombeada a través de un intercambiador de doble tubo (Pérez et al., 2017) para ser precalentada hasta alcanzar una temperatura de 37 °C. Se establece esta temperatura en correspondencia con estudios realizados por Ramos (2011), el cual indica que las células producen proteínas en respuesta al estrés térmico. Al aumentar la temperatura se incrementa el flujo de entrada de la crema al secador haciendo más productivo el proceso (Mezhericher et al., 2015; Paneque, 2010). Una vez precalentada la crema se transporta hacia el interior de la cámara de secado utilizando una bomba tipo tornillo sinfín específica para sustancias viscosas y microorganismos, con un caudal de alimentación de 14 ±1 kg/h.
Etapa de secado: Consta de cuatro sub-etapas: La primera tiene lugar en el atomizador, en donde la corriente de líquido es dispersada por el atomizador en pequeñas gotas. La segunda consiste en la dispersión de las partículas en el aire (mezcla aire-líquido asperjado) lo cual tiene gran influencia en el secado de las partículas. La tercera etapa corresponde propiamente al secado y por último tiene lugar la recolección de los sólidos deshidratados (polvo). En el interior del secador la formulación es atomizada a 25 000 rpm lo que permite obtener un rociado de partículas en el orden de 50 a 100 µm, aumentando la superficie de contacto aire-gota. Ramos (2011), propuso esta velocidad de atomización luego de analizar la influencia de esta variable en la viabilidad de la crema atomizada. La gota atomizada se pone en contacto con una masa de aire caliente que se induce mediante un extractor y es calentada por un quemador de gas licuado alcanzando los 130 °C, donde comienza el secado de la gota que ocurre en dos períodos (Scenna, 1999). El primer período acontece a velocidad constante, donde toda el agua que se encuentra en la superficie de la gota es evaporada en un pequeño instante de tiempo. El segundo período es a velocidad decreciente, donde es extraída el agua del interior de la partícula atomizada a una temperatura de 60 °C (Masters, 1991). La partícula seca es arrastrada por la masa de aire hasta el ciclón donde ocurre la separación física del polvo y el aire, debido a la diferencia de densidad entre ellos. El polvo cae por gravedad directo a una vasija colectora mientras que el aire pasa a través de un filtro que garantiza que las partículas de polvo que quedaron en él no sean lanzadas a la atmósfera. El polvo colectado de forma manual es envasado al vacío en bolsas de 250 gramos de material tricapa, constituyendo el producto final (HeberNem-S().
2.2 Diseño de experimentos
El experimento se realizó con el objetivo de evaluar el comportamiento en el tiempo de la viabilidad del polvo de HeberNem-S( a las temperaturas de 16, 28 y 37 ºC sin aplicar condiciones de vacío. Se realizó un diseño de experimentos del tipo factorial multinivel con dos factores, los cuales son el tiempo y la temperatura, en donde el tiempo tuvo seis niveles separados por siete días, resultando en un tiempo total del estudio de 42 días, mientras que la temperatura se dividió en tres niveles, los cuales son 16, 28 y 37 ºC. Se seleccionaron estas temperaturas debido a que son las promedio encontradas a lo largo de todo un año en Cuba, en dependencia de la estación climatológica. Se procesaron un total de siete muestras, en donde a cada muestra se le determinó la viabilidad por duplicado, mientras que el experimento se realizó por triplicado. Se diseñó el experimento para obtener como resultado a qué temperatura y tiempo los valores de viabilidad comienzan a disminuir y por consiguiente obtener un rango de control óptimo para ambas variables, con relación a la viabilidad en la etapa de envase realizada sin vacío. La viabilidad de las diferentes muestras se realizó por conteo en placas utilizando el método de la gota (Herigstad et al., 2001). La supervivencia se determinó como la relación entre la viabilidad de cada muestra y la viabilidad al inicio del experimento. El diseño de experimentos fue elaborado con Microsoft Excel.
2.3 Propuesta de modelo matemático
Los resultados obtenidos en el diseño de experimentos fueron procesados en el paquete Microsoft Excel, el cual brinda las opciones matemáticas necesarias para obtener el modelo con mejor ajuste de regresión, considerando el valor obtenido del indicador R2, siendo esta la variable estadística a considerar.
3. Resultados y discusión
Con respecto al monitoreo del estado de anhidrobiosis en bacterias, sólo existen aislados informes al respecto. La mayoría de los autores describen la estabilidad de las células anhidrobióticas mediante modelos de primer orden (França et al., 2007; Achour et al., 2007; Ziadi et al., 2005; Ananta et al., 2005). Sin embargo, cada microorganismo tiene sus particularidades y características, y tanto para células desecadas como para células en suspensión líquida, los patrones de muerte térmica pueden ser distintos.
Los modelos de primer orden utilizados para evaluar la estabilidad de células desecadas, como es el caso en estudio, describen la degradación térmica y mecanismos de oxidación que ocurren en el interior de las células al ser sometidas a períodos de vida de estante o estabilidad.
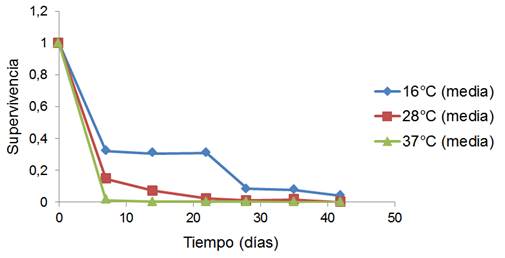
En la cinética descrita en este experimento (ver Figura 1) se observa que en los primeros 7 dias, bajo las diferentes temperaturas en estudio, ocurre una disminución significativa de la supervivencia, lo cual no coincide con lo reportado en estudios de estabilidad acelerada del mismo producto envasado al vacío (Hernández, 2009), lo cual puede estar relacionado con la presencia de oxígeno.
En las diferentes curvas de supervivencia obtenidas experimentalmente, se observa que pasados los 7 días la curva tiende a cambiar de pendiente bruscamente, lo que puede estar relacionado con la disminución de oxígeno en las bolsas utilizadas con sellaje hermético. En la Figura 1 también se puede apreciar que la supervivencia del microorganismo B. celere C-924 en el tiempo es mayor a las temperaturas más bajas, lo cual coincide con lo reportado por Golowczyc et al. (2010), en donde se establece que la temperatura es un parámetro crítico que afecta la supervivencia de microorganismos durante su almacenamiento, obteniendo las mayores tasas de supervivencia a temperaturas más bajas. Lo anterior también se reporta en Maciel et al., (2014), donde se observó que la viabilidad de una bacteria probiótica es superior si se almacena a 4 ºC en comparación con el almacenamiento a una temperatura superior (25 ºC). En Zhu et al. (2016), también se observó que el polvo obtenido mediante secado por aspersión de la bacteria probiótica Lactobacillus plantarum BM-1, presentó una viabilidad superior a una temperatura de almacenamiento de 4 ºC en comparación con la temperatura ambiente (20-23 ºC).
En Lapsiri et al. (2012), el incremento de la temperatura de almacenamiento hasta 25 ºC generó una pérdida significativa de viabilidad de la bacteria Lactobacillus plantarum TISTR 2075, hasta su muerte total después de los 4 meses de almacenamiento, en comparación con el almacenamiento de este microorganismo a 4 ºC. Otros autores (Hamsupo et al., 2005), reportan que la supervivencia de bacterias secadas por atomización depende fuertemente de la temperatura de almacenamiento, y que la viabilidad de almacenamiento se incrementa con el decrecimiento de la temperatura.
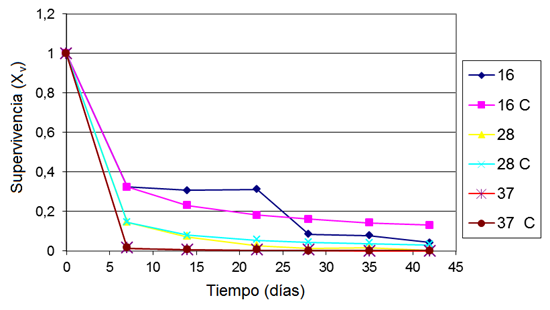
En la Figura 1 los valores calculados de supervivencia para cada tiempo y temperatura constituyen los promedios (o media) de las tres réplicas realizadas en ese punto. Para poder predecir la supervivencia en las diferentes condiciones de almacenamiento en las etapas del proceso, se aplicó un modelo matemático que describe la supervivencia en el tiempo, bajo las tres temperaturas de diseño (Figura 2). Las curvas que en la leyenda de la Figura 2 tienen la letra C son las curvas estimadas por el modelo matemático, mientras que las curvas sin la letra C constituyen los datos experimentales. En la Tabla 1 se muestran las ecuaciones de las tres curvas y el coeficiente de correlación lineal.
Tabla 1 Ecuaciones de las curvas de la Figura 2.
Dónde:
El modelo obtenido al que fueron ajustadas las diferentes curvas no son modelos lineales porque el coeficiente de correlación lineal presentaba un valor muy bajo, lo que traería un error por aproximación muy alto. Los modelos logarítmicos también presentaban un valor de R2 muy bajo, por tanto, se empleó un modelo combinado exponencial logarítmico que describe mejor las curvas de los resultados experimentales, ya que presenta un valor de R2 por encima de 0,96 (Tabla 1) siendo estos valores coherentes para el ajuste de las curvas de supervivencia. Para poder estimar los valores de supervivencia a temperaturas diferentes a la del estudio, se graficaron los valores de las pendientes de la Tabla 1, obteniéndose un modelo de los coeficientes de las pendientes de las tres curvas obtenidas en el modelo inicial.
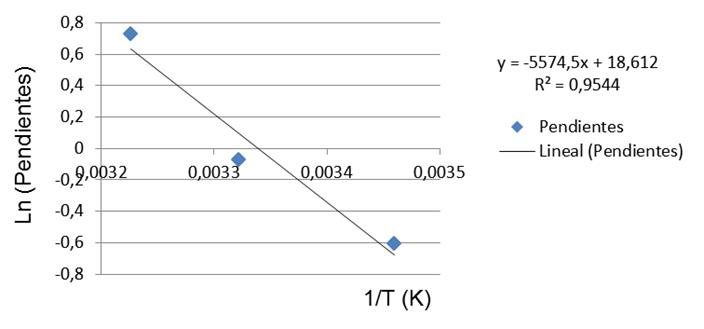
A los valores de las pendientes de la Tabla 1 se les aplicó el logaritmo natural, mientras que a las temperaturas se les aplicó el inverso, obteniendo un gráfico con tres puntos, el cual se ajustó a una curva de tendencia lineal debido a que el modelo exponencial no se ajusta adecuadamente a la curva obtenida. En contraste, el modelo logarítmico brinda un buen ajuste con un R2 de 0,9584, muy semejante al R2 obtenido mediante el ajuste lineal (0,9544), por lo cual se decide por los autores seleccionar el ajuste lineal del modelo por cuestiones de simplificación del proceso de ajuste de los datos obtenidos.
En la Figura 3 se muestran los tres puntos del coeficiente de las pendientes (Tabla 1) ajustado a una curva de tendencia lineal. Esta figura fue construida en Microsoft Excel aplicando el logaritmo natural de las pendientes (2,069, 0,930 y 0,544) y el inverso de las temperaturas en grados Kelvin (310, 301 y 289 K) los cuales son presentados en la Tabla 1. En esta figura se muestra la ecuación de ajuste de la recta con un coeficiente de regresión lineal de 0,9544.
Con la integración de las ecuaciones de la Tabla 1 y de la curva de la Figura 3, se obtuvo el modelo que describe el comportamiento de la supervivencia de la bacteria B. celere C-924 en dependencia de la temperatura y el tiempo:
Dónde:
Vale destacar que para la obtención de este modelo no se realizó el recálculo de las constantes debido a que el coeficiente R2 del modelo se encuentra por encima de 0.95. Con la obtención del modelo, y la simulación utilizando otras temperaturas, se puede establecer que el oxígeno tiene una alta influencia en la viabilidad del polvo. La supervivencia del polvo con presencia de oxígeno disminuye un 60 % en 1,5 días, a las temperaturas inferiores a 28 ºC,y disminuye ese mismo valor pero a la temperatura de 37 ºC en 9 horas. Este aspecto tendrá que tomarse en cuenta en el proceso del envase del producto, para lograr una mayor viabilidad del producto en el tiempo.
Los autores Hernández et al. (2007), desarrollaron un método para determinar el orden de muerte celular para la bacteria Tsukamurella paurometabola C-924 (denominada en la actualidad Brevibacterium celere C-924), almacenada a bajas temperaturas, en donde los polvos almacenados al vacío mostraron un comportamiento ajustado a la ecuación de Arrhenius con respecto a la cinética de muerte celular. En este estudio, el gráfico de Arhenius fue ajustado a una línea recta para los polvos almacenados bajo condiciones de vacío en el intervalo de 4 - 32 ºC, en donde la ecuación obtenida fue la siguiente:
Con un valor del coeficiente R2 de 0,9435, y con una energía de activación calculada a partir de la pendiente de este gráfico de (E# = 8,75 kcal/kmol. En este estudio los polvos expuestos al aire (esto es, sin aplicar vacío) no tuvieron un comportamiento ajustado a Arrhenius, el cual puede ser debido a la transición vítrea.
En Hamsupo et al. (2005), se estableció un sistema de modelo para predecir la viabilidad de la bacteria Lactobacillus reuteri KUB-AC5 durante el almacenamiento a largo plazo basado en la ecuación de Arrhenius, y verificada mediante datos experimentales, debido a que la viabilidad de las células durante el almacenamiento pueden ser correlacionadas con la temperatura de almacenamiento. El modelo obtenido en este trabajo fue el siguiente:
Con un valor del coeficiente R2 de 0,995.
En Lapsiri et al. (2012), se desarrolló un modelo de predicción dependiente de la temperatura basado en la ecuación de Arrhenius para determinar la viabilidad del polvo de Lactobacillus plantarum TISTR 2075, obtenido mediante secado por atomización en diferentes agentes protectantes, para el almacenamiento a largo plazo. Los modelos obtenidos fueron los siguientes, en dependencia del agente protectante utilizado, mientras que también se muestra el valor del coeficiente para la ecuación pertinente:
1. Protectante: Maltodextrina DE 10.
R2: 0,994
2. Protectante: Maltodextrina DE 10 + Trehalosa.
R2: 0,989
3. Protectante: Maltodextrina DE 10 + proteína de soya aislada y concentrado de proteína de leche.
R2: 0,986
4. Protectante: Maltodextrina DE 10 + Fibersol-2.
R2: 0,993
5. Protectante: Maltodextrina DE 10 + goma acacia.
R2: 0,997
En Bommasamudram et al. (2022), se investigó la influencia de la aplicación de estrés térmico subletal en la supervivencia de la bacteria probiótica Lacticaseibacillus casei N durante el secado por atomización y en su posterior almacenamiento a 4 ºC por 90 días, en donde se obtuvo como resultado que los polvos del probiótico sujetos a estrés térmico subletal mostraron una mejor supervivencia y una estabilidad mejorada después de los 90 días de almacenamiento a 4 ºC de temperatura.
4. Conclusiones
En este trabajo se obtuvo un modelo matemático que describe el comportamiento de la supervivencia de la bacteria B. celere C-924 a temperaturas cercanas al ambiente y sin aplicar condiciones de vacío, determinándose además que el oxígeno tiene una elevada influencia en la supervivencia del microorganismo durante los primeros seis días de exposición del mismo a este compuesto químico. También la supervivencia de B. celere C-924 en el tiempo es superior a las temperaturas de almacenamiento más bajas, lo cual coincide con lo reportado por la literatura.