Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Revista Cuidarte
versão impressa ISSN 2216-0973
Rev Cuid vol.2 no.1 Bucaramanga jan. 2011
https://doi.org/10.15649/cuidarte.v2i1.62
http://dx.doi.org/10.15649/cuidarte.v2i1.62
Artículo de reflexión
Consideraciones éticas del rol de la enfermería en la coordinación de estudios clínicos1
Ethical Considerations of the Nursing Role in the Coordination of Clinical Studies
Miriam Jaramillo-Jiménez2, Paola Delgado-Tarazona3, María Stella Campos de Aldana4
1 Artículo de Reflexión.
2 Estudiante Décimo Semestre de Enfermería Universidad de Santander - UDES. Bucaramanga, Colombia.
3 Enfermera Egresada Universidad de Santander - UDES, Coordinadora de Estudios Clínicos Unidad de Investigación y eEducación del Instituto del Corazón de Bucaramanga. Bucaramanga, Colombia.
4 Licenciada en Enfermería: Universidad Industrial de Santander- Enfermera Ortoneuro-Rehabilitación: Jackson Memorial Hospital, Miami. USA- Especialista en Gerencia Social: Universidad Antonio Nariño- Especialista en Salud Ocupacional: Universidad Manuela Beltrán- Enfermera MSc en Salud Familiar: Universidad Nacional de Colombia- Docente Universidad de Santander - UDES. Bucaramanga, Colombia.
Autor para Correspondencia: Miriam Elena Jaramillo Jiménez, Teléfono: 3188700409, E- mail: miriamjaramillo@gmail.com.
Articulo recibido el 30 de Octubre de 2011 y aceptado para publicación el 22 de Noviembre de 2011
Resumen
Introducción: A nivel mundial, el fenómeno de la investigación en el área de la salud está en ascenso, con la aparición de nuevos protocolos de ensayos clínicos la sociedad se está viendo obligada a garantizar la seguridad de sus pacientes participantes, cumpliendo con las consideraciones legales, éticas y derechos fundamentales vigentes. De esta manera se asegura un cumplimiento de los principios éticos durante todo el desarrollo de un estudio de investigación. Es en éste escenario donde la Enfermera a cargo de la coordinación de estudios, tiene una gran responsabilidad e importancia por la naturaleza de su profesión, que es el cuidado en el ser humano. Materiales y Métodos: Mediante una búsqueda de literatura científica usando las palabras claves: bioética, investigación y estudios clínicos, se realiza un análisis de los fundamentos éticos que están involucrados en el desarrollo de la investigación, con énfasis en la disciplina de Enfermería y en la coordinación de estudios clínicos. Resultados: Se logró evidenciar que a nivel mundial existen varias herramientas que protegen la integridad de los individuos participantes en estudios clínicos, siendo las más relevantes a nuestro parecer: El Código de Nüremberg, La Declaración de Helsinki, Las Guías De Buenas Prácticas Clínicas, códigos deontológicos de Enfermería y la regulación nacional; así mismo se encontró que existe controversia a nivel mundial en cuanto al uso del placebo, sin embargo existen recomendaciones puntuales que justifican su uso. Discusión y Conclusiones: Durante el desarrollo de estudios clínicos el enfermero puede verse enfrentado a dilemas éticos, por lo que es importante la formación de competencias y habilidades que aseguren la toma de decisiones asertivas acerca del bienestar del paciente y cumplimiento de la normatividad. Por lo anterior se recomienda la realización de cursos dirigidos al conocimiento de las nuevas reglamentaciones vigentes y Guías de Buenas Prácticas Clínicas. (Rev Cuid 2011; 2(2): 230-35)
Palabras clave: Ética, Enfermería, Investigación, Estudios Clínicos. (Fuente: DeCS BIREME).
Abstract
Introduction: Worldwide, the research phenomenon on health areas is increasing, with the emergence of new clinical trial protocols, the society is being forced to ensure in a stricter way the safety of their patients who participate, comply with the legal, ethical and actual fundamental rights. This ensures compliance with the ethical principles throughout the development of a research study. This is where the Nurse clinical research coordinator, takes great importance by the nature of your profession, which is the care and your active participation in all processes that lead to the improvement and maintenance of health, recovery and rehabilitation of the disease. Materials and Methods: Through a search of the literature using the key words: bioethics, research and clinical studies, is presented an analysis of the major ethical foundations that are involved in the development of research, with emphasis on the discipline of nursing and coordination of clinical studies. Results: It was possible to observe that globally there are several tools that protect the integrity of the individuals who participate in clinical trials, the most important in our view are: The Nuremberg Code, the Declaration of Helsinki, Good Clinical Practice Guides, Nursing ethics codes and national regulation.It was found that there is worldwide controversy about the use of placebo; however there are specific recommendations that justify its use. Discussion and Conclusions: During the development of clinical studies, the nurse may be confronted with ethical dilemmas; it realizes the importance of the formation of competencies and skills that ensure assertive decision to established patient comfort and compliance with regulations. Hence it is recommended to conduct courses for the new knowledge of current regulations and Good Clinical Practice Guidelines.
Key words: Ethics, Nursing, Research, Clinical Studies. (Source: DeCS BIREME).
Introducción
La investigación clínica desde sus inicios ha generado gran polémica por las implicaciones éticas que esto conlleva. Una de estas controversias se destaca por los excesos cometidos con el pueblo judío en la segunda guerra mundial, a quienes les realizaban pruebas de investigación de forma indiscriminada sin marco legal ni ético (1). A partir de esto se han creado regulaciones que buscan la protección de los sujetos implicados en estudios clínicos como el código de Nüremberg el 20 de agosto de 1947, que nace como producto del juicio celebrado a los médicos y militares que participaron de dichas investigaciones, La Declaración de los Derechos Humanos por la Organización de las naciones unidas en 1948, la declaración de Ginebra de 1948, la declaración de Helsinki de 1964 por la asociación médica mundial, entre otros.
A nivel mundial, los estudios de investigación clínica han avanzado aceleradamente logrando mejorar la calidad de vida de las personas proponiendo tratamientos innovadores académicamente aprobados. Cabe resaltar que el personal encargado de la dirección y el desarrollo de estos, debe estar capacitado en los procesos regulatorios y en los principios éticos que esto involucra.
Es así que en las últimas décadas el Enfermero ha venido desempeñando coordinación de estudios clínicos, rol que es de real importancia y responsabilidad, debido a que debe fomentar y garantizar la defensa de los derechos fundamentales de los individuos que participan, y así mismo, asumir la responsabilidad de mantener un marco ético para que el desarrollo del estudio garantice el bienestar y beneficio en el manejo del proceso de la enfermedad y el respeto de los participantes.
Por tanto, en este artículo pretendemos resolver las siguientes preguntas:
1. ¿Definición de un estudio clínico de investigación, quienes son sus miembros?
2. ¿Qué fundamentos éticos existen para realizar investigaciones clínicas?
3. ¿Qué implicaciones éticas tiene la enfermera en la coordinación de estudios clínicos?
Para ello, se ha realizado una exploración de la literatura científica sobre bioética, investigación y normatividad, teniendo en cuenta las palabras claves: Ética, enfermería, investigación, estudios clínicos. Los artículos encontrados y analizados, permiten sustentar la argumentación expuesta en este artículo y adicionalmente se expone la experiencia de enfermeros(as) coordinadores(as).
1. ¿Definición de un estudio clínico de investigación, quienes son sus miembros?
El estudio clínico de Investigación es la herramienta mediante la cual se implementa el método científico para plantear, resolver y justificar hipótesis terapéuticas. De acuerdo al objetivo propuesto y las hipótesis conocidas, se decide diseñar el estudio, su protocolo, manual de procedimientos, y establecer los desenlaces a buscar. En cuanto al tipo de estudio; su selección se fundamenta la manera de medición de desenlaces, en la dirección del tiempo, entre otros.
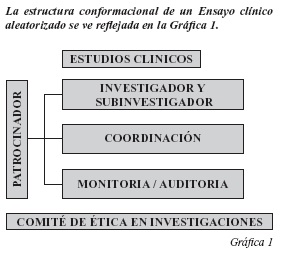
Para este artículo nos vamos a concentrar en el tipo de estudio que requiere mayor vigilancia clínica, ética y legal, y a su vez requiere de mayor inversión en términos económicos; que son los estudios de analíticos tipo Ensayos clínicos Aleatorizados.
El patrocinador del estudio ó Laboratorio clínico en la mayoría de los casos: este asegura la dirección, conducción y desarrollo del estudio por medio de apoyo en su financiación, y en el caso de ser el mismo laboratorio clínico otorgando la medicación del estudio. El Investigador principal: es el encargado que el desarrollo del estudio clínico, cumpla con las condiciones instauradas en el manual y protocolo de investigación, este a su vez puede ser reemplazado por el sub-investigador en caso que no pueda estar presente en la ejecución de alguna actividad que lo involucre.
Coordinador de estudios clínicos, es dirigido bajo la supervisión inmediata del investigador principal y es responsable de la conducción de las actividades del estudio como asegurar la asistencia de los pacientes a las visitas programadas, el cumplimiento y adherencia de los mismos a los procedimientos pactados en el protocolo de investigación, buenas prácticas clínicas y regulaciones locales.
Monitores: Cumplen la función de auditar el curso del estudio clínico para que trascurra como está indicado en el protocolo y sirven como puente entre el centro de investigación y los patrocinadores del mismo.
Las unidades que regulan los estudios son: el Instituto Nacional De Vigilancia De Medicamentos Y Alimentos (INVIMA) y el comité de ética e investigaciones de alguna institución avalada por el INVIMA.
2. ¿Qué fundamentos éticos existen para realizar investigaciones clínicas?
La ética es la ciencia que fundamenta el comportamiento del ser humano para adecuarlo al bien del universo, la sociedad y el individuo (2), esta debe dar argumentos racionales para sustentar los comportamientos referidos de un valor moral. Desde este punto de partida se puede afirmar que los valores son estructuras de la conciencia sobre las cuales el individuo se adapta e interactúa en el universo. Existen profesiones de mayor connotación social que realizan adecuaciones de los principios de la ética en general, es decir que apropian los principios morales a las características particulares de cada una de ellas, de allí nacen los códigos deontológicos de cada una de estas disciplinas (3). Estos códigos son pilar esencial en el ejercicio de cualquier investigación, fundamenta el respeto de nuestro que hacer y lo delimita a la formación universitaria que compete.
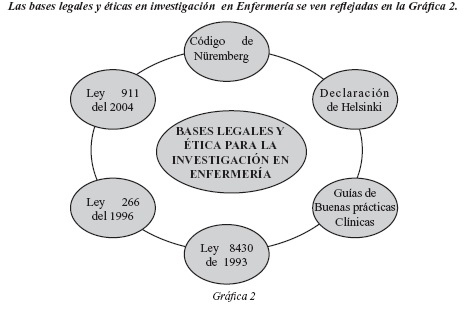
Dentro del marco legal de enfermería en Colombia encontramos la ley 911 de 2004 por la cual se dictan disposiciones en materia de responsabilidad deontológica para el ejercicio de la profesión, se establece el régimen disciplinario correspondiente y se dictan otras disposiciones (4). Enuncia los principios éticos de Beneficencia, No-Maleficencia, Autonomía, Justicia, Veracidad, Solidaridad, Lealtad y Fidelidad que orientan el ejercicio de nuestro que hacer, más adelante se hará un hincapié en cada una de ellas. Encontramos también la ley 266 de 1996 donde enuncian los principios de la práctica profesional que también son principios y valores fundamentales que la Constitución Nacional consagra, como la integralidad, individualidad, dialogicidad, calidad y continuidad (5). La integralidad orienta el cuidado de enfermería a la persona, familia y comunidad, de visión unitaria para atender sus dimensiones física, social, mental y espiritual. Teniendo en cuenta como lo menciona La Doctora Rose Mary Risso Parse, teorista de Enfermería "El ser humano no pude separarse de las relaciones con el universo" (6) y entender que el individuo hace parte de un contexto en el cual su rol es de gran importancia. Encontramos otro principio como la individualidad que asegura la atención teniendo en cuenta las características socioculturales, históricas y de los valores. La dialogicidad fundamenta la relación enfermera paciente, familia, comunidad como elemento esencial para una comunicación asertiva. La calidad orienta el cuidado de enfermería de forma eficiente y efectiva.
A nivel nacional encontramos en el capítulo 1 de la resolución N° 008430 de 1993 los aspectos éticos de la investigación en seres humanos, la cual refiere que debe prevalecer el criterio de respeto a la dignidad, la protección de los derechos y bienestar en los individuos participantes en un estudio clínicos, a su vez, estos deberán realizarse por profesionales con conocimiento y experiencia para cuidar la integridad del ser humano, de igual forma el sujeto debe diligenciar el consentimiento informado el cual deberá presentar de forma clara la naturaleza de los procedimientos, beneficios, riesgos a que se someterá, con la capacidad de libre elección y sin coacción alguna (2).
En muchas unidades de investigación encontraremos que los coordinadores de estudios clínicos no son específicamente enfermeros (as) de igual forma la regulación que fundamenta éticamente la investigación clínica debe ser conocida claramente por éstos. A continuación mencionaremos las que consideramos más relevantes para su ejercicio.
El código de Núremberg del 20 de agosto de 1947 fue de las primeras políticas internacionales para guiar las investigaciones dentro de marcos éticos y en bien de los individuos que participan en estas, resaltando que dichas prácticas son para el bien de la humanidad y que no existe otra manera de probarlas.
Como lo habíamos mencionado el código nace a raíz del juicio realizado a los médicos nazis quienes realizaron investigaciones en seres humanos sin soporte legal ni ético y en consecuencia la preocupación de la humanidad por estas prácticas deliberadas. En éste principalmente se establece el consentimiento voluntario del sujeto humano (7), según la Real Academia de la Lengua Española, consentimiento se refiere a la manifestación de voluntad, expresa o tácita, por la cual un sujeto se vincula jurídicamente (8). En investigación se puede mirar de dos puntos de vista: legal y ético, pero ¿cuál sería más relevante de los dos? En efecto si es investigador sería un requisito primordial para poner en marcha cualquier protocolo, pero va más allá de una exigencia, son las pautas morales que indican que es imprescindible que los sujetos quieran pertenecer a dicho estudio, sin amenazas que finalmente violen los principios fundamentales como el de la Autonomía.
Otro pilar fundamental es la declaración de Helsinki de 1964 para la realización de cualquier investigación con seres humanos. Ha nuestro parecer La Declaración de Helsinki no es un manual de procedimientos sino que representa un conjunto de principios, una guía del ideal ético al cual todos los involucrados en la investigación clínica (investigadores, patrocinadores, comités de ética y autoridades regulatorias) deberíamos tomar como referencia para intentar acercarnos" (9). Se sustentan en ésta las investigaciones en seres humanos como necesidad del avance científico pero enmarcado en la protección de los individuos primando ante el bien de la humanidad. Para cualquier actividad en investigación con seres humanos la declaración formula una serie de pautas a tener en cuenta. Entre los requisitos que plantea, que como punto de partida el proyecto o investigación y método debe formularse claramente en un protocolo experimental, el cual debe ser evaluado y aprobado por un Comité de Ética Institucional (10). Los investigadores deberán ser personas preparadas científicamente los cuales darán parte al comité del transcurso de la investigación y siempre debe primar el beneficio que el riesgo, el cual debe ser evaluado con anterioridad. Las personas que participan de los estudios deben como lo menciona el Código de Nüremberg dar consentimiento de su participación y pueden retirarse cuando ellos a si lo quieran, de igual forma las personas incapaces o inhabilitadas física o mentalmente de otorgar el consentimiento, el investigador debe obtenerlo del representante legal; las razones para que estos participen debe estar estipuladas y fundamentadas científicamente en el protocolo (9). Una de las pautas que describe la declaración enmarca cuidadosamente la realización de estudios clínicos controlados con placebo y en la última clarificación realizada en el 2002, la Asociación Médica Mundial (AMM) expresa que se debe tener mucho cuidado al utilizar ensayos con placebo, estos son aceptados éticamente en ciertos casos , cuando por razones metodológicas, científicas su uso es necesario para determinar la eficacia y la seguridad de un método preventivo, diagnóstico o terapéutico (9); Cuando se prueba un método preventivo, diagnóstico o terapéutico para una enfermedad de menos importancia que no implique un riesgo adicional, efectos adversos graves o daño irreversible para los pacientes que reciben el placebo (9).
El artículo "La ética del placebo" el autor realiza una analogía interesante al expresar "Los ensayos clínicos controlados con placebo son, sin duda, el estándar ideal para la obtención de los más altos niveles de evidencia para probar la eficacia de una intervención, tal como la Declaración de Helsinki es el patrón de oro para los aspectos éticos en la investigación médica" (11) y aunque sustenta aparentemente el uso del placebo hace referencia a la gran polémica por el uso de éstos y ligada al aspecto del retiro del tratamiento, específicamente a los considerados probados y estándar. Consideramos importante mencionar como lo cita el García Marzá que el uso del placebo está sustentado científica y éticamente si existen terapias efectivas no probadas o que las ya probadas presentan efectos adversos serios (11).
Hacemos hincapié en el uso del placebo ya que como coordinadores (as) y enfermeros (as) hacemos uso y entrega del mismo, por lo cual es de suma importancia conocer bien la fundamentación científica, ya que como lo mencionáramos con anterioridad somos protectoras de la vida y el bienestar del individuo ante cualquier interés. De igual forma La International Conference on Harmonization (ICH) el 1 de mayo de 1996 adoptaron los lineamientos de las Buenas Prácticas Clínicas y actualmente son utilizadas como guía en los estudios clínicos que evalúan la seguridad y eficacia de los medicamentos ya que son un estándar de calidad ética y científica. En las cuales garantizan la protección de los derechos del individuo y están realizados en base a la declaración de Helsinki anteriormente citada (12).
3. ¿Qué implicaciones éticas tiene la enfermera en la coordinación de estudios clínicos?
No solo es prescindible tener resoluciones, leyes y/o tratados, es de suma importancia la posición personal; la ética y nuestro comportamiento nacen de tener claro que es el bien y el mal y es el punto de partida para el ejercicio de nuestra labor como enfermeros (as) teniendo en cuenta los valores personales y profesionales. También es de suma importancia la formación profesional en el pregrado para que el Enfermero cuente con las bases necesarias para tomar decisiones ante un dilema ético, como lo menciona Muñoz de Bermúdez O que tenga libertad de conciencia, de manera que esté en capacidad de rechazar situaciones que vayan en contra de su formación moral (13).
La enfermería en el desarrollo de la investigación experimental juega un papel muy importante, su desempeño en la coordinación y dirección de los estudios clínicos le implica desde el inicio, conocer y aplicar los principios éticos como el de beneficencia, en este caso la enfermera debe permanecer orientada siempre a proteger los deberes y derechos de los pacientes, velar porque el sujeto potencial a ingresar en un estudio clínico sea elegible, asegurándose que cumple todos los criterios de inclusión y que de algún modo tenga un beneficio para el mejoramiento en su tratamiento de la enfermedad y calidad de vida. Consideramos que la mayoría de los sitios que desarrollan investigación clínica han presenciado el caso de tener sujetos elegibles pero no incluibles, aquí debemos detenernos y pensar si el beneficio para este sujeto es mayor que los riesgos teniendo claro que prioriza el bienestar del paciente sobre el proceso investigativo y nuestros propios beneficios, es decir, que no debemos incluir pacientes por aumentar el número y cumplir nuestro compromiso con el patrocinador de una determinada cantidad de pacientes y llevarnos el reconocimiento de ser los mejores, olvidando que estos actos van a generar un cambio en los resultados, estropeando la investigación que finalmente busca generar un bien para la sociedad en general.
Por otro lado el Enfermero(a) debe velar porque el sujeto realmente entienda el contenido del formato de consentimiento informado, es decir que comprenda las implicaciones de su participación, en que procedimientos va a participar, que debe hacer o cumplir y si la medicación asignada puede o no generarle mejoría en el proceso de tratamiento de su enfermedad, a que riesgos está expuesto y que la decisión de su participación sea voluntaria y no coaccionada por alguien o algo.
En el principio de Justicia en la investigación debemos asegurar la igualdad de condiciones y oportunidades a los sujetos de recibir los cuidados y tratamientos, al igual que debemos asegurar que los sujetos participantes conozcan y entiendan que existen otros tratamientos diferentes a los que pueden optar para su recuperación y/o control de la enfermedad.
Discusión
Los estudios de investigación están presentando un incremento acelerado a nivel mundial, inclusive a nivel nacional. Las incógnitas que surgen después de analizar las guías de buenas prácticas clínicas y la extensa normatividad vigente es; Realmente en todos los centros donde se realizan estudios de investigación, se están cumpliendo las normas y códigos éticos establecidos?
Durante el desarrollo del artículo pudimos observar una polémica interesante entre los que piensan que existen implicaciones éticas en el desarrollo de estudios que en su metodología incluyen control con placebo, suscitando que existen investigaciones que suspenden la medicación tradicional y los que sustentan que el control con placebo es la mejor manera de evidenciar y sustentar una intervención; y es realmente un punto de vista muy difícil de abordar ya que se pueden ver involucrados conflictos de intereses.
Conclusión
Los profesionales de la salud en centros de investigación deben conocer bien los fundamentos éticos mundiales, reglamentación nacional y guías de Buenas Prácticas Clínicas, para no realizar actos deliberados, gestionando el cumplimiento de estos principios y el mantenimiento del marco ético de la investigación por parte de todo el equipo que interviene. A sí mismo es primordial, conocer la fisiología y actividad bioquímica de los fármacos en prueba, para ofrecer un cuidado integral a la persona participante.
Agradecimientos
Al Dr. Edward Cáceres por su gran colaboración en asesoría y edición del artículo.
Referencias bibliográficas
1. Fraile Duicq C. Ciencia, ética y enfermería. Rev. CIENCIA Y ENFERMERIA 2002; 8 (1):9-14. [ Links ]
2. Vélez Correa L. Ética médica, interrogantes acerca de la medicina la vida y la muerte. 3ª ed. Medellín, Colombia: Editorial CIB; 2003. [ Links ]
3. Amaro Cano M. Problemas éticos y bioéticos en enfermería. La Habana: Editorial Ciencias Médicas; 2005. [ Links ]
4. Colombia. Ley 911 de 2004. Octubre de 2004 Diario oficial año CXL. N. 4569. Pág. 22. [ Links ]
5. Colombia. Ley 266 de 1996 del 5 de febrero de 1996. Diario Oficial No. 42.710. [ Links ]
6. Alligood M. Marrinier A. Modelos y teorías en enfermería. 7 ed. España: Elsevier; 2011. [ Links ]
7. Penchaszadeh, Víctor B. Ética de las investigaciones biomédicas en poblaciones humanas. Rev Cubana Salud Pública. 2002, vol.28, n.2, 2011-10-17, pp. 149-156. Disponible en: <http://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S0864-34662002000200005&lng=es&nrm=iso>. ISSN 0864-3466. [ Links ]
8. Diccionario de la lengua española Vigésima segunda edición 2009. [ Links ]
9. Klimovsky E, Saidon P, Nudelman L. Declaración de Helsinki sus vicisitudes en los últimos cinco años. Medicina (B. Aires) [revista en la Internet]. 2002 Ago. [citado 2011 Oct 17]; 62(4): 365-370. Disponible en: http://www.scielo.org.ar/scielo.php?script=sci_arttext&pid=S0025-76802002000400014&lng=es. [ Links ]
10. García Marzá D. La apuesta ética en las organizaciones sanitarias. 3 ed. Publicaciones de la universidad Jaume; 2005. [ Links ]
11. Padilla Ygreda J. La ética del placebo, Rev. peru. pediatr., set./dic. 2007, vol.60, no.3, p.195-197. ISSN 1993-6826. [ Links ]
12. Mendoza Patiño N. Farmacología médica. Editorial Médica Panamericana: Universidad Autónoma de México, Facultad de Medicina; 2008. [ Links ]
13. Muñoz De Bermúdez O. Libertad de conciencia en el currículo oculto de la Facultad de Enfermería. Medicina (Colombia) Repertorio de Medicina y cirugía. 2000 Agosto. Facultad de Enfermería Fundación Universitaria de Ciencias de la Salud Bogotá-Colombia. [ Links ]