Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Revista Cuidarte
versão impressa ISSN 2216-0973
Rev Cuid vol.8 no.1 Bucaramanga jan./abr. 2017
https://doi.org/10.15649/cuidarte.v8i1.373
Articles
APLICAÇÃO DA RANDOMIZAÇÃO MENDELIANA: PODEMOS ESTABELECER FATORES DE RISCO CAUSAIS PARA A DIABETES TIPO 2 EM PAÍSES DE BAIXA E MÉDIA RENDA?
1BSc, Integrative Epidemiology Unit, University of Bristol, Bristol, United Kingdom. Corresponding author, E-mail: ryan.langdon@bristol.ac.uk
2 PhD, Integrative Epidemiology Unit, University of Bristol, Bristol, United Kingdom, E-mail: kaitlin.wade@bristol.ac.uk
A carga global da diabetes tipo 2 (T2D, por suas siglas em inglês) está aumentando, em parte facilitado por um aumento acentuado da doença em países de baixa e média renda (LMICs, por suas siglas em inglês)1,2. LMICs não só mostra uma alta prevalência da DT2 (8.7%), senão que ainda tem mostrado um incremento muito mais rápido na sua prevalência nos últimos 30 anos quando comparada com os países com renda alta (HICs, por suas siglas em inglês)1. Os fatores de risco convencionais para a T2D nos HICs, tais como o índice de massa corporal elevado (BMI, por suas siglas em inglês)3, baixos níveis de atividade física4, e comportamentos alimentares maus5, não são completamente responsáveis pelo grande incremento na prevalência do T2D nos LMICs2. Por tanto, os fatores de risco para a T2D especificamente dentro do âmbito dos LMIC precisam ser determinados.
Atualmente, análises epidemiológicas observacionais estão sendo usadas para explicar a prevalência crescente e determinar os fatores de risco notáveis para a T2D nos LMICs, porém ainda estando bem desenhados, esses estudos tendem a ter confundimento, causalidade reversível e múltiplas fontes de viés (p.ex. seleção e mensuração)6. Sendo assim, estes desenhos de estudo podem potencialmente gerar estimativos de causalidade pouco fiáveis entre um fator de risco e uma doença. Uma abordagem mais robusta para superar estas limitações e melhorar a inferência causal é a randomização Mendeliana (MR, por suas siglas em inglês)6,7.
Sucintamente, resultando das analises de variáveis instrumentais (IV, por suas siglas em inglês) em econometria, a MR explora a primeira e a segunda lei de herança de Mendel (isto é, o sortimento e segregação independente dos alelos que leva à distribuição aleatória dos genótipos na população) favorecendo o uso das variantes genéticas para serem usadas como substitutos para uma caraterística clínica (p.ex. BMI)6,7, relevante (e geralmente modificável). Previstas um número de premissas chave que se cumprem (Figura 1), estas IVs genéticas podem ser usadas para obter o efeito causal em uma caraterística na doença ou desfecho adverso de saúde, conferindo múltiplas vantagens sobre os estimados de associação derivados das análises epidemiológicos observacionais.
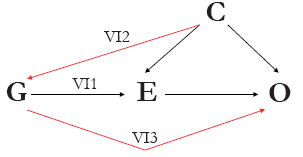
Figura 1 Grafo acíclico dirigido (DAG, por suas siglas em inglês) da teoria e premissas da randomização Mendeliana. A variante genética (ou variantes, G) podem ser usadas como variáveis instrumentais para uma exposição de interesse (E) para avaliar a associação causal entre E e o desfecho do interesse (O) dado que as próximas três premissas contêm: (IV1) G deve estar fortemente associada com E; (IV2) G não deve estar associada com nenhuma variável de confusão mensurada ou não mensurada (C); e (IV3) não deve haver uma associação independente entre G e O, dadas E e C.
Análogo aos braços de um ensaio clínico randomizado (RCT, por suas siglas em inglês), as variantes genéticas usadas na MR são amplamente independentes de fatores de confusão devido à natureza aleatória da sua distribuição dentro da população. Elas também não são modificadas pelo desenvolvimento tardio da doença ou desfechos de saúde. (Figura 2) e, com a vinda de variedades de genótipos mais precisos, o erro na mensuração é grandemente reduzido. Consequentemente, ao nível da população, a porção da variância na característica modificável por variantes genéticas usadas como uma IV (diferentes da mensuração direta da caraterística) é livre de limitações as quais de outra forma debilitam a inferência causal nos estudos observacionais. A MR fornece uma robusta, estimativa não confundida da associação causal entre a característica e a doença(6,7.
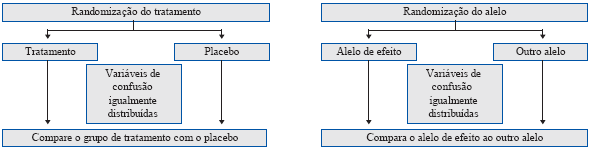
Figura 2 A metodologia da randomização Mendeliana comparada com ensaios clínicos randomizados (RCTs, por suas siglas em inglês). Em um RCT, os indivíduos são randomizados para ambos os braços, tratamento ou controle (placebo), os quais teoricamente garantem que os fatores de confusão sejam distribuídos igualmente entre os braços do ensaio. Similar a isto, a alocação aleatória e variedade independente de alelos na concepção e a meiose, respetivamente garantem que os fatores de confusão sejam distribuídos igualmente entre os grupos de genótipos. As diferenças nos indivíduos entre grupos de genótipos diferirão só devido ao grupo de genótipo; logo, podemos usar variantes genéticas como variáveis instrumentais para exposições de interesse nas análises de randomização Mendeliana.
No contexto dos HICs, a MR há confirmado e identificado fatores de risco endógenos para a T2D incluído a obesidade, inflamação sistêmica y lipídios no sangue, e fatores de risco exógenos incluído o álcool e o consumo de lácteos8,9. Por exemplo, o uso da MR em uma avaliação abrangente recente da associação causal entre o BMI e a T2D produziu estimativas causais aprimoradas as quais sugeriam que o risco da T2D se incrementou em aproximadamente 30% com cada unidade (kg/m2) no BMI (razão de chances (OR, por suas siglas em inglês): 1.26, intervalo de confiança de 95% (CI, por suas siglas em inglês): 1.19, 1.32; P=3.29x10-10)10. Contudo, estes achados não podem ser fielmente aplicadas para os LMICs. Até há pouco, o custo e disponibilidade de grandes amostras de dados genéticos e fenotípicos restringiram as análises MR para os HICs; a maioria deles residem dentro de populações com ascendência europeia. Portanto, embora é bem possível que uma adiposidade maior, pelo menos em parte, explique a prevalência crescente da diabetes nos LMICs, a associação estimada permanece não testada e atualmente só existem uns poucos estudos de MR que avaliem o impacto de qualquer exposição modificável no risco de doença, especialmente nos LMICs.
Especificamente dentro do contexto da América Latina, Borges et al.11 investigaram o efeito causal dos níveis de homocisteína na pressão do sangue na Coorte de Nascimento de Pelotas, Brasil em 1982 usando a MR, logo compararam esses resultados com aqueles de uma coorte Europeia de indivíduos. Para a análise europeia, os autores usaram dados resumidos de uma meta-análise recente de estudos de associação ampla de genomas (GWAS, por suas sigas em inglês)12 de homocisteína, ( >44,000 indivíduos da Europa) para gerar uma IV para os níveis de circulação de homocisteína, os quais eles usaram para testar o efeito causal da homocisteína na pressão arterial (BP, por suas siglas em inglês) usando informação resumida do Consórcio Internacional de Pressão Arterial (ICBP, por suas siglas em inglês)13, ( >69,000 indivíduos da Europa), em uma abordagem de MR de duas amostras. Os resultados da MR mostraram que a pressão arterial sistólica (SBP, por suas siglas em inglês) decresceu em 1.8mmHg (95% CI: -3.9, 0.4; P=0.11) na coorte de Pelotas, porém aumentou em 0,6mmHg (95% CI: -0.8, 1.9; P=0.41) na população Europeia com cada aumento no desvio padrão (SD, por suas siglas em inglês) nos níveis de circulação log(homocisteína). Do mesmo modo, a pressão arterial diastólica (DBP, por suas siglas em inglês) aumentou em 0.1mmHg (95% CI: -1.5, 1.7; P=0.93) na coorte de Pelotas, porém aumentou em 1.1mmHg (95% CI: 0.2, 1.9; P00.01) na população Europeia.
Em outra análise de MR usando a mesma coorte de nascimentos de Pelotas de 1982, Hartwig et al.14 encontraram que a persistência de lactase (p.ex. no consumo de leite) em adultos estava associada positivamente com o BMI (efeito estimado por 1dL/ incremento diário na ingestão de leite: 0.17kg/m2; 95% CI: 0.07, 0.27; P=0.001) e o risco de obesidade (OR por 1dL/ incremento diário na ingestão de leite: 1.09; 95% CI: 1.02, 1.17; P=0.015), ao contrário das estimativas observacionais na mesma coorte. A ingestão de leite no Brasil (e potencialmente de outros países similares da América Latina) poderia predispor aos indivíduos a terem um maior nível de adiposidade, um resultado que diverge das estimativas observacionais inconsistentes derivadas da população Europeia.
Estes dois exemplos, por si destacam ambas as necessidades de que análises de MR sejam conduzidos nos LMICs, e os problemas enfrentados quando tratando com os dados genéticos. Primeiro, grandes tamanhos de amostras são requeridos para um adequado poder estatístico nas análises de MR, devido à relativa pequena porção de variância explicada no fator de risco pela IV genética. O exemplo descrito anteriormente, avaliando o efeito causal dos níveis de circulação de homocisteína na BP, enfatiza este ponto em particular. Além disso, um GWAS recente em mais de 340.000 indivíduos achou que 66 variantes genéticas associadas com a BP em população Europeia também eram preditivas da BP em 64.000 amostras não europeias; no entanto, grandes tamanhos de amostras não europeias que sejam comparáveis serão precisados para mostrar esta concordância entre a direção das estimativas de efeito e elucidar quais variantes genéticas estavam associadas com um grupo específico ancestral15. Consequentemente, o notoriamente diferente tamanho da amostra entre a Coorte de Nascimento de Pelotas em 1982 (N=3,701) e a IBPC (N>69,000) no estudo acima mencionado, poderia explicar parcialmente a direção oposta do efeito gerado entre as duas populações. O custo relativo das variedades de genotipagem e o processamento apresentam um risco de poder estatístico limitado devido aos tamanhos de amostras mais pequenos nas análises de MR, particularmente nos LMICs, onde apropriados tamanhos de amostras poderiam ser relativamente poucos.
Segundo, os LMICs comumente possuem uma estrutura de população multiétnica (como pode-se ver na coorte de Pelotas no exemplo acima descrito), a qual mostra um grande nível de mistura genética e heterogeneidade. O efeito de fatores de risco em doenças que poderiam tipicamente afetar uma população ancestral (como os da Europa, por exemplo) poderiam ser irrelevantes para uma população nos LMIC como resultado disso. Em um estudo recente feito por Zanetti et al.16, o efeito nas estimativas globais para a associação entre SNPs y várias doenças comuns, tais como a T2D, foram geralmente na mesma direção entre diferentes populações ancestrais. Contudo, a estrutura de desequilíbrio da variedade de ligações (p.ex. a associação não aleatória de variantes genéticas) entre ascendências diferentes influencia amplamente a magnitude do efeito entre estas populações. Finalmente, a diferencia na magnitude das estimativas do ponto e a provável população heterogênea nos países da América Latina, destacam a extensão do porquê as análises MR realizadas em populações europeias poderiam não representar os efeitos da mesma exposição em desfechos nas populações LMIC.
Embora nenhum estudo tem medido a relevância causal de qualquer exposição à T2D nos LMICs usando a metodologia MR, os exemplos MR acima descritos não só realçam sua viabilidade nos LMICs, senão também sugerem que tais estudos fornecerão efeitos estimados mais pertinentes para os LMICs. Quanto mais estudos MR sejam publicados nos LMICs, eles potencialmente poderiam refinar as IVs de populações específicas as quais levam em conta o contexto ancestral, os efeitos estimados e os fatores de risco causal para doenças relevantes como a T2D.
Para que futuros análises MR nos LMICs sejam eficazes, há certas propriedades, fundamentos e limitações que devem ser levados em conta, os quais têm sido descritos e discutidos em detalhe anteriormente6. É particular dos cenários dos LMIC, a mistura e a heterogeneidade da população devido a que o background multiétnico pode introduzir confundimento genético e produzir resultados enviesados. Isto pode ser abordado usando métodos de controle genômico ancestral implementado em GWAS. Além disso, o viés de seleção e a generalização dos achados (especialmente em populações onde é provável a sobre-amostragem em grupos de baixo nível socioeconômico) são de particular importância na prática. Finalmente, tais estudos também se apoiarão na disponibilidade dos dados genéticos, o alto poder computacional e locais de infraestrutura apropriados para guardar, manter e analisar os dados requeridos pelas análises MR.
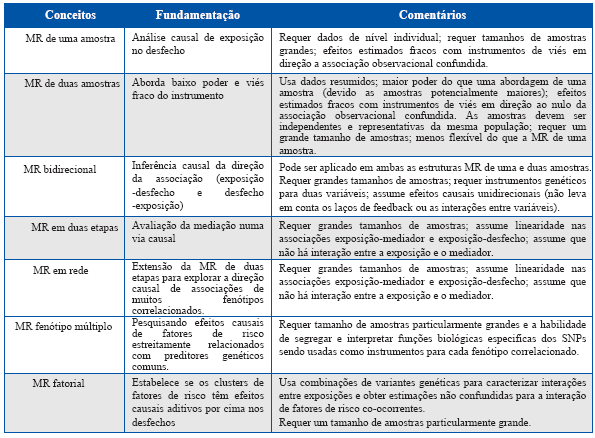
Ao longo da década passada, a metodologia MR há sido aplicada cada vez mais para melhorar a inferência causal em uma série de contextos epidemiológicos. Desenvolvimentos metodológicos recentes construídos sob conceito básico da MR, tais como duas amostras, duas etapas, network e fenótipos múltiplos MR tornaram tais análises complexas de fácil acesso para a comunidade de pesquisadores, e forneceram mais ferramentas para analisar networks causais entre características com maior poder estatístico (Tabela 1)6,7.
Tabela 1 Conceitos metodológicos, desenvolvimentos recentes, fortalezas e limitações das análises de randomização Mendeliana.
Dada a prevalência da T2D na América Latina e nos LMICs, é importante gerar um entendimento maior dos potenciais fatores de riscos modificáveis da T2D (junto com outras doenças de alta prevalência e desfechos adversos de saúde). Com o crescimento económico, a disponibilidade de tecido humano, crescente custo-efetividade de variedades de genótipos e desenvolvimentos recentes na metodologia MR, as análises MR estão se voltando ainda mais praticáveis e poderiam provar ser de importância fundamental na hora de fazer tentativas para achar fatores de risco extraordinários para a T2D que sejam particularmente pertinentes nos LMICs.
REFERENCES
1. NCD Risk Factor Collaboration (NCD-RisC). Worldwide trends in diabetes since 1980: a pooled analysis of 751 population-based studies with 4.4 million participants. Lancet. 2016; 387 (10027): 1513-30. http://dx.doi.org/10.1016/S0140-6736(16)00618-8. [ Links ]
2. Dagenais GR, Gerstein HC, Zhang X, McQueen M, Lear S, Lopez-Jaramillo P, et al. Variations in Diabetes Prevalence in Low-, Middle-, and High-Income Countries: Results From the Prospective Urban and Rural Epidemiological Study. Diabetes Care. 2016; 39(5):780-7. http://dx.doi.org/10.2337/dc15-2338. [ Links ]
3. Prospective Studies Collaboration, Whitlock G, Lewington S, Sherliker P, Clarke R, Emberson J, Halsey J, et al. Body-mass index and cause-specific mortality in 900000 adults: collaborative analyses of 57 prospective studies. Lancet. 2009; 373(9669):1083-96. http://dx.doi.org/10.1016/S0140-6736(09)60318-4. [ Links ]
4. Zaccardi F, O'Donovan G, Webb DR, Yates T, Kurl S, Khunti K, et al. Cardiorespiratory fitness and risk of type 2 diabetes mellitus: A 23-year cohort study and a meta-analysis of prospective studies. Atherosclerosis. 2015; 243(1):131-7. http://doi.org/10.1016/j.atherosclerosis.2015.09.016. [ Links ]
5. Ezzati M, Riboli E. Behavioral and dietary risk factors for noncommunicable diseases. N Engl J Med. 2013; 369(10):954-64. https://doi.org/10.1056/NEJMra1203528. [ Links ]
6. Haycock PC, Burgess S, Wade KH, Bowden J, Relton C, Davey Smith G. Best (but oft-forgotten) practices: the design, analysis, and interpretation of Mendelian randomization studies. Am J Clin Nutr. 2016; 103(4): 965-78. https://doi.org/10.3945/ajcn.115.118216. [ Links ]
7. Davey Smith G, Hemani G. Mendelian randomization: genetic anchors for causal inference in epidemiological studies. Hum Mol Genet. 2014; 15; 23(R1): R89-98. https://doi.org/10.1093/hmg/ddu328. [ Links ]
8. Sandhu MS, Debenham SL, Barroso I, Loos RJ. Mendelian randomisation studies of type 2 diabetes: future prospects. Diabetologia. 2008; 51(2):211-3. https://doi.org/10.1007/s00125-007-0903-x. [ Links ]
9. Swerdlow DI. Mendelian Randomization and Type 2 Diabetes. Cardiovasc Drugs Ther. 2016; 30(1):51-7. https://doi.org/10.1007/s10557-016-6638-5. [ Links ]
10. Corbin LJ, Richmond RC, Wade KH, Burgess S, Bowden J, Davey Smith G, et al. BMI as a modifiable risk factor for type 2 diabetes: refining and understanding causal estimates using Mendelian randomisation. Diabetes. 2016; 65(10): 3002-7. https://doi.org/10.2337/db16-0418. [ Links ]
11. Borges MC, Hartwig FP, Oliveira IO, Horta BL. Is there a causal role for homocysteine concentration in blood pressure? A Mendelian randomization study. Am J Clin Nutr. 2016;103(1):39-49. https://doi.org/10.3945/ajcn.115.116038. [ Links ]
12. van Meurs JB, Pare G, Schwartz SM, Hazra A, Tanaka T, Vermeulen SH, et al. Common genetic loci influencing plasma homocysteine concentrations and their effect on risk of coronary artery disease. Am J Clin Nutr. 2013; 98(3):668-76. https://doi.org/10.3945/ajcn.112.044545. [ Links ]
13. The International Consortium for Blood Pressure Genome-Wide Association Studies. Genetic variants in novel pathways influence blood pressure and cardiovascular disease risk. Nature. 2011; 478(7367):103-9. https://doi.org/10.1038/nature10405. [ Links ]
14. Hartwig FP, Horta BL, Davey Smith G, de Mola CL, Victora CG. Association of lactase persistence genotype with milk consumption, obesity and blood pressure: a Mendelian randomization study in the 1982 Pelotas (Brazil) Birth Cohort, with a systematic review and meta-analysis. Int J Epidemiol. 2016; 45(5): 1573- 87. https://doi.org/10.1093/ije/dyw074. [ Links ]
15. Ehret GB, Ferreira T, Chasman DI, Jackson AU, Schmidt EM, Johnson T, et al. The genetics of blood pressure regulation and its target organs from association studies in 342,415 individuals. Nat Genet. 2016;48(10):1171-84. https://doi.org/10.1038/ng.3667. [ Links ]
16. Zanetti D, Weale ME. True causal effect size heterogeneity is required to explain trans-ethnic differences in GWAS signals. bioRxiv. 2016. http://dx.doi.org/10.1101/085092. [ Links ]
Recebido: 18 de Novembro de 2016; Aceito: 16 de Dezembro de 2016











 texto em
texto em 


