Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Revista Colombiana de Nefrología
versión On-line ISSN 2500-5006
Rev. colom. nefrol. vol.4 no.1 Bogotá ene./jun. 2017
https://doi.org/10.22265/acnef.4.1.262
Gestión de riesgo de enfermedad renal
Obesidad y enfermedad renal: consecuencias ocultas de la epidemia
5 Unidad de Nefrología, Departamento de Medicina, Centro de Ciencias de la Salud de la Universidad de Tennessee, Memphis, TN, Estados Unidos
6 Unidad de Nefrología, Centros Médico del Departamento de Asuntos de Veteranos, Memphis, TN, Estados Unidos
7 Departamento de Pediatría, Facultad de Medicina Perelman de la Universidad de Pensilvania, Filadelfia, PA, Estados Unidos
8 Instituto de Fisiología Clínica, Consejo Nacional de Investigación - Epidemiología Clínica y fisiopatología de enfermedades renales e hipertensión, Reggio Calabria, Italia
La obesidad se ha convertido en una epidemia mundial, y se ha proyectado que su prevalencia se incrementará en un 40% en la próxima década. Esta creciente prevalencia supone implicaciones tanto para el riesgo de desarrollo de diabetes y enfermedades cardiovasculares como para el desarrollo de Enfermedad Renal Crónica. Un elevado índice de masa corporal es uno de los factores de riesgo más importantes para el desarrollo de Enfermedad Renal Crónica. En individuos afectados por la obesidad, tiene lugar una hiperfiltración compensatoria necesaria para alcanzar la alta demanda metabólica secundaria al aumento del peso corporal. El incremento de la presión intraglomerular puede generar daño renal y elevar el riesgo de desarrollar Enfermedad Renal Crónica a largo plazo. La incidencia de glomerulopatía asociada a obesidad se ha incrementado 10 veces en los últimos años. Así mismo se ha demostrado que la obesidad es un factor de riesgo para el desarrollo de nefrolitiasis y un número de neoplasias, incluyendo cáncer renal. Este año, el Día Mundial del Riñón promueve la educación a cerca de las consecuencias nocivas de la obesidad y su asociación con la enfermedad renal, abogando por un estilo de vida saludable y la implementación de políticas públicas de salud que promuevan medidas preventivas alcanzables.
Palabras clave: obesidad; enfermedad renal crónica; nefrolitiasis; cáncer renal; prevención
Obesity has become a worldwide epidemic, and its prevalence has been projected to grow by 40% in the next decade. This increasing prevalence has implications for the risk of diabetes, cardiovascular disease and also for Chronic Kidney Disease. A high body mass index is one of the strongest risk factors for new-onset Chronic Kidney Disease. In individuals affected by obesity, a compensatory hyperfiltration occurs to meet the heightened metabolic demands of the increased body weight. The increase in intraglomerular pressure can damage the kidneys and raise the risk of developing Chronic Kidney Disease in the long-term. The incidence of obesity-related glomerulopathy has increased ten-fold in recent years. Obesity has also been shown to be a risk factor for nephrolithiasis, and for a number of malignancies including kidney cancer. This year the World Kidney Day promotes education on the harmful consequences of obesity and its association with kidney disease, advocating healthy lifestyle and health policy measures that makes preventive behaviors an affordable option.
Key words: Obesity; chronic kidney disease; nephrolithiasis; kidney cancer; prevention
Introducción
En 2014, más de 600 millones de adultos en el mundo, mayores de 18 años, eran obesos. La obesidad es un factor de alto riesgo para el desarrollo de la enfermedad renal. Por un lado, aumenta la probabilidad de desarrollar factores de riesgo significativos de Enfermedad Renal Crónica (ERC), como la diabetes y la hipertensión; por el otro, se asocia directamente con el desarrollo de la ERC e Insuficiencia Renal Terminal (IRT). En individuos que padecen obesidad, aparece un mecanismo compensatorio (probable) de hiperfiltración para satisfacer las elevadas demandas metabólicas del mayor peso corporal. El aumento en la presión intraglomerular puede dañar la estructura del riñón e incrementar el riesgo de desarrollar la ERC a largo plazo.
La buena noticia es que la obesidad, al igual que la ERC asociada, se puede prevenir en gran medida. La educación y la concientización sobre los riesgos de la obesidad y un estilo de vida sano, incluyendo la nutrición adecuada y el ejercicio, pueden contribuir sustancialmente a este propósito. En este artículo se revisa la asociación entre la obesidad y la enfermedad renal con motivo del Día Mundial del Riñón en 2017.
Epidemiología de la obesidad en adultos y niños En las últimas tres décadas, la prevalencia de sobrepeso y obesidad en adultos (IMC >25 kg/m2) ha aumentado considerablemente en todo el mundo[1]. En los Estados Unidos, entre 2013 y 2014, la prevalencia de obesidad, ajustada por edad, era de 35% en hombres y 40,4% en mujeres[2]. Además, el problema de la obesidad también afecta a los niños. En Estados Unidos, entre 2011 y 2014, la prevalencia de obesidad en jóvenes entre 2 y 19 años era de 17%, mientras que la de obesidad extrema era de 5,8%. El aumento de la prevalencia de obesidad es también una preocupación mundial[3,4], dado que se espera que aumente un 40% en todo el mundo durante la próxima década. En los países de ingresos bajos y medios, se está evidenciando una transición de peso normal a sobrepeso y obesidad extrema, como sucedió en algunas regiones de Europa y en los Estados Unidos hace algunas décadas[5]. Esta prevalencia cada vez mayor tiene implicaciones para el riesgo de desarrollo de enfermedades cardiovasculares (ECV) y de la ERC. Un índice de masa corporal (BMI) elevado es uno de los factores de más alto riesgo para la ERC de inicio reciente[6,7].
Gran parte de las definiciones de obesidad se basan en el IMC (es decir, el peso (kilogramos) de la persona dividido entre el cuadrado de su estatura (metros)). Un IMC entre 18,5 y 25 kg/m2 corresponde, según la Organización Mundial de la Salud (OMS) a un peso normal; un IMC entre 25 y 30 kg/ m2, a sobrepeso; y un IMC de más de 30 kg/m2, a obesidad. Si bien el IMC es fácil de calcular, no es un buen indicador de la distribución de la masa de grasa corporal, dado que individuos musculosos o con una mayor cantidad de grasa subcutánea pueden tener un IMC similar al de individuos con mayor cantidad de grasa intraabdominal (visceral). Este último tipo de IMC se asocia con un riesgo sustancialmente mayor de enfermedades cardiovasculares y metabólicas. Otros parámetros para determinar la cantidad de grasa visceral incluyen la circunferencia de la cintura (CC) y el índice cintura/cadera (ICC), los cuales indican obesidad cuando toman valores, respectivamente, de >102 cm y> 0,9 en los hombres y >88 cm y >0,8 en las mujeres. Se ha encontrado que el ICC es un indicador más preciso que el IMC para la clasificación correcta de la obesidad en la ERC.
Asociación de la obesidad con la ERC y otras complicaciones renales
En numerosos estudios de poblaciones se ha encontrado una asociación entre los indicadores de obesidad y tanto el desarrollo como la progresión de la ERC (Tabla 1). Un IMC elevado se asocia con la presencia[8] y desarrollo[9,11] de proteinuria en individuos sin enfermedad renal. Además, múltiples estudios con grandes poblaciones sugieren que existe una asociación entre un IMC elevado y la presencia[8,12] y desarrollo de una tasa baja estimada de filtración glomerular (TFG)[9,10,13], con una pérdida más rápida de TFG en el tiempo[14] y la incidencia de la enfermedad renal terminal (ERT)[15,18]. También se han asociado altos niveles de IMC, obesidad clase II y superiores, con una progresión de la ERC más rápida en pacientes con ERC preexistente[19]. Algunas investigaciones sobre la relación entre la obesidad abdominal usando la ICC o la CC y la ERC sugieren una asociación entre una mayor circunferencia de la cintura con albuminuria[20], baja TFG8 o ERT incidente[21] independientemente del valor del IMC.
Tabla 1 Estudios que abordan la asociación de la obesidad con varias medidas de ERC
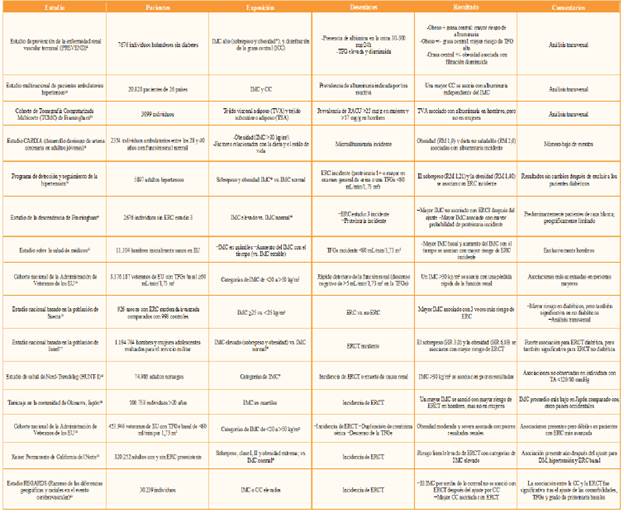
*Peso normal: IMC de 18,5 a 24,9 kg/m2; sobrepeso: IMC de 25,0 a 29,9 kg/m2; obesidad clase I: IMC de 30,0 a 34,9 kg/m2; obesidad clase II: IMC de 35,0 a 39,9 kg/m2; obesidad clase III: IMC >40 kg/m2.
DM: diabetes mellitus; ERC: enfermedad renal crónica; ERCT: enfermedad renal crónica terminal; HR: cociente de riesgo; IMC: índice de masa corporal; RM: razón de momios; RACU: razón albúmina/creatinina urinaria; TFGe: tasa de filtrado glomerular estimada.
Una mayor cantidad de tejido adiposo visceral medido por tomografía computarizada se ha asociado con una mayor prevalencia de albuminuria en hombres[22]. La observación de una asociación entre obesidad abdominal y malos resultados renales, independiente del IMC, se ha descrito también con relación a la mortalidad en pacientes con ERCT[23] y trasplante renal[24], lo que indica un papel directo de la grasa visceral. En general, la asociación entre obesidad y los malos resultados renales persiste aun después del ajuste por posibles mediadores de sus efectos cardiovascular y metabólico, como las elevadas cifras de tensión arterial y diabetes mellitus, lo que indica que la obesidad puede afectar la función renal a través de mecanismos no relacionados en parte con estas complicaciones (vide infra).
Los efectos nocivos de la obesidad se extienden a otras enfermedades como el desarrollo de nefrolitiasis y neoplasias renales malignas. Un alto IMC se asocia con un aumento en la prevalencia[25] e incidencia[26,27] de nefrolitiasis. También la ganancia de peso corporal con el tiempo y un mayor índice de CC basal se han asociado con una mayor incidencia de nefrolitiasis[27]. La obesidad se asocia además con algunos tipos de neoplasias malignas, particularmente los cánceres renales. En un estudio poblacional del Reino Unido, que incluyó 5,24 millones de individuos, el incremento en el IMC de 5 kg/m2 se asoció con un riesgo de cánceres renales mayor al 25%, y atribuyó el 10% de todos los cánceres renales al exceso de peso[28]. Otro estudio que analizó la carga global de la obesidad en la aparición de neoplasias estimó que un 17% y un 26% de todos los cánceres renales en hombres y mujeres, respectivamente, fueron atribuibles al exceso de peso[29]. La asociación entre obesidad y cánceres renales fue consistente tanto en hombres como en mujeres y entre poblaciones de diferentes partes del mundo, en un metaanálisis que incluyó datos de 221 estudios, de los cuales 17 evaluaron neoplasias renales[30]. Entre las neoplasias evaluadas en este último estudio, los cánceres renales tuvieron el tercer lugar de riesgo más alto asociado con obesidad (riesgo relativo por cada 5 kg/m2 de IMC de incremento: 1,24; IC 95%: 1,20-1,28; p < 0,0001)[30].
Mecanismos de acción subyacentes a los efectos renales de la obesidad
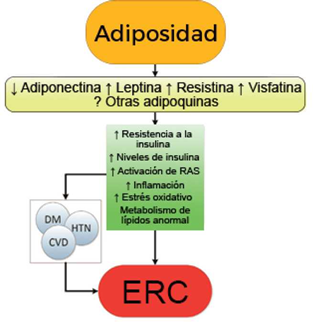
La obesidad ocasiona anomalías metabólicas complejas que tienen una amplia gama de efectos en las diversas enfermedades que afectan a los riñones. El mecanismo exacto a través del cual la obesidad puede causar o empeorar la ERC es aún poco claro. El hecho de que la mayoría de los individuos obesos nunca desarrollen la ERC, y que se clasifique hasta un 25% de la población obesa como «metabólicamente saludable», indica que el aumento de peso por sí solo no es suficiente para inducir el daño renal[31]. Algunas de las consecuencias renales deletéreas de la obesidad pueden estar mediadas por ciertas condiciones comórbidas asociadas como la diabetes mellitus y la hipertensión; sin embargo, existen también efectos de la propia adiposidad que pueden impactar directamente sobre los riñones, inducidos por la actividad endocrina del tejido graso, mediante la producción de adiponectina[32], leptina[33] y resistina[34], entre otros (Figura 1). Estos incluyen el desarrollo de inflamación[35], estrés oxidativo[36], metabolismo de lípidos anormal[37], activación del sistema renina-angiotensina-aldosterona[38] e incremento de la producción de insulina y resistencia a la insulina[39,40].
Estos diversos efectos dan lugar a cambios patológicos específicos en los riñones[41], lo que podría explicar el riesgo elevado de ERC demostrado por algunos estudios observacionales. Estos incluyen la acumulación ectópica de lípidos[42] y el aumento de los depósitos grasos en el seno renal[43,44], el desarrollo de hipertensión glomerular e incremento de la permeabilidad glomerular generada por un estado de hiperfiltración, el cual se asocia al daño en la barrera de filtración glomerular[45], y finalmente, el desarrollo de glomerulomegalia[46] y glomeruloesclerosis focal y segmentaria[41] (Figure 2). La incidencia de la llamada glomerulopatía asociada a obesidad (GAO) se ha incrementado hasta 10 veces en el periodo comprendido entre 1986 y el año 2000[41]. Es importante destacar que la GAO en ocasiones se presenta en conjunto con otros procesos fisiopatológicos propios de otras enfermedades o de la edad avanzada, lo que perpetúa la generación de mayor daño renal en pacientes con hipertensión[47] o en ancianos[14,39].
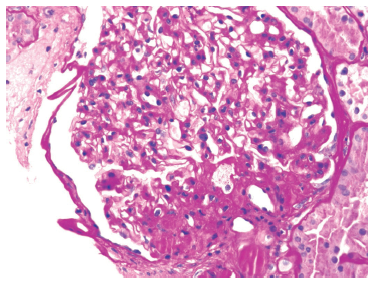
Figura 2 Glomeruloesclerosis focal y segmentaria perihiliar relacionada con la obesidad en un marco de glomerulomegalia. Tinción con ácido periódico de Schiff, aumento original al 400x.
La obesidad se asocia también con una serie de factores de riesgo que contribuyen a la alta incidencia y prevalencia de nefrolitiasis. Un mayor peso corporal está asociado con un menor pH[48] en la orina y mayor excreción de oxalato urinario[49], ácido úrico, sodio y fósforo[50]. Las dietas ricas en proteínas y sodio pueden contribuir a la acidificación de la orina y a la disminución del citrato urinario, lo que también contribuye al riesgo de cálculos renales. La resistencia a la insulina, característica de la obesidad, puede predisponer al desarrollo de nefrolitiasis[51] a través del impacto que genera en el intercambio tubular Na-H[52], la amoniogénesis[53] y la generación de un medio ácido[54]. Lo que complica aún más el panorama es el hecho de que algunas terapias de pérdida de peso aumentan el riesgo de desarrollar cálculos renales; por ejemplo, la cirugía gástrica puede generar un incremento sustancial en la absorción enteral de oxalato y aumentar el riesgo de nefrolitiasis[55].
Los mecanismos que hay detrás del mayor riesgo de aparición de cánceres renales en individuos obesos no están muy bien caracterizados. La resistencia a la insulina y, consecuentemente, la hiperinsulinemia crónica, así como el incremento en la producción de factor de crecimiento semejante a insulina tipo 1 y numerosos efectos humorales secundarios complejos, pueden ejercer efectos estimulantes en el crecimiento de varios tipos de células tumorales[56]. Más recientemente han surgido otras explicaciones, tales como las funciones endocrinas del tejido adiposo[57], sus efectos en la inmunidad[58] y la generación de un estado proinflamatorio con efectos complejos sobre el cáncer[59,60].
Obesidad en pacientes con enfermedad renal avanzada: la necesidad de un enfoque matizado
Teniendo en cuenta la evidencia antes mencionada sobre los efectos abrumadoramente deletéreos de la obesidad en varios procesos patológicos, es un contrasentido que la obesidad se asocie a menores tasas de mortalidad en pacientes con ERC[19,61] y ERCT[62,63]. Se han descrito asociaciones «paradójicas» similares en otras poblaciones, como en pacientes con insuficiencia cardiaca congestiva[64], enfermedad pulmonar obstructiva crónica[65], artritis reumatoide[66] e incluso en pacientes de edad avanzada[67]. Es posible que el efecto aparentemente protector de un IMC alto sea el resultado de la imperfección del IMC como medida del grado de obesidad, en tanto que no distingue los efectos de la adiposidad de los del tejido no adiposo sobre el IMC. De hecho, los estudios que separaron los efectos de una mayor CC de aquellos con mayor IMC demuestran una reversión en la asociación inversa con la mortalidad[23,24]. También se ha demostrado que una mayor masa muscular explica al menos algunos de los efectos positivos atribuidos al IMC elevado[63,68]. Sin embargo, existe evidencia que señala que mayores niveles de adiposidad, especialmente grasa subcutánea (no visceral), también se asocian con mejores resultados en pacientes con ERCT[62]. Tales beneficios pueden estar presentes en pacientes que tienen una corta expectativa de vida, como la mayoría de los pacientes con ERCT[69]. De hecho, algunos estudios que han evaluado la asociación del IMC con sobrevida dependiente del tiempo en la ERCT han demostrado un marcado contraste entre los efectos protectores a corto plazo y los efectos deletéreos a largo plazo de un mayor IMC[70]. Existen varios presuntos beneficios a corto plazo atribuibles a una mayor masa corporal, especialmente en individuos enfermos. Esto incluye el beneficio de un mejor estado nutricional que se observa típicamente en individuos obesos y que provee mejores reservas energético-proteicas frente a una enfermedad aguda y una mayor masa muscular con mejor capacidad antioxidante[63] y menores niveles plasmáticos circulantes de actina y mayores de gelsolina[71], los cuales se asocian con mejores resultados. Otras características hipotéticamente benéficas de la obesidad incluyen una mayor estabilidad hemodinámica con mejor respuesta al estrés, y mayor actividad simpática y del sistema renina angiotensina[72]; mayor producción de adiponectinas[73] y receptores solubles del factor de necrosis tumoral alfa[74] por el tejido adiposo que neutralizan los efectos adversos del factor de necrosis tumoral alfa; mejor unión de endotoxinas circulantes[75] por los niveles de colesterol característicamente altos que se observan en la obesidad y secuestro de toxinas urémicas por el tejido adiposo[76].
Intervenciones potenciales para el manejo de la obesidad
La obesidad genera daño renal a través de mecanismos directos tales como la alteración en la síntesis de diversas citocinas en el tejido adiposo con potencial nefrotóxico, así como de forma indirecta al desencadenar la aparición de diabetes e hipertensión, dos condiciones que se encuentran entre los factores de riesgo más importantes para el desarrollo de la ERC. Tal vez debido a la ventaja de supervivencia de los pacientes obesos con ERC, la prevalencia de ERCT aumentará tanto en EEUU[77] como en Europa[78]. Las estrategias para controlar la epidemia de ERC relacionada con la obesidad a nivel de la población y contrarrestar la evolución de ERC en insuficiencia renal en pacientes obesos representan una de las tareas más importantes que enfrentan los sistemas y administradores de salud, así como los nefrólogos de hoy en día.
La lucha contra la ERC a nivel poblacional
Las asociaciones más importantes en el ámbito de la nefrología, incluyendo la Sociedad Internacional de Nefrología (ISN), la Federación Internacional de Fundaciones Renales (IFKF), la Sociedad Europea de Nefrología (ERA-EDTA) y otras sociedades nacionales, han convocado intervenciones de salud pública en las comunidades con el fin de prevenir y tratar la ERC en una etapa temprana. En los EEUU, se puso en marcha el programa «Healthy People 2020», cuyo objetivo es la promoción y prevención en salud a 10 años y se enfoca en la ERC y la obesidad. Las encuestas para detectar pacientes obesos, en particular aquellos con alto riesgo de desarrollar ERC (p.ej. individuos obesos con hipertensión o diabetis) y aquellos que reciben cuidados subóptimos, e informarlos sobre los riesgos potenciales de desarrollar la ERC a los que están expuestos son el primer paso hacia la generación de intervenciones en salud pública. Es una prioridad urgente encontrar evidencia de que las intervenciones actuales para reducir el riesgo de ERC en pacientes obesos son eficaces y reproducibles, con el fin de establecer las metas y los medios que modifiquen estos factores. Se requiere documentar de forma adecuada la información existente que explique el riesgo y los beneficios de las intervenciones de prevención primaria y secundaria en individuos obesos, así como la realización de nuevos estudios en esta población para llenar los vacíos de conocimiento (véase a continuación) que aún existen. Finalmente, los programas de vigilancia para la monitorización de los avances en detección de individuos en riesgo y la efectividad de los programas de prevención que se están implementando[79] constituyen el tercer elemento fundamental para el establecimiento de planes eficaces de prevención de ERC a nivel poblacional.
En lugares como el Reino Unido ya se ha implementado un sistema exitoso de vigilancia de la ERC[80] con el lanzamiento de una campaña para difundir y aplicar las guías K DOQI de ERC en niveles de atención primaria dentro del Servicio Nacional de Salud. Esto aumentó progresivamente la adopción de estas guías clínicas y, además, gracias a los incentivos específicos otorgados a los médicos generales del Reino Unido para fomentar la detección de ERC, ha conducido a una mejora impresionante en temas de detección y cuidado de la ERC, es decir, un mejor control de la hipertensión y un mayor uso de bloqueadores de los receptores de la enzima convertidora de angiotensina[80]. Este sistema puede servir como una plataforma para mejorar la prevención de la ERC relacionada con la obesidad. Las campañas encaminadas a reducir la carga de obesidad se encuentran en el centro del escenario mundial y son ampliamente recomendadas por la Organización Mundial de la Salud, y se espera que ayuden a disminuir la incidencia de complicaciones relacionadas con ella, incluyendo la ERC. Sin embargo, las metas en cuanto a obesidad para pacientes obesos con ERC siguen siendo vagas, en gran parte debido a la escasez de estudios de intervención con alto nivel de evidencia para modificar la obesidad en pacientes con ERC[81].
Prevención de la progresión de la ERC en individuos obesos
Los estudios observacionales en individuos obesos metabólicamente sanos muestran que el fenotipo obeso no asociado con anomalías metabólicas predice per se un mayor riesgo de la ERC incidented[82], lo que indica que la obesidad por sí misma puede generar disfunción y daño renal incluso sin diabetes e hipertensión (vide supra). En pacientes diabéticos con sobrepeso u obesidad, una intervención en el estilo de vida que incluya restricción calórica y aumento de la actividad física en comparación con un seguimiento estándar basado en la educación y el apoyo para mantener el tratamiento de la diabetes reducen el riesgo de incidencia de ERC en un 30%, aunque no afecta la incidencia de eventos cardiovasculares[83]. Este efecto protector se da, en parte, gracias a la reducción de peso, del HbA1c y de la presión arterial sistólica. No se han observado problemas de seguridad respecto a eventos adversos renales[83]. En un metaanálisis reciente de estudios experimentales en pacientes obesos con ERC, las intervenciones encaminadas a reducir el peso corporal mostraron beneficios en la reducción de la tensión arterial, hiper-filtración glomerular y proteinuria[81]. En un análisis post hoc del estudio REIN se demostró que el efecto nefroprotector de la inhibición de la ECA en pacientes con ERC y proteinuria es máximo en obesos con ERC, pero mínimo en pacientes con ERC e IMC normal o bajo[84]. Cabe destacar que se ha propuesto la cirugía bariátrica para pacientes seleccionados con ERC y ERCT, incluyendo a aquellos en diálisis o en lista de espera para trasplante renal[85,87].
A nivel mundial, estos hallazgos experimentales proporcionan una prueba de la importancia que tienen las intervenciones como la reducción de peso y el uso de inhibidores de la ECA en el tratamiento de la ERC en los pacientes obesos. Sin embargo, quedan por explicar los estudios que demuestran un beneficio de supervivencia de un mayor IMC en pacientes con ERC[88]. Estos hallazgos limitan nuestra capacidad para hacer recomendaciones fuertes acerca de la utilidad y seguridad de la reducción de peso en individuos con estadios más avanzados de ERC. Las recomendaciones sobre el estilo de vida para la reducción de peso en personas obesas con riesgo de ERC y aquellos con ERC en estadios tempranos parecen justificables, particularmente las recomendaciones para el control de la diabetes y la hipertensión. Dado que el efecto independiente que tiene el control de la obesidad en la incidencia y progresión de la ERC es difícil de separar de los efectos de la hipertensión y la diabetes tipo 2, la recomendación de la pérdida de peso en la minoría de pacientes obesos no hipertensos y metabólicamente sanos sigue siendo injustificada. Estas consideraciones muestran que se debe seguir cuidadosamente el tratamiento del sobrepeso y la obesidad en pacientes con ERC avanzada u otros estados comórbidos, teniendo en cuenta los beneficios esperados y las posibles complicaciones de la pérdida de peso sobre la esperanza de vida de cada paciente en particular.
Conclusiones
La epidemia mundial de la obesidad afecta a toda la población del planeta de muchas maneras. Las enfermedades renales, incluyendo ERC, nefrolitiasis y neoplasias, se encuentran entre los efectos más insidiosos de la obesidad, con grandes consecuencias deletéreas que conllevan mayores tasas de morbimortalidad y altos costos tanto para los individuos como para la sociedad en general.
Las intervenciones poblacionales para controlar la obesidad pueden tener efectos benéficos en la prevención del desarrollo o en el retraso de la progresión de la ERC. Corresponde a toda la comunidad del cuidado de salud el diseño de estrategias de largo alcance para mejorar la comprensión de los vínculos entre la obesidad y las enfermedades renales y así determinar estrategias óptimas para frenar esta marea. El Día Mundial del Riñón 2017 es una gran oportunidad para fomentar la educación y la concienciación con ese fin.
REFERENCIAS
1. Forouzanfar MH, Alexander L, Anderson HR, Bachman VF, Biryukov S, Brauer M, Burnett R, et al. RA: Global, regional, and national comparative risk assessment of 79 behavioural, environmental and occupational, and metabolic risks or clusters of risks in 188 countries, 1990-2013: a systematic analysis for the Global Burden of Disease Study 2013. Lancet 386:2287-2323, 2015. [ Links ]
2. Flegal KM, Kruszon-Moran D, Carroll MD, Fryar CD, Ogden CL: Trends in Obesity Among Adults in the United States 2005 to 2014. , JAMA 315:2284-2291, 2016. [ Links ]
3. Cattaneo A, Monasta L, Stamatakis E, Lioret S, Castetbon K, Frenken F, Manios Y, Moschonis G, Savva S, Zabors-kis A, Rito AI, Nanu M, Vignerova J, Caroli M, Ludvigsson J, Koch FS, Serra-Majem L, Szponar L, van LF, Brug J: Overweight and obesity in infants and pre-school children in the European Union: a review of existing data. Obes Rev 11:389-398, 2010. [ Links ]
4. Olaya B, Moneta MV, Pez O, Bitfoi A, Carta MG, Eke C, Goelitz D, Keyes KM, Kuijpers R, Lesinskiene S, Mihova Z, Otten R, Fermanian C, Haro JM, Kovess V: Country-level and individual correlates of overweight and obesity among primary school children: a cross-sectional study in seven European countries. BMC Public Health 15:475, 2015. [ Links ]
5. Subramanian SV, Perkins JM, Ozaltin E, Davey SG: Weight of nations: a socioeconomic analysis of women in low- to middle-income countries. Am J Clin Nutr 93:413-421, 2011. [ Links ]
6. Tsujimoto T, Sairenchi T, Iso H, Irie F, Yamagishi K, Watanabe H, Tanaka K, Muto T, Ota H: The dose-response relationship between body mass index and the risk of incident stage >/=3 chronic kidney disease in a general japanese population: the Ibaraki prefectural health study (IPHS). J Epidemiol 24:444-451, 2014. [ Links ]
7. Elsayed EF, Sarnak MJ, Tighiouart H, Griffith JL, Kurth T, Salem DN, Levey AS, Weiner DE: Waist-to-hip ratio, body mass index, and subsequent kidney disease and death. Am J Kidney Dis 52:29-38, 2008. [ Links ]
8. Pinto-Sietsma SJ, Navis G, Janssen WM, de ZD, Gans RO, de Jong PE: A central body fat distribution is related to renal function impairment, even in lean subjects. Am J Kidney Dis 41:733-741, 2003. [ Links ]
9. Foster MC, Hwang SJ, Larson MG, Lichtman JH, Parikh NI, Vasan RS, Levy D, Fox CS: Overweight, obesity, and the development of stage 3 CKD: the Framingham Heart Study. Am J Kidney Dis 52:39-48, 2008. [ Links ]
10. Kramer H, Luke A, Bidani A, Cao G, Cooper R, McGee D: Obesity and prevalent and incident CKD: the Hypertension Detection and Follow-Up Program. Am J Kidney Dis 46:587-594, 2005. [ Links ]
11. Chang A, Van HL, Jacobs DR, Jr., Liu K, Muntner P, Newsome B, Shoham DA, Durazo-Arvizu R, Bibbins-Domin-go K, Reis J, Kramer H: Lifestyle-related factors, obesity, and incident microalbuminuria: the CARDIA (Coronary Artery Risk Development in Young Adults) study. Am J Kidney Dis 62:267-275, 2013. [ Links ]
12. Ejerblad E, Fored CM, Lindblad P, Fryzek J, McLaughlin JK, Nyren O: Obesity and risk for chronic renal failure. J Am Soc Nephrol 17:1695-1702, 2006. [ Links ]
13. Gelber RP, Kurth T, Kausz AT, Manson JE, Buring JE, Levey AS, Gaziano JM: Association between body mass index and CKD in apparently healthy men. Am J Kidney Dis 46:871-880, 2005. [ Links ]
14. Lu JL, Molnar MZ, Naseer A, Mikkelsen MK, Kalantar-Zadeh K, Kovesdy CP: Association of age and BMI with kidney function and mortality: a cohort study. Lancet Diabetes Endocrinol 3:704-714, 2015. [ Links ]
15. Munkhaugen J, Lydersen S, Wideroe TE, Hallan S: Prehypertension, obesity, and risk of kidney disease: 20-year follow-up of the HUNT I study in Norway. Am J Kidney Dis 54:638-646, 2009. [ Links ]
16. Iseki K, Ikemiya Y, Kinjo K, Inoue T, Iseki C, Takishita S: Body mass index and the risk of development of end-stage renal disease in a screened cohort. Kidney Int 65:1870-1876, 2004. [ Links ]
17. Vivante A, Golan E, Tzur D, Leiba A, Tirosh A, Skorecki K, Calderon-Margalit R: Body mass index in 1.2 million adolescents and risk for end-stage renal disease. Arch Intern Med 172:1644-1650, 2012. [ Links ]
18. Hsu C, McCulloch C, Iribarren C, Darbinian J, Go A: Body mass index and risk for end-stage renal disease. Ann Intern Med 144:21-28, 2006. [ Links ]
19. Lu JL, Kalantar-Zadeh K, Ma JZ, Quarles LD, Kovesdy CP: Association of body mass index with outcomes in patients with CKD. J Am Soc Nephrol 25:2088-2096, 2014. [ Links ]
20. Thoenes M, Reil JC, Khan BV, Bramlage P, Volpe M, Kirch W, Bohm M: Abdominal obesity is associated with microalbuminuria and an elevated cardiovascular risk profile in patients with hypertension. Vasc Health Risk Manag.5:577-585, 2009. [ Links ]
21. Kramer H, Gutierrez OM, Judd SE, Muntner P, Warnock DG, Tanner RM, Panwar B, Shoham DA, McClellan W: Waist Circumference, Body Mass Index, and ESRD in the REGARDS (Reasons for Geographic and Racial Differences in Stroke) Study. Am J Kidney Dis 67:62-69, 2016. [ Links ]
22. Foster MC, Hwang SJ, Massaro JM, Hoffmann U, DeBoer IH, Robins SJ, Vasan RS, Fox CS: Association of subcutaneous and visceral adiposity with albuminuria: the Framingham Heart Study. Obesity (Silver Spring) 19:12841289, 2011. [ Links ]
23. Postorino M, Marino C, Tripepi G, Zoccali C: Abdominal obesity and all-cause and cardiovascular mortality in end-stage renal disease. J Am Coll Cardiol 53:1265-1272, 2009. [ Links ]
24. Kovesdy CP, Czira ME, Rudas A, Ujszaszi A, Rosivall L, Novak M, Kalantar-Zadeh K, Molnar MZ, Mucsi I: Body mass index, waist circumference and mortality in kidney transplant recipients. Am J Transplant 10:2644-2651 2010. [ Links ]
25. Scales, CD Jr., Smith AC, Hanley JM, Saigal CS: Prevalence of kidney stones in the United States. Eur Urol 62:160-165, 2012. [ Links ]
26. Curhan GC, Willett WC, Rimm EB, Speizer FE, Stampfer MJ: Body size and risk of kidney stones. J Am Soc Nephrol 9:1645-1652, 1998. [ Links ]
27. Taylor EN, Stampfer MJ, Curhan GC: Obesity, weight gain, and the risk of kidney stones. JAMA 293:455-462, 2005. [ Links ]
28. Bhaskaran K, Douglas I, Forbes H, dos-Santos-Silva I, Leon DA, Smeeth L: Body-mass index and risk of 22 specific cancers: a population-based cohort study of 5.24 million UK adults. Lancet 384:755-765, 2014 [ Links ]
29. Arnold M, Pandeya N, Byrnes G, Renehan AG, Stevens GA, Ezzati M, Ferlay J, Miranda JJ, Romieu I, Dikshit R, Forman D, Soerjomataram I: Global burden of cancer attributable to high body-mass index in 2012: a population-based study. Lancet Oncol 16:36-46, 2015. [ Links ]
30. Renehan AG, Tyson M, Egger M, Heller RF, Zwahlen M: Body-mass index and incidence of cancer: a systematic review and meta-analysis of prospective observational studies. Lancet 371:569-578, 2008. [ Links ]
31. Bluher M: The distinction of metabolically ‘healthy’ from ‘unhealthy’ obese individuals. Curr Opin Lipidol 21:38-43, 2010. [ Links ]
32. Sharma K: The link between obesity and albuminuria: adiponectin and podocyte dysfunction. Kidney Int 76:145-148, 2009. [ Links ]
33. Wolf G, Ziyadeh FN: Leptin and renal fibrosis. Contrib Nephrol 151:175-183, 2006. [ Links ]
34. Ellington AA, Malik AR, Klee GG, Turner ST, Rule AD, Mosley TH, Jr., Kullo IJ: Association of plasma resistin with glomerular filtration rate and albuminuria in hypertensive adults. Hypertension 50:708-714, 2007. [ Links ]
35. Bastard JP, Maachi M, Lagathu C, Kim MJ, Caron M, Vidal H, Capeau J, Feve B: Recent advances in the relationship between obesity, inflammation, and insulin resistance. Eur Cytokine Netw 17:4-12, 2006. [ Links ]
36. Furukawa S, Fujita T, Shimabukuro M, Iwaki M, Yamada Y, Nakajima Y, Nakayama O, Makishima M, Matsuda M, Shimomura I: Increased oxidative stress in obesity and its impact on metabolic syndrome. J Clin Invest 114:1752-1761, 2004. [ Links ]
37. Ruan XZ, Varghese Z, Moorhead JF: An update on the lipid nephrotoxicity hypothesis. Nat Rev Nephrol 5:713-721, 2009 Obesidad y enfermedad renal: consecuencias ocultas de la epidemia Rev. Colomb. Nefrol. 2017;4(1): 95 - 108. http://www.revistanefrologia.org [ Links ]
38. Ruster C, Wolf G: The role of the renin-angiotensin-aldosterone system in obesity-related renal diseases. Semin Nephrol 33:44-53, 2013. [ Links ]
39. Oterdoom LH, de Vries AP, Gansevoort RT, de Jong PE, Gans RO, Bakker SJ: Fasting insulin modifies the relation between age and renal function. Nephrol Dial Transplant 22:1587-1592, 2007. [ Links ]
40. Reaven GM: Banting lecture 1988. Role of insulin resistance in human disease. Diabetes 37:1595-1607, 1988 . [ Links ]
41. Kambham N, Markowitz GS, Valeri AM, Lin J, D’Agati VD: Obesity-related glomerulopathy: an emerging epidemic. Kidney Int 59:1498-1509, 2001. [ Links ]
42. de Vries AP, Ruggenenti P, Ruan XZ, Praga M, Cruzado JM, Bajema IM, D’Agati VD, Lamb HJ, Pongrac BD, Hojs R, Abbate M, Rodriquez R, Mogensen CE, Porrini E :Fatty kidney: emerging role of ectopic lipid in obesity-related renal disease. Lancet Diabetes Endocrinol 2:417-426, 2014. [ Links ]
43. Foster MC, Hwang SJ, Porter SA, Massaro JM, Hoffmann U, Fox CS: Fatty kidney, hypertension, and chronic kidney disease: the Framingham Heart Study. Hypertension 58:784-790, 2011 . [ Links ]
44. Henegar JR, Bigler SA, Henegar LK, Tyagi SC, Hall JE: Functional and structural changes in the kidney in the early stages of obesity. J Am Soc Nephrol 12:1211- 1217, 2001. [ Links ]
45. Knight SF, Quigley JE, Yuan J, Roy SS, Elmarakby A, Imig JD: Endothelial dysfunction and the development of renal injury in spontaneously hypertensive rats fed a high-fat diet. Hypertension 51:352-359, 2008. [ Links ]
46. Tsuboi N, Utsunomiya Y, Kanzaki G, Koike K, Ikegami M, Kawamura T, Hosoya T: Low glomerular density with glomerulomegaly in obesity-related glomerulopathy. Clin J Am Soc Nephrol 7:735-741, 2012. [ Links ]
47. Ribstein J, du CG, Mimran A: Combined renal effects of overweight and hypertension. Hypertension 26:610-615, 1995. [ Links ]
48. Maalouf NM, Sakhaee K, Parks JH, Coe FL, Adams-Huet B, Pak CY: Association of urinary pH with body weight in nephrolithiasis. Kidney Int 65:1422-1425, 2004 . [ Links ]
49. Lemann J, Jr., Pleuss JA, Worcester EM, Hornick L, Schrab D, Hoffmann RG: Urinary oxalate excretion increases with body size and decreases with increasing dietary calcium intake among healthy adults. Kidney Int 49:200-208, 1996. [ Links ]
50. Siener R, Glatz S, Nicolay C, Hesse A: The role of overweight and obesity in calcium oxalate stone formation. Obes Res 12:106-113, 2004. [ Links ]
51. Taylor EN, Stampfer MJ, Curhan GC: Diabetes mellitus and the risk of nephrolithiasis. Kidney Int 68:1230-1235, 2005 . [ Links ]
52. Klisic J, Hu MC, Nief V, Reyes L, Fuster D, Moe OW, Ambuhl PM: Insulin activates Na(+)/H(+) exchanger 3: biphasic response and glucocorticoid dependence. Am J Physiol Renal Physiol 283:F532-F539, 2002. [ Links ]
53. Chobanian MC, Hammerman MR: Insulin stimulates ammoniagenesis in canine renal proximal tubular segments. Am J Physiol 253:F1171-F1177, 1987. [ Links ]
54. Daudon M, Lacour B, Jungers P: Influence of body size on urinary stone composition in men and women. Urol Res 34:193-199, 2006. [ Links ]
55. Sinha MK, Collazo-Clavell ML, Rule A, Milliner DS, Nelson W, Sarr MG, Kumar R, Lieske JC: Hyperoxaluric nephrolithiasis is a complication of Roux-en-Y gastric bypass surgery. Kidney Int 72:100-107, 2007. [ Links ]
56. Calle EE, Kaaks R: Overweight, obesity and cancer: epidemiological evidence and proposed mechanisms. Nat Rev Cancer 4:579-591, 2004. [ Links ]
57. Dalamaga M, Diakopoulos KN, Mantzoros CS: The role of adiponectin in cancer: a review of current evidence. Endocr Rev 33:547-594, 2012. [ Links ]
58. Lamas O, Marti A, Martinez JA: Obesity and immunocompetence. Eur J Clin Nutr 56 Suppl 3:S42-S45, 2002. [ Links ]
59. Lim C, Savan R: The role of the IL-22/IL-22R1 axis in cancer. Cytokine Growth Factor Rev 25:257-271, 2014. [ Links ]
60. Grivennikov SI, Greten FR, Karin M: Immunity, inflammation, and cancer. Cell 140:883-899, 2010 Kovesdy Csaba, Furth Susan, Zoccali Carmine, et al. Rev. Colomb. Nefrol . 2017;4(1): 95 - 108. http://www.revistanefrologia.org. [ Links ]
61. Kovesdy CP, Anderson JE, Kalantar-Zadeh K: Paradoxical association between body mass index and mortality in men with CKD not yet on dialysis. Am J Kidney Dis 49:581-591, 2007. [ Links ]
62. Kalantar-Zadeh K, Kuwae N, Wu DY, Shantouf RS, Fouque D, Anker SD, Block G, Kopple JD: Associations of body fat and its changes over time with quality of life and prospective mortality in hemodialysis patients. Am J Clin Nutr 83:202- 210, 2006. [ Links ]
63. Beddhu S, Pappas LM, Ramkumar N, Samore M: Effects of body size and body composition on survival in hemodialysis patients. J Am Soc Nephrol 14:2366- 2372, 2003. [ Links ]
64. Curtis JP, Selter JG, Wang Y, Rathore SS, Jovin IS, Jadbabaie F, Kosiborod M, Portnay EL, Sokol SI, Bader F, Krumholz HM: The obesity paradox: body mass index and outcomes in patients with heart failure. Arch Intern Med 165:55-61, 2005. [ Links ]
65. Wilson DO, Rogers RM, Wright EC, Anthonisen NR: Body weight in chronic obstructive pulmonary disease. The National Institutes of Health Intermittent Positive-Pressure Breathing Trial. Am Rev Respir Dis 139:1435-1438, 1989. [ Links ]
66. Escalante A, Haas RW, del R, I: Paradoxical effect of body mass index on survival in rheumatoid arthritis: role of comorbidity and systemic inflammation. Arch Intern Med 165: 1624-1629, 2005. [ Links ]
67. Kalantar-Zadeh K, Kilpatrick RD, Kuwae N, Wu DY: Reverse epidemiology: a spurious hypothesis or a hardcore reality? Blood Purif 23:57-63, 2005. [ Links ]
68. Noori N, Kopple JD, Kovesdy CP, Feroze U, Sim JJ, Murali SB, Luna A, Gomez M, Luna C, Bross R, Nissenson AR, Kalantar-Zadeh K: Mid-arm muscle circumference and quality of life and survival in maintenance hemodialysis patients. Clin J Am Soc Nephrol 5:2258-2268, 2010. [ Links ]
69. Dekker FW, de MR, van Dijk PC, Zoccali C, Jager KJ: Survival analysis: time- dependent effects and time-varying risk factors. Kidney Int 74:994-997, 2008. [ Links ]
70. Snyder JJ, Foley RN, Gilbertson DT, Vonesh EF, Collins AJ: Body size and outcomes on peritoneal dialysis in the United States. Kidney Int 64:1838-1844, 2003. [ Links ]
71. Lee PS, Sampath K, Karumanchi SA, Tamez H, Bhan I, Isakova T, Gutierrez OM, Wolf M, Chang Y, Stossel TP, Thadhani R: Plasma gelsolin and circulating actin correlate with hemodialysis mortality. J Am Soc Nephrol 20:1140-1148, 2009. [ Links ]
72. Horwich TB, Fonarow GC, Hamilton MA, MacLellan WR, Woo MA, Tillisch JH: The relationship between obesity and mortality in patients with heart failure. J Am Coll Cardiol 38:789-795, 2001. [ Links ]
73. Stenvinkel P, Marchlewska A, Pecoits-Filho R, Heimburger O, Zhang Z, Hoff C, Holmes C, Axelsson J, Arvidsson S, Schalling M, Barany P, Lindholm B, Nordfors L: Adiponectin in renal disease: relationship to phenotype and genetic variation in the gene encoding adiponectin. Kidney Int 65:274-281, 2004. [ Links ]
74. Mohamed-Ali V, Goodrick S, Bulmer K, Holly JM, Yudkin JS, Coppack SW: Production of soluble tumor necrosis factor receptors by human subcutaneous adipose tissue in vivo. Am J Physiol 277:E971-E975, 1999. [ Links ]
75. Rauchhaus M, Coats AJ, Anker SD: The endotoxin-lipoprotein hypothesis. Lancet 356:930-933, 2000 . [ Links ]
76. Jandacek RJ, Anderson N, Liu M, Zheng S, Yang Q, Tso P: Effects of yo-yo diet, caloric restriction, and olestra on tissue distribution of hexachlorobenzene. Am J Physiol Gastrointest Liver Physiol 288:G292-G299, 2005. [ Links ]
77. Kramer HJ, Saranathan A, Luke A, Durazo-Arvizu RA, Guichan C, Hou S, Cooper R: Increasing body mass index and obesity in the incident ESRD population. J Am Soc Nephrol 17:1453-1459, 2006. [ Links ]
78. Postorino M, Mancini E, D’Arrigo G, Marino C, Vilasi A, Tripepi G, Gallus S, Lugo A, Santoro A, Zoccali C: Body mass index trend in haemodialysis patients: the shift of nutritional disorders in two Italian regions. Nephrol Dial Transplant 2016 . [ Links ]
79. 2008-2013 Action Plan for the Global Strategy for the Prevention and Control of Noncommunicable Diseases. 2009. World Health Organization. Ref Type: Online Source Obesidad y enfermedad renal: consecuencias ocultas de la epidemiaRev. Colomb. Nefrol . 2017;4(1): 95 - 108. http://www.revistanefrologia.org. [ Links ]
80. O’Donoghue DJ, Stevens PE: A decade after the KDOQI CKD/guidelines: a perspective from the United Kingdom. Am J Kidney Dis 60:740-742, 2012. [ Links ]
81. Bolignano D, Zoccali C: Effects of weight loss on renal function in obese CKD patients: a systematic review. Nephrol Dial Transplant 28 Suppl 4:iv82-iv98, 2013. [ Links ]
82. Chang Y, Ryu S, Choi Y, Zhang Y, Cho J, Kwon MJ, Hyun YY, Lee KB, Kim H, Jung HS, Yun KE, Ahn J, Rampal S, Zhao D, Suh BS, Chung EC, Shin H, Pastor-Barriuso R, Guallar E: Metabolically Healthy Obesity and Development of Chronic Kidney Disease: A Cohort Study. Ann Intern Med 16 4:305-312, 2016 . [ Links ]
83. Wing RR, Bolin P, Brancati FL, Bray GA, Clark JM, Coday M, Crow RS, Curtis JM, Egan CM, Espeland MA, Evans M, Foreyt JP, Ghazarian S, Gregg EW, Harrison B, Hazuda HP, Hill JO, Horton ES, Hubbard VS, Jakicic JM, Jeffery RW, Johnson KC, Kahn SE, Kitabchi AE, Knowler WC, Lewis CE, Maschak- Carey BJ, Montez MG, Murillo A, Nathan DM, Patricio J, Peters A, Pi-Sunyer X, Pownall H, Reboussin D, Regensteiner JG, Rickman AD, Ryan DH, Safford M, Wadden TA, Wagenknecht LE, West DS, Williamson DF, Yanovski SZ: Cardiovascular effects of intensive lifestyle intervention in type 2 diabetes. N Engl J Med 369:145-154, 2013. [ Links ]
84. Mallamaci F, Ruggenenti P, Perna A, Leonardis D, Tripepi R, Tripepi G, Remuzzi G, Zoccali C: ACE inhibition is renoprotective among obese patients with proteinuria. J Am Soc Nephrol 22:1122-1128, 2011. [ Links ]
85. Friedman AN, Wolfe B: Is Bariatric Surgery an Effective Treatment for Type II Diabetic Kidney Disease? Clin J Am Soc Nephrol 11:528-535, 2016 . [ Links ]
86. Chang AR, Chen Y, Still C, Wood GC, Kirchner HL, Lewis M, Kramer H, Hartle JE, Carey D, Appel LJ, Grams ME: Bariatric surgery is associated with improvement in kidney outcomes. Kidney Int 90: 16 4-171, 2016 . [ Links ]
87. Jamal MH, Corcelles R, Daigle CR, Rogula T, Kroh M, Schauer PR, Brethauer SA: Safety and effectiveness of bariatric surgery in dialysis patients and kidney transplantation candidates. Surg Obes Relat Dis 11:419-423, 2015. [ Links ]
88. Ahmadi SF, Zahmatkesh G, Ahmadi E, Streja E, Rhee CM, Gillen DL, De NL, Minutolo R, Ricardo AC, Kovesdy CP, Kalantar-Zadeh K: Association of Body Mass Index with Clinical Outcomes in Non-Dialysis-Dependent Chronic Kidney Disease: A Systematic Review and Meta-Analysis. Cardiorenal Med 6:37-49, 2015. [ Links ]
Referenciar este artículo: Kovesdy Csaba, Furth Susan, Zoccali Carmine, et al. *Members of the World Kidney Day Steering Committee are: Philip Kam Tao Li, Guillermo Garcia-Garcia, Mohammed Benghanem-Gharbi, Rik Bollaert, Sophie Dupuis, Timur Erk, Kamyar Kalantar-Zadeh, Csaba Kovesdy, Charlotte Osafo, Miguel C. Riella, Elena Zakharova. Obesity and kidney disease: hidden consequences of the epidemic. Rev. Colomb. Nefrol. 2017; 4(1): 112 - 121
Recibido: 12 de Enero de 2016; Aprobado: 02 de Febrero de 2017; Publicado: 07 de Febrero de 2017











 texto en
texto en