Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Nefrología
On-line version ISSN 2500-5006
Rev. colom. nefrol. vol.4 no.2 Bogotá July/Dec. 2017
https://doi.org/10.22265/acnef.4.2.255
Artículo de revisión
Metformina en enfermedad renal diabética: estado actual
1 Médico cardiólogo, Capítulo de Hipertensión Arterial, Sociedad Venezolana de Cardiología, Venezuela.
2 Médico nefrólogo, Capítulo Cardiorrenal, Sociedad Venezolana de Cardiología, Venezuela.
El tratamiento actual dirigido a retardar la progresión de la enfermedad renal diabética incluye el control intensivo de la glucemia, con control óptimo de la hipertensión arterial y bloqueo del sistema renina-angiotensina-aldosterona, junto con otras intervenciones multifactoriales. Sin embargo, a pesar de estas medidas, la protección renal no se alcanza en su totalidad. Hay escasos estudios que analizan el efecto nefroprotector de las drogas antihiperglucemiantes, más allá de su efecto hipoglucemiante.
Este artículo analiza la información existente sobre el estatus actual de la metformina en la enfermedad renal diabética.
Palabras clave: metformina; enfermedad renal diabética; antihiperglucemiante; nefroprotección
Current therapy directed at delaying the progression of diabetic renal disease includes intensive glycemic and optimal blood pressure control, renin angiotensin-aldosterone system blockade and multifactorial intervention. However, the renal protection provided by these therapeutic modalities is not complete. There is a scarcity of studies analyzing the nephroprotective effect of antihyperglycemic drugs beyond their glucose lowering effect and progression of diabetic renal disease. This article updates the existing data about metformin in diabetic kidney disease.
Key words: Diabetic renal disease; metformin; antihyperglycemic; nephroprotective
Introducción
La enfermedad renal crónica (ERC) es un serio problema de salud pública cuya prevalencia se ha estimado entre 8 % y 16 % de la población a nivel mundial1. El manejo de esta afección representa un alto costo y un elevado porcentaje de estos pacientes termina en terapia sustitutiva renal (diálisis o trasplante)2. Por otro lado, el aumento acelerado en el número de pacientes con diabetes tiene un gran impacto sobre el desarrollo de la enfermedad renal diabética (ERD), pues es una de las complicaciones más frecuentes de ambos tipos de diabetes. A su vez, es la primera causa de enfermedad renal terminal (ERT), responsable de casi el 50 % de los casos en países del primer mundo3.
Por tal motivo, se justifican las intervenciones intensivas sobre el control metabólico de la enfermedad, con el fin de minimizar el riesgo de ERT y aliviar la pesada carga socioeconómica que esta afección respresenta2-4.
La ERD ocurre hasta en el 40 % de las personas con diabetes, tipo 1 o 2. Ello no solo representa el riesgo de progresar a ERT, sino que también se expresa con un aumento significativo en la morbilidad y mortalidad cardiovascular4,5. Por consiguiente, es de capital importancia identificar tempranamente a los pacientes en riesgo de afectación renal y/o retardo en su progresión, si ya existiere. El diagnóstico siempre se ha sustentado en el reconocimiento de la hiperglucemia crónica; la presencia de albuminuria junto con deterioro en la función renal, expresada por la tasa de filtración glomerular estimada (TFGe, representada por la hiperfiltración, fases de albuminuria y proteinuria); la presencia de otras afecciones microvasculares, especialmente la retinopatía diabética; y la ausencia de signos de otro tipo de enfermedad renal4,6,7 (figura 1). En resumen, la génesis de la ERD es un proceso complejo que se puede modificar con el control metabólico adecuado, donde es fundamental el buen manejo de la glucemia.
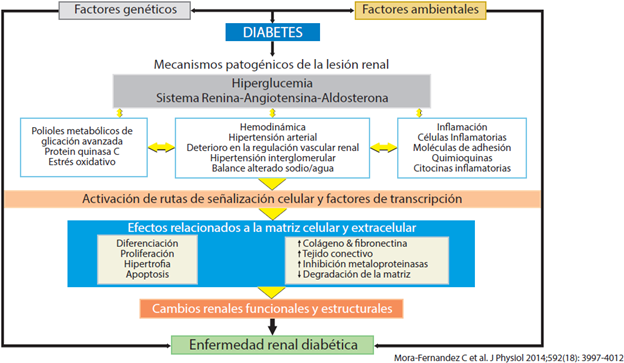
Figura 1 Factores involucrados en la génesis de la enfermedad renal diabética (modificado de Mora-Fernández y colaboradores7).
El uso de la metformina (en monoterapia o combinada) se ha consolidado como estrategia terapéutica de primera línea8,9. En este artículo se revisa el papel de la metformina en la ERD10, sus riesgos y potenciales beneficios.
Diabetes, enfermedad renal y metformina
Por varias décadas, esta biguanida ha sido considerada como la medicación antidiabética por excelencia. Sin embargo, la aceptación de esta droga no fue fácil. En Europa, devino con la publicación del United Kingdom Prevention Diabetes Study (UKPDS) en los años setenta11. Posteriores revisiones del comité ad hoc de la Administración Federal de Drogas (FDA por sus siglas en inglés) recomendaron que fuera administrada según la TFGe, pero nunca si esta era menor de 30 mL/ min/1,73m2, en un dictamen que modificó la apreciación de la seguridad de la droga, discutido más adelante12. Pocas semanas antes, la Agencia Europea del Medicamento (EAM) había adoptado una posición similar13.
Como objetivo original, la metformina suprime la producción hepática de glucosa, siento este su principal mecanismo de acción para mejorar la hiperglucemia en la diabetes mellitus tipo 2 (DM2). Bioquímicamente, la metformina suprime la gluconeogénesis y estimula la glucólisis, además de inhibir la glucogenólisis, una vía que contribuye críticamente a elevar la producción hepática de glucosa. Aparte de estos efectos beneficiosos sobre la hiperglucemia, la metformina también mejora la resistencia a la insulina y corrige la dislipidemia en los pacientes con DM2 y diversas acciones pleiotrópicas. Sus propiedades antiinflamatorias aún no han sido aclaradas por completo10,14,15.
¿Es realmente nefroprotectora la metformina?
Es bien conocido que la hiperglucemia es el principal desencadenante de la ERD, que inicia numerosos cambios microscópicos y ultramicroscópicos en la arquitectura renal16.
Entre los primeros, se han descrito: engrosamiento de la membrana basal, glomerular y tubular; así como proliferación del mesangio, arteriosclerosis y anormalidades en la unión glomérulo tubular. Los cambios ultramicroscópicos se fundamentan en la lesión del podocito ("borramiento", pérdida de los diafragmas de rendija y disminución de su densidad) y se consideran como el punto medular en la génesis de la proteinuria en la ERD17. De los varios mecanismos involucrados en infringir daño a los podocitos, resalta la agresión sostenida por el incremento del estrés oxidativo16,18. Entre las diferentes variables vinculadas con esta mayor producción de especies de oxígeno reactivo, se encuentra la reducción del glutatión, inducida por hiperglucemia; la activación de la nicotinamida adenina dinucleotida fosfato (NADPH) oxidasa, vía hiperglucemia; de los productos finales de glicasión avanzada (AGEs); de proteína quinasa C (PKC); y del sistema renina angiotensina aldosterona (SRAA). Por lo demás, el estrés oxidativo es un fuerte inductor de apoptosis de células renales, especialmente de los podocitos16,19.
Visto este complejo escenario con numerosos actores de primer orden, es deseable que los fármacos antihiperglucemiantes ejerzan cierto control, o corrección, sobre varios de tales actores con la finalidad de retardar el avance de la ERD. Sin embargo, solo se han obtenido resultados esperanzadores y consistentes con el efecto sobre el control metabólico con los nuevos fármacos, como glifozinas o incretinas (específicamente, los agonistas del receptor del péptido-1, similar al glucagón [GLP-1], ya que, para los inhibidores de la dipeptidil peptidasa [DPP-4], no hay información pertinente) y los inhibidores del cotransportador-2 de sodio-glucosa (SGLT2 por sus siglas en inglés) o glifozinas se han obtenido resultados esperanzadores y consistentes con el efecto sobre el control metabólico20,21.
En cuanto a la metformina, un fármaco que ha superado la prueba del tiempo con 60 años de uso, tan solo se conocen algunos datos indirectos que apuntan a la protección. Estos deben ser considerados desde el punto de vista experimental y clínico, como se resume a continuación:
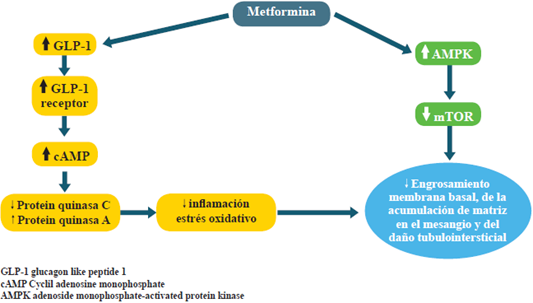
a) Experimentales: como ya se mencionó, la hiperglucemia incrementa la producción de las especies reactivas del oxígeno (ERO) en las células renales y, hasta hace poco tiempo, no se había demostrado que ningún fármaco tuviese la capacidad de evitar esta situación. En 2010, sin embargo, Piwkowska y su grupo demostraron que la activación de la proteína quinasa activada por AMP (AMPK por AMP, activated protein kinase)22, generada por la metformina, disminuye la oxidación del sistema NADPH. Esto lleva a la disminución de la producción de ERO en podocitos renales humanos cultivados.
Si bien esta activación de la AMPK es la principal vía terapéutica de los efectos de la metformina, las células renales bajo condiciones de hiperglucemia o proteinuria exhiben inactivación de los mecanismos celulares de defensa. Por ejemplo, AMPK y autofagia con activación de rutas patológicas, tales como: las dianas de la rapamicina en mamíferos (mTOR), estrés del retículo endoplásmico, transición epitelio-mesénquima, estrés oxidativo e hipoxia (figura 2)23.
Otro aspecto importante es la relación entre metformina y la concentración GLP-1, efecto comprobado tanto en ratones como en seres humanos24,25. Las posibles explicaciones son: incremento en la secreción de GLP-1, a partir de las células L de intestino; y, en menor grado, por reducción de su degradación por la enzima DPP4.
Otra ruta mencionada es indirecta, a través del "pool" de ácidos biliares26, que actuarían sobre sus receptores de las células L, para favorecer la secreción de GLP-1. Hasta ahora, se conoce poco el alcance de tal efecto en los pacientes con diabetes tipo 2. Otro estudio, en ratas con nefropatía diabética inducida por estreptozotocina, mostró que el tratamiento de la afectación renal con metformina normalizó todos los cambios bioquímicos y los depósitos de energía en el tejido renal28. A nivel transcripcional, el suministro de metformina causó una restauración significativa en los valores del ácido ribonucleico mensajero (mRNA), inducida por el estrés oxidativo, mientras que ocurría inhibición en los genes proinflamatorios, como el del factor alfa de necrosis tumoral y de la interleuquina-618.
De hecho, ya se han comprobado algunas de estas acciones, como en los siguientes casos:
Isquemia y reperfusión, posiblemente por la activación de la AMPK y de la sintasa del óxido nítrico29.
Restauración de los podocitos en ratas diabéticas tratadas con metformina, quizás por amortiguación o represión de la agresión oxidativa17, lo cual explicaría la reducción de la albuminuria en los pacientes con DM230.
Reprogramación de la autofagia, un mecanismo esencial con el cual la célula degrada y recicla macromoléculas y organelos. Funciona como mecanismo esencial para mantener la homeostasis del glomérulo y del túbulo renal31, proceso que se altera por el estrés oxidativo y la carga hiperglucémica. La activación de la AMPK por la metformina o resveratrol restaura debidamente el proceso de autofagia32.
b) En cuanto al respaldo clínico, varias publicaciones, derivadas de estudios de observación o de otro tipo, resaltan cierto rol de nefroprotección, como se resume a continuación:
En la publicación del Registro sueco de diabetes, la metformina fue bien tolerada en pacientes con ERC-3 y su uso estuvo asociado con una reducción del 13 % en la mortalidad total21. Más aún, en comparación con las sulfonilureas, el uso de metformina está asociado con una menor probabilidad de deterioro de la función renal33.
Crowley y colaboradores34, en una revisión sistemática de varios estudios que utilizaron metformina en pacientes con contraindicaciones históricas (ERD con TFG menor de 60 mL/ min/1,73 m2, insuficiencia cardíaca o enfermedad hepática), encontraron que su empleo estuvo asociado con reducción en la mortalidad total y con menos readmisiones por insuficiencia cardíaca, en los pacientes con ERC o falla cardíaca.
En la serie de pacientes con infarto agudo de miocardio que serán sometidos a intervención coronaria percutánea (ICP) de emergencia, presentada por Zeller y colaboradores35, hubo menos casos de IRA en el grupo que recibía metformina, que en el grupo que no la recibía. En un reducido de portadores de ERC concomitante, la ocurrencia de IRA fue similar con o sin metformina, sin que se detectaran casos de acidosis láctica. Estos resultados corroboran los de Posma y colaboradores36, quienes administraron metformina por cuatro meses a sujetos no diabéticos, que fueron sometidos a ICP. En el grupo tratado, se apreció un menor deterioro en la TFG y menor incidencia de IRA secundaria al contraste, aunque ninguno de los dos resultados fue estadísticamente significativo.
Metformina y la restricción de la función renal
Por varias décadas, una de las limitaciones más importantes impuesta por las autoridades regulatorias a la metformina fue la función renal, estableciendo, para contraindicar su empleo, el límite de creatinina en 1,4 mg/dL en mujeres y 1,5 mg/dL en hombres. Esta restricción se mantuvo, a pesar de que, ya en el año 2009, tanto la ADA (American Diabetes Association) como la EASD (European Association for Study of Diabetes) 37 postulaban que la metformina parecía segura, a no ser que la TFGe cayera por debajo de 30 mL/ min/1,73 m2. En años posteriores, se publicaron estudios clínicos y revisiones que justificaban la ampliación del uso de la metformina a pacientes con ERC-3 (es decir, entre 59 y 30 ml/min/1,73 m2) 37-41, debido a que estos pacientes, de por sí con mayor riesgo cardiovascular, se beneficiaban de esta droga.
Estas acciones culminaron en la decisión de la FDA12 y la EAM13 de permitir el uso de metformina hasta el grupo de pacientes con ERC-3, bajo ciertas condiciones bajo ciertas condiciones descritas más adelante:
Acidosis Láctica Asociada a Metformina (ALAM o MALA en inglés). La metformina se elimina, principalmente, sin ser metabolizada, por vía renal, mediante filtración glomerular y secreción tubular. Por tanto, los pacientes con falla renal son más susceptibles a su acumulación y al desarrollo de acidosis láctica, complicación que puede resultar mortal. De hecho, el factor precipitante para acidosis láctica en quienes reciben metformina es una pérdida abrupta de la secreción tubular. Dicha pérdida no ocurre en la ERC estable, pero es un rasgo característico de la agresión renal aguda o de la depleción rápida de volumen, asociada a una enfermedad intercurrente. Por tanto, los pacientes con ERC deben ser advertidos sobre el perfil de seguridad de la droga, de tal forma que puedan estar alerta a los potenciales efectos adversos y suministrar información escrita acerca de la suspensión de la metformina, si experimentan alguna enfermedad intercurrente que pueda conducir a una depleción rápida de volumen42.
Hasta hace pocos años, la relación entre acidosis láctica y acumulación de metformina estaba mal fundamentada. Ello contribuyó a las advertencias regulatorias que, lamentablemente, restringieron su uso, creando un temor exagerado ante el riesgo de dicho evento adverso43,44.
A la fecha, está bien documentado que el riesgo de ALAM es muy bajo (5/100.000 pacientes/año) y se asocia, habitualmente, a situaciones de mal estado general39,40,45. Además, en los últimos años, ha aumentado de forma considerable la experiencia en la utilización de la metformina, como lo revelan Inzucchi y colaboradores39 en su análisis de las publicaciones relacionadas con el tema entre enero de 1950 y junio de 2014. Ellos demostraron que los valores de lactato, frecuentemente, fueron normales en los pacientes que recibían metformina con ERC leve (TFGe 60 a 90 mL/min) o moderada (30 a 60 mL/ min). En los estudios en que el uso de la metformina estuvo asociado con incremento en la concentración de lactato, no se elevó hasta el nivel de acidosis láctica evidente (definida como nivel de lactato > 5 mmol/L y pH < 7,35). En los casos reportados de acidosis láctica, hubo otros factores causales asociados, como infección, insuficiencia hepática, insuficiencia renal aguda o colapso cardiovascular. Claramente, el uso de metformina fue concomitante, pero no causal, y la frecuencia de acidosis láctica, en los pacientes bajo tratamiento con metformina, fue la misma que la observada en los pacientes con DM2 que no recibían metformina39,45.
Otro estudio relevante, ya citado, fue el derivado del análisis de una base de datos del Registro nacional sueco, en 51.675 pacientes. No demuestra incremento del riesgo de ALAM en ninguno de los grupos, incluyendo a portadores de ERC33. Antes bien, los autores reportan que su empleo estuvo asociado con disminución de riesgo de enfermedad cardiovascular, infección severa y mortalidad por todas las causas, en comparación al tratamiento con insulina y reducción de la mortalidad total, en referencia a los otros agentes hipoglucemiantes.
En la revisión Cochrane de Salpeter y colaboradores46, del año 2010, se examinó el riesgo de acidosis láctica, fatal y no fatal, con metformina en la DM2. Se concluyó que, hasta el presente, no hay evidencia de que su empleo esté asociado con un incremento en el riesgo de acidosis láctica, cuando se prescribió bajo las condiciones del estudio. Los autores comentan que 153 (53 %) de los 334 estudios prospectivos permitieron la inclusión de pacientes con falla renal, lo que representó un seguimiento de 37.360 pacientes - años de uso de metformina. Uno de los estudios incluidos cuestionó las contraindicaciones estándar, al analizar 393 pacientes con, al menos, una contraindicación para su administración y no encontrar ningún caso de acidosis láctica en cuatro años de seguimiento47.
No obstante, es importante mencionar que la conjunción de pequeñas modificaciones en hidratación, función renal, concentración plasmática de metformina o la oxigenación tisular puede desencadenar ALAM48.
En consecuencia, dada la rareza de la acidosis láctica en el contexto del tratamiento con metformina, es totalmente impráctico un estudio clínico que pudiera demostrar la no inferioridad de la metformina en comparación con otros fármacos. Por consiguiente, los registros y estudios de observación son una alternativa razonable.
La reciente revisión de la FDA12, considerados los beneficios y la seguridad en los pacientes con falla renal leve a moderada, reglamentó el uso de la droga de este modo:
Antes de iniciar un tratamiento con metformina, calcular la TFG, utilizando este parámetro en lugar de la concentración de creatinina sérica, ya que la TFG aporta una mejor estimación de la función renal, considerando variables adicionales importantes, como la edad, sexo, raza o peso.
Uso contraindicado si la TFG es<30 mL/ min/1,73 m2.
No iniciar metformina si la TFG está entre 30-45 mL/min/1,73 m2.
Medir la TFG, al menos una vez al año, a todos los pacientes que reciban metformina. En aquellos con mayor riesgo de desarrollar insuficiencia renal (ancianos, pacientes frágiles), el monitoreo debe ser más frecuente.
Si, durante el tratamiento, el filtrado cae por debajo de 45 mL/min/1,73 m2, valorar la relación riesgo/beneficio de continuar con metformina. Si el filtrado desciende por debajo de 30 mL/ min/1,73 m2, debe suspenderse.
Interrumpir el tratamiento con metformina antes de un estudio con contraste de imagen iodado, en pacientes con filtrados entre 30-60 mL/min/1,73 m2 y en pacientes con enfermedad hepática, alcoholismo o insuficiencia cardíaca. Reevaluar el filtrado tras las 48 horas del estudio y, si la función renal es estable, reiniciar el tratamiento.
Adicionalmente, la Agencia Europea del Medicamento añade las siguientes consideraciones13:
Antes y durante el tratamiento deben revisarse los factores de riesgo para la acidosis láctica. La deshidratación significa un mayor riesgo.
En las combinaciones a dosis fijas que contienen metformina, deben tenerse en cuenta las recomendaciones de ajuste de dosis del otro medicamento, en los pacientes con función renal reducida. Es posible que el ajuste de dosis solo pueda realizarse usando tabletas individuales de metformina y del otro medicamento.
Algunos productos de combinación de dosis fija no se recomiendan en pacientes con función renal reducida, porque no se debe utilizar la otra sustancia activa en la combinación. Por ejemplo, dapagliflozina/metformina no se recomienda en pacientes con TFG < 60 mL/min; canagliflozina/ metformina y empagliflozina /metformina no se recomiendan en pacientes con TFG < 45 mL/ min y no deben iniciarse en pacientes con TFG < 60 mL/min.
Otro aspecto importante es el control estricto de la función renal, cuando se efectúa algún cambio en la dosis o clase de antihipertensivo que, potencialmente, afecta la presión de perfusión renal (especialmente diuréticos e inhibidores del SRA). Ajustar la dosis de metformina según convenga49.
El mejor abordaje para evitar la ERD es la prevención de la diabetes por sí misma. No obstante, una vez diagnosticada, el control de la glucemia puede retardar el desarrollo de la afección renal. En aquellos pacientes portadores de ERD, se impone el control estricto e intensivo de la glucemia, presión arterial con inhibidores del SRA y lípidos sanguíneos, para reducir la agresión vascular y el riesgo de enfermedad cardiovascular aterosclerótica8,9,37,42 (figura 3).
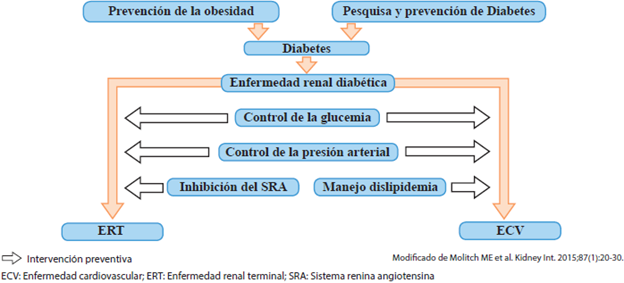
Figura 3 Abordaje múltiple de la enfermedad renal diabética (modificado de Molitch y colaboradores42).
Mensajes claves
El balance riesgo/beneficio de la metformina es claramente favorable en la mayoría de los pacientes diabéticos, especialmente cuando se cumplen cabalmente con los cambios en el estilo de vida. No obstante, su utilización no está exenta de riesgos que tanto el médico, como el paciente y familiares, deben conocer50. Bajo la conceptualización actual de la droga, es conveniente ser consciente de que:
Su inicio en pacientes con ERC estadio 4-5 no está permitido y tampoco sustentado por la evidencia.
El paciente debe ser informado de que, como cualquier otra droga, la metformina posee ventajas, desventajas y efectos putativos.
Los factores de riesgo identificados para ALAM incluyen: falla renal aguda, deshidratación, hipoxemia, sepsis, abuso de alcohol, insuficiencia hepática y shock.
Más aún, debe contarse que, en la edad avanzada, los pacientes con fragilidad hemodinámica, portadores con varias comorbilidades y con ERC se encuentran en mayor riesgo de ALAM, a pesar del ajuste de dosis de la metformina39,45,48,51.
Eventualmente, un estudio radiológico con contraste puede llevar a la insuficiencia renal aguda (IRA), por lo que se recomienda en pacientes con TFGe < 45 mL/min la suspensión de la metformina 48 antes del estudio y reiniciarla 48 horas después. Hasta el presente, se mantienen las contraindicaciones para su uso en pacientes con daño hepático y en embarazadas, con las limitaciones impuestas en los casos de deterioro severo de la función renal.
Protección de personas y animales
Los autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datos
Los autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informado
Los autores declaran que en este artículo no aparecen datos de pacientes.
Contribución de los autores
Cada uno de los autores participó en la revisión de la literatura, organización del artículo, escogencia de las figuras y referencias bibliográficas y en la redacción y revisión del texto definitivo.
REFERENCIAS
1. Jha V, Garcia-Garcia G, Iseki K, Li Z, Naicker S, Plattner B, Saran R, Wang AY, Yang CW. Chronic kidney disease: Global dimension and perspectives. Lancet. 2013;382:260-72. Disponible en: https://doi.org/10.1016/S0140-6736(13)60687-X. [ Links ]
2. Anand S., Bitton A., Gaziano T. The gap between estimated incidence of end-stage renal disease and use of therapy. PLoS ONE. 2013;8:e72860. Disponible en: https://doi.org/10.1371/journal.pone.0072860. [ Links ]
3. Tuttle KR, Bakris GL, Bilous RW, Chiang JL, de Boer IH, Goldstein-Fuchs J, Hirsch IB, Kalantar-Zadeh K, Narva AS, Navaneethan SD, Neumiller JJ, Patel UD, Ratner RE, Whaley-Connell AT, Molitch ME. Diabetic kidney disease: a report from an ADA Consensus Conference. Am J Kidney Dis. 2014;64(4):510-33. Disponible en: https://doi.org/10.1053/j.ajkd.2014.08.001. [ Links ]
4. National Kidney Foundation. KDOQI Clinical practice guideline for diabetes and CKD: 2012 update. Am J Kidney Dis . 2012;60(5):850-86. Disponible en: https://doi.org/10.1053/j.ajkd.2012.07.005. [ Links ]
5. Lopez-Giacoman S, Madero M. Biomarkers in chronic kidney disease, from kidney function to kidney damage. World J Nephrol. 2015;4(1):57-73. Disponible en: https://doi.org/10.5527/wjn.v4.i1.57. [ Links ]
6. Adler AI, Stevens RJ, Manley SE, et al. Development and progression of nephropathy in type 2 diabetes: The United Kingdom Prospective Diabetes Study (UKPDS 64). Kidney Int. 2003;63:225-32. Disponible en: https://doi.org/10.1046/j.1523-1755.2003.00712.x. [ Links ]
7. Mora-Fernández C, Domínguez-Pimentel V, de Fuentes MM, Górriz JL, Martínez-Castelao A, Navarro-González JF. Diabetic kidney disease: from physiology to therapeutics. J Physiol. 2014;592(18):3997-4012. Disponible en: https://doi.org/10.1113/jphysiol.2014.272328. [ Links ]
8. Inzucchi SE, Bergenstal RM, Buse JB, et al. Management of hyperglycemia in type 2 diabetes, 2015: A patient-centered approach update to a position statement of the American Diabetes Association and the European Association for the Study of Diabetes. Diabetes Care. 2015;38(1):140-9. Disponible en: https://doi.org/10.2337/dc14-2441. [ Links ]
9. American Diabetes Association. Pharmacological approaches to glycemic treatment. Diabetes Care , 2017;40(Suppl. 1):S64-74. Disponible en: https://doi.org/10.2337/dc17-S012. [ Links ]
10. Anabtawi A, Miles JM. Metformin: Nonglycemic effects and potential novel indications. Endocr Pract. 2016;22(8):999-1007. Disponible en: https://doi.org/10.4158/EP151145.RA. [ Links ]
11. UK Prospective Diabetes Study (UKPDS) Group. Effect of intensive blood-glucose control with metformin on complications in overweight patients with type 2 diabetes (UKPDS 34). Lancet. 1998;352:854-65. Disponible en: https://doi.org/10.1016/S0140-6736(98)07037-8. [ Links ]
12. US Food and Drug Administration. FDA Drug Safety Communication: FDA revises warnings regarding use of the diabetes medicine metformin in certain patients with reduced kidney function. April 8, 2016. Disponible en: Disponible en: http://www.fda.gov/downloads/Drugs/DrugSafety/UCM494140.pdf Accedido: Octubre 12, 2016. [ Links ]
13. European Medicines Agency. Use of metformin to treat diabetes now expanded to patients with moderately reduced kidney function. 14 October 2016. EMA/603690/2016. Disponible en: Disponible en: www.ema.europa.eu/.../index.jsp?curl=pages/news_and_events/news/2016/10/news_detail_002620.jsp&mid=WC- 45k Accedido: Noviembre 15, 2016. [ Links ]
14. Zheng J, Woo SL, Hu X, Botchlett R, Chen L, Huo Y, Wu C. Metformin and metabolic diseases: a focus on hepatic aspects. Front Med. 2015;9(2):173-86. Disponible en: https://doi.org/10.1007/s11684-015-0384-0. [ Links ]
15. Cameron AR, Morrison VL, Levin D, Mohan M, Forteath C, Beall C, et al. Anti-inflammatory effects of metformin irrespective of diabetes status. Circ Res. 2016;119(5):652-65. Disponible en: https://doi.org/10.1161/CIRCRESAHA.116.308445. [ Links ]
16. Bhatti AB, Usman M. Drug Targets for oxidative podocyte injury in diabetic nephropathy. Cureus. 2015;7(12):e393. Disponible en: https://doi.org/10.7759/cureus.393. [ Links ]
17. Anil Kumar P, Welsh GI, Saleem MA, Menon RK. Molecular and cellular events mediating glomerular podocyte dysfunction and depletion in diabetes mellitus. Front Endocrinol (Lausanne). 2014;5:151. Disponible en: https://doi.org/10.3389/fendo.2014.00151. [ Links ]
18. Fakhruddin S, Alanazi W, Jackson KE. Diabetes-induced reactive oxygen species: Mechanism of their generation and role in renal injury. J Diabetes Res. 2017;2017:8379327. Disponible en: https://doi.org/10.1155/2017/8379327. [ Links ]
19. Kim J, Shon E, Kim CS, Kim JS. Renal podocyte injury in a rat model of type 2 diabetes is prevented by metformin. Exp Diabetes Res. 2012;2012:210821. Disponible en: https://doi.org/10.1155/2012/210821. [ Links ]
20. Tonneijck L, Smits MM, Muskiet MH, Hoekstra T, Kramer MH, Danser AH, Diamant M, Joles JA, van Raalte DH. Acute renal effects of the GLP-1 receptor agonist exenatide in overweight type 2 diabetes patients: a randomised, double-blind, placebo-controlled trial. Diabetologia. 2016;59(7):1412-21. Disponible en: https://doi.org/10.1007/s00125-016-3938-z. [ Links ]
21. Cherney D, Lund SS, Perkins BA, Groop PH, Cooper ME, Kaspers S, Pfarr E, Woerle HJ, von Eynatten M. The effect of sodium glucose cotransporter 2 inhibition with empagliflozin on microalbuminuria and macroalbuminuria in patients with type 2 diabetes. Diabetologia . 2016;59(9):1860-70. Disponible en: https://doi.org/10.1007/s00125-016-4008-2. [ Links ]
22. Piwkowska A, Rogacka D, Jankowski M, Dominiczak MH, Stepinski JK, Angielski S. Metformin induces suppression of NAD(P) H oxidase activity in podocytes. Biochem Biophys Res Commun. 2010;393(2):268-73. Disponible en: https://doi.org/10.1016/j.bbrc.2010.01.119. [ Links ]
23. Ravindran S, Kuruvilla V, Wilbur K, Munusamy S. Nephroprotective effects of metformin in diabetic nephropathy. J Cell Physiol. 2017;232(4):731-42. Disponible en: https://doi.org/10.1002/jcp.25598. [ Links ]
24. Preiss D, Dawed A, Welsh P, Heggie A, Jones AG, Dekker J, Koivula R, Hansen TH, Stewart C, Holman RR, Franks PW, Walker M, Pearson ER, Sattar N; Direct consortium group. Sustained influence of metformin therapy on circulating glucagon-like pepti-de-1 levels in individuals with and without type 2 diabetes. Diabetes Obes Metab. 2017;19(3):356-63. Disponible en: https://doi.org/10.1111/dom.12826. [ Links ]
25. DeFronzo RA, Buse JB, Kim T, Burns C, Skare S, Baron A, Fineman M. Once-daily delayed-release metformin lowers plasma glu cose and enhances fasting and postprandial GLP-1 and PYY: results from two randomised trials. Diabetologia . 2016;59(8):1645-54. Disponible en: https://doi.org/10.1007/s00125-016-3992-6. [ Links ]
26. McCreight LJ, Bailey CJ, Pearson ER. Metformin and the gastrointestinal tract. Diabetologia . 2016;59(3):426-35. Disponible en: https://doi.org/10.1007/s00125-015-3844-9. [ Links ]
27. Kim J, Shon E, Kim CS, Kim JS. Renal podocyte injury in a rat model of type 2 diabetes is prevented by metformin. Exp Diabetes Res . 2012;2012:210821. Disponible en: https://doi.org/10.1155/2012/210821. [ Links ]
28. Alhaider AA, Korashy HM, Sayed-Ahmed MM, Mobark M, Kfoury H, Mansour MA. Metformin attenuates streptozotocin-induced diabetic nephropathy in rats through modulation of oxidative stress genes expression. Chem Biol Interact. 2011;192(3):233-42. Disponible en: https://doi.org/10.1016/j.cbi.2011.03.014. [ Links ]
29. Taheri N, Azarmi Y, Neshat M, Garjani A, Doustar Y. Study the effects of metformin on renal function and structure after unilateral ischemia-reperfusion in rat. Res Pharm Sci. 2012;7:274. [ Links ]
30. Amador-Licona N, Guizar-Mendoza J, Vargas E, Sanchez-Camargo G, Zamora-Mata L. The short-term effect of a switch from glibenclamide to metformin on blood pressure and microalbuminuria in patients with type 2 diabetes mellitus. Arch Med Res. 2000;31:571-5. Disponible en: https://doi.org/10.1016/S0188-4409(00)00241-1. [ Links ]
31. Ding Y, Choi ME. Autophagy in diabetic nephropathy. J Endocrinol. 2015;224(1):R15-30. Disponible en: https://doi.org/10.1530/JOE-14-0437. [ Links ]
32. Kim J, Kundu M, Viollet B, Guan KL. AMPK and mTOR regulate autophagy through direct phosphorylation of Ulk1. Nature Cell Biology. 2011;13:132-41. Disponible en: https://doi.org/10.1038/ncb2152. [ Links ]
33. Ekstrom N, Schioler L, Svensson AM, et al. Effectiveness and safety of metformin in 51 675 patients with type 2 diabetes and different levels of renal function: a cohort study from the Swedish National Diabetes Register. BMJ Open. 2012;2:e001076. Disponible en: https://doi.org/10.1136/bmjopen-2012-001076. [ Links ]
34. Crowley MJ, Diamantidis CJ, McDuffie JR, Cameron CB, Stanifer JW, Mock CK et al. Clinical outcomes of metformin use in populations with chronic kidney disease, congestive heart failure, or chronic liver disease: A Systematic Review. Ann Intern Med. 2017;166(3):191-200. Disponible en: https://doi.org/10.7326/M16-1901. [ Links ]
35. Zeller M, Labalette-Bart M, Juliard JM, Potier L, Feldman LJ, Steg PG et al. Metformin and contrast-induced acute kidney injury in diabetic patients treated with primary percutaneous coronary intervention for ST segment elevation myocardial infarction: A multicenter study. Int J Cardiol. 2016;220:137-42. Disponible en: https://doi.org/10.1016/j.ijcard.2016.06.076. [ Links ]
36. Posma RA, Lexis CP, Lipsic E, Nijsten MW, Damman K, Touw DJ et al. Effect of metformin on renal function after primary percutaneous coronary intervention in patients without diabetes Presenting with ST-elevation myocardial infarction: Data from the GIPS-III Trial. Cardiovasc Drugs Ther. 2015;29(5):451-9. Disponible en: https://doi.org/10.1007/s10557-015-6618-1. [ Links ]
37. Nathan DM, Buse JB, Davidson MB, et al.; American Diabetes Association; European Association for Study of Diabetes. Medical management of hyperglycemia in type 2 diabetes: a consensus algorithm for the initiation and adjustment of therapy: a consen sus statement of the American Diabetes Association and the European Association for the Study of Diabetes. Diabetes Care . 2009;32:193-203. Disponible en: https://doi.org/10.2337/dc08-9025. [ Links ]
38. Miles JM, Rule AD, Borlaug BA. Use of metformin in diseases of aging. Curr Diab Rep. 2014;14:490. Disponible en: https://doi.org/10.1007/s11892-014-0490-4. [ Links ]
39. Inzucchi SE, Lipska KJ, Mayo H, Bailey CJ, McGuire DK. Metformin in patients with type 2 diabetes and kidney disease: a sys tematic review. JAMA. 2014;312(24):2668-75. Disponible en: https://doi.org/10.1001/jama.2014.15298. [ Links ]
40. Inzucchi SE, Bergenstal RM, Buse JB, et al. Management of hyperglycemia in type 2 diabetes: a patient-centered approach: po sition statement of the American Diabetes Association (ADA) and the European Association for the Study of Diabetes (EASD). Diabetes Care . 2012;35:1364-79. Disponible en: https://doi.org/10.2337/dc12-0413. [ Links ]
41. Holstein A, Stumvoll M. Contraindications can damage your health: is metformin a case in point? Diabetologia . 2005;48(12):2454-9. Disponible en: https://doi.org/10.2337/dc12-0413. [ Links ]
42. Molitch ME, Adler AI, Flyvbjerg A, Nelson RG, So WY, Wanner C, Kasiske BL, Wheeler DC, de Zeeuw D, Mogensen CE. Diabetic kidney disease: a clinical update from Kidney Disease: Improving Global Outcomes. Kidney Int . 2015;87(1):20-30. Disponible en: https://doi.org/10.1038/ki.2014.128. [ Links ]
43. Nye HJ, Herrington WG. Metformin: The safest hypoglycaemic agent in chronic kidney disease? Nephron Clin Pract. 2011;118(4):c380-3. Disponible en: https://doi.org/10.1159/000323739. [ Links ]
44. Stades AM, Heikens JT, Erkelens DW, Holleman F, Hoekstra JB. Metformin and lactic acidosis: cause or coincidence? A review of case reports. J Intern Med. 2004;255(2):179-87. Disponible en: https://doi.org/10.1046/j.1365-2796.2003.01271.x. [ Links ]
45. DeFronzo R, Fleming GA, Chen K, Bicsak TA. Metformin-associated lactic acidosis: Current perspectives on causes and risk. Metabolism. 2016;65(2):20-9. Disponible en: https://doi.org/10.1016/j.metabol.2015.10.014. [ Links ]
46. Salpeter SR, Greyber E, Pasternak GA, Salpeter EE. Risk of fatal and nonfatal lactic acidosis with metformin use in type 2 diabetes mellitus. Cochrane Database Syst Rev 2010;CD002967: 10.1002/14651858.CD002967.pub3. [ Links ]
47. Hung SC, Chang YK, Liu JS, Kuo KL, Chen YH, Hsu CC, Tarng DC. Metformin use and mortality in patients with advanced chronic kidney disease: national, retrospective, observational, cohort study. Lancet Diabetes Endocrinol. 2015;3(8):605-14. [ Links ]
48. Visconti L, Cernaro V, Ferrara D, Costantino G, Aloisi C, Amico L et al. Metformin-related lactic acidosis: Is it a myth or an underestimated reality? Renal Failure 2016;38:1560-65. [ Links ]
49. Ioannidis I. Diabetes treatment in patients with renal disease: Is the landscape clear enough? World J Diabetes. 2014;5(5):651-58. [ Links ]
50. Arocha Rodulfo JI, Navas Blanco T, Aure G, Palacios A. Metformina, el fármaco paradigma del siglo XXI. Med Interna (Caracas). 2017;33:4-18. [ Links ]
51. Moioli A, Maresca B, Manzione A, Napoletano AM, Coclite D, Pirozzi N, Puns G, Menè P. Metformin associated lactic acidosis (MALA): clinical profiling and management. J Nephrol. 2016;29(6):783-789. [ Links ]
Referenciar este artículo: Arocha Rodulfo JI, Amair Maini P. Metformina en enfermedad renal diabética: estado actual. Rev. Colomb. Nefrol. 2017;4(2): 188-199. Doi: http://dx.doi.org/10.22265/acnefA2.255
Recibido: 23 de Mayo de 2017; Aprobado: 08 de Agosto de 2017











 text in
text in