Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Revista Colombiana de Nefrología
versión On-line ISSN 2500-5006
Rev. colom. nefrol. vol.4 no.2 Bogotá jul./dic. 2017
https://doi.org/10.22265/acnef.4.2.218
Reporte de caso
Enfermedad linfoproliferativa en el injerto renal. Reporte de un caso y revisión de la literatura
1 Hospital Universitario San Ignacio, Departamento de Medicina Interna, Bogotá D.C, Colombia.
2 Pontificia Universidad Javeriana, Facultad de Medicina, Bogotá D. C, Colombia.
Los desórdenes linfoproliferativos postrasplante (PTLD por sus siglas en inglés: Posttransplant Lymphoproliferative disorders) se presentan en 3 a 10% de adultos con trasplante de órgano sólido (TOS). Se ha asociado a infección por Virus Epstein Barr (VEB). Es difícil diferenciar PTLD de rechazo o infección viral, porque los hallazgos clínicos e histopatológicos son muy similares. Presentamos el caso de un paciente con enfermedad renal crónica (ERC) secundaria a glomerulonefritis IgM, con trasplante renal de donante cadavérico, quien presentó proteinuria y disminución de la función renal, se le documentó una masa en el injerto renal compatible con desorden linfoproliferativo pos-trasplante renal de tipo polimórfico (PTLD), VEB positivo y CD 20 positivo. El tratamiento consistió en rituximab 375 mg/m2 semanales, cuatro dosis, se realizó control con imágenes y se adicionó el esquema CHOP (ciclofosfamida, vincristina, doxorubicina). El paciente toleró de manera adecuada la quimioterapia, no requirió radioterapia, ni trasplantectomía y después del R-CHOP la masa disminuyó de manera significativa hasta desaparecer al año de seguimiento manteniendo función óptima del injerto renal.
Palabras clave: trastornos linfoproliferativos; trasplante renal; tituximab; virus Epstein Barr
Posttransplant Lymphoproliferative Disorders (PTLDs) occur in 3 to 10% of adults with solid organ transplant (SOT). It has been associated with Epstein Barr Virus (EBV) infection. Differential diagnostics of PTLD from rejection or viral infection is difficult when the tumor infiltrates the graft, because the clinical and histopathological findings are similar. We report a case of patient with chronic kidney disease due to Ig M glomerulonephritis with cadaveric donor kidney transplantation who presented proteinuria and decreased glomerular filtration rate, with a solid mass at renal graft and confirmatory histology of polymorphic renal transplant lymphoproliferative disorder (PTLD), VEB positive, and CD 20 positive. The patient was treated with rituximab 375 mg / m2 weekly, four doses, followed by chemotherapy with ciclophosphamide, vincristine and doxorubicin. He didn't need radiotherapy or graft nephrectomy, with complete remission at one year of follow-up and optimal graft function.
Key words: Epstein Barr Virus; kidney transplantation; rituximab; lymphoproliferative disorders
Introducción
La enfermedad linfoproliferativa en el postrasplante (PTLD) representa una de las complicaciones más severas en el trasplante de órgano sólido (TOS) y de células hematopoyéticas. El riesgo de presentación es de 10 a 20 veces más alto que en la población general1,2. Afecta de 1 a 20 % de pacientes con TOS2,3. La incidencia es de 0,7 % a 2,9 % en el trasplante renal1,3, siendo mayor en trasplante de intestino, páncreas y pulmón (4-7 %)1,3. Se caracteriza por la producción descontrolada de linfocitos B y de linfocitos T, con menos frecuencia3,4. Existen factores de riesgo asociados, como raza caucásica, infección primaria por el virus Epstein Barr (EBV), uso de anticuerpos antilinfocíticos en terapia de inducción, coinfección por citomegalovirus (CMV), terapia antiviral, rechazo del injerto y tiempo previo en diálisis2,5. PTLD durante el primer año de trasplante, o de presentación temprana, es la forma más frecuente (hasta un 40 %) y puede asociarse a CD20 positivo. Se origina en la célula B, donde el rol del virus es incierto6. La forma tardía, o de tipo monomórfico, aparece después del primer año de trasplante, es EBV negativo y se origina en la célula T y las natural killer, tiene, además, peor pronóstico7. Diferenciar PTLD de episodios de rechazo o infección viral es difícil cuando el tumor infiltra el injerto porque los hallazgos clínicos e histopatológicos son muy similares. Es más frecuente en niños con inmunosupresión agresiva que no han presentado infección por el VEB8.
Las alteraciones linfoproliferativas se clasifican en hiperplasia benigna, donde hay proliferación difusa de células mononucleares con tejido conservado; PTLD tipo polimórfico, caracterizado por linfocitos en distintas fases de diferenciación, daño tisular y zonas de necrosis; tipo monomórfico, donde el tejido tiene transformación neoplásica; y, por último, el linfoma de Hodgkin clásico7,9,10. El PTLD que surge de las células B se identifica con la tinción CD20. La reducción de la inmunosupresión es la primera línea de tratamiento en PTLD polimórfico temprano9.
La remisión después del tratamiento con quimioterapia CHOP (ciclofosfamida, doxorubicina, vincristina y prednisolona) alcanza el 75 %, y es superior cuando se realiza radioterapia o extracción del tumor. La mortalidad es del 40-70 % a 5 años8,9.
Reportamos el caso de un paciente con una masa en el riñón trasplantado compatible con PTLD polimórfico CD 20+ y VEB positivo, que recibió tratamiento con R-CHOP mostrando buena respuesta y evolución clínica favorable.
Descripción del caso clínico
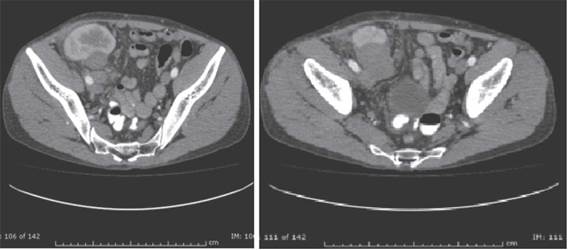
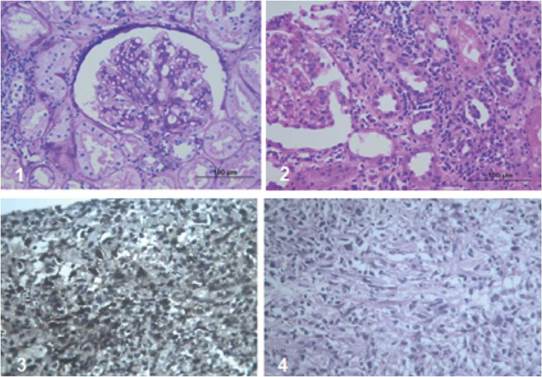
Se trata de un hombre de 38 años, con diagnóstico de enfermedad renal crónica (ERC) secundaria a glomerulonefritis IgM, en hemodiálisis por 9 años. Fue trasplantado con donante cadavérico en enero de 2008, riesgo intermedio para CMV, serologías IgG para VEB donante/receptor positivo. Recibió inducción con basiliximab y terapia de mantenimiento con ciclosporina, manteniendo niveles séricos C2 acorde a lo recomendado en esos años. Micofenolato mofetil 2000 mg día y prednisolona 5 mg cada día. La creatinina promedio durante el primer año fue 1,3 mg/dL. Tres meses postrasplante, presenta proteinuria de 1,2 g/día, por lo que se le toma biopsia renal encontrando necrosis tubular aguda, sin evidencia de otras alteraciones. Sin embargo, persistía la proteinuria y se realiza nueva biopsia renal encontrando glomerulopatía del trasplante e infiltrado plasmocitario, sin inclusiones virales ni rechazo agudo celular o humoral; se optimizó inmunosupresión y se continuó seguimiento. Quince meses post trasplante presentó dolor abdominal y del injerto, ecografía doppler del injerto mostró masa hipoecoica, heterogénea con morfología irregular de contornos bien definidos de 49,7 x 37 x 33,3 mm con algunas estructuras vasculares en su interior, para este momento cursó con proteinuria de 9 gr/24 horas; se complementó estudio con escanografía de abdomen (figura 1) que confirmó el hallazgo de una masa hipodensa de 40 x 48 x 40 mm, dependiente del polo inferior del injerto renal. Se realizó biopsia de la lesión, que mostró infiltrado inflamatorio mononuclear intersticial que permeaba algunos túbulos renales con abundantes eosinófilos; en otros fragmentos, lesión tumoral compuesta por plasmocitos, linfocitos con nucléolo prominente y escasos macrófagos. La inmunohistoquímica presentaba abundantes células B CD20 positivas, entremezcladas con linfocitos T CD3 positivo, inmunoblastos activados CD30 positivos y algunos de ellos positivos para VEB. Asociado a nefritis túbulo intersticial crónica y nefropatía mediada por complejos inmunes incipiente. Se identificaron plasmocitos con expresión policlonal con cadenas livianas kappa y lambda, hallazgos compatibles con diagnóstico de PTLD polimórfico, VEB positivo (figura 2).
Injerto renal en fosa iliaca derecha, tamaño normal, masa hipodensa de contorno lobulado 50x48x40mm, localizada delante de los vasos iliacos, dependiente del polo inferior de este riñón, compatible con lesión neoplástica del injerto renal.
Tinciones de inmunoperoxidasa en la lesión tumoral
Plasmocitos con expresión policlonal, cadenas livianas Kappa y Lambda.
Células B CD20 positivas.
Linfocitos T CD3 positivo.
Inmunoblastos activados CD30 positivos y VEB positivo.
El tratamiento inicial consistió en disminuir la inmunosupresión, suspender ciclosporina e iniciar sirolimus. Se redujo el micofenolato mofetil a 1000 mg/día y posteriormente a 500 mg/d. Fue valorado por hematología, quien inició rituximab 375 mg/m2 semanales, cuatro dosis. Las imágenes de control mostraron disminución de la masa en solo un 20 %, por lo que se decidió tratamiento con esquema CHOP, (ciclofosfamida, vincristina, doxorubicina y prednisolona) por 6 ciclos.
La evolución del paciente fue favorable. Persistió con proteinuria y dislipidemia, sin hematuria y función renal estable. Toleró de manera adecuada la quimioterapia, no requirió radioterapia, ni nefrectomía del trasplante y, después del tratamiento, la masa disminuyó de manera significativa hasta desaparecer al año de seguimiento. El paciente evolucionó satisfactoriamente, con desaparición de la masa, creatinina de 1,0 mg/dL y proteinuria menor a 500 mg/día. El reporte del PET SCAN, al terminar todo el tratamiento, fue normal.
Discusión
El caso que presentamos muestra un compromiso de PTLD temprano, con VEB positivo y riesgo intermedio para infección por CMV. Se realizaron dos biopsias del riñón trasplantado debido a proteinuria y hematuria, las cuales no fueron compatibles con malignidad. La segunda biopsia mostró infiltrado severo plasmocitario intersticial, motivo por el cual se solicitaron estudios para infección por poliomavirus, que fueron negativos. Recibió profilaxis universal con valganciclovir para CMV durante 3 meses.
Un factor de riesgo claramente relacionado con PTLD es el grado de inmunosupresión. Sin embargo, el paciente tenía bajo riesgo inmunológico, la inducción fue con basiliximab y la asociación más frecuente es timoglobulina, que el paciente nunca recibió. Los niveles de ciclosporina estuvieron entre 900 y 1300 ng/mL durante los primeros 3 meses, situación que no se correlaciona con una inmunosupresión profunda.
Basados en lo publicado en la literatura, el tratamiento de PTLD debe ser individualizado y dependerá de la agresividad del tumor; de los cambios histológicos; del estado serológico del VEB; y de la localización de la lesión tumoral. Todos estos aspectos fueron tenidos en cuenta al momento decidir el esquema de tratamiento que se indicaría al paciente.
La disminución de la inmunosupresión es la primera línea de tratamiento en pacientes con PTLD polimórfico menos agresivo, debido al buen pronóstico9. En la literatura se ha documentado que, aun en los casos menos agresivos, puede ser insuficiente la reducción de la inmunosupresión4. En este paciente, la respuesta al reducir la inmunosupresión fue inadecuada, la positividad de tinciones histológicas para CD3, CD20, CD30 y de VEB justificó la adición de rituximab, sin alcanzar tampoco disminución de la masa, por lo que se adicionó quimioterapia con CHOP. No existe una recomendación clara respecto al manejo conjunto de rituximab y CHOP, pero lo cierto es que se puede administrar de manera concomitante o secuencial con similares resultados11.
El hallazgo de células linfoides atípicas soporta el diagnóstico de PTLD. Sin embargo, los hallazgos histológicos son muy variados y es muy difícil diferenciar PTLD de infección, rechazo o hipersensibilidad asociada a fármacos9.
En ocasiones, es necesario practicar radioterapia o cirugía1. El paciente no presentó efecto de masa, ni compromiso severo de la función renal, por lo que no fueron requeridas estas intervenciones. Por otra parte, parece haber relación entre aparición de PTLD e inmunosupresión con tacrolimus. El paciente estaba en manejo con ciclosporina y ante el diagnóstico de PTLD se cambió la inmunosupresión a sirolimus a pesar de la proteinuria y, se mantuvo el 25 % de la dosis de mofetil micofenolato como lo recomiendan muchos estudios11,12. La literatura no es clara respecto a qué tanto reducir la dosis de los inmunosupresores; pacientes críticamente enfermos deberían recibir mínimas dosis o inclusive manejarse libres de inmunosupresión y mantener la prednisolona en dosis de 7,5 a 10 mg/ día13. En casos menos severos, se podría reducir la dosis del inhibidor de calcineurina al 50 % y dos semanas después se puede hacer otra reducción del 50 % y suspender el micofenolato o la azatioprina14. La terapia antiviral es recomendada por muchos autores en niños con PTLD; es controversial su utilidad en adultos13.
El rituximab es un anticuerpo quimérico monoclonal anti CD20 con potente actividad depletora de células B. Inicialmente se utilizó para el tratamiento de linfoma folicular. Ha sido eficaz en el tratamiento de PTLD, ha mejorado la supervivencia y es considerado medicamento de segunda línea en PTLD. La dosis es de 375 mg/ m2/semanal, por cuatro dosis, y la monoterapia se usa en receptores de TOS que no responden a la reducción de la inmunosupresión en ausencia de CD20 circulante12. El rituximab no restaura la inmunidad específica de la célula T contra el VEB, lo que explica que el PTLD puede recurrir a los 4-8 meses de seguimiento15. El rituximab ha sido usado con sirolimus para mejorar la supervivencia del paciente y del injerto15.
Tsai DE y colegas analizaron a 42 pacientes con PTLD. La respuesta favorable al reducir la inmunosupresión se determinó por el valor normal de LDH y la carga viral con respecto al basal. La tasa de respuesta global fue de 44 % y la supervivencia a un año de 67 %, la tasa de recaída fue de 21 % y de rechazo 22 %16. La quimioterapia a base de CHOP (ciclofosfamida, doxorubicina, vincristina y prednisolona), ha demostrado remisión de PTLD en 75 % de los casos17. Penn realizó un estudio retrospectivo en Israel, en el que demostró que la sobrevida a 5 años es inferior al 5 % en pacientes tratados con monoquimioterapia, a diferencia de cuando se usan regímenes como CHOP y Pro MACE - CytaBOM (ciclofosfamida, doxorubicina, etopósido, prednisona, bleomicina, citarabina, vincristina, metotrexate y leucovorin), mostrando remisión cercana al 75 %17.
La radioterapia y/o cirugía resultan efectivas cuando el PTLD ocasiona efecto de masa, dolor o sangrado; o cuando el injerto es afectado por el tumor, caso en el cual se requiere tratamiento sistémico adicional1,17.
La respuesta fue adecuada, sin deterioro de la función renal y con disminución del tamaño de la masa. Algunos estudios han encontrado incremento de los episodios de rechazo al reducir la inmunosupresión; el paciente no presentó esta complicación. La posibilidad de recaída es variable, cercana al 20 %, por lo que se debe continuar seguimiento estricto a estos pacientes. En pacientes de alto riesgo parece ser útil vigilar la carga viral para VEB.
Conclusión
La presentación de PTLD en el injerto renal es rara, siendo más frecuente en el tipo polimórfico de aparición temprana. El compromiso tumoral a nivel del injerto es infrecuente. Diferentes informes de la literatura han mostrado una incidencia de hasta 2,9 % en pacientes con trasplante renal, sin encontrar estadísticas precisas del compromiso tumoral en el injerto por PTLD. El objetivo primordial del tratamiento es la cura de la enfermedad y concomitantemente preservar la función del injerto. Nuestro paciente respondió de manera satisfactoria al esquema rituximab junto a CHOP, lográndose preservar el injerto renal, sin alterar la función renal y sin requerir nefrectomía.
Protección de personas y animales
Los autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datos
Los autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informado
Los autores declaran que en este artículo no aparecen datos de pacientes.
Contribución de los autores
Martha Patricia Rodríguez Sánchez: construcción, presentación del caso, análisis del caso, elaboración de la discusión, revisión final y envío del artículo.
Paola Karina García Padilla: presentación del caso, análisis de resultados y revisión de documento final.
Kateir Mariel Contreras: actualización del documento, discusión y revisión de la bibliografía.
Camilo Alberto González González: análisis epidemiológico de los resultados.
Sofía Puentes: revisión y concepto de las imágenes radiográficas y presentación del caso.
REFERENCIAS
1. Jagadeesh D, Woda BA, Draper J, Evens AM. Post-transplant lymphoproliferative disorders: Risk, classification, and therapeutic recommendations. Curr Treat Options Oncol. 2012;13(1):122-36. Disponible en: https:doi.org/10.1007/s11864-011-0177-x. [ Links ]
2. Caillard S, Lamy FX, Quelen C, et al. Epidemiology of posttransplant lymphoproliferative disorders in adult kidney and kidney pancreas recipients: Report of the French registry and analysis of subgroups of lymphomas. Am J Transplant. 2012;12(3):682-93. Disponible en: https://doi.org/10.1111/j.1600-6143.2011.03896.x. [ Links ]
3. Petrara MR, Giunco S, Serraino D, Dolcetti R, De Rossi A. Post-transplant lymphoproliferative disorders: From epidemiology to pathogenesis-driven treatment. Cancer Lett. 2015;369(1):37-44. Disponible en: https://doi.org/10.1016/j.canlet.2015.08.007. [ Links ]
4. Tse E, Kwong Y-L. Epstein Barr virus-associated lymphoproliferative diseases: the virus as a therapeutic target. Exp Mol Med. 2015;47(1):e136. Disponible en: https://doi.org/10.1038/emm.2014.102. [ Links ]
5. Yoon J-H, Lee S, Kim H-J, et al. Comparative analysis of post-transplant lymphoproliferative disorder after kidney transplantation versus hematopoietic stem cell transplantation. Transpl Int. 2014;27(7):721-32. Disponible en: https://doi.org/10.1111/tri.12328. [ Links ]
6. Taylor AL, Marcus R, Bradley JA. Post-transplant lymphoproliferative disorders (PTLD) after solid organ transplantation. Crit Rev Oncol Hematol. 2005;56(1 Spec No):155-67. doi:10.1016/j.critrevonc.2005.03.015. [ Links ]
7. Morton M, Coupes B, Roberts SA, et al. Epidemiology of post-transplantation lymphoproliferative disorder in adult renal transplant recipients. Transplantation. 2013;95(3):470-8. Disponible en: https://doi.org/10.1097/TP.0b013e318276a237. [ Links ]
8. Jha B, Mohan N, Gajendra S, et al. Prompt diagnosis and management of Epstein-Barr virus-associated post-transplant lymphoproliferative disorder and hemophagocytosis: A dreaded complication in a post-liver transplant child. Pediatr Transplant. 2015;19(7):E177-80. Disponible en: https://doi.org/10.1111/petr.12558. [ Links ]
9. Dierickx D, Tousseyn T, Gheysens O. How I treat posttransplant lymphoproliferative disorders. Blood. 2015;126(20):2274-83. https://doi.org/10.1182/blood-2015-05-615872. [ Links ]
10. Singavi AK, Harrington AM, Fenske TS. Post-transplant lymphoproliferative disorders. Cancer Treat Res. 2015;165:305-27. https://doi.org/10.1007/978-3-319-13150-4_13. [ Links ]
11. Foran JM, Norton AJ, Micallef INM, et al. Loss of CD20 expression following treatment with rituximab (chimaeric monoclonal anti-CD20): A retrospective cohort analysis. Br J Haematol. 2001;114(4):881-3. Disponible en: https://doi.org/10.1046/j.1365-2141.2001.03019.x. [ Links ]
12. Parker A, Bowles K, Bradley JA, et al. Management of post-transplant lymphoproliferative disorder in adult solid organ transplant recipients - BCSH and BTS Guidelines. Br J Haematol . 2010;149(5):693-705. Disponible en: https://doi.org/10.1111/j.1365-2141.2010.08160.x. [ Links ]
13. Birkeland S a, Andersen HK, Hamilton-Dutoit SJ. Preventing acute rejection, Epstein-Barr virus infection, and posttransplant lymphoproliferative disorders after kidney transplantation: use of aciclovir and mycophenolate mofetil in a steroid-free immuno-suppressive protocol. Transplantation . 1999;67(9):1209-14. https://doi.org/10.1097/00007890-199905150-00002. [ Links ]
14. Caillard S, Dharnidharka V, Agodoa L, Bohen E, Abbott K. Posttransplant lymphoproliferative disorders after renal transplantation in the United States in era of modern immunosuppression. Transplantation . 2005;80(9):1233-43. Disponible en: https://doi.org/10.1097/01.tp.0000179639.98338.39. [ Links ]
15. Elstrom RL, Andreadis C, Aqui NA, et al. Treatment of PTLD with rituximab or chemotherapy. Am J Transplant . 2006;6(3):569-76. Disponible en: https://doi.org/10.1111/j.1600-6143.2005.01211.x. [ Links ]
16. Tsai DE, Hardy CL, Tomaszewski JE, et al. Reduction in immunosuppression as initial therapy for posttransplant lymphoproliferative disorder: analysis of prognostic variables and long-term follow-up of 42 adult patients. Transplantation . 2001;71(8):1076-88. Disponible en: https://doi.org/10.1097/00007890-200104270-00012. [ Links ]
17. Buell JF, Gross TG, Hanaway MJ, et al. Chemotherapy for posttransplant lymphoproliferative disorder: The Israel Penn International Transplant Tumor Registry Experience. Transplantation Proceedings. 2005;37(2):956-7. Disponible en: https://doi.org/10.1016/j.transproceed.2004.12.124. [ Links ]
Referenciar este artículo: Rodríguez Sánchez MP, García Padilla PK, Contreras KM, González González CA, Puentes S. Enfermedad linfoproliferativa en el injerto renal. Informe de un caso y revisión de la literatura Rev. Colomb. Nefrol. 2017;4(2): 210-216. Doi: http://dx.doi.org/10.22265/acnefA2.218
Recibido: 28 de Abril de 2017; Aprobado: 17 de Julio de 2017; : 27 de Julio de 2017











 texto en
texto en