Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Revista Colombiana de Nefrología
versión On-line ISSN 2500-5006
Rev. colom. nefrol. vol.5 no.1 Bogotá ene./jun. 2018
https://doi.org/10.22265/acnef.5.2.290
Artículo de investigación original
Resultados clínicos en receptores de trasplante renal posterior a la conversión a ImTOR
1 Unidad de Trasplantes, Fundación Valle del Lili, Cali, Colombia.
2 Centro de Investigaciones Clínicas, Fundación Valle del Lili, Cali, Colombia.
3 Facultad de Ciencias de la Salud, Universidad Icesi, Cali, Colombia.
Introducción:
los ImTOR, sirolimus y everolimus son una alternativa de inmunosupresión en personas que han recibido transplantes renales. En este artículo, se describe la experiencia de pacientes que han experimentado una conversión a ImTOR, y a los que se les ha hecho un seguimiento por más de cinco años.
Materiales y métodos:
se incluyeron pacientes con transplantes renales desde 1995 hasta 2013, quienes tuvieron indicación de suspensión del inhibidor de calcineurina (ICN) después del tercer mes posterior al trasplante. Todos los pacientes fueron sometidos a biopsia renal antes de la administración de ImTOR. Ningún paciente tuvo diagnóstico de nefropatía crónica, IFTA >40 % o proteinuria >350 mg/24h. Se elaboró un análisis descriptivo para todas las variables. Para estudiar la supervivencia del paciente y del injerto, y la incidencia de rechazo agudo, se usó el método de Kaplan-Meier.
Resultados:
de 1273 trasplantes renales, la conversión de ICN a ImTOR se realizó en 166 casos (13 %). Al 78 % (n=129) se le administró sirolimus. El 13 % de los pacientes perdió la función del injerto y 7 pacientes (4,2 %) fallecieron. En el 37 % de los casos, se retiró el ImTOR. La principal causa de retiro fue el hallazgo de proteinuria patológica. La incidencia de rechazo agudo después del cambio a ImTOR fue de 9,6 %. La supervivencia del injerto tras uno y cinco años fue de 96,6 % y 83,5 %, respectivamente; y la supervivencia del paciente a uno y cinco años fue de 98 % y 97 %, respectivamente.
Conclusiones:
el uso de inhibidores ImTOR parece ser seguro en este grupo de pacientes trasplantados, pues hubo una baja tasa de rechazo y buena supervivencia del injerto.
Palabras clave: trasplante de riñon; inmunosupresión; sirolimus; everolimus; insuficiencia renal crónica
Introduction:
mTOR inhibitors Sirolimus and Everolimus are an alternative for inmunosuppression in renal transplant recipients. The aim of the study was to describe the experience of patients with switch to mTOR inhibitors, followed up for more than five years.
Materials and methods:
Patients with renal transplantation from 1995 to 2013, who had indication of calcineurin inhibitor (CNI) withdrawl after the third month post-transplant were included. All patients underwent renal biopsy prior to conversion. No patient had a diagnosis of chronic nephtopathy, IFTA>40 % or proteinuria >350mg/24h. A descriptive analysis for all variables was devoloped. Kaplan-Meier method was used for the patient's and graft survival and graft rejection incidence.
Results:
From 1273 renal transplants, the switch from CNI to mTOR inhibitors was performed in 166 (13 %), 78 % (n=129) were switched to Sirolimus. 12,6 % of the patients lost graft function and 4,2 % (n=7) died. 37% had mTOR inhibitors withdrawal, and the major cause was pathologic proteinuria. The incidence of graft rejection after switching to mTOR inhibitors was 9,6 %. The one and five year graf survival was 96,6 % and 83,5 %. The patient survival at one and five years was 98 % and 97 %.
Conclusions:
The use of mTOR inhibitors drugs appears to be safe in the managgement of specific renal transplant recipients, with a low rejection rate and good survival.
Key words: Kidney transplantation; immunosuppression; sirolimus; everolimus; renal insufficiency chronic
Introducción
En Colombia, desde hace 40 años existen programas de trasplante de riñón como una alternativa definitiva en el tratamiento de la enfermedad renal crónica terminal (ERCT). Para el año 2015, se identificaron en Colombia 979.409 personas con ERCT, 34.469 de ellas se encontraban terapia de reemplazo renal (TRR) 1. Según el último informe del Sistema Nacional de Información en Donación y Trasplantes del Instituto Nacional de Salud 2, en el año 2015, 1.906 personas estaban en lista de espera para un trasplante renal. El promedio de espera fue 400 días y 61 pacientes fallecieron en lista de espera. Se realizaron 844 trasplantes de riñón 2. Según nuestro conocimiento, en Colombia no hay datos sobre la supervivencia global en pacientes trasplantados. Sin embargo, un estudio mostró una supervivencia a largo plazo de 90.7 % para los pacientes y 90.4 % para los injertos 3.
El trasplante renal es el tratamiento definitivo de elección para pacientes con ERCT, con una ostensible menor mortalidad respecto a pacientes en TRR con diálisis 4. Para lograr con éxito la supervivencia del injerto, se deben seguir regímenes farmacológicos de inmunosupresión, que permitan conseguir la aceptación del órgano trasplantado 5. La introducción de los inhibidores de calcineurina (ICN), unos de los principales fármacos utilizados para inmunosupresión postrasplante, mejoró de manera significativa la supervivencia de los pacientes trasplantados, alcanzando una supervivencia mayor al 90 %.
Sin embargo, a largo plazo se ha evidenciado una relación directa entre el tiempo de exposición/ dosis del fármaco y el desarrollo de eventos adversos. La causa del deterioro de la función del injerto es multifactorial. En contraste con lo que se pensaba anteriormente, la mayoría de los casos de pérdida del injerto renal tienen una causa aloinmune identificable 6, y también están relacionados con los efectos deletéreos de los ICN sobre la supervivencia del paciente y el injerto. Los ICN generan múltiples efectos adversos, dentro de los que se encuentran: nefrotoxicidad, hipertensión, hiperlipidemia, diabetes mellitus de novo, neoplasia e infección viral 7,8,9.
Con el advenimiento de nuevas terapias inmunosupresoras, se ha logrado diseñar estrategias terapéuticas encaminadas a minimizar el impacto negativo de los inhibidores de calcineurina sobre la disfunción crónica del injerto, y a disminuir las comorbilidades renales, cardiovasculares e infecciosas 10,11. Los fármacos inhibidores de la rapamicina o ImTOR (del inglés Mammalian Target of Rapamycin) son inmunosupresores con capacidad antiproliferativa y antimigratoria. Esto les confiere un potencial papel para proteger frente a la disfunción del injerto renal, disminuir el rechazo agudo, optimizar el perfil cardiovascular y reducir la aparición de tumores de novo 11,12. Todo ello puede, teóricamente, preservar la función renal y la vida del paciente a largo plazo en un grupo seleccionado de pacientes. Sin embargo, los efectos secundarios podrían contrarrestar estos beneficios en un plazo mayor 13,14,15. Así pues, el estudio pretende evaluar la experiencia de nuestra institución con el cambio de un anticalcineurínico a un ImTOR en 5 años de seguimiento, con el fin de evaluar la supervivencia del injerto, los efectos adversos y las complicaciones con el uso de estos medicamentos.
Materiales y métodos
Se realizó un estudio observacional retrospectivo. Se incluyeron pacientes con ERCT que fueron trasplantados en la Fundación Valle de Lili desde octubre de 1995 hasta diciembre de 2013. A partir de la introducción de ImTOR en el país, estos pacientes recibieron indicación de suspensión de ICN después del tercer mes posterior al trasplante.
Todos los pacientes fueron sometidos a biopsia renal previa a la conversión. Ningún paciente tuvo diagnóstico de nefropatía crónica, IFTA >40 % o proteinuria >350 mg/24h. Se excluyeron los pacientes provenientes de otras ciudades, pues para ellos el seguimiento postrasplante fue inferior a 30 días. El uso de ImTOR estuvo indicado en pacientes con antecedente de cáncer, neoplasia de novo, nefrotoxicidad documentada por biopsia y neurotoxicidad.
Los datos de los receptores fueron obtenidos del registro institucional de trasplante renal (TRENAL), creado desde 2009. La recolección de los datos específicos para el estudio fue realizada en una base de datos alterna, mediante revisión de historias clínicas y reportes de paraclínicos.
La toxicidad por ICN, tanto renal como neurológica, se estableció mediante biopsia y resonancia magnética cerebral, respectivamente. Para el análisis de los efectos adversos y las complicaciones, se tomaron las definiciones de la guía KDIGO 2009 16, que definió la proteinuria como una excreción urinaria de proteínas totales mayor a 300 mg/día; la dislipidemia como un registro de triglicéridos >500 mg/dL y/o LDL >100 mg/dL; la anemia como un nivel de hemoglobina <13,5 g/dL en hombres y <12 g/dL en mujeres. Adicionalmente, se realizó un diagnóstico de diabetes según las guías ADA 17. Para definir el rechazo agudo del injerto, se usaron los cirterios y clasificación de Banff 200718.
Se realizó un análisis estadístico descriptivo para todas las variables y para subgrupos seleccionados usando STATA 12.0. Se realizó el test de Shapiro-Wilk para determinar la normalidad de los datos. Aquellos datos con una distribución normal fueron resumidos en promedio ± desviación estándar, de lo contrario se resumieron por medio de medianas y rangos intercuartílicos. Las variables cualitativas fueron presentadas en proporciones y analizadas con la prueba de chi-cuadrado. Para el análisis de supervivencia del paciente, del injerto y para el estudio de la incidencia del rechazo agudo, se usó el análisis de Kaplan Meier y el test log-rank para comparar los diferentes grupos.
Resultados
De 1273 trasplantes renales, la conversión de ICN a ImTOR se realizó en 166 (13 %), de los cuales 25 (15,1 %) estuvieron en tratamiento menos de 6 meses. La mediana de la edad fue 48 años (RIC=35-57), el 59 % estuvo conformado por hombres y el 81 % de los trasplantes provino de donante fallecido.
El 85 % (n=141) estaba en tratamiento con ciclosporina; y el 15 % (n=25), con tacrolimus. El 78 % (n=129) fue convertido a sirolimus y el 22 % (n=37) a everolimus. La mediana de seguimiento postrasplante fue de 84 meses (RIC=43-126); y la mediana del tiempo de tratamiento con ImTOR, de 37 meses (RIC=10-71). Se presentó rechazo agudo en el 9,6 % (n=16), ninguno de los cuales fue humoral; pérdida del injerto, en 12,6 % (n=21); y muerte, en el 4,2 % (n=7). Las causas de muerte fueron malignidad (n=4) y sepsis (n=3) (Tabla 1).
Tabla 1 Características demográficas y clínicas de pacientes trasplantados renales con conversión a ImTOR
| Edad (años)* | 48 (35-57) |
|---|---|
| Tipo de donante | n (%) |
| Vivo | 31 (19 %) |
| Fallecido | 135(81%) |
| Género | n (%) |
| Femenino | 68 (41 %) |
| Masculino | 98 (59 %) |
| ICN | n (%) |
| Ciclosporina | 141(85 %) |
| Tacrolimus | 25 (15 %) |
| ImTOR | n (%) |
| Sirolimus | 129 (78 %) |
| Everolimus | 37 (22 %) |
| Tiempo de seguimiento postrasplante (meses)* | 84(43-126) |
| Tiempo de tratamiento con ImTOR (meses)* | 37 (10-71) |
| Rechazo agudo, n (%) | 16 (9,6 %) |
| Pérdida del injerto, n(%) | 21 (12,6 %) |
| Muerte, n (%) | 7 (4,2 %) |
* Mediana (RIC)
RIC: rango intercuartílico; ICN: inhibidores de calcineurina; ImTOR: inhibidores de rapamicina.
En el 56,6 % (n=94) de los pacientes, la causa de conversión a ImTOR fue la toxicidad por ICN. Esta causa estuvo seguida por la malignidad, en el 27,1 % (n=45), y por la infección por poliomavirus (4,8 %, n=8). El 53 % (n=24) de los pacientes con malignidad presentó cáncer de piel; el 17,8 % (n=8), síndrome linfoproliferativo postrasplante (PTLD); y el 28,9 % (n=13), otros tumores. De estos pacientes, 6 (13 %) tuvieron recaída de la malignidad.
En 62 pacientes (37 %), se retiró el ImTOR, y las principales causas para ello fueron: proteinuria patológica de novo (48,8 %, n=30), rechazo agudo tardío (19,4 %, n=12) y eventos adversos a ImTOR (11,3 %, n=7), como diarrea y estomatitis, entre otras.
En dos pacientes, la causa del retiro del ImTOR fue el desarrollo de infecciones: un paciente presentó infecciones urinarias por Klebsiella pneumoniae multirresistente y un paciente presentó tuberculosis pulmonar (Tabla 2).
Las complicaciones que se presentaron tras a la conversión a ImTOR fueron dislipidemia, en el 56,6 % de los casos (n=94); anemia, en el 20,4 % (n=34); diabetes mellitus de novo postrasplante, en el 5,4 % (n=7); infarto agudo de miocardio, en el 5,4 % (n=7); diagnóstico de hepatitis B y C, en el 1,2 % (n=2); y en 1 paciente (0,6 %) se presentó accidente cerebrovascular (Tabla 2).
Tabla 2 Características del uso de ImTOR
| Causas de conversión a ImTOR | n (%) |
|---|---|
| Toxicidad a ICN | 94 (56,6 %) |
| Malignidad | 45 (27,1 %) |
| Poliomavirus | 8 (4,8 %) |
| Disfunción crónica del injerto | 5 (3 %) |
| Efectos adversos gastrointestinales | 4 (2,4 %) |
| Otras | 10 (6 %) |
| Complicaciones posconversión | n (%) |
| Dislipidemia | 94 (56,6 %) |
| Anemia | 34 (20,4 %) |
| Diabetes mellitus | 7 (5,4 %) |
| Infarto agudo de miocardio | 5 (3 %) |
| Hepatitis B y C | 2 (1,2 %) |
| Accidente cerebrovascular | 1 (0,6 %) |
| Causas de retiro de ImTOR, n(%) | n=62, (%) |
| Proteinuria patológica | 30 (48,4 %) |
| Rechazo agudo tardío | 12 (19,4 %) |
| Efectos adversos a ImTOR | 7 (11,3 %) |
| Dislipidemia | 5 (8,1 %) |
| Infección | 2 (3,2 %) |
| Miopatía | 1 (1,6 %) |
| Anemia | 1 (1,6 %) |
| Otras | 4 (6,5 %) |
ImTOR: inhibidores de rapamicina; ICN: inhibidores de calcineurina.
Entre los 141 pacientes en tratamiento con ImTOR por más de 6 meses, se observó que la mediana de la creatinina sérica (Scr) a los 6, 12, 24, 36, 48 y 60 meses posteriores a la conversión fue: 1,49 mg/dL (RIC=1,1-2), 1,42 mg/dL (RIC=1-1,9), 1,38 mg/dL (RIC=0,98-1,76), 1,3 mg/dL (RIC=0,91-1,69), 1,35 mg/dL (RIC=0,89-1,7) y 1,25 mg/dL (RIC=0,88-1,7), respectivamente.
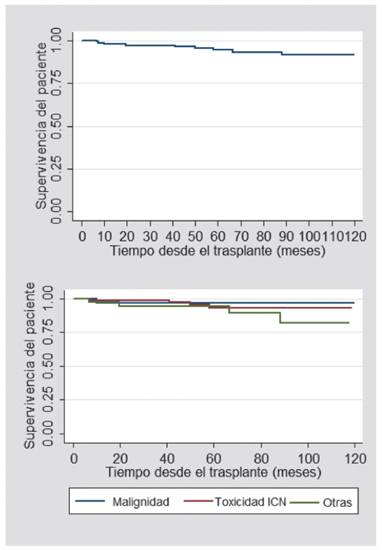
Se analizó la supervivencia global del injerto después de la conversión a ImTOR. Se encontró que, a un año, esta fue de 96,6 %; y a cinco años, de 83,5 %. Al comparar las causas por las cuales se realizó la conversión a ImTOR, la supervivencia global del injerto al primer y quinto año fue de 96,8 % para aquellos cuya causa de conversión fue malignidad; 98,7 %-80 % para los que fueron modificados debido a toxicidad por un ICN; y 92 %-77 % para otras causas de conversión (Figura 1).
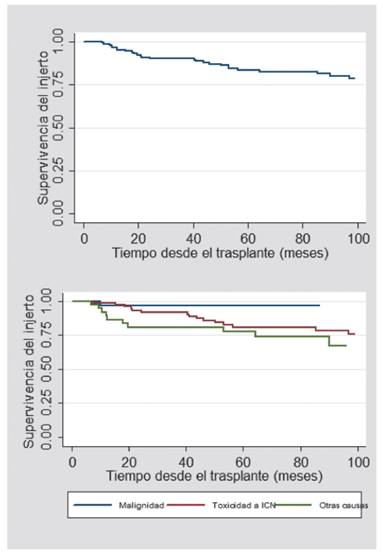
Figura 1 Supervivencia del injerto renal (superior: pacientes con conversión a ImTOR; inferior: según indicación para la conversión a ImTOR)
También se analizó la supervivencia global del paciente posterior a la conversión al ImTOR. En el primer año, esta fue de 98 %; y a los cinco años, de 97 %. En los pacientes cuya causa de conversión al ImTOR fue malignidad, se encontró una supervivencia de 96,8 %; para los que presentaron toxicidad al ICN, fue de 98,7 %; y por otras causas, de 97,3 % (Figura 2).
Discusión
Hasta el año 2013, se encontraban en seguimiento postrasplante más de 1.500 pacientes, en su mayoría tratados en el periodo posoperatorio con ICN como primera opción de manejo 14. En nuestra cohorte, el 12,6 % de los pacientes requirió cambio a ImTOR. La principal causa de conversión fue toxicidad por ICN (principalmente renal y neurológica), demostrada por biopsia renal y resonancia magnética cerebral. La siguiente causa fue el diagnóstico de malignidad, en su mayoría cáncer de piel. Estas causas han sido reportadas en otros estudios 15. En la mayoría de los pacientes, se realizó conversión a sirolimus.
Es conocido que el uso temprano del ImTOR se asocia con un aumento del rechazo del injerto, con infecciones en el sitio operatorio y con alteración de la cicatrización 19,20. Por esta razón, en nuestro estudio se realizó la conversión a ImTOR en pacientes que llevaran más de 3 meses postrasplante.
El 37 % de los pacientes de nuestro estudio requirió el retiro del ImTOR. La principal causa para ello fue la proteinuria patológica y el rechazo agudo tardío, a pesar de que nuestra población tenía una buena función renal previa a la conversión, con tasas de filtración glomerular superiores a 40mL/ min/M2 y con proteinurias inferiores a 500mg/24h. Se ha demostrado que los ImTOR tienen altas tasas de eventos adversos y que estas constituyen la principal causa de retiro del medicamento 21.
De los 45 pacientes con malignidad, el 13 % tuvo recaída posterior a la conversión de ImTOR. El cáncer de piel fue la principal neoplasia presentada en nuestro estudio. También se evidenció neoplasia de órganos sólidos y hematológicos, en menor proporción 22.
Se ha descrito que el sirolimus se relaciona con el desarrollo de dislipidemia. De hecho, encontramos que esta fue la principal complicación posconversión en nuestros pacientes. En nuestro estudio, fue frecuente la aparición de anemia después de la conversión a ImTOR con requerimiento de tratamiento con eritropoyetina 23. La diabetes de novo se presentó en el 5,4 % de nuestra población.
La supervivencia encontrada del injerto y del paciente es buena y no es diferente a la reportada en otros estudios 23,24. El rechazo agudo del injerto se presentó en el 9, 6 % pacientes. Un estudio demostró que la incidencia del rechazo agudo varía entre el 10 y el 20 % con el uso de inhibidores ImTOR 25.
En numerosos estudios que muestran el beneficio de conversión a ImTOR, la calidad de las pruebas para justificar el remplazo de los ICN por ImTOR es poco concluyente 13,14. La conversión a ImTOR tiene unas indicaciones muy precisas y debe realizarse en condiciones específicas, con la intención de reducir los riesgos inherentes a su uso que puedan afectar la supervivencia del paciente y del injerto.
En la población de pacientes trasplantados renales que fueron cambiados a ImTOR, encontramos una baja incidencia de recaída o aparición de enfermedad maligna. Un gran número de pacientes presentaron eventos adversos al medicamento. Las principales complicaciones posconversión fueron la proteinuria, la dislipidemia y la anemia. En pacientes con indicación específica para uso de ImTOR, el protocolo con biopsia del injerto renal, tasa de filtración glomerular mayor a 40ml/min/ M2 y proteinuria inferior a 350mg/24h previo a la conversión a ImTOR permitió mayor seguridad, menores efectos adversos y buena supervivencia del injerto y del paciente.
Responsabilidades éticas
Protección de personas y animales
Los autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Contribución de los autores
Liliana Mesa-Ramírez: diseño del estudio, redacción del artículo, revisión y edición de manuscrito.
Juan C. Gómez-Vega, Jessica Pino-Escobar: diseño del estudio, revisión de literatura, base de datos, redacción del artículo.
Lina M Rivera: revisión de literatura, redacción del artículo.
Eliana Manzi-Tarapues: diseño del estudio, análisis de datos, revisión y edición del manuscrito.
Juan G. Posada-Chávez, Johanna Schweineberg-López, Carlos E. Durán-Rebolledo, Jorge I. Villegas-Otálora, Oscar J. Serrano-Ardila, Luis A. Caicedo-Rusca: revisión y edición del manuscrito.
Conflictos de interés y financiación
Los autores del artículo declaramos no tener ningún tipo de conflicto de intereses, ni ninguna relación económica, personal, política, interés financiero ni académico que pueda influir en nuestro juicio. Declaramos, además, no haber recibido ningún tipo de beneficio monetario, bienes ni subsidios de alguna fuente que pudiera tener interés en los resultados de esta investigación.
Este estudio fue financiado por la Fundación Valle del Lili, a través del Centro de Investigaciones Clínicas. También fue aprobado por el Comité de Ética en Investigación Biomédica de la Fundación Valle del Lili, Cali, Colombia.
Agradecimientos
Este trabajo se llevó a cabo gracias al apoyo y colaboración de personal del Centro de Investigaciones Clínicas de la Fundación Valle del Lili y la Facultad de Ciencias de la Salud de la Universidad ICESI, Cali, Colombia; en especial, gracias al doctor Fernando Rosso, la doctora Diana Dávalos y el doctor Gabriel Jaime Echeverri J.
REFERENCIAS
1. Cuenta de Alto Costo. Situación de la enfermedad renal crónica, hipertensión arterial y diabetes mellitus, 2015. Bogotá: Fondo Colombiano de enfermedades alto costo; 2015. [ Links ]
2. Acosta O, Arias Y, Garcia S, Salinas M, Torres E, Osorio L. Informe anual red de donacion y trasplante en Colombia. [Internet] 2016 [accedido 23 Jun 2017]. Disponible en: Disponible en: http://www.ins.gov.co/lineas-de-accion/Red-Nacional-Laboratorios/Estadsticas/InformeReddeDonaciónyTrasplante2015.pdf . [ Links ]
3. Dávila FA, Pareja MJ, Rodriguez ES, Fajardo WR, Luna RD, Flórez KV. Análisis de supervivencia del trasplante renal (cohorte retrospectiva). Urol Colomb. 2017; 26(1):12-16. doi: 10.1016/j.uroco.2016.03.005. [ Links ]
4. Méndez Durán A, Fermin Piñón JG. Mortalidad en ingresos a diálisis peritoneal. Estudio comparativo de la modalidad continua ambulatoria y automatizada Rev Fac Med UNAM. 2009; 52(5):199-203. [ Links ]
5. Montero Benzo R, Vicente Guillén R. Tratado de transplante de órganos, España. Madrid: Arán Ediciones; 2006. [ Links ]
6. El-Zoghby ZM, Stegall MD, Lager DJ, Kremers WK, Amer H, Gloor JM, Cosio FG. Identifying Specific Causes of Kidney Allograft Loss. Am J Transplant. 2009; 9(3):527-535. DOI: 10.1111/j.1600-6143.2008.02519.x. [ Links ]
7. Graham RM. Cyclosporine: Mechanisms of Action and Toxicity. Cleve Clin J Med. 1994; 61(4); 308-313. [ Links ]
8. de Mattos AM, Olayaei AJ, Bennett WM. Nephrotoxicity of Immunosuppressive Drugs: Long-Term Consequences and Challenges for the Future. Am J Kidney Dis. 2000; 35(2):333-346. [ Links ]
9. Riva N, Cáceres Guido P, Rousseau M, Dip M, Monteverde M, Imventarza O, et al. Farmacovigilancia de inhibidores de calcineurina en trasplante renal y hepático pediátrico. Farm Hosp. 2013; 37(6):441-449. DOI: 10.7399/FH.2013.37.6.778. [ Links ]
10. Andrés A, Polanco N, González E. Optimización de la función renal con inhibidores de mTOR. Nefrologia. 2011;2(3):10-18. DOI: 10.3265/NefrologiaSuplementoExtraordinario.pre2011.Jun.10992. [ Links ]
11. Rodriguez Pérez JC. El papel de los inhibidores de mTOR en las enfermedades renales. Nefrologia. 2011;31(3):251-255. DOI: 10.3265/Nefrologia.pre2011.Apr.10947. [ Links ]
12. Franco-Esteve A, Tordera D, de la Sen ML, Jiménez L, Mas P, Muñoz C, Olivares J. mTOR Inhibitor Monotherapy. A Good Treatment Choice in Renal Transplantation?. Nefrologia. 2012;32(5):631-638. DOI: 10.3265/Nefrologia.pre2012.Jun.11314. [ Links ]
13. Lebranchu Y, Snanoudj R, Toupance O, Weestel PF, Hurault de Ligny B, Buchler M, et al. Five-Year Results of a Randomized Trial Comparing De Novo Sirolimus and Cyclosporine in Renal Transplantation: The SPIESSER Study. Am J Transplant . 2012; 12(7):1801-1810. DOI: 10.1111/j.1600-6143.2012.04036.x. [ Links ]
14. Letavernier E, Legendre C. mToR Inhibitors-Induced Proteinuria: Mechanisms, Significance, and Management. Transplant Rev (Orlando). 2008; 22(2):125-130. DOI: 10.1016/j.trre.2007.12.001. [ Links ]
15. Diekmann F, Andrés A, Oppenheimer F. mTOR Inhibitor-Associated Proteinuria in Kidney Transplant Recipients. Transplant Rev (Orlando) . 2012; 26(1):27-9. DOI: 10.1016/j.trre.2011.10.003. [ Links ]
16. Kidney Disease: Improving Global Outcomes (KDIGO) Transplant Work Group. KDIGO Clinical Practice Guideline for the Care of Kidney Transplant Recipients. Am J Transplant . 2009; 9(Suppl 3):S1-S157. DOI: 10.1111/j.1600-6143.2009.02834.x. [ Links ]
17. American Diabetes Association. Standards of Medical Care in Diabetes-2009. Diabetes Care. 2009; 32(Suppl 1):S13-S61. DOI: 10.2337/dc09-S013. [ Links ]
18. Soles K, Colvin RB, Racusen LC, Haas M, Sis B, Mengel M, et al. Banff 07 Classification of Renal Allograft Pathology: Updates and Future Directions. Am J Transplant . 2008; 8(4):753-760. DOI: 10.1111/j.1600-6143.2008.02159.x. [ Links ]
19. Montero C, Aldana G, Torres R. 24-Month Monitoring to a Late Conversion From a Calcineurin Inhibitor Regime to Everolimus in Kidney Transplant Recipients. Rev Colomb Nefrol. 2015; 2(2):78-95. DOI: /10.22265/acnef.2.2.209. [ Links ]
20. Lieberthal W, Levine JS. The Role of the Mammalian Target of Rapamycin (mTOR) in Renal Disease. J Am Soc Nephrol. 2009; 20(12):2493-2502. DOI: 10.1681/ASN.2008111186. [ Links ]
21. Gaber AO, Kahan BD, Van Buren C, Schulman SL, Scarola J, Neylan JF; Sirolimus High-Risk Study Group. Comparison of Siro-limus Plus Tacrolimus Versus Sirolimus Plus Cyclosporine in High-Risk Renal Allograft Recipients: Results from an Open-Label, Randomized Trial. Transplantation. 2008; 86(9):1187-1195. DOI: 10.1097/TP.0b013e318187bab0. [ Links ]
22. Knoll GA, Kokolo MB, Mallick R, Beck A, Buenaventura CD, Ducharme R, et al. Effect of Sirolimus on Malignancy and Survival after Kidney Transplantation: Systematic Review and Meta-Analysis of Individual Patient Data. BMJ. 2014; 349. DOI: 10.1136/bmj.g6679. [ Links ]
23. El-Agroudy AE, Alarrayed SM, Al-Ghareeb SM, Farid E, Alhelow H, Abdulla S. Efficacy and Safety of Early Tacrolimus Conversion to Sirolimus after Kidney Transplantation: Long-Term Results of a Prospective Randomized Study. Indian J Nephrol. 2017; 27(1):28-36. DOI: 10.4103/0971-4065.176146. [ Links ]
24. Mayer AD, Dmitrewski J, Squifflet JP, Besse T, Grabensee B, Klein B, et al. Multicenter Randomized Trial Comparing Tacrolimus (FK506) and Cyclosporine in the Prevention of Renal Allograft Rejection: A Report of the European Tacrolimus Multicenter Renal Study Group. Transplantation.1997; 64(3):436-443. [ Links ]
25. Guba M, von Breitenbuch P, Steinbauer M, Koehl G, Flegel S, Hornung M, et al. Rapamycin Inhibits Primary and Metastatic Tumor Growth by Antiangiogenesis: Involvement of Vascular Endothelial Growth Factor. Nat Med. 2002; 8(2):128-135. [ Links ]
Referenciar este artículo: Mesa-Ramírez L, Gómez-Vega JC, Pino-Escobar J, Rivera LM, Manzi-Tarapues E, Posada-Chávez JG, et, al, Resultados clínicos en receptores de trasplante renal posterior a la conversión a ImTOR. Rev. Colomb. Nefrol. 2018; (1): 26-35 doi: http://dx.doi.org/10.22265/acnef.5.2.290
Recibido: 17 de Abril de 2017; Aprobado: 21 de Agosto de 2017; Aprobado: 23 de Noviembre de 2017











 texto en
texto en