Introducción
La prevalencia de la diabetes mellitus tipo 2 (DT2) se incrementa a nivel mundial, con el consecuente aumento de morbilidad y mortalidad asociado a sus complicaciones vasculares. Estos trastornos vasculares aumentan con la gravedad de la hiperglucemia y el tiempo de evolución, lo cual se relaciona con las alteraciones metabólicas1. El objetivo del tratamiento de la diabetes mellitus es disminuir la hiperglucemia, evitando así complicaciones agudas y crónicas (v. g.: microvasculares y macrovasculares).
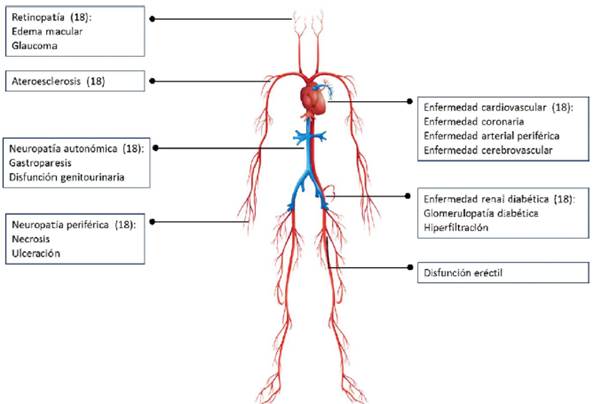
Las complicaciones de la diabetes se han dividido tradicionalmente en macrovasculares (enfermedad arterial coronaria adicionada a la cardiomiopatía y la disautonomía diabética; enfermedad cerebro-vascular y enfermedad vascular periférica) y microvasculares (nefropatía albuminúrica o no albuminúrica, retinopatía proliferativa o no proliferativa, y neuropatía). Según la literatura, la mitad de los pacientes con DT2 presentan complicaciones microvasculares y 27% macrovasculares generalmente ya avanzadas o establecidas en el momento del diagnóstico2. El riesgo relativo de compromiso microvascular y macrovascular en pacientes con diabetes es al menos 10 a 20 veces mayor y 2 a 4 veces mayor respectivamente, en comparación con personas no diabéticas3.
La DT2 y sus complicaciones contribuyen de manera importante a la carga de mortalidad y discapacidad, esta última con un aumento sustancial en los últimos años, agregando disminución en la productividad general. A esta condición se atribuye el 10,7% de todas las muertes en población entre los 20 y 79 años a nivel mundial y es una de las 10 primeras causas de disminución de la expectativa de vida a nivel mundial, lo que representa un alto impacto en la salud pública a nivel global4.
Estudios clínicos recientes dedicados a evaluar los eventos cardiovasculares como desenlace principal demuestran que los medicamentos antidiabéticos innovadores como la empagliflozina5 y la liraglutida1 pueden agregar un beneficio significativo para pacientes con DT2, incluso con enfermedad cardiovascular aterosclerótica ya establecida, especialmente en disminución de la mortalidad por causas cardiovasculares.
En este artículo se proporciona una visión actualizada del impacto cardiovascular y renal (dos de los sistemas blanco más afectados) de la DT2, y a su vez, del rol terapéutico sobre estos desenlaces específicos por parte de agentes farmacológicos vigentes en el tratamiento.
Materiales y métodos
Se diseñó una estrategia de búsqueda genérica con base en los términos clave para el desarrollo de la revisión de la literatura del efecto de las terapéuticas farmacológicas para el control glicémico en DT2 en los desenlaces cardiovasculares y renales. Por lo tanto, se incluyeron los términos «Diabetes Mellitus, Type 2», «Cardiovascular Diseases», «Diabetic Nephropathies)), «Hypoglycemic Agents» y «Diabetes Complications». Posteriormente, se llevó a cabo una búsqueda sistemática y exhaustiva de literatura, de la cual se obtuvieron 141 referencias, luego de eliminar duplicados, para la ejecución de la tamización pareada. Posteriormente se identificaron 22 referencias para revisar en texto completo, de las cuales 21 cumplían con los criterios de inclusión para ser consideradas en el análisis. Se priorizó la selección de revisiones sistemáticas de ensayos clínicos o de estudios observacionales, todos disponibles como publicación completa, en los últimos cinco años.
Principales órganos blanco afectados
Enfermedad cardiovascular
La enfermedad cardiovascular (enfermedad coronaria, enfermedad arterial periférica y enfermedad cerebrovascular) constituye una de las primeras causas de morbilidad y mortalidad a nivel mundial6. (Los pacientes con DT2 tienen el doble del riesgo de desarrollar enfermedad cardiovascular7, la cual tiene una aparición temprana (14,6 años antes que en la población general), una mayor severidad clínica8-10 y mayor mortalidad10. Así, hombres de 60 años con DT2 y antecedentes de enfermedad cardiovascular (infarto de miocardio o evento cerebrovascular) tendrán una esperanza de vida 12 años menor, principalmente debido a un aumento del 58% en el riesgo de muerte de origen cerebro-cardio-reno-vascular11.
La incidencia de ataque cerebrovascular en pacientes con DT2 es dos a cuatro veces mayor a la de la población sin esta patología; además los pacientes diabéticos presentan un peor pronóstico y mayor riesgo de recurrencia. La enfermedad cerebrovascular subcortical se asocia de manera significativa con la presencia de DT2 y el panorama se complica, pues tanto la hiperglucemia como la hipoglucemia producen daño cognitivo12.
La cardiomiopatía diabética, la aterosclerosis coronaria, la enfermedad valvular o la cardiopatía congénita son las principales patologías cardiacas relacionadas con la DT2 y representan un mayor impacto en la salud de estos pacientes. La cardiomiopatía diabética se relaciona con una incidencia de falla cardíaca 2 a 4 veces mayor que en la población general, que se manifiesta en sus etapas tempranas con disfunción sistólica y angina microvascular o enfermedad coronaria de pequeños vasos13,14.
Enfermedad renal
La incidencia de la enfermedad renal diabética se ha duplicado en la última década debido principalmente al aumento de la prevalencia de pacientes que padecen DT2, en quienes el compromiso renal es frecuente; se calcula que alrededor del 25% presenta enfermedad renal diabética en algún momento de la vida, definida como albuminuria persistente, tasa de filtración glomerular estimada (TFG) disminuida o ambas15. La diabetes mellitus causa aproximadamente 44% de los casos incidentes de enfermedad renal crónica terminal6 y es la causa de diálisis más frecuente. Cerca del 10% de la mortalidad en pacientes diabéticos se atribuye a la insuficiencia renal16.
El advenimiento de nuevas clases de fármacos para el tratamiento de la DT2, incluidos los inhibidores del cotransportador renal de sodio-glucosa-2 (SGLT-2) y los agonistas del receptor del péptido-1 similar al glucagón (GLP-1), además de reducir la glucemia, tienen otros efectos beneficiosos para los sistemas cardiovascular y renal, como la pérdida de peso y la reducción de la presión arterial. Los ensayos de resultados mostraron que los inhibidores de SGLT-2 y los agonistas de los receptores GLP-1 pueden reducir los eventos cardiovasculares y la mortalidad por todas las causas, así como la progresión de la enfermedad renal, en pacientes con DT2. La evidencia disponible sobre los efectos cardioprotectores y nefroprotectores de los inhibidores de SGLT-2 y análogos de GLP-1 es contundente; hoy, a la luz de dichos estudios clínicos, las guías de la Asociación Americana de Diabetes (ADA), la Asociación Europea para el Estudio de la Diabetes (EASD) y la Asociación Americana de Endocrinólogos Clínicos (AACE) los incluyen en sus diferentes algoritmos y recomendaciones como medicamentos de primera línea en el tratamiento de pacientes con enfermedad renal crónica (ERC) y DT2 con enfermedad renal diabética (ERD) y ERC5,17.
Enfermedad vascular
Las complicaciones vasculares de la diabetes, iniciadas en la disfunción endotelial, son manifestaciones graves de la enfermedad. La aterosclerosis sistémica y la enfermedad renal diabética son la razón principal de la menor esperanza de vida en los pacientes que padecen esta enfermedad. Aunque la disminución de la hiperglucemia retrasa la aparición de nefropatía y retinopatía, su impacto sobre la enfermedad cardiovascular es menos claro, ya que se ha observado un menor beneficio del control glucémico sobre estos cambios macro-vasculares. Así, la resistencia a la insulina y sus efectos biológicos en varios tejidos puede ser un factor más importante que la hiperglucemia en la mediación de las complicaciones aterotrombóticas. A pesar de los avances en la prevención, el diagnóstico y el tratamiento de la diabetes, las complicaciones siguen siendo un grave problema para la salud pública18.
Por su parte, la enfermedad arterial periférica cuenta con una prevalencia en pacientes diabéticos del 20 al 30%. Tanto la duración de la diabetes como el grado de control glucémico se relacionan con la incidencia y gravedad de la enfermedad arterial periférica19. En un metaanálisis realizado en 2016 que evaluó el impacto de la diabetes sobre los desenlaces en enfermedad arterial periférica, se encontró que la diabetes se asocia con un aumento estadísticamente significativo del riesgo de isquemia crítica del miembro (Odds Ratio: 2,38, IC95%: 1,224,63, P <0,001) como la forma más grave de enfermedad vascular periférica20, y es la causa más frecuente de amputaciones.
A finales de agosto de 2019 se publicaron las guías de diabetes, prediabetes y enfermedades cardiovasculares de la European Society of Cardiology, desarrolladas en conjunto con la European Association for the Study of Diabetes21. Un punto fuerte de estas guías es la categorización del riesgo cardiovascular, lo que permite favorecer el tratamiento integral de los factores de riesgo cardiovascular en personas con DT2. Un punto fuerte de las guías es la discusión orientada al manejo de los diferentes factores de riesgo cardiovascular como hipertensión, dislipidemia, ERC, cardiopatía coronaria, etcétera. Uno de los aspectos más notables que se relaciona a un cambio en el paradigma de tratamiento es el establecimiento de una clasificación de riesgo cardiovascular específica para personas con diabetes (tabla 1).
Tabla 1 Clasificación de riesgo cardiovascular en personas con diabetes. Modificado de ESC Guidelines 201921.

La clasificación tiene como propósito que el manejo sea orientado al riesgo cardiovascular y al control de los factores de riesgo, incluso alejándose del concepto de prevención primaria y secundaria.
Aterosclerosis
La naturaleza de las lesiones ateroscleróticas en pacientes con diabetes es similar a la de pacientes con otras características, aunque son lesiones más precoces, aceleradas y agresivas. La apolipoproteína B y el colesterol LDL oxidado, acumulados en la íntima arterial son reclutados por las moléculas de adhesión expresadas a nivel endotelial. Las citoquinas y las quiomioquinas liberadas de las células espumosas y otras células inmunes reclutan otras de similares características. Adicionalmente, la resistencia a la insulina causa disfunción endotelial, manifestándose por la expresión aumentada de moléculas de adhesión22. En resumen, las alteraciones en la homeostasis vascular debidas a la disfunción endotelial y de las células de músculo liso vascular son las principales características de la vasculopatía diabética que favorece un estado protrombótico y proinflamatorio que finalmente lleva a aterotrombosis9.
En la figura 1 se describen los principales efectos a nivel micro y macrovascular de la hiperglucemia.
Efectos del control glucémico en los desenlaces vasculares
HbA1c y estimación de la media de glucemia
Basados en dos estudios internacionales que buscaban evaluar la correlación entre los niveles de hemoglobina glicosilada (HbA1 c) y glucemia, la American Diabetes Association (ADA) y la American Association for Clinical Chemistry determinaron que la correlación encontrada en los estudios (r 0,92) era lo suficientemente fuerte para reportar el resultado de la HbA1c con una cifra del promedio de glucemia estimado23. Sin embargo, en estudios recientes se ha demostrado que la HbA1c puede sub o sobre estimar la media de glucemia, debido a factores que pueden alterar los resultados (v. g. variabilidad de medida intra e interlaboratorio, la duración de la exposición del eritrocito a la glucosa, y el efecto de patologías frecuentes en los diabéticos como la enfermedad renal crónica y anemias).
Metas de HbA1c
A pesar de sus limitaciones (por ejemplo, no detecta o discrimina los enfermos que hacen picos posprandiales, los cuales generan mayor daño endotelial), se acepta que la HbA1c refleja la glucemia promedio de los últimos tres meses y tiene un fuerte valor predictivo para las complicaciones de la diabetes18,24.
La valoración de los niveles de HbA1c debe realizarse de manera individualizada de acuerdo con las características del paciente y los factores no glucémicos que pueden afectar la HbA1c. Además de esta medición, el clínico debe apoyarse en datos clínicos e idealmente monitoreo de la glucemia para optimizar su manejo médico25,26. Según los Estándares de Atención Médica en la Diabetes, publicados en 2018 por la American Diabetes Association (ADA), las recomendaciones para la medición y las metas de HbA1c son las siguientes:
Dos veces al año en pacientes con DT2 con glucemia estable y dentro de las metas de tratamiento25.
Aproximadamente cada 3 meses en los pacientes con modificaciones de tratamiento o que no hayan alcanzado las metas de tratamiento25.
Los pacientes inestables o con manejo intensivo pueden requerir pruebas con una frecuencia mayor a cada 3 meses, recordando que la HbA1c no detecta variaciones glucémicas que son las más vasculo-tóxicas25.
Una meta razonable de HbA1c es 7,5- 8%; exceptuando en embarazadas, que es 7%. Metas más estrictas de HbA1c (6,5%) en algunos casos25.
Si bien la ADA propone rangos óptimos de HbA1c, es necesario individualizar las metas para cada paciente, teniendo en cuenta sus preferencias, y siempre con el fin de evitar la hipoglucemia y cualquier otro efecto adverso relacionado con el tratamiento1. El control glucémico intensivo tiene un papel importante en la prevención primaria en pacientes con diabetes tipo 1 y con tipo 2 recién diagnosticada. Sin embargo, en la enfermedad avanzada no es beneficioso y podría ser potencialmente deletéreo22. Así, pacientes con diabetes de larga data, historia conocida de hipoglucemia o aterosclerosis avanzada, o pacientes ancianos o con fragilidad, pueden beneficiarse de metas menos agresivas27.
Existe evidencia sobre el daño endotelial producido por la hipoglucemia, la cual aumenta la producción de especies reactivas de oxígeno (estrés oxidativo) y biomarcadores inflamatorios como la proteína C reactiva y las interleucinas 6 y 8; favorece la agregación plaquetaria, la producción del factor VIII, el factor de Von Willebrand y los procesos implicados en la aterotrombosis; potencia la vasoconstricción y la producción de endotelina, y de forma aguda potencia la respuesta simpático-adrenérgica con aumento de la incidencia de arritmias y muerte cardiaca súbita28,29.
Estrategias farmacolóicas para el control glucémico y sus efectos sobre los desenlaces vasculares
Como se ha descrito en apartados anteriores, los pacientes con diabetes tienen un riesgo aumentado de morbilidad y mortalidad vascular, y en consecuencia, actualmente se recomienda en la práctica clínica la estratificación del riesgo para la prevención de dichos eventos30. Se considera que el control glucémico debe ser multifactorial e individualizado con intervención en el estilo de vida, manejo terapéutico de la tensión arterial, lípidos, antitrombóticos y control glucémico27,31,32. En la tabla 2 se presenta un resumen de las principales estrategias farmacológicas.
Tabla 2 Comparación entre las diferentes alternativas terapéuticas para el tratamiento de diabetes mellitus tipo 2.
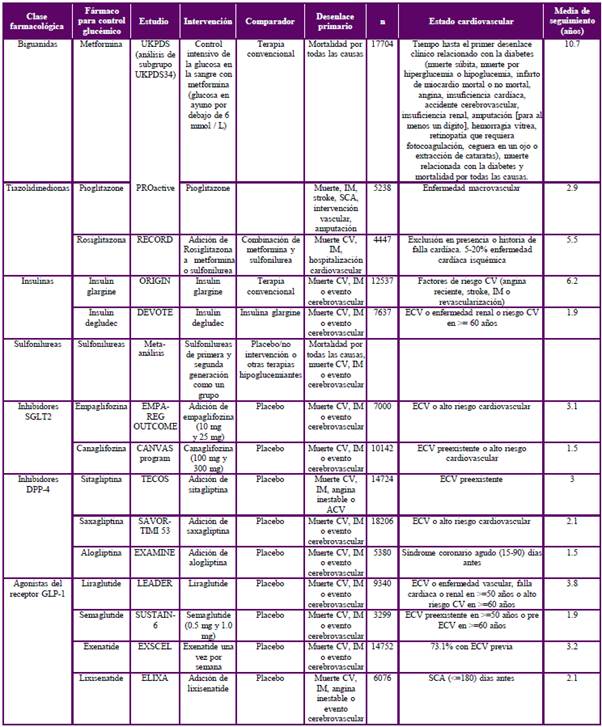
CV cardiovascular. ECV Enfermedad cardiovascular. ERC Enfermedad renal crónica. SCA Síndrome coronario agudo. IM Infarto de miocardio. Terapia convencional: modificación del estilo de vida y/o metformina y/o sulfonilurea.
En los últimos años los entes reguladores como la FDA de EE. UU. y la Agencia Europea de Medicamentos (EMA) han exigido estudios que demuestren la seguridad cardiovascular de los nuevos medicamentos de control glucémico27. Se describe a continuación la evidencia disponible sobre el impacto vascular de los fármacos para el control glucémico, por clase farmacológica, destacando los estudios que respaldan la seguridad vascular y su ubicación en las guías de tratamiento actual.
Biguanidas
Son moléculas hipoglicemiante s orales, y la metformina hace parte de este grupo farmacológico. Este fármaco es la medicación oral más recetada en el mundo para el manejo de la DT2, debido a que tiene un buen perfil de seguridad, incluso entre pacientes con insuficiencia renal33. La combinación temprana con otros fármacos se debe considerar de forma individualizada para lograr un buen control glucémico, reducción del riesgo cardiovascular y protección renal1,30. Si la metformina no está contraindicada y se tolera, debe continuarse cuando se usa en combinación con otros agentes, incluida la insulina25.
Sulfonilureas
Las sulfonilureas son otro hipoglicemiante oral muy importante y muy eficaz en el control glucémico. Estas moléculas estimulan la secreción de insulina desde las células beta pancreáticas y reducen la glucosa plasmática en ayunas de 36 a 72 mg/dl y los niveles de HbA1c en 1 a 2%9. Las sulfonilureas disponibles se asocian variablemente con eventos de hipoglucemia moderada y grave (20-40% y 1-7% respectivamente). También alteran el precondicionamiento isquémico, lo cual las contraindica en pacientes con enfermedad coronaria (excepto la gliclazida).
Tiazolidinedionas
Estas moléculas son hipoglicemiantes orales que originalmente fueron desarrollados como hipolipemiantes34. Los receptores tipo PPAR gamma (PPARy) se expresan principalmente en adipocitos, músculo e hígado, y participan en el metabolismo de la glucosa y los lípidos; y es a través de estos receptores que las tiazolidinedionas ejercen su efecto pleiotrópico34. La acción de las tiazolidinedionas se centra en estimular la sensibilidad a la insulina en el músculo esquelético, el hígado y el tejido adiposo por su capacidad de activar el receptor activado por el factor de proliferación de peroxisomas.
Inhibidores DPP-4
Los inhibidores de la dipeptidil peptidasa-4 (DPP4) son análogos de estos péptidos y actúan inhibiendo la enzima DPP-4. Su mecanismo de acción es de tipo incretina, el cual inhibe la degradación de la proteasa por DPP4, lo que prolonga la vida media y la actividad biológica de GLP-1, aumenta la secreción fisiológica de insulina y suprime la liberación de glucagón, con efectos moderados de reducción de la glucosa27. Estas moléculas están indicadas en monoterapia o en terapia combinada en situaciones especiales, tales como intolerancia a metformina, enfermedad renal crónica (TFG menor de 30 ml/minuto), insuficiencia hepática leve a moderada, entre otros35.
Inhibidores SGLT-2
Los inhibidores del cotransportador sodio-glucosa 2 (SGLT-2) están involucrados en el primer paso en la reabsorción de la glucosa de la orina, con el transporte de glucosa desde los túbulos a los capilares peritubulares a través de las células epiteliales tubulares. La glucosuria inducida por el inhibidor del cotransportador 2 de sodio glucosa promueve una leve diuresis y pérdida de calorías, lo que lleva a modestas reducciones en el peso corporal. Reducción significativa en la presión arterial, especialmente en la sistólica, así como efectos favorables sobre la rigidez arterial, posibles factores determinantes de los resultados positivos para los pacientes con DT236.
Insulina
La insulina es un fármaco utilizado por más del 30% de los pacientes con diabetes en el mundo22, y en la práctica clínica se ha considerado como un componente esencial de la estrategia de tratamiento para los pacientes que no logran objetivos glucémicos con otras terapias33.
La glargina es la insulina más comúnmente utilizada a nivel mundial por su seguridad cardiovascular en personas con DT2 con o sin eventos cardiovasculares previos. La evidencia sugiere que en pacientes con glucosa en ayunas alterada, intolerancia a la glucosa o DT2, y riesgo cardiovascular, seguidos durante 7 años, la comparación de insulina glargina versus terapia convencional (modificación del estilo de vida y/o metformina y/o sulfonilurea) no mostró diferencias estadísticamente significativas en los resultados compuestos de infarto de miocardio, accidente cerebrovascular y muerte cardiovascular, ni en el compuesto extendido que incluyó revascularización y hospitalizaciones por insuficiencia cardíaca22,37. Por su parte, la insulina degludec es un análogo de insulina basal de acción prolongada que se administra una vez al día. El ensayo clínico DEVOTE muestra la seguridad cardiovascular de insulina degludec versus un comparador activo (insulina glargina), cada uno agregado a la terapia convencional38. El desenlace primario (infarto de miocardio no fatal, ictus no fatal y muerte cardiovascular) se produjo en el 8,5% de los pacientes tratados con degludec y en el 9,3% de los pacientes tratados con glargina (RR 0,91; p no significativo), lo cual no demuestra inferioridad. Sin embargo, con respecto al desenlace secundario, los pacientes tratados con degludec experimentaron tasas significativamente menores de hipoglucemia severa en comparación con el grupo de glargina U100 (p<0,001) 39.
Agonistas GLP1
El péptido similar al glucagón 1 (GLP-1), secretado por células L entero-endocrinas, posterior a la ingesta de alimentos, aumenta la secreción de insulina. Los agonistas del receptor del péptido 1 de tipo glucagón, también conocidos como agonistas del receptor GLP-1 o miméticos de incretina, aumentan la secreción de insulina dependiendo de la concentración de glucosa y generan una inhibición de la secreción de glucagón, con efectos duraderos sobre las células beta pancreáticas. La expresión del receptor para GLP-1 en el endotelio vascular y en las células del músculo liso tiene un impacto favorable demostrado a nivel cardiovascular, peso corporal, presión arterial, función endotelial y lipoproteínas de baja densidad.
La evidencia sugiere que los agonistas GLP-1 mejoran el control glucémico y reducen el peso corporal en comparación con el placebo, con un perfil de tolerancia gastrointestinal similar entre ellos.
Cuando se compararon los agentes de acción prolongada (semaglutida, dulaglutida, liraglutida y exenatida una vez a la semana) con los de acción corta (exenatida dos veces al día y lixisenatida), aquellos fueron superiores para reducir los niveles de HbA1c y de glucemia en ayunas40. El uso de liraglutida se recomienda en pacientes con intolerancia a la metformina, o adicionado a esta misma para reducir los eventos cardiovasculares adversos mayores como infarto no fatal, ataque cerebrovascular no fatal, mortalidad cardiovascular en población con enfermedad aterosclerótica establecida y filtración glomerular mayor a 15 cc/min25,30.
Discusión
El efecto de un buen control glucémico, sobre los resultados clínicos, específicamente en la progresión de la enfermedad renal diabética, ha sido objetivo de múltiples estudios a gran escala, tanto en pacientes diabéticos tipo 1 como en diabéticos tipo 2.
La principal evidencia del buen control glucémico en pacientes diabéticos tipo 1 es The Diabetes Control and Complications Trial (DCCT), ensayo clínico controlado aleatorizado con 1441 pacientes, que comparó el control glucémico intensivo (objetivo de HbA1c menor de 6,0%) versus el control glucémico convencional con insulina, con un seguimiento promedio de 6,5 años. El promedio de HbA1c fue de 7,3% para el grupo de control intensivo versus 9,1% para el grupo de control convencional (casi 2% de diferencia), y demostró asociación del control glucémico intensivo con disminución del 54% en la progresión de la nefropatía41. Posteriormente, el estudio Epidemiology of Diabetes Interventions and Complications (EDIC), que continuó el seguimiento de la cohorte del DCCT (1375 pacientes con seguimiento a 4 años), también demostró el beneficio del control glucémico estricto sobre la microvasculatura42.
Los datos disponibles en pacientes con diabetes tipo 2 incluyen el Kumamoto Study43 y el UK Prospective Diabetes Study (UKPDS) 44, que confirmaron los hallazgos descritos y su persistencia a largo plazo. El estudio United Kingdom Prospective Diabetes Study (UKPDS), en donde la HbA1C era 0,9% más baja en el grupo con tratamiento intensivo que en aquel con terapia convencional, concluyó tras 10 años de seguimiento que había una reducción de 25% en las complicaciones microvasculares en el grupo de tratamiento intensivo, y que por cada 1% de reducción en la HbA1C, había un 21% de reducción en el riesgo de cualquier desenlace primario de la diabetes o de muerte, un 37% de reducción en las complicaciones microvasculares y un 14% de reducción en el riesgo de infarto de miocardio45,46. Es importante mencionar que en este estudio el promedio de diagnóstico de la diabetes no fue mayor a un año; es decir, el daño vascular y/o memoria metabólica no estaba aún instaurado, acorde a estudios que sugieren la necesidad de un tratamiento activo muy temprano para reducir al mínimo las complicaciones diabéticas a largo plazo47.
Tres grandes estudios clínicos con la participación de aproximadamente 25.000 pacientes evaluaron el potencial efecto benéfico del control glucémico intensivo en pacientes diabéticos tipo 2. Los estudios Action to Control Cardiovascular Risk in Diabetes (ACCORD) 48, Action in Diabetes and Vascular Disease: Preterax and Diamicron MR Controlled Evaluation (ADVANCE) 49 y Veterans Affairs Diabetes Trial (VADT) 50 mostraron que niveles bajos de HbA1c se asociaron con un inicio tardío o disminución de la progresión de algunas complicaciones microvasculares. Debe tenerse en cuenta que los pacientes de estos estudios llevaban varios años de diagnóstico de diabetes, con daño vascular y memoria metabólica ya instaurada. Además, se debe considerar el riesgo de hipoglucemia y la necesidad de polifarmacia para alcanzar esas metas glucémicas, por lo que estos estudios soportan la recomendación de ajustar las metas de HbA1 c de manera individualizada.
La evidencia disponible plantea dudas sobre el impacto de la metformina en la enfermedad vascular. Los beneficios cardiovasculares de la metformina proceden principalmente del UK Prospective Diabetes Study (UKPDS), en el que se asignaron de manera aleatoria sulfonilureas o insulina, versus terapia convencional en 3867 pacientes con DT2 recientemente diagnosticada. La terapia intensiva con metformina fue asignada a 342 individuos con sobrepeso (con más del 120% del peso corporal ideal), mientras 411 recibieron medidas dietéticas convencionales. El análisis de este subgrupo de pacientes mostró en el grupo tratado con metformina reducción de muertes relacionadas con la diabetes, mortalidad general e infarto de miocardio no fatal de 42% (p=0,017), 36% (p=0,011) y 39% (P=0,01) respectivamente. Estos efectos protectores de la metformina se observaron aun en los 10 años de seguimiento de los pacientes, pese a lograr metas de HbA1c en todos los brazos de tratamiento9.
Aunque los resultados del UKPDS favorecen la metformina, el poder estadístico de este ensayo es limitado. En metaanálisis recientes que incluyen el UKPDS, todos los resultados, con la excepción del ataque cerebrovascular, favorecieron la metformina, pero ninguno alcanzó significación estadística51. Los ensayos clínicos desarrollados hasta la fecha no demostraron la capacidad de la metformina para modificar los resultados vasculares clínicamente relevantes, y además confirmaron un aumento del riesgo cardiovascular y mortalidad de la adición de metformina a sulfonilureas versus sulfonilurea sola (HR 1,60; IC 95%, 1,02-2,52) 9.
Respecto a la evaluación de la seguridad de los inhibidores DPP4 y su eficacia en pacientes con DT2, en los últimos años se han realizado tres ensayos clínicos que evaluaron los resultados cardiovasculares: con saxagliptina (SAVOR-TIMI 53) 52,53, con alogliptina (EXAMINE) 54 y con sitagliptina (TECOS) 55. Todos estos determinaron la no inferioridad estadística comparados con placebo para el resultado combinado de eventos adversos cardiovasculares mayores (muerte cardiovascular, infarto de miocardio no fatal o ataque cerebrovascular no fatal) 27. Por otro lado, metanálisis recientes y el ensayo clínico SAVOR-TIMI 53 reportan que el uso de saxagliptina aumentó las hospitalizaciones por insuficiencia cardíaca un 27% y redujo la albuminuria progresiva independientemente de la función renal inicial52. Aunque el EXAMINE no reportó diferencias significativas en falla cardíaca con el uso de alogliptina versus placebo, análisis post hoc mostraron que aumentó la incidencia de esta patología en pacientes con signos de insuficiencia cardíaca en el momento de la aleatorización (RR 1,76, IC 95%, 1,07-2,90). Los hallazgos descritos han dado lugar a advertencias regulatorias para saxagliptina y alogliptina56. Entre los pacientes con DT2 y enfermedad cardiovascular establecida, la sitagliptina adicionada a la terapia convencional no aumentó el riesgo de eventos cardiovasculares adversos mayores, hospitalización por insuficiencia cardíaca (incluso después del ajuste para la insuficiencia cardíaca preexistente) u otros eventos adversos9,55.
Los datos descritos sugieren que el aumento del riesgo de insuficiencia cardíaca no es un efecto de clase de los inhibidores de la DPP-49,57, con evidencia además de superioridad de estos fármacos en comparación con las sulfonilureas respecto a la admisión hospitalaria por insuficiencia cardíaca. Del mismo modo, los ensayos clínicos con inhibidores DPP4 reportaron no encontrar diferencias significativas en los desenlaces microvasculares27; es decir, mejoran la cifras glucémicas pero no han demostrado impactar desenlaces. Las recomendaciones más recientes sobre los inhibidores DPP4 los consideran opciones razonables y seguras para lograr el control glucémico30, de preferencia para pacientes que no son aptos para un inhibidor SGLT2 o un agonista de receptor de GLP-1, así como en todos los estadios de la enfermedad renal crónica incluyendo pacientes en diálisis (hemodiálisis o diálisis peritoneal) 1.
En el estudio EMPAREG OUTCOME5 se evidenció que la empagliflozina (inhibidores SGLT-2), comparada con placebo, mostraba una reducción significativa en el desenlace primario compuesto (HR 0,86; IC95% 0,74-0,99), así como en la muerte cardiovascular (HR 0,62; IC95% 0,49-0,77), hospitalizaciones por insuficiencia cardíaca (HR 0,65; IC95% 0,50-0,85) y mortalidad por cualquier causa (HR 0,68; IC95% 0,57-0,82). Este estudio fue el primero con adecuado poder estadístico que mostró reducción del riesgo cardiovascular con el empleo de un nuevo antidiabético. En el programa CANVAS que integró datos de dos ensayos clínicos con un total de 10.142 participantes con DT2 y alto riesgo cardiovascular, se evidenció que el desenlace compuesto por mortalidad por causas cardiovasculares, infarto de miocardio no fatal o ataque cerebro-vascular no mortal fue menos frecuente en pacientes tratados con canagliflozina que con placebo (HR 0,86, IC 95% 0,75 - 0,97; p <0,001 para no inferioridad; P = 0,02 para superioridad) 58.
En cuanto al impacto renal de los inhibidores SGLT2, se observó que la aparición o progresión de nefropatía se redujo significativamente en un 39% con empagliflozina, la duplicación de la creatinina sérica se redujo en un 44%, y la combinación de nefropatía incidental o progresión y muerte cardiovascular se redujo en 39%59. También se observó un posible beneficio de la canagliflozina con respecto a la progresión de la albuminuria (HR 0,73, IC95% 0,67-0,79) y en el resultado compuesto por una reducción sostenida del 40% en la tasa de filtración glomerular estimada, la necesidad de terapia de reemplazo renal o muerte por causas renales (HR 0,60, IC 95% 0,47-0,77) 58. También, se han observado resultados similares con la dapagliflozina, es decir, también puede tener efectos nefroprotectores (disminución en los desenlaces renales). En Colombia, actualmente, este medicamento se recomienda para pacientes con una TFG estimada mayor de 60 ml/min/1,73 m60.
Las recomendaciones de la ADA (2018) incluyen el uso de empagliflozina en combinación con metformina, en pacientes con DT2 y enfermedad cardiovascular aterosclerótica establecida, con el fin de reducir los eventos cardiovasculares adversos mayores y la mortalidad cardiovascular, de acuerdo con las características del paciente25. La empaglifozina está aprobada en la actualidad para uso en pacientes con TFG mayor de 45 cc/min. No se recomienda en pacientes diabéticos tipo 2 con TFG más bajas.
A la fecha existen cuatro estudios de seguridad cardiovascular con agonistas del receptor GLP: ELIXA (con lixisenatida), LEADER (con liraglutida), SUSTAIN-6 (con semaglutida) y EXSCEL (con Exenatide). Respecto a los desenlaces vasculares, los hallazgos de metaanálisis describen una reducción significativa del riesgo de muerte por todas las causas versus el grupo control (RR 0,888; IC 0,804 0,979; p=0,018) y del riesgo de muerte cardiovascular (RR 0,858; IC 0,757 0,973; p=0,017). Se reportó también que los agonistas GLP1 no afectaron el riesgo de infarto de miocardio, accidente cerebrovascular, retinopatía y nefropatía (RR 0,866; IC: 0,625 a 1,199; p=0,385) 61.
En el estudio EXSCEL, que evaluó los efectos cardiovasculares del tratamiento con exenatida en pacientes con DT2 y que incluyó 14.752 pacientes, se encontró un HR de 0,91 (IC95% 0,83-1,00) para el desenlace compuesto por aparición de muerte por causas cardiovasculares, infarto de miocardio no fatal o ataque cerebrovascular no mortal. Así, las tasas de muerte por causas cardiovasculares, infarto de miocardio fatal o no fatal, ataque cerebro-vascular fatal o no fatal, hospitalización por insuficiencia cardíaca y hospitalización por síndrome coronario agudo, y la incidencia de pancreatitis aguda, cáncer de páncreas, carcinoma medular de tiroides y eventos adversos graves no fue diferente entre exenatida y placebo62.
A partir del estudio Liraglutide Effect and Action in Diabetes: Evaluation of Cardiovascular Results (LEADER) se determinaron los resultados renales secundarios de la liraglutida comparada con placebo, encontrando un HR de 0,78 (IC95% 0,67-0,92; p = 0,003) para el desenlace compuesto por macro-albuminuria persistente de inicio reciente, duplicación persistente del nivel de creatinina sérica, enfermedad renal en etapa terminal o muerte por enfermedad renal. Este resultado está relacionado principalmente por la reducción de la macro-albuminuria persistente, que se produjo en un menor número de participantes en el grupo tratado con liraglutida (HR 0,74, IC95% 0,60-0,91; P = 0,004).
En el ensayo LEADER con inclusión de pacientes con alto riesgo cardiovascular, la liraglutida redujo significativamente la ocurrencia de los eventos cardiovasculares adversos mayores en 13%, la muerte cardiovascular en 22% y la mortalidad por todas las causas en 15%, sin efectos significativos sobre el infarto de miocardio no fatal, ictus no fatal y hospitalización por insuficiencia cardíaca. Los beneficios cardiovasculares de liraglutida se observaron mucho más temprano en comparación con los ensayos clásicos de control glucémico en diabetes (Diabetes Control and Complications Trial [DCCT], UKPDS).
Conclusiones
Dentro de las principales causas de morbilidad y mortalidad de los pacientes con DT2, se encuentran las relacionadas con daño vascular, en especial enfermedad cardiovascular y compromiso renal. En este contexto, el tratamiento farmacológico de la diabetes mellitus se ha enfocado en encontrar medicamentos que reduzcan de manera significativa los eventos cardiovasculares y que al mismo tiempo retrasen la aparición de nefropatía o su progresión. Las tiazolidinedionas, los inhibidores de DPP4 (alogliptina, saxagliptina y sitagliptina), la insulina glargina y degludec han demostrado seguridad cardiovascular, pero no beneficio cardiovascular incremental en pacientes con DT2 que tienen alto riesgo de enfermedad cardiovascular aterosclerótica.
En los últimos años, se han realizado grandes ensayos clínicos controlados aleatorizados que han reportado disminución estadísticamente significativa en los eventos cardiovasculares, en general para los inhibidores SGLT2 (empaglifozina, canaglifozina y dapaglifozina) y para algunos agonistas GLP-1 (liraglutida, semaglutida y dulaglutida) en pacientes diabéticos con enfermedad cardiovascular aterosclerótica. El riesgo de hipoglucemia de estos medicamentos es bajo y cuentan con un adecuado perfil de seguridad.
Finalmente, es importante mencionar la reducción de la aparición o progresión de la enfermedad renal diabética con estos medicamentos, incluso en pacientes con enfermedad renal crónica estadio 3 con HbA1c mayor que 7% pero menor que 8%. Dado que el empeoramiento de la enfermedad renal diabética es un factor de riesgo importante para una amplia gama de complicaciones de la enfermedad cardiovascular aterosclerótica, incluida la insuficiencia cardíaca, el uso adecuado de estos fármacos podría contribuir a cerrar aún más la brecha de pronóstico en pacientes con enfermedad cardiovascular aterosclerótica y diabetes.
Así, para pacientes con DT2 que tienen enfermedad cardiovascular aterosclerótica, se recomienda incorporar un agente con fuerte evidencia de reducción del riesgo cardiovascular al tratamiento con metformina, especialmente aquellos con beneficio comprobado tanto en eventos cardiovasculares adversos importantes como en muerte cardiovascular, después de considerar de manera individual las características y preferencias del paciente. Sin embargo, es importante tener presente que el eje fundamental en el manejo del enfermo diabético es el logro de cambios persistentes en el estilo de vida.