Introducción
La infección por citomegalovirus afecta fre cuentemente a pacientes receptores de tras plante renal, asociándose con un aumento del riesgo de rechazo y mortalidad1. La infección en receptores de trasplante renal se presenta como in fección activa (evidencia en sangre de replicación de CMV independientemente de signos y síntomas com patibles) o como enfermedad por CMV, que se divi de en síndrome por CMV (detección viral en sangre con signos y síntomas inespecíficos y ausencia de invasión tisular) y enfermedad tisular invasiva por CMV (infección por CMV con signos y síntomas de daño orgánico específico)2,3.
La enfermedad gastrointestinal es la manifesta ción clínica más común de la enfermedad tisular invasiva por CMV (tissue invasive CMV disease), presentándose con náusea, vómito, diarrea y/o do lor abdominal; en los estudios endoscópicos se en cuentran erosiones eritematosas, úlceras localizadas y menos frecuentemente placas, nódulos y pólipos4.
Presentamos dos casos de enfermedad tisular invasiva por CMV, haciendo énfasis en los factores de riesgo asociados a la infección y con propuestas en cuanto a duración de la profilaxis y el ajuste del tratamiento inmunosupresor.
Presentación del caso 1
Paciente masculino de 30 años con anteceden tes de trisomía 21 y enfermedad renal crónica G5 sin requerir terapia de sustitución previa al trasplante. Trasplantado de riñón de origen vivo relacionado en enero del 2018. La inmunosupresión se indujo con metilprednisolona 500 mg y timoglobulina 50 mg, y se mantuvo con tacrolimus 2 mg cada 12 horas, ácido micofenólico 720 mg cada 1 2 horas y prednisona 30 mg cada 24 horas.
El seroestatus del paciente para CMV era nega tivo previo al trasplante (IgG 4,3 AU/ml, IgM 0,08 AU/ml); sin embargo, su donador tenía IgG 135 UI/ ml (0-14) e IgM 5 UI/ml (0-22). Se dio profilaxis con valganciclovir 450 mg cada 12 horas durante un mes posterior al trasplante.
Se hospitalizó cinco meses después por presen tar diarrea sanguinolenta, náuseas y vómito de con tenido gástrico de una semana de evolución, con tensión arterial de 100/80 mmHg, frecuencia car díaca 86 lpm, frecuencia respiratoria 18 rpm, y tem peratura 36,4 °C. Al análisis bioquímico con hemoglobina de 7,4 g/dl, hematocrito 23,48%, plaquetas 72x10^3/µl, leucocitos 3,03x10^3/µl, glu cosa 114 mg/dl, urea 58 mg/dl, creatinina 1,5 mg/dl, Na 144 mmol/l, K 4,5 mmol/l, Cl 108 mmol/l, Ca 9,1 mg/dl, Mg 1,5 mg/dl, P 3,9 mg/dl.
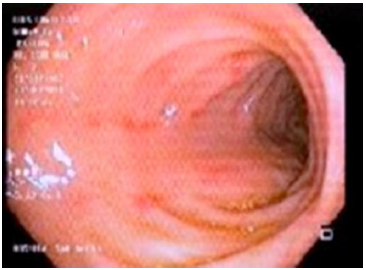
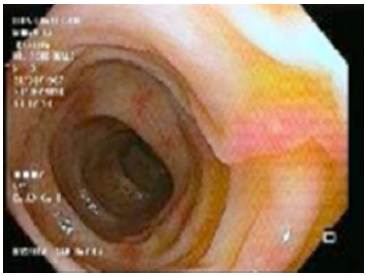
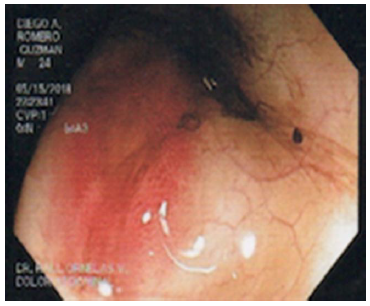
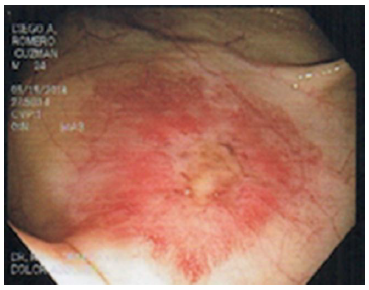
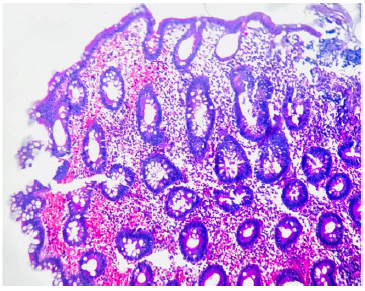
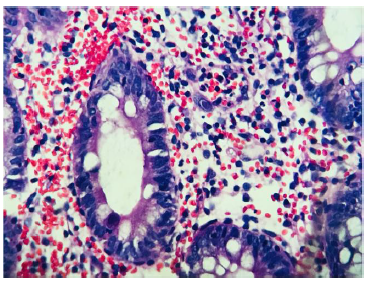
Se realizó colonoscopía, encontrando colitis inespecífica con erosiones de aspecto aftoso en bo tón de camisa (figuras 1 y 2). El histopatológico reportó estroma de sostén ligeramente edematoso y conges tivo, infiltrado inflamatorio de tipo mixto de predomi nio linfoide y hemorragia sin afección de estructuras glandulares y mucosa de revestimiento. Se identifi caron células endoteliales de la mucosa con inclusio nes basófilas intranucleares prominentes, compatibles con infección por CMV (figuras 3 y 4). Se realizó carga viral en las primeras semanas posteriores al diagnóstico, con resultado 1,724 copias/ml (< 200).
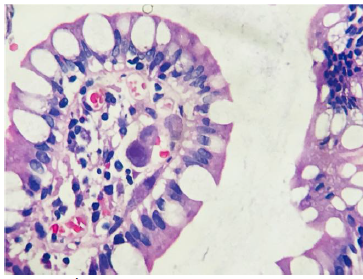
Figura 3 Íleon terminal con células endoteliales de la mucosa con inclusiones basófilas intranucleares.
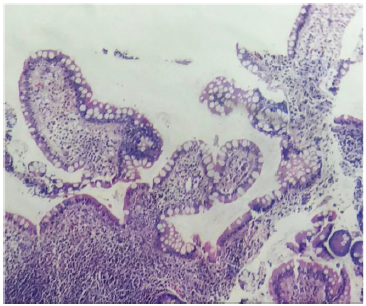
Figura 4 Íleon terminal con estroma de sostén edematoso y congestivo, con infiltrado inflamatorio de predominio linfoide.
Se consideró como diagnóstico enfermedad tisular invasiva por CMV. Se trató con ganciclovir 350 mg intravenoso cada 12 horas durante 2 días y posteriormente valganciclovir 450 mg vía oral cada 48 horas durante 3 meses, presentando mejoría de los síntomas. Últimos estudios: urea 55,9 mg/dl, BUN 26 mg/dl, creatinina 1,2 mg/dl.
Caso 2
Paciente masculino de 23 años con enfermedad renal crónica G5 de 2 años de evolución, en terapia de sustitución renal con hemodiálisis durante 5 me ses previo al trasplante renal de donador vivo rela cionado en octubre del 2017. La inducción de la inmunosupresión se realizó con metilprednisolona 500 mg y basiliximab 20 mg, y se mantuvo con prednisona 40 mg cada 24 horas, tacrolimus 3 mg cada 12 ho ras y ácido micofenólico 720 mg cada 12 horas.
Previo al trasplante el seroestatus de CMV del paciente era negativo (IgG < 5 UI/ml, IgM < 5 UI/ ml), y su donador positivo, con IgG de 250 AU/ml (0-6) e IgM de 0,270 AU/ml (negativo < 0,85). Re cibió profilaxis con valganciclovir 450 mg cada 12 horas durante 2 meses.
A los dos meses del trasplante fue hospitalizado por datos compatibles con rechazo agudo del injer to, corroborado por biopsia con isquemia aguda transitoria, dándose manejo con seis dosis de timoglobulina de 1,25 mg/kg, con remisión y normaliza ción de azoados.
A los siete meses del trasplante presenta dolor abdominal, evacuaciones diarreicas, astenia, y adinamia de 5 días de evolución. Sin alteración en sus signos vitales (tensión arterial de 120/74 mmHg, frecuencia cardiaca de 81 lpm, frecuencia respira toria de 16 rpm, y temperatura de 36,2 °C), pero con urea de 71 mg/dl, creatinina de 2,99 mg/dl, Na 133 mmol/l, K 3,33 mmol/l, hemoglobina 13,5 g/dl, hematocrito 40,5%, leucocitos 3,7 x 10^3/µl, gluco sa 115 mg/dl y Cl 104 mmol/l.
Se le realizó colonoscopía, observando ulcera ciones aisladas con base fibrinoide y halo elevado eritematoso en colon descendente, en colon transverso de casi 1 cm de diámetro y en colon ascendente más abundantes y de mayor tamaño (figu ras 5 y 6). El histopatológico reportó estroma de sostén ligeramente edematoso y congestivo, con moderada cantidad de infiltrado inflamatorio de tipo mixto de predominio linfoide y hemorragia sin afec ción de estructuras glandulares y mucosa de revestimiento. Se identificaron células epiteliales y endoteliales de la mucosa con cambios citopáticos virales caracterizados por inclusiones basófilas intranucleares prominentes, compatibles con infec ción por CMV (figuras 7 y 8). Se realizó carga viral con resultado 38,386 copias/ml (< 200).
Se trató con ganciclovir 350 mg intravenoso cada 12 horas durante 4 días y posteriormente valganciclovir 450 mg vía oral cada 12 horas hasta completar 21 días de tratamiento, con remisión del cuadro clínico y mejoría bioquímica (urea 39,2 mg/dl, BUN 18.3 mg/dl, creatinina 2,3 mg/dl). La carga viral de control a los dos meses de iniciar el cuadro era me nor de 200 UI/ml.
Discusión
La infección por citomegalovirus es un riesgo latente en pacientes inmunosuprimidos por trasplante renal, con una incidencia de enferme dad por CMV los primeros 100 días de 24%, con una frecuencia general de infección del 50-80% y de enfermedad por CMV del 20-60%5-7. Se presenta de tres formas: primoinfección (receptor seronegativo y donador seropositivo, D+/R-), reactivación del CMV latente (consecuencia de la inmunosupresión, aun cuando tanto receptor como donador son seronegativos) y reinfección (recep tor previamente seropositivo que se infecta con otro serotipo del virus) 8.
Coincidiendo con los reportes internacionales y otros casos documentados, ambos casos se presen taron con enfermedad gastrointestinal, la manifes tación clínica más común del CMV invasivo, caracterizada por náusea, vómito, diarrea y/o dolor abdominal, con hallazgos endoscópicos de erosio nes eritematosas, úlceras localizadas y menos fre cuentemente placas, nódulos y pólipos8-11. Otras manifestaciones menos frecuentes son neumonitis, nefritis, retinitis, pancreatitis y hepatitis2.
Los principales factores de riesgo para el desa rrollo de la infección son los siguientes:
El seroestatus donador/receptor:
Donador positivo/receptor negativo (D+/R-): el de mayor riesgo, sin profilaxis 69% pueden desarrollar infección y 56% enfermedad por CMV.
Receptor positivo (R+): menor riesgo de en fermedad por CMV sin profilaxis (20%), pero hasta 67% de riesgo de reinfección.
Donador/receptor negativos (D-/R-): bajo ries go, desarrollando infección menos del 5% sin profilaxis.
Inducción de inmunosupresión con agentes depletores de linfocitos como la timoglobulina.
Mantenimiento de inmunosupresión con micofenolato.
Uso de depletores de linfocitos o altas dosis de glucocorticoides para tratar un rechazo agudo1,3,7.
Como se puede observar, los dos casos presen tados compartían todos los factores de riesgo men cionados. Ambos eran D+/R- y se mantuvo la inmunosupresión con micofenolato. En el caso 1 se indujo la inmunosupresión con un depletor de linfocitos y en el caso 2 se utilizó un depletor de linfocitos como tratamiento del rechazo agudo que presentó; por lo tanto, se consideran de alto riesgo.
Desde hace 20 años existe una recomendación grado A para profilaxis de CMV en receptores seronegativos con donador seropositivo e inmunosupresión con un depletor de linfocitos, así como en receptores seropositivos que utilizan inmunosupresión con depletor de linfocitos independientemen te del seroestatus del donador.
En casos de receptor seronegativo con donador seropositivo e inmunosupresión sin depletor de linfocitos, la recomendación es grado B. En el re ceptor seropositivo con inmunosupresión sin depletor de linfocitos, independientemente del seroestatus del donador la recomendación es grado C, y cuando tanto donador como receptor tienen seroestatus negativo, independientemente del régimen de inmunosupresión, no se recomienda la profilaxis12,13. Aun así, el seroestatus previo al trasplante, la identificación de receptores de alto o bajo riesgo y el uso estanda rizado de profilaxis contra CMV en casos de alto riesgo no se reportan generalmente en otras publi-caciones9.
Aun cuando se considera una recomendación grado C, en la experiencia de un centro con seroestatus D+/R+ en todos los casos, el uso de profilaxis para CMV de manera universal redujo la in cidencia de enfermedad por CMV en un 14.2%7.
En ausencia de profilaxis, la replicación viral apa rece entre el primer y el sexto mes postrasplante, co incidiendo con el periodo de máxima inmunosupresión8. Sin embargo, desde la publicación de la guía de práctica clínica para la prevención de enfermedad por CMV hace 20 años, hasta la actualidad, la duración de la profilaxis para CMV no se ha estandarizado, (se reco mienda en alguna bibliografía su administración duran te 1 a 3 meses12-14, mientras que en otra ya se recomienda por hasta 6 meses, sobre todo en pacien tes de alto riesgo)1,15. En nuestros casos presentados, los pacientes recibieron profilaxis con valganciclovir 450 mg cada 12 horas, uno durante un mes y el otro durante dos meses, a pesar de ser ambos considera dos de alto riesgo. La causa de suspensión fue la pre sencia de efectos adversos (leucopenia).
Se ha encontrado que el riesgo de enfermedad por CMV persiste incluso posterior a la culminación de la profilaxis. El estudio IMPACT, realizado con 326 pacientes de alto riesgo, comparó el tiempo de profi laxis con valganciclovir por 100 vs. 200 días, encon trando una disminución de la tasa de enfermedad tardía en el grupo de 200 días (16 vs. 37%, respectivamente)16. Además, una revisión sistemática que analizó los beneficios y riesgos de los fármacos antivirales encontró que la profilaxis para CMV re duce el riesgo de enfermedad por herpes simple, her pes zóster, neumocistosis e infección bacteriana, rechazo agudo y pérdida del injerto8. Se considera que la profilaxis prolongada es una medida de reduc ción de la tasa de infección16. Por lo tanto, la profi laxis extendida en pacientes de alto riesgo, con énfasis en riesgo-beneficio y costo-beneficio, es un tema de alto impacto a incluir en ensayos clínicos y en guías de práctica clínica. A pesar de ser muy común el re porte de efectos adversos, la mayoría son leves y sin mayor repercusión (91%), sobre todo gastrointes tinales (diarrea). Con respecto a los efectos hematológicos (principalmente leucopenia), a pesar de que se presentaron con mayor frecuencia en pacientes por profilaxis extendida (38 vs. 26%), el conteo prome dio de leucocitos, la incidencia de neutropenia febril, la agranulocitosis, la anemia, la trombocitopenia y la pancitopenia fueron similares en la profilaxis estándar (100 días) y la extendida (200 días), así como el re querimiento de factor estimulante de colonias de granulocitos (14 vs. 13% respectivamente)16.
Se recomienda el ajuste de la dosis de valganciclovir dependiendo de la función renal (estimada con las fórmulas Cockroft-Gault o MDRD), de la siguiente manera: TFGe >60 ml/min = 900 mg/día, 40-59 ml/min = 450 mg/día, 25-39 ml/min = 450 mg cada 48 horas, 10-24ml/min = 450 mg dos veces por semana, en caso de TFGe <10ml/min no se recomienda su uso15.
Otro aspecto de controversia radica en el ajuste de la inmunosupresión una vez documentada la enfermedad por CMV. Además del tratamiento es pecífico con ganciclovir intravenoso o valganciclovir vía oral, algunos autores recomiendan disminuir o sus pender el antimetabolito (micofenolato o azatioprina), bajo el concepto de que la infección es una manifes tación de inmunosupresión excesiva (recomendación grado 2D)13. Sin embargo, existe otra teoría que pro pone un aumento de la dosis de inmunosupresor en pacientes con enfermedad por CMV, ya que el pro ceso infeccioso se relaciona a un mayor riesgo de rechazo del injerto2. En los casos presentados, la do sis del micofenolato del caso 1 se disminuyó y la del caso 2 se aumentó. Ambos casos tuvieron una evolu ción favorable; sin embargo, se requiere de mayor evidencia para emitir una recomendación sólida so bre el ajuste de inmunosupresión.
Conclusión
La infección por CMV es un riesgo latente en pacientes receptores de trasplante renal. Hacemos énfasis en la necesidad de identificar los factores de riesgo para infección por CMV en los recepto res de trasplante renal, especialmente el seroestatus donador/receptor y los medicamentos inmunosupresores. Se propone que en futuros ensayos clí nicos se incluya la profilaxis extendida en casos de alto riesgo, así como el ajuste de inmunosupresión una vez detectada la infección por CMV.