Introducción
La talla baja (TB) en la edad pediátrica puede ser signo de un trastorno subyacente que requiere diagnóstico y tratamiento adecuados1,2; Su prevalencia oscila entre 2,23% y 5,12%, con diferencias importantes entre nivel de desarrollo socioeconómico, países y regiones urbanas y rurales3,4.
En Colombia, la Encuesta Nacional de la Situación Nutricional de 20155 indica una prevalencia de retraso en talla o en el crecimiento del 10,8% en menores de 5 años, de 7,4% en niños entre 5 y 12 años y de 9,7% en niños entre 13 y 17 años6. Aunque las causas nutricionales de la TB en niños no suponen un tratamiento hormonal, dadas las condiciones socioeconómicas o de pertenencia étnica y la inequidad que existe en diferentes regiones del país, es importante tener en cuenta estas causas en el abordaje diagnóstico.
La mayoría de casos de niños con TB corresponden a variantes de la normalidad, estimando que solo cerca del 20% de los casos corresponde a niños con TB patológica7-9. Por tanto, el reto es identificar este último grupo de pacientes para facilitar las decisiones sobre la necesidad de pruebas diagnósticas específicas e indicaciones de tratamiento con hormona de crecimiento recombinante humana (somatropina).
Dentro de las causas de TB patológica se encuentran los trastornos endocrinos, que corresponden al 5-10% de todos los casos. El más frecuente de estos trastornos es el déficit de hormona de crecimiento (DHC), que afecta principalmente a los hombres con una relación 4:1 y tiene una prevalencia que puede ir de 1 caso por cada 3.480 niños, hasta 1 caso por cada 30.000 niños9-11. En Colombia no se conocen datos específicos de frecuencia del DHC12.
La terapia con somatropina es el tratamiento aprobado para una serie de afecciones relacionadas con el crecimiento, siendo la más común el DHC. Otras indicaciones de este tratamiento difieren según los países y las formulaciones disponibles de la hormona2,13. En Colombia su uso está aprobado para DHC, síndrome de Turner (ST), recién nacido pequeño para la edad gestacional (PEG) sin recuperación del crecimiento o sin reatrapaje, síndrome de Prader-Willi (SPW) y enfermedad renal crónica (ERC) en menores de 18 años, siendo esta última condición la única incluida en el plan de beneficios en salud (Anexo 1)14,15.
Al igual que la Agencia Europea de Medicamentos16, el Instituto Nacional de Vigilancia de Medicamentos y Alimentos (INVIMA), como entidad regulatoria en Colombia, aún no ha autorizado el uso de la somatropina para pacientes con diagnóstico de Talla Baja Idiopática (TBI). Tampoco se cuenta con aprobación para condiciones que sí están autorizadas en otros países como la deficiencia del gen que contiene homeobox de baja estatura (SHOX)2,13, ni para el manejo de TB familiar o el aumento de masa muscular en deportistas de alto rendimiento o para condiciones estéticas; en estos últimos casos no hay certeza de que los beneficios superen los riesgos a largo plazo17-19.
De acuerdo con los registros del Sistema de Información de Precios de Medicamentos de Colombia20, en el año 2014 el valor promedio del microgramo de somatropina fue de 24,83 pesos y, según análisis del Instituto de Evaluación Tecnológica en Salud, el costo promedio anual de tratamiento por paciente para ese mismo año fue de 11.269.325 pesos, lo que equivale a 2.800 dólares a abril de 202021. Lo anterior supone un alto impacto en el uso de los recursos del sistema de salud y una gran responsabilidad de la comunidad médica y científica para la prescripción adecuada de este tratamiento.
Es de mencionar que las corrientes internacionales de endocrinología pediátrica, las cuales tienen una sana heterogeneidad, influencian la práctica médica en el territorio colombiano, por lo que se han hecho esfuerzos para poner en práctica estos lineamientos en el contexto del país, como por ejemplo la iniciativa de la Universidad de Antioquia de formalizar en 2007 el primer postgrado nacional en esta especialidad. No obstante, existen barreras para el acceso de los pacientes a consulta con endocrinos pediatras y/o a la toma de laboratorios especializados y de pruebas dinámicas en algunas zonas del país.
En cuanto a la interpretación de los resultados de las pruebas bioquímicas, es necesario indicar que existe incertidumbre en torno a los valores de referencia (en especial en las solicitadas para determinar DHC), falsas expectativas de los pacientes y familiares e incluso repercusiones médico legales, lo que convierte el abordaje de un paciente con TB y el requerimiento de un tratamiento hormonal en un problema complejo. Estas y otras consideraciones fueron tenidas en cuenta en un análisis de situación con representantes de sociedades científicas, Asociación Colegio Colombiano de Endocrinología Pediátrica (ACCEP), Sociedad Colombiana de Pediatría (SCP)-, entes del estado -Secretaría Distrital de Salud de Bogotá), universidades -Fundación Universitaria Sanitas y Universidad de los Andes- y expertos clínicos de algunas instituciones de salud públicas y privadas del país -Hospital Infantil Concejo de Medellín, IPS Universitaria, Hospital Pablo Tobón Uribe, Hospital Militar Central y Fundación Santa Fe de Bogotá- para la identificación y priorización de los escenarios de mayor incertidumbre que fueron abordados en esta publicación.
Este trabajo tuvo como objetivo presentar los principios fundamentales de buena práctica clínica para el uso de somatropina en pacientes pediátricos. En este sentido, se presentan las recomendaciones más adecuadas establecidas a partir de la mejor evidencia disponible con el fin de que se facilite su implementación en el contexto clínico, social y de reglamentación de la práctica médica en Colombia.
Metodología
Se llevó a cabo un estudio en el que se integró la mejor evidencia disponible con el propósito de informar cada uno de los problemas relacionados con el uso de somatropina en pacientes pediátricos. En una primera fase, el líder del estudio realizó un análisis DOFA (debilidades, oportunidades, fortalezas y amenazas) para identificar y priorizar los escenarios de mayor incertidumbre. En la siguiente fase, que duró cerca de tres meses, cada escenario fue abordado en múltiples sesiones de trabajo (virtuales y presenciales) por un equipo base conformado por cinco personas (tres endocrinólogos pediatras y dos médicos epidemiólogos). Cuando la naturaleza del problema lo permitía, se formulaban preguntas bajo la estructura PICO (población, intervención, comparación, desenlace (outcome) para orientar la búsqueda de literatura relevante. En los otros casos, y cuando no fue posible identificar estudios primarios o secundarios, se formularon preguntas orientadoras para rescatar documentos en texto completo de agencias gubernamentales, ministerios de salud, sociedades científicas, agencias de evaluación de tecnologías sanitarias y sitios recopiladores y desarrolladores de guías de práctica clínica (GPC).
De manera preliminar se definieron 27 preguntas de interés clínico que fueron discutidas en una sesión presencial con 25 miembros de la ACEP y tres de la SCP, quienes aprobaron la inclusión de 22 preguntas mediante votación electrónica anónima de una sola ronda. Se consideró acuerdo o desacuerdo si los resultados eran >70% y acuerdo parcial <70%. Del total de preguntas se descartaron cuatro y se sugirió la revisión y el replanteamiento de tres. Al final se formuló y aprobó la inclusión de una pregunta nueva en la misma sesión y una pregunta adicional incluida durante la fase de revisión virtual, para un total de 22 preguntas clínicas.
A partir de la búsqueda de evidencia y la definición de las preguntas se revisaron documentos en texto completo, extrayendo e interpretando los resultados y conclusiones más relevantes, y se analizaron con el equipo base de expertos teniendo en cuenta su grado de aplicabilidad en el contexto colombiano. No se aplicó ningún método estadístico para el análisis de datos en esta investigación. Posteriormente se formularon las recomendaciones, respaldadas en la evidencia consultada, que fueron analizadas por expertos clínicos en pediatría, endocrinología pediátrica, genética y laboratorio clínico en una ronda virtual de revisión. Luego de ajustar el documento se requirió una segunda ronda virtual para la aprobación del contenido del documento con las recomendaciones finales.
Búsqueda de información
La búsqueda de GPC se realizó en los siguientes sitios recopiladores y desarrolladores de este tipo de documentos: Ministerio de Salud y Protección Social (MSPS) de Colombia, Guía Salud España, Guidelines International Network, CPG Infobase Canadá, National Institute for Health and Care Excellence, Scottish Intercollegiate Guidelines Network, New Zealand Guidelines Group, Ministerio de Salud de Chile, Centro Nacional de Excelencia Tecnológica en Salud de México, Organización Mundial de la Salud (OMS) y Sociedad Europea de Endocrinología Pediátrica; para esta búsqueda se utilizaron los términos growth, short stature, turner, prader, small for gestational age, chronic kidney disease and clinical practice guideline, en inglés o español según el sitio de búsqueda.
También se consultó la base de datos médica Ovid MEDLINE y el portal Google para ampliar la búsqueda de GPC sobre SPW y ERC utilizando los términos prader willi, chronic kidney disease, growth hormone y guidelines.
En total, se identificaron 149 artículos de los cuales se seleccionaron cinco22-26 por cumplir los criterios de selección (GPC basadas en evidencia, dirigidas a población menor de 18 años y publicadas en los últimos 10 años en inglés o español).
Se consultaron cinco agencias de evaluación de tecnologías sanitarias (Instituto de Evaluación Tecnológica en Salud de Colombia, Red de Evaluación de Tecnología en Salud de las Américas, Red Española de Agencias de Evaluación de Tecnologías Sanitarias y Prestaciones del Sistema Nacional de Salud, Canadian Agency for Drugs and Technologies in Health y National Institute for Health Research) utilizando los términos growth hormone o somatropin y sus equivalentes en español, y se identificaron 41 documentos, de los cuales se seleccionaron seis12,13,27-30 por cumplir los criterios de selección (ser una evaluación de tecnología en salud dirigida a población menor de 18 años, haber sido publicada en los últimos 10 años en inglés o español y que no haber sido referenciada en una evaluación de tecnología en salud más reciente).
Posteriormente se realizó una revisión no sistemática de la literatura en las bases de datos PubMed y Cochrane para ampliar la información sobre pruebas diagnósticas bioquímicas, pruebas genéticas y manejo farmacológico en pacientes de TB con enfermedades y condiciones de salud específicas: ST, SPW, ERC y PEG; en esta búsqueda se utilizaron los términos growth, child, turner syndrome, prader willi syndrome, chronic kidney disease, mineral and bone disorder, small for gestational age, growth hormone, somatropin, pharmacological tests, stimulation tests, provocative testing, sin límite de fecha en artículos en inglés y en español. Los criterios de inclusión fueron: estudios en menores de 18 años sobre patologías aprobadas en Colombia para tratamiento con somatropina.
Las búsquedas se realizaron entre abril y septiembre de 2019 y los desenlaces analizados con mayor interés correspondían a métodos diagnósticos, tratamiento, seguridad, eficacia, eventos adversos, desenlaces en crecimiento y composición corporal, talla final alcanzada y otros desenlaces relacionados con el uso de somatropina.
Resultados
A continuación, se presentan las recomendaciones derivadas para cada una de las 22 preguntas priorizadas por los expertos.
Pregunta 1. ¿Cuál es la definición de TB propuesta para Colombia?
La TB se define como la talla por debajo de -2 desviaciones estándar (DE) o del percentil 2,3 para la edad cronológica y el sexo de un paciente determinado, e idealmente del mismo grupo étnico o racial31-34. También corresponde a la talla que, aun estando entre ±2 DE para la población general, se sitúa por debajo del carril de crecimiento correspondiente a la talla genética.
La literatura ha definido la TB a partir de la talla medio parental cuando el paciente se encuentran entre 1 y 1,8 DE por debajo de la misma32,34. Al no haber unidad de criterio auxológico en las publicaciones, la recomendación para población colombiana es considerar TB para talla medio parental cuando el paciente crece a -1DE ±5 cm de la misma. La talla baja grave sería la que se encuentre por debajo de -3DE31,35.
Pregunta 2. ¿Cuál es la clasificación de TB propuesta para Colombia?
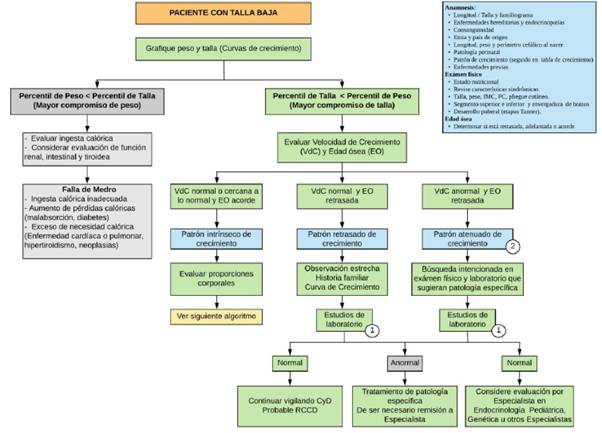
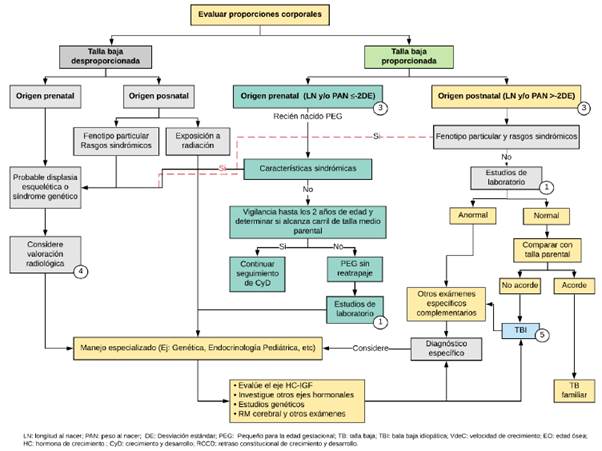
Dadas las características de la población colombiana y considerando las múltiples clasificaciones disponibles para TB, se presenta la propuesta de clasificación expuesta en el Anexo 2, la cual integra conceptos de la versión de la Sociedad Europea de Endocrinología Pediátrica36, la sugerida en Argente, España37,38 y la propuesta por Allen & Cuttler39.
Pregunta 3. ¿Qué criterios generan alta sospecha para considerar que un paciente con TB requiera tratamiento con somatropina?:
Existen patologías cuyo desenlace auxológico es la TB, pero no todas son susceptibles de tratamiento con somatropina, por lo tanto se considera que las siguientes características ameritan ampliar los estudios para así poder establecer un posible tratamiento farmacológico en este tipo de pacientes7,40-42:
Tener TB de acuerdo con la definición propuesta en estas recomendaciones.
Presentar retraso patológico en la edad ósea43.
Evidenciar alteración en la velocidad de crecimiento (VdC) con respecto al carril percentil de talla (usualmente de -1 DE) para edad y sexo documentada en períodos de mínimo 6 meses y por un tiempo acumulado de 2 a 3 años, o en general, cuando la VdC se ha deteriorado de forma significativa, incluso antes de situarse a -2.5 DE33.
Contar con datos en la historia clínica compatibles con las indicaciones de uso de somatropina (pruebas dinámicas sugestivas de DHC, cariotipo compatible con ST, antecedente de nacido PEG, obesidad mórbida acompañada de déficit cognitivo, características fenotípicas patognomónicas y ERC).
Haber descartado la presencia de otras causas de TB (genética, nutricional, orgánica, metabólica o psicogénica) no susceptibles de tratamiento con somatropina.
Pregunta 4. ¿Cuáles son los criterios para remitir de pediatría a endocrinología pediátrica a un paciente que presenta TB?
El médico pediatra deberá remitir el paciente al endocrinólogo pediatra cuando:
Se documente una VdC por debajo del percentil 25 (o -1 DE) en quien no se detecte una causa específica de la TB22.
Se esté frente a un paciente con antecedente de nacido PEG que no presenta recuperación de la talla a los dos años y en quien no se detecta causa específica22,44.
El paciente presenta TB con peso alto para la talla en rango de sobrepeso u obesidad y se sospecha hipotiroidismo, exceso de glucocorticoides o DHC22.
Se detecte discordancia entre la edad cronológica y la madurez sexual según estadíos de Tanner22.
Se detecte edad ósea retrasada y se sospeche de hipotiroidismo en niños con TB posnatal22.
Se sospeche o identifique alguna de las siguientes patologías: DHC; disfunción en la secreción de somatropina secundaria a radioterapia; ERC en tratamiento conservador, en diálisis o hemodiálisis; pre y postrasplante renal; ST; dismorfismo o TB desproporcionada, y sospecha de anomalía cromosómica22.
No se considera una buena práctica clínica la remisión a endocrinología pediátrica de pacientes que crecen por su carril genético, que su talla blanco está incluida en la referencia poblacional y además cuentan con una buena VdC.
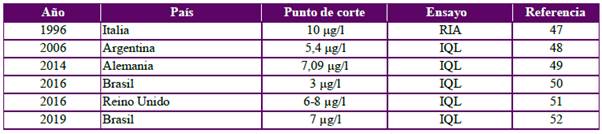
Pregunta 5. ¿Cuáles son los puntos de corte de las pruebas de estimulación para hormona de crecimiento?
La literatura refiere diferentes puntos de corte de hormona de crecimiento que varían de acuerdo a la población estudiada, así como en el caso de pacientes con diagnóstico de obesidad y sobrepeso45, y de acuerdo a la metodología utilizada en el laboratorio46-52. En Colombia no se cuenta con información para definir o establecer estos puntos de corte, por lo que en la Tabla 1 se presentan algunos estudios que informan valores para la determinación de niveles adecuados de hormona de crecimiento en plasma que difieren según el tipo de prueba de estimulación utilizada y la estandarización de las pruebas a nivel local.
Pregunta 6. ¿Cuál es la utilidad de la determinación del factor de crecimiento similar a la insulina tipo 1 (IGF-1) en niños con TB?
La determinación de IGF-1 es una ayuda diagnóstica y un criterio de seguimiento, ya que los valores bajos sugieren DHC y la elevación de los mismos durante el tratamiento con hormona de crecimiento permite evaluar la respuesta53. Sin embargo, para niños entre 3 y 8 años se recomienda ser cauto con la solicitud de dicho examen y la interpretación de los resultados, pues los valores considerados como normales pueden superponerse entre pacientes con y sin DHC53,54.
En pacientes que se encuentren en tratamiento con somatropina se sugiere monitorizar los niveles de IGF-1 dos veces al año y vigilar de manera especial a los pacientes con determinaciones elevadas. Asimismo, diversos autores recomiendan titular la dosis de esta hormona con base en los valores de IGF-123,25,55.
Pregunta 7. ¿Qué valores de referencia de IGF-1 se sugiere utilizar en Colombia?
En Colombia no existen valores de referencia de IGF-1 y estos están ligados a la plataforma (equipo) y la técnica de procesamiento, por lo que los resultados pueden variar entre cada laboratorio. En la literatura existen diferentes valores de referencia que pueden ser consultados por los endocrinólogos pediatras56-59, pero dado el panorama nacional es importante que los profesionales conozcan la plataforma de procesamiento en la que se realizó la prueba con el fin de correlacionar los resultados con la información disponible.
Algunos autores sugieren que los valores de IGF-1 varían dependiendo la edad, el género y el estado de desarrollo puberal, por lo que existen tablas que muestran valores de referencia de acuerdo a la etapa de desarrollo puberal de Tanner58,60. De igual forma, los resultados también pueden analizarse de acuerdo a la DE (puntuación z) de la población referencia de cada prueba y cuyos valores están distribuidos entre +2 DE (percentil 97,5) y -2 DE (percentil 2,5).
Pregunta 8. ¿Qué pruebas de estimulación de somatropina se deben solicitar cuando se sospecha DHC?
Se sugiere que las pruebas dinámicas con estímulo químico para diagnóstico de DHC las solicite el endocrinólogo pediatra como estudio de última línea para confirmar dicho diagnóstico, lo anterior teniendo en cuenta que los resultados no son un criterio único para definir el tratamiento farmacológico y que se requieren dos pruebas dinámicas con estímulos diferentes para confirmar DHC siguiendo protocolos de laboratorio estandarizados25,52.
La realización de pruebas dinámicas implica el cumplimiento de requisitos técnicos, de infraestructura y de procesos estandarizados, pues supone la administración de medicamentos con riesgo potencial para la seguridad del paciente; en este sentido, se hace necesaria la vigilancia médica en un centro de servicio con capacidad de atención inicial de posibles efectos adversos, y de hospitalización ante casos de difícil manejo.
Con base en lo anterior, en Colombia se considera una buena práctica clínica el solicitar las pruebas dinámicas disponibles en los laboratorios autorizados en el país con los estímulos de clonidina, insulina, glucagón y levodopa8,33,52,61-69.
Pregunta 9. ¿Cuáles son las indicaciones de uso de impregnación con testosterona o estrógenos?
Es deber del clínico tomar la decisión de formular impregnación con esteroides sexuales antes de las pruebas funcionales solicitadas ante la sospecha de DHC en niños pre-púberes >11 años y en niñas pre-púberes >10 años para prevenir el tratamiento innecesario con somatropina en niños con retraso constitucional del crecimiento y el desarrollo.
Independientemente del sexo, se recomienda indicar 2 mg de β-estradiol (1 mg para peso corporal <20 kg) por vía oral durante las dos noches anteriores a la prueba. Los varones pueden prepararse con testosterona intramuscular (50-100 mg de una formulación de depósito administrada una semana antes de la prueba)25.
Dado que la disponibilidad de esteroides sexuales no es constante en algunos países para la realización de la impregnación, se sugiere individualizar la decisión de realizar las pruebas dinámicas en esta forma.
Pregunta 10. ¿En qué población y con qué frecuencia está indicada la determinación de edad ósea?
Es necesario determinar la edad ósea a través de una radiografía anteroposterior de mano y muñeca izquierda (carpograma) en niños >3 años en quienes se haya documentado alteración de la VdC43,46,70,71; esta prueba no es recomendable en <2 años, en quienes la evaluación de la edad ósea es menos confiable. De igual forma se recomienda tener especial cuidado en niños con obesidad, en quienes la edad ósea es típicamente avanzada54. No hay certeza sobre en qué momento se debe repetir o hacer seguimiento radiológico, pero se recomienda evaluar el beneficio de su realización dados los niveles de exposición a radiación ionizante a los que se puede ver sometido un niño en el caso de repetir de forma indiscriminada el estudio.
En general, se sugiere considerar la toma anual de un carpograma en pacientes que se encuentran en tratamiento con somatropina; en condiciones específicas como el desarrollo puberal podrá tomarse a intervalos menores de acuerdo al criterio del médico tratante.
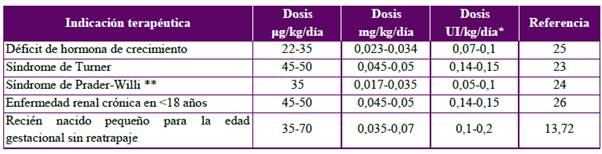
Pregunta 11. ¿Cuál es la dosis de somatropina según las indicaciones aprobadas en Colombia?
En la Tabla 2 se relacionan las dosis de somatropina de acuerdo a las indicaciones aprobadas hasta el momento en Colombia. La literatura sugiere titular la dosis con base en los valores de IGF-123,25,55.
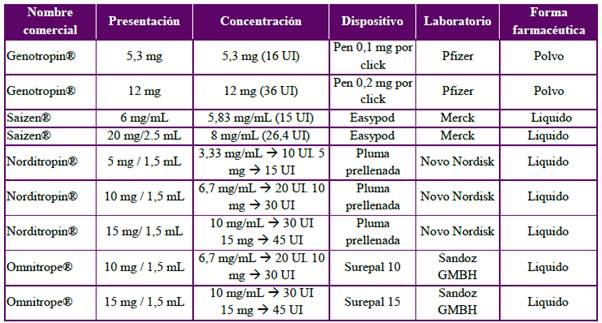
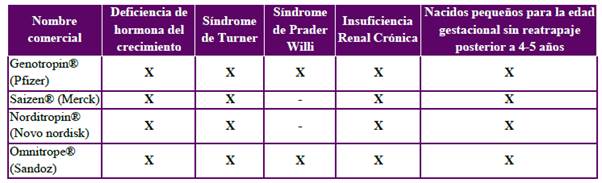
Pregunta 12. ¿Cuáles son las moléculas y especificaciones técnicas de la somatropina de mayor uso en Colombia?
En Colombia existen varias moléculas de somatropina con registro INVIMA, pero las más frecuentemente utilizadas se listan en el Anexo 1, junto con sus especificaciones técnicas.
Pregunta 13. ¿Qué curvas de crecimiento se sugiere utilizar para el seguimiento de niños con TB en Colombia?
Se sugiere seguir las recomendaciones de la GPC de crecimiento y desarrollo del MSPS de Colombia74, en donde se hacen dos principales recomendaciones:
Emplear el indicador talla para la edad por debajo de -2 DE para su edad y sexo en los patrones de referencia de crecimiento de la OMS para clasificar en TB para la edad (retraso en talla) a niños entre los 0 y 5 años de edad74.
Emplear el indicador talla para la edad por debajo de -2 DE para su edad y sexo en las curvas colombianas de crecimiento para clasificar en TB para la edad (retraso en talla) a niños entre los 5 y 10 años de edad74.
Para el diagnóstico clínico y el seguimiento de pacientes con TB se propone comparar los parámetros auxológicos (talla, peso, índice de masa corporal y perímetro cefálico) con los generados a partir de población colombiana de 0 a 20 años de edad y publicados por Durán et al.75 en el 2015, pues la dinámica de crecimiento y la talla final de penden principalmente de la carga genética y tienen en cuenta el efecto sustancial de los factores ambientales propios de cada población.
En cuanto a la VdC, se debe considerar que mientras se generan curvas locales se deben utilizar los patrones de referencia del estudio de Kelly et al.16 publicados en el 2014, los cuales demostraron superioridad estadística respecto a los planteados por Tanner & Whitehouse77, que fueron desarrollados con la técnica estadística de centralización que puede sobredimensionar la VdC y tuvieron un evidente sesgo de selección de la población para el desarrollo de los mismos. El estudio de Kelly et al.76, realizado con el método matemático Lambda-Mu-Sigma (LMS) para el ajuste de datos antropométricos, incluyó además población latina y contempló los perfiles de maduración lenta, promedio y rápida.
Pregunta 14. ¿Qué códigos de la 10.a edición de la Clasificación internacional de enfermedades (CIE-10) se deben utilizar en Colombia para el registro unificado de las condiciones de salud relacionadas con TB en niños?
Para el registro unificado de las condiciones de salud relacionadas con TB en niños se sugiere utilizar los códigos CIE-10 que se presentan en la Tabla 3.
Tabla 3 Principales códigos CIE-10 relacionados con talla baja en niños.
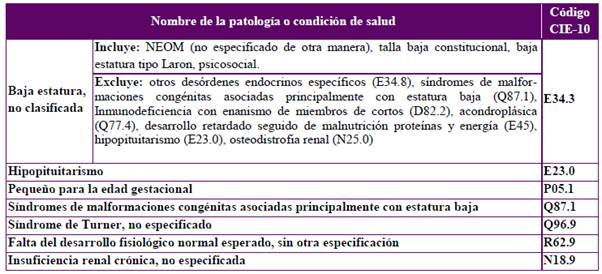
Fuente: Elaboración propia.
Se sugiere usar el código E230: hipopituitarismo en los pacientes en quienes se ha confirmado deficiencia de hormona de crecimiento. El código R629 se usará en el paciente con talla baja en estudio etiológico.
Pregunta 15. ¿Cuáles son los criterios de suspensión o retiro de la somatropina?
La decisión de interrumpir el tratamiento con somatropina debe tomarse en conjunto con el paciente y/o los cuidadores cuando se demuestre el cierre epifisiario26; cuando el paciente se encuentra en rango genético de talla blanco y su VdC sea <2 cm de crecimiento total en un año13, y cuando haya problemas insuperables de adherencia al tratamiento13. También se debe interrumpir en pacientes con edad ósea >16 años cuando sean niños y >15 cuando sean niñas.
Haber llegado a una estatura dentro del rango de la talla familiar calculada según la fórmula de Tanner78,79 también se debe considerar como un evento para interrumpir el tratamiento. En pacientes con ERC e hiperparatiroidismo secundario severo persistente (Hormona paratiroidea [PTH]> 500 pg/ml) la somatropina se debe suspender, pero se puede restablecer cuando los niveles vuelvan al rango objetivo deseado de PTH26. Esta suspensión también debe darse cuando aparezca cualquier evento adverso serio (necrosis avascular de la cabeza del fémur o epifisiólisis de la cabeza femoral)26 y/o reportado en la ficha técnica del medicamento (Ver Anexo 1). Por último, si el paciente, a pesar de un control nutricional y metabólico óptimo, no responde adecuadamente al tratamiento este debe aplazarse26,80.
Pregunta 16. ¿En Colombia se sugiere el uso de un Consentimiento Informado para iniciar tratamiento con somatropina?
Se sugiere que el consentimiento informado forme parte de la historia clínica del paciente como documento que evidencie el proceso de participación en la toma de decisiones informadas por parte del paciente y sus cuidadores, tanto para aceptar como para rechazar el inicio del tratamiento (Anexos 3 y 4).
Pregunta 17. ¿Cuáles son las consideraciones relacionadas con el uso de somatropina en pacientes con y sin DHC?
De acuerdo con la GPC de Grimberg et al.25, se proponen las siguientes consideraciones respecto al uso se somatropina en pacientes con y sin DHC:
El diagnóstico de DHC no requiere pruebas de provocación cuando se cumplen las siguientes tres condiciones: criterios auxológicos, algún defecto hipotálamo-hipofisiario (malformación, neoplasia o irradiación) y deficiencia de al menos una hormona hipofisaria adicional25.
El DHC debido a hipopituitarismo congénito no requiere pruebas de provocación de somatropina en un recién nacido con hipoglucemia que no alcanza una concentración sérica de esta hormona por encima de 5 µg/L y tiene una deficiencia de al menos una hormona pituitaria adicional y/o la tríada clásica de imagen (hipófisis posterior ectópica e hipoplasia hipofisaria con tallo anormal)25.
Dado el número sustancial de niños sanos con crecimiento normal y pruebas por debajo de los límites aceptados, se requiere una respuesta inadecuada a dos pruebas de provocación con estímulos diferentes para el diagnóstico de DHC25.
Dadas las grandes discrepancias entre los ensayos de somatropina, se recomienda que las instituciones soliciten que los laboratorios proporcionen ensayos armonizados de esta hormona utilizando el estándar (IRP IS 98/574, isoforma de 22k rhGH) según lo recomendado por las declaraciones de consenso de 2006 y 2011 y los estándares de conmutabilidad publicados25,81.
No es útil solicitar hormona de crecimiento basal para confirmar el diagnóstico de DHC en un entorno clínico25, por lo que para este fin se usan pruebas dinámicas.
En Colombia no es necesario practicar pruebas dinámicas para otras indicaciones aprobadas de uso de somatropina (diferentes a DHC), toda vez que se documentan con los estudios respectivos para cada diagnóstico (ST, SPW, ERC, PEG)23,24,26,82.
Es recomendable realizar una resonancia magnética nuclear con contraste de silla turca y región suprasellar una vez confirmado el diagnóstico de DHC y antes de iniciar tratamiento con somatropina34, así como evaluar las demás hormonas pituitarias.
Se deben reevaluar los ejes suprarrenal y tiroideo después del inicio de la terapia con somatropina en pacientes cuyo DHC se asocie con posibles deficiencias de hormonas hipofisarias múltiples (panhipopituitarismo)25.
Algunas condiciones tienen un riesgo intrínseco incrementado de malignidad (neurofibromatosis-1, síndrome de Down, síndrome de Bloom, anemia de Fanconi, síndrome de Noonan y anemia de Diamond-Blackfan), por lo que no se recomienda la prescripción de somatropina en estos pacientes25.
Pregunta 18. ¿Cuáles son las consideraciones relacionadas con el uso de somatropina en pacientes con ST?
De acuerdo con la GPC de Gravholt et al.23 se proponen las siguientes consideraciones:
Se recomienda realizar cariotipo a toda niña que haya llegado por TB sin causa aparente a consulta supraespecializada (endocrinología pediátrica o genética)23.
En mujeres con ST se debe iniciar el tratamiento con somatropina en forma temprana (alrededor de los 4 a 6 años de edad), cuando se evidencia disminución en la VdC por debajo del percentil 50 y sostenida en esa forma durante 6 meses; en ausencia de otra causa tratable de déficit del crecimiento; cuando existe alta probabilidad de TB por padres con baja estatura o TB adulta predicha, y cuando la paciente se encuentra en una edad poblacional de pubertad al momento del diagnóstico de ST23.
El tratamiento con somatropina se debe monitorizar en mujeres con ST midiendo la estatura cada 4-6 meses durante el primer año de tratamiento y cada 6 meses a partir de entonces23.
La seguridad de la terapia con somatropina debe ser vigilada midiendo la IGF-1 al menos una vez al año; si los valores están por encima de +3 DE de la media de la edad se justifica una disminución de la dosis de la hormona, pero para valores de entre +2 DE y +3 DE, el juicio clínico debe guiar la selección de la dosis23.
Se debe hacer una tamización para hipotiroidismo en el momento del diagnóstico y luego anualmente con mediciones de T4 libre y TSH a partir de la primera infancia y durante toda la vida23.
Es necesario solicitar medición anual de HbA1c de por vida con o sin glicemia en ayunas23.
Se recomienda realizar evaluación clínica para escoliosis cada 6 meses durante la terapia con somatropina hasta que se complete el crecimiento; si la evaluación se hace de otra forma, debe ser anual23.
Se sugiere no agregar de forma rutinaria suplementos de estrógenos de muy baja dosis en pacientes prepúberes para promover el crecimiento23 y que la inducción puberal con estrógenos entre los 11 y los 12 años de edad ósea sea un efecto mimético del estirón puberal23.
Pregunta 19. ¿Cuáles son las consideraciones relacionadas con el uso de somatropina en pacientes con SPW?
De acuerdo con la GPC de Deal et al.24 se proponen las siguientes consideraciones:
Los pacientes con SPW deben tener un diagnóstico confirmado genéticamente y una evaluación clínica multidisciplinaria antes de iniciar el tratamiento con somatropina. Si este se inicia, se deberá continuar mientras los beneficios superen los riesgos24.
En niños con SPW no se requiere prueba de estimulación de somatropina como parte del proceso de toma de decisiones terapéuticas24.
Los criterios de exclusión para el inicio del tratamiento con somatropina en pacientes con SPW son obesidad mórbida, diabetes no controlada, apnea obstructiva grave del sueño no tratada, cáncer activo y psicosis activa24.
La escoliosis no es una contraindicación absoluta, pero sí relativa para el tratamiento con somatropina en pacientes con SPW. Por tanto, debe llevarse un seguimiento estricto ya que la enfermedad puede empeorar durante el tratamiento24.
El tratamiento con somatropina debe realizarse en el contexto de las intervenciones dietéticas, medioambientales y de estilo de vida adecuadas para el cuidado de todos los pacientes con SPW24.
El deterioro cognitivo no debe ser una barrera para el tratamiento con somatropina en pacientes con SPW24.
Los niveles de IGF-1 en pacientes con SPW en tratamiento con somatropina pueden mantenerse dentro del límite superior del rango normal (máximo +2DE)24, esto teniendo en cuenta que los niveles de IGF-1 inmunorreac-tiva no representan los niveles de IGF-1 bioactiva en niños con SPW tratados con la hormona. Por lo tanto, niveles elevados no son indicación de sobredosis73.
Los pacientes con SPW que reciben somatropina deben tener un cuidadoso seguimiento para detectar posibles efectos adversos del tratamiento cada 3 a 6 meses24.
Pregunta 20. ¿Cuáles son las consideraciones relacionadas con el uso de somatropina en pacientes con ERC?
Los pacientes con ERC y tratamiento con somatropina deben ser evaluados de forma interdisciplinaria por nefrología y endocrinología pediátrica, pues si bien el nefrólogo pediatra podría iniciar el tratamiento en pacientes adecuadamente seleccionados, el endocrinólogo pediatra debe ser el encargado del mismo, idealmente desde el inicio, y el responsable del seguimiento.
Por otro lado, de acuerdo con el consenso de Drube et al.26 y con recomendaciones de un grupo de expertos locales, basadas en evidencia científica (datos por publicar)se proponen las siguientes consideraciones:
Para el inicio del tratamiento con somatropina se deberá tener en cuenta edad, evaluación del estado puberal según la escala de Tanner, fondo de ojo, etiología de la enfermedad renal, trastornos sistémicos, estadio de la ERC, adecuación de la diálisis (para pacientes en diálisis), tiempo de trasplante y grado de función del injerto y la terapia con glucocorticoides (en niños post-trasplante), esto último dado que las dosis altas de glucocorticoides pueden suprimir casi por completo el efecto de la hormona26.
La eficacia del tratamiento en los pacientes adecuadamente seleccionados será mayor si se inicia antes de la pubertad y previo a que el deterioro de talla sea marcado.
Antes de iniciar la terapia con somatropina se deben controlar los factores asociados a la ERC que limitan el crecimiento, tales como la desnutrición proteico-calórica, la acidosis metabólica, los trastornos electrolíticos (hiponatremia), la deshidratación y la enfermedad mineral ósea, incluido el hiperparatiroidismo secundario26.
La evidencia sugiere que el tratamiento con somatropina aumenta la talla en pacientes con ERC, siendo mayor si se inicia antes de la diálisis, menor si se inicia durante la misma e intermedia si se inicia postransplante. El tratamiento es seguro desde el punto de vista de la intervención y la enfermedad renal en sí misma.
Al iniciar el tratamiento se debe realizar una valoración auxológica, de desarrollo puberal, maduración ósea, densidad mineral ósea, perfil lipídico, glucosa, HbA1c, insulina, IGF-1, creatinina sérica, tasa de filtración glomerular estimada, urea, calcio, fósforo, fosfatasa alcalina total, bicarbonato, hormona paratiroidea y 25(OH)-vitamina D y albúmina26.
En los niños postrasplante renal se debe iniciar la terapia con somatropina un año después del trasplante si la recuperación del crecimiento no es espontánea y la inmunosupresión sin esteroides no es factible26.
La terapia con somatropina se debe considerar en pacientes con ERC en cualquier estadio, pues debido a la cistinosis nefropática presentan una falla de crecimiento persistente a pesar de un tratamiento adecuado para dicha condición26.
En un paciente con ERC avanzada y tratamiento con somatropina se debe realizar control trimestral/semestral para controlar la estatura, la VdC, el desarrollo puberal, la función renal y los niveles de TSH, T3 libre, glicemia, calcio, fosfato, bicarbonato y hormona paratiroidea26.
Si la VdC en el primer año de tratamiento con somatropina es inferior a 2 cm por año sobre la línea de referencia, se debe evaluar la adherencia del paciente al tratamiento incluyendo la medición de los niveles séricos de IGF-1, dosis de somatropina ajustadas al peso y evaluación de los factores nutricionales y metabólicos26.
La somatropina se debe suspender en el momento del trasplante renal, en caso de una disminución inexplicable en la tasa de filtración glomerular estimada26, en casos de aparición de proteinuria significativa no explicada por recurrencia de la enfermedad primaria en el injerto83, en sospecha de malignidad, cuando se haya alcanzado la meta con base a talla media parental o percentil 50 para edad y cuando haya cierre epifisiario, desplazamiento de epífisis femoral e hipertensión intracraneana.
Pregunta 21. ¿Cuáles son las consideraciones relacionadas con el uso de somatropina en niños PEG?
Por definición, un recién nacido es PEG cuando nace con peso, longitud y/o perímetro cefálico por debajo de -2 DE para las semanas de gestación y el sexo con respecto a los estándares publicados en el estudio INTERGROWTH 2184,85. En ese sentido, todos los pacientes que son o fueron PEG requieren un estudio exhaustivo de la probable etiología que les condujo a este desenlace en los primeros 2 años de vida. En caso de encontrar una causa específica, esta se debe tratar o remitir para tratamiento con el especialista pertinente82.
Los niños PEG que no tengan una recuperación del crecimiento o reatrapaje de talla a los 2 años de edad requieren nueva evaluación clínica para determinar la causa. En caso de no encontrarse o de sospechar una alteración hormonal, se recomienda valoración por endocrinología pediátrica para diagnóstico y/o tratamiento44,82.
Son candidatos a tratamiento con somatropina los niños PEG sin reatrapaje de talla a los 2 años de edad en quienes no se establece una causa específica de falla en crecimiento y se descarta etiología sindrómica diferente a las indicaciones aprobadas consignadas en este texto44,82.
De igual forma, en pacientes PEG se debe monitorizar la terapia con los parámetros clínicos y paraclínicos expuestos en este documento, y aunque no hay consenso acerca de los niveles de seguridad de IGF-1, se sugiere mantenerlos durante la terapia con somatropina en un límite entre 1,5 y 2 DE para la edad y el sexo86.
Pregunta 22. ¿Qué pacientes con TB requieren valoración por especialista en genética?
Se requiere una evaluación por genética clínica cuando un paciente presenta TB asociada a retraso del neurodesarrollo o déficit cognitivo, alteración en las proporciones corporales, dismorfismo facial, malformaciones congénitas múltiples (entendidas como dos o más órganos o sistemas afectados) y/o características que son consistentes con una asociación sindromática específica como síndrome Noonan, ST, SPW.). En estos pacientes el análisis citogenético o molecular puede ayudar a determinar la causa de la TB y/o la condición del paciente, e incluso puede establecer la necesidad de estudiar a los padres u otros familiares, todo esto con una adecuada consejería genética que permita la determinación de riesgos de recidiva y un diagnóstico prenatal oportuno en próximas generaciones38,87,88.
Las pruebas genéticas y/o epigenéticas no son necesarias para todos los niños con TB, pero deben utilizarse en la evaluación diagnóstica de grupos específicos de niños cuyo fenotipo sugiere una alta probabilidad de una causa genética como los DHC aislados, la TB de presentación familiar, los síndromes específicos con deficiencias hipofisiarias múltiples, la TB grave (<-3 DE de la población más de 3 DE por de bajo de su talla medio parental), la desproporción corporal y/o las displasias esqueléticas; también se deben practicar en los niños PEG sin recuperación adecuada del crecimiento54.
Conclusión
La somatropina es un medicamento de uso frecuente en la práctica del endocrinólogo pediatra. Para su uso existen criterios y dosis específicas, así como pruebas diagnósticas y seguimiento, según sea la indicación con la que se prescribe. Responder a las preguntas que generan incertidumbre en la práctica clínica permite establecer unidad de criterio a nivel nacional que generará impacto en el registro estadístico, trabajos de investigación, seguimiento clínico, y uso racional de los recursos en el sistema de salud, con base en la mejor evidencia disponible y el acuerdo de expertos en el contexto del ejercicio profesional en Colombia.