Introducción
La glomerulonefritis membranoproliferativa (GnMP), antiguamente denominada mesangio capilar, corresponde a un grupo lesiones glomerulares de origen primario o secundario; estas lesiones de origen primario tienen una prevalencia del 10 %1 y son la cuarta causa de enfermedad renal terminal entre las glomerulonefritis primarias2. Además, hace algún tiempo estas formas idiopáticas eran más frecuentes en la población infantil y adultos jóvenes; sin embargo, con el descubrimiento de nuevas técnicas diagnósticas y el surgimiento de una nueva clasificación, se han vuelto poco comunes, por lo que las formas secundarias se diagnostican con mayor frecuencia tanto en edad adulta, con en jóvenes2,3.
Las GnMP evolucionan lenta y progresivamente con hematuria y proteinuria en rango no nefrótico; también se ha descrito la presencia de síndrome nefrótico y presentaciones más severas. Esta presentación clínica variada es causada por diferencias en la patogenia del trastorno y en el momento de toma de la biopsia en relación con el curso clínico4. De igual forma, según la nueva clasificación, esta patología puede estar mediada por un aumento en los niveles de complejos inmunes o puede ocurrir debido a trastornos asociados con la regulación en la vía alternativa del complemento5.
La GnMP mediada por complejos inmunes resulta del depósito de complejos inmunes en los glomérulos debido a la antigenemia persistente, lo que provoca la formación de complejos inmunes de anticuerpos antigénicos como resultado de infecciones crónicas, enfermedades autoinmunes o paraproteinemias debidas a gammapatías monoclonales. Otro mecanismo fisiopatológico para desarrollar GnMP consiste en la desregulación de la vía alternativa del complemento debido a mutaciones o autoanticuerpos contra proteínas reguladoras de este, y genera el depósito de estos productos en el mesangio y la región subendotelial desencadenando una inflamación glomerular y conduciendo a la GnMP6.
A continuación, se presenta el caso de un paciente adulto, quien cursó con una glomerulonefritis de patrón histológico membranoproliferativo que se manifestó como un síndrome nefrótico y marcada proteinuria, pero que no registró carga de comorbilidad previa, por lo que se contempló el abordaje clínico y diagnóstico de GnMP.
Presentación del caso
Paciente masculino de 48 años de edad sin antecedentes patológicos previos, quien consultó al servicio de urgencias en el 2019 por un cuadro clínico de tres semanas de evolución consistente en edema bilateral en miembros inferiores, progresivo y periorbitario, asociado a la presencia de cifras tensionales elevadas. Los estudios ambulatorios evidenciaron proteinuria en rango nefrótico (62 g en 24 horas), elevación de nitrogenados con creatinina sérica (2,4 mg/dL) e hipoalbuminemia (2,4 mg/dL); los valores basales de creatinina fueron 1,2 mg/dL. Se estableció que el sujeto presentaba síndrome nefrótico y se iniciaron estudios para descartar etiologías secundarias (Figura 1) como enfermedades autoinmunes, procesos infeccios
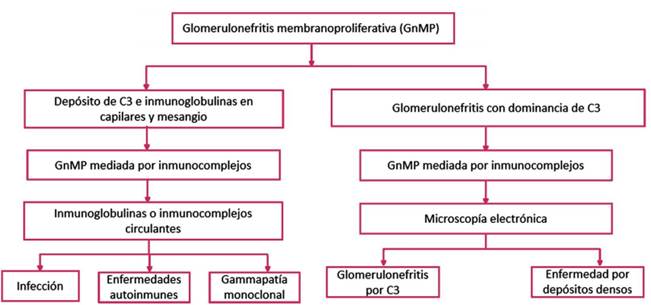
Fuente: elaboración propia.
Figura 1 Algoritmo diagnóstico en glomerulonefritis membranoproliferativa.
GnMP: glomerulonefritis membranoproliferativa; C3:Complemento C3.
Los paraclínicos solicitados para el enfoque de la GnMP se presentan en la Tabla 1, junto con los resultados obtenidos en cada uno de ellos.
Tabla 1 Resultados de laboratorios.
| Prueba de laboratorio | Resultado | |
|---|---|---|
| Creatinina | 2,4 mg/dL | |
| BUN | 60 | |
| Microalbuminuria en orina parcial | 950 mg | |
| Proteínas en orina de 24 horas | 62 g/24 hr | |
| Sodio | 137 meq/L | |
| Perfil renal | Potasio | 4,6 meq/L |
| Magnesio | 2,2 meq/L | |
| Calcio | 7,4 meq/L | |
| Fósforo | 4,7 meq/L | |
| Albúmina | 2,6 g/dL | |
| PTH | 176,4 pg/mL | |
| Ac hepatitis B core | No reactivo | |
| Ag S hepatitis B | No reactivo | |
| Perfil infeccioso | Ac hepatitis C | No reactivo |
| VIH | No reactivo | |
| VDRL | No reactivo | |
| ANAS | negativo | |
| ENAS | Negativo | |
| ANCAS | Negativo | |
| Anti DNA | Negativo | |
| Perfil inmunológico | Complemento C3 | <40 mg/dL |
| Complemento C4 | 18,7 mg/dL | |
| Crioglobulinas | negativo | |
| Electroforesis de proteínas | Tenue proteína monoclonal en región gamma | |
Fuente: elaboración propia.
Dentro de la evolución clínica se evidenció rápido deterioro de la función renal, asociado a consumo de complemento C3, por lo que se realizó biopsia renal y se iniciaron pulsos de esteroides y manejo antiproteinurico. Posteriormente, el paciente presentó mejoría clínica, adecuado control de cifras tensionales, mejoría de edemas y descenso en valores de creatinina, llegando a 1,4 mg/dL.
Se realizó biopsia de tejido renal con hematoxilina eosina, pas y tricrómico, en la que se observó esclerosis glomerular segmentaria en dos de los diez glomérulos evaluados; esto se asoció a glomerulomegalia, ensanchamiento mesangial en relación a proliferación celular endocapilar, permeación glomerular por polimorfonucleares neutrófilos, desdoblamiento del glomérulo y engrosamiento con mínimos cambios de cronicidad tubulointersticiales. En el estudio de inmunofluorescencia (IF) llamaron la atención los depósitos mesangiales y de membrana basal glomerular para IgG, IgA, IgM, C3, C1q, así como la expresión más prominente de lambda que la de kappa. En los hallazgos de ultra estructura se corroboraron depósitos a nivel mesangial que podrían haber estado relacionados con depósitos de imunocomplejos (Figura 2).
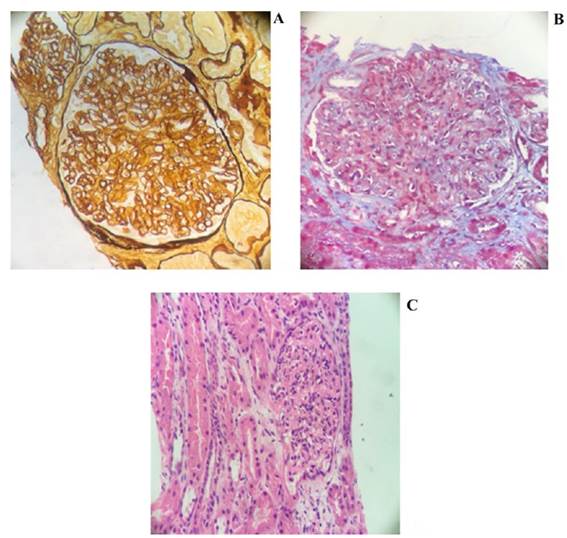
Fuente: documentos obtenidos durante la realización del estudio.
Figura 2 Biopsia renal. A) Coloración de plata; B) Tinción de PAS, C) Coloración H&E.
En seguimiento por consulta externa se registró que el paciente persistió con proteinuria en descenso a 5 gramos en 24 horas, además mediante electroforesis de proteínas en sangre se evidenció tenue proteína monoclonal en región gamma, por lo que se solicitaron complementos de análisis en búsqueda de gammapatía monoclonal, cuyos resultados no estaban listos al momento de la elaboración del presente reporte de caso.
Discusión
Las GnMP son un grupo heterogéneo de entidades que producen daño glomerular; comparten como evento fisiopatogénico el daño de la célula mesangial y las células del subendotelio, y se manifiestan con depósitos subendoteliales, subepiteliales o ambos. 7
El término membranoproliferativa hace referencia a una serie de características vistas en microscopía que corresponden a hipercelularidad mesangial, proliferación endocapilar, remodelación de la pared capilar, formación de doble contorno y duplicación de las membranas basales, las cuales representan alrededor del 10 % de todas las glomerulopatías7. La clasificación de estas entidades se basaba en los hallazgos vistos bajo microscopía electrónica; sin embargo, dado que se reconoce el papel del complemento en la patogénesis de este tipo de patologías, en la actualidad existe una nueva clasificación basada en observaciones en la IF7 (Figura 1).
En cuanto a la presentación clínica, la GnMP es una entidad que con mayor frecuencia afecta a jóvenes, aunque se ha descrito a cualquier de edad. Asimismo, las manifestaciones clínicas son muy variables y van desde proteinuria o hematuria asintomática, hasta presentaciones severas con glomerulonefritis rápidamente progresiva, aunque estas últimas involucran patrones de síndrome nefrítico-nefrótico con mayor frecuencia. Además, pueden presentarse diversos grados de disfunción renal, de los cuales el 40 % puede progresar a enfermedad renal crónica terminal en 10 años7,8.
En el presente caso el paciente cursó con cifras tensionales elevadas, deterioro de la función renal y síndrome nefrótico puro, con evidencia de proteinuria marcada (62 gr en 24 horas) nunca antes vista en la amplia trayectoria del servicio de nefrología del Hospital de San José.
El enfoque inicial para el manejo de la GnMP incluye realizar biopsia renal con el fin de reconocer el patrón histológico, determinar estudios pertinentes según el patrón ilustrativo en la IF y así orientar el tratamiento dirigido correspondiente7. Las GnMP pueden tener como origen una etiología primaria/idiopática o secundaria, siendo la etiología secundaria la más frecuente. Previo a establecer como diagnóstico una etiología primaria y partiendo de la relación en la patogénesis del complemento, es imprescindible tener en cuenta entidades relacionadas con formación de inmunocomplejos7, por lo que en caso de no evidencia de C3 en la IF, es indispensable descartar la presencia de infecciones; por lo tanto, las entidades más frecuentes a descartar corresponden a infección por hepatitis B y C, asociado o no a crioglobulinemia; endocarditis infecciosa, y algunas infecciones por parásitos e incluso en presencia de abscesos. En las GnMP secundarias a infecciones se ha descrito como etiología principal la asociada a infección por hepatitis C7.
En paralelo a la búsqueda de enfermedades infecciosas, tanto por clínica como por evidencia serológica, se deben realizar estudios de enfermedades autoinmunes, ya que la relación entre estas y el desarrollo de GnMP ha sido ampliamente descrita, aunque se debe mencionar que su presentación es poco frecuente9. Dicha afectación se considera predominante en mujeres que padecen alguna de estas entidades por largos periodos de tiempo y se asocian, además, a hematuria y/o proteinuria con hipocomplementemia. Estudios de IF en la biopsia renal pueden presentar IgM y C39. Las enfermedades autoinmunes descritas en asociación a las GnMP son lupus eritematoso sistémico (LES), con mayor frecuencia, y, ocasionalmente, síndrome de Sjögren, artritis reumatoide y enfermedades del colágeno10.
Siguiendo por la misma línea del depósito de los inmunocomplejos, se ha reconocido relación entre gammapatías monoclonales y desarrollo de GnMP, dentro de las cuales la gammapatía monoclonal de significado incierto (MGUS) es la entidad más comúnmente asociada, seguida, con menos frecuencia, de mieloma múltiple (MM), linfoma de célula B de bajo grado y leucemia linfocítica crónica10. La MGUS se refiere a una lesión premaligna, precursora de MM o de amiloidosis de cadenas ligeras (AL), que se presenta en raras ocasiones en menores de 30 años, pero cuya prevalencia aumenta a partir de los 50 años, representando en este último grupo etario el 2 % y 1,4 % de casos en hombres y mujeres, respectivamente. 10
La gammapatía monoclonal se caracteriza por la proliferación de un solo clon de células plasmáticas o linfocitos productores de inmunoglobulinas (Ig) que llevan a la circulación de Ig monoclonales y su posterior depósito en la estructura glomerular10. Por lo tanto, los pacientes con GnMP requieren estudios que deben incluir electroforesis de proteínas e inmunofijación en suero y orina; en caso de ser positivos, se debe realizar biopsia de médula ósea para determinar si la gammapatía monoclonal es causada por MGUS, mieloma múltiple o un trastorno linfoproliferativo distinto10. La electroforesis de proteínas es un estudio con buena sensibilidad para detectar gammapatía monoclonal por MM, aunque no tanto para detectar gammapatía monoclonal por amiloidosis (88 % y 66 %, respectivamente) 11. La sensibilidad para detectar MM mejora cuando además de la electroforesis de proteínas, se realiza inmunofijación en suero y cuantificación de cadenas libres en suero llegando al 100 % y al 97 % en caso de la amiloidosis, respectivamente. 11
Adicionalmente, recientemente surgió una nueva clasificación llamada gammapatía monoclonal de significancia renal (MGRS) 11, que consiste en la presencia de daño renal asociado a gammapatía monoclonal sin evidencia de malignidad manifiesta, sin que para ello requiera necesariamente la presencia de depósitos de inmunoglobulina monoclonal en la estructura glomerular11 (Tabla 2).
Tabla 2 Causas de glomerulonefritis membranoproliferativa por inmunocomplejos.
| Estímulos antigénicos | Enfermedad asociada |
| Infecciones | Viral: hepatitis B, hepatitis C y VIH Bacteriana: endocarditis, abscesos Parasitaria: malaria, esquistosomiasis Otros: micobacterias |
| Enfermedades autoinmunitarias | Lupus eritematoso sistémico Esclerodermia Síndrome de Sjögren Crioglobulinemia |
| Paraproteinemias | Gammapatía monoclonal de significado indeterminado Leucemias Linfoma Mieloma |
| Misceláneas | Cirrosis Carcinomas Sarcoidosis Fármacos Idiopática |
Fuente: elaboración propia
Sin embargo, cuando en la biopsia se evidencia tinción para C3, con poco o ningún depósito de otras inmunoglobulinas, es preciso contemplar alteraciones derivadas en la vía alternativa del complemento, configurando así las glomerulopatías por C3. A su vez, este grupo puede dividirse en dos según la presencia o ausencia de depósitos de gránulos densos (DD o C3G, respectivamente) en la membrana basal glomerular12,13. Las glomerulopatías por C3 son mucho menos frecuentes que las otras causas de GnMP descritas previamente: la prevalencia estimada de DD es de 2-3 casos por cada millón de habitantes12,13, mientras que la de C3G es difícil de calcular al ser una entidad nueva12,13. El desarrollo de estas entidades implica mutaciones genéticas del complemento en la vía alterna, que a su vez implican disfunción en las vías de regulación del mismo, dentro de las cuales se han descrito tres principales alteraciones:
Deficiencia de factor H resultando en activación excesiva de C3.
C3 hiperfuncional sin disfunción de factor H.
Proteína relacionada con factor H (CFHR) anormal, la cual conlleva a regulación anormal del factor H (CFH) y posterior activación excesiva de C312.
De esta forma, es relevante que en presencia de C3 en la biopsia renal se evalúe la vía alterna del complemento, así como las mediciones del factor H. Además, estudios han descrito una relación entre las alteraciones del factor H y las gammapatías monoclo-nales, por lo que es fundamental excluir estas últimas en este contexto, sobre todo cuando se encuentra en mayores de edad13-15.
De igual forma, puede ser necesario realizar estudios complementarios para diferenciar las dos clases de glomerulopatías por C3, tal como sucede en el caso de mutaciones del factor I (CFI) y/o de los genes CD46 que pueden estar presentes en pacientes con glomerulopatías por C3 tipo DD15. Adicionalmente, mutaciones adquiridas se han relacionado con producción de glomerulopatías por C3, de las cuales la principal mutación es la relacionada con el factor nefritogénico15.
Finalmente, tal como lo indican Sethi et al.16, a pesar de realizar estudios en búsqueda de la etiología de las GnMP, en un pequeño grupo de pacientes no se logra determinar el origen de los depósitos de Ig, y cuando esto sucede se categoriza la GnMP de etiología primaria o idiopática. 16
En el paciente reportado no se demostró presencia de C3 significativa en la IF, razón por la cual el abordaje se hizo hacia enfermedades por inmunocomplejos; de igual forma, se descartaron entidades infecciosas debido a que no se encontró nexo epidemiológico ni sintomatología infecciosa y a que las serologías fueron negativas en cuanto a enfermedades autoinmunes y se descartaron las más relevantes; sin embargo, llamó la atención el pico monoclonal en la región gamma (Tabla 1), por lo que se procedió a solicitar estudios complementarios con inmunofijación en suero y en orina. Considerando la alta relación de gammapatía monoclonal con GnMP, fue necesario descartar los subtipos previamente descritos, como el MGUS, MGRS o incluso MM.
Conclusiones
Las entidades poco frecuentes con amplia heterogeneidad en su presentación clínica como la GnMP son un reto médico al momento de identificarlas y tratarlas de manera oportuna para evitar desenlaces fatales y complicaciones irreversibles como la enfermedad renal terminal. Por lo anterior, se hace importante definir y estructurar guías de abordaje, al igual que algoritmos diagnósticos y terapéuticos, a partir de herramientas en investigación en las que se incluyan series o notificaciones de casos para poder contrarrestar las limitaciones y los interrogantes que aún existen en la práctica clínica alrededor de estas enfermedades.















