Introducción
Los resúmenes de evidencia en salud son una fuente de información y una vía de transferencia del conocimiento para los tomadores de decisiones. Se construyen a partir de la mejor evidencia disponible, constituyéndolos como información de alta calidad, que también sirve de insumo para la construcción de protocolos o guías clínicas institucionales.
Habitualmente la síntesis de la información en salud se realiza a través del uso de metodologías estructuradas como las revisiones sistemáticas (RS) de la literatura1, que aunque se han posicionado como una metodología que permite reunir de manera completa y exhaustiva la evidencia disponible alrededor de una pregunta de investigación, minimizando los sesgos por la aplicación de métodos sistemáticos y rigurosos, presentan grandes desafíos y limitaciones ante el desarrollo acelerado de nuevas tecnologías en salud, el gran volumen de producción científica y la mayor confianza en la investigación por parte de tomadores de decisiones y pacientes2.
El Centro Colaborador Nacional de Métodos y Herramientas de la Universidad de McMaster, la Organización Mundial de la Salud, la colaboración Cochrane y Osteba coinciden en reportar la necesidad de revisar el método de síntesis de la evidencia de tal manera que se optimice el tiempo de producción y la transferencia de conocimiento para la toma de decisiones3-6.
Así, la vertiginosa disponibilidad de información y sobre todo su actualización/desactualización en dinámicas veloces como es la atención de pacientes en entornos complejos pero rápidamente cambiantes, como lo puede ser una emergencia sanitaria en un momento de pandemia, exigen respuestas que permitan incorporar la evidencia en la toma de decisiones cotidianas a diferentes niveles organizacionales en tiempos más cortos7. Esto constituye un reto para los generadores de evidencia, quienes deben adaptarse rápidamente a cambios en el marco de las decisiones informadas, de tal manera que ayuden a garantizar la salud y la calidad de vida de los individuos y al mismo tiempo la sostenibilidad de las organizaciones.
Una alternativa metodológica igualmente rigurosa y de calidad, que logra dar respuesta en menor tiempo, son las revisiones sistemáticas restringidas o también denominadas rápidas, con las cuales se logran responder preguntas específicas del día a día de los tomadores de decisiones, con menor uso de recursos para facilitar la producción, la síntesis y la información actualizada, logrando así una transferencia de conocimiento casi en tiempo real.
Con la emergencia del coronavirus SARS-CoV-2 desde diciembre del 2019, se ha generado un gran volumen de producción científica, en algún caso incierta o controvertida especialmente en el manejo farmacológico, situación que, en la coyuntura pandémica, se presenta como un reto para la toma de decisiones contra el tiempo a fin de mitigar los desenlaces en salud, por lo que es requerida una metodología sistemática rápida y rigurosa para la síntesis de evidencia.
Por lo anterior, el objetivo del presente trabajo es presentar la evidencia disponible respecto al manejo farmacológico de personas con sospecha o diagnóstico de infección respiratoria por SARS-CoV-2 (COVID-19), aplicando la metodología de revisiones sistemáticas rápidas (RS-R) a medicamentos potencialmente eficaces para su manejo, en el escenario de la pandemia, buscando ofrecer información a corto plazo para los tomadores de decisiones.
Metodología
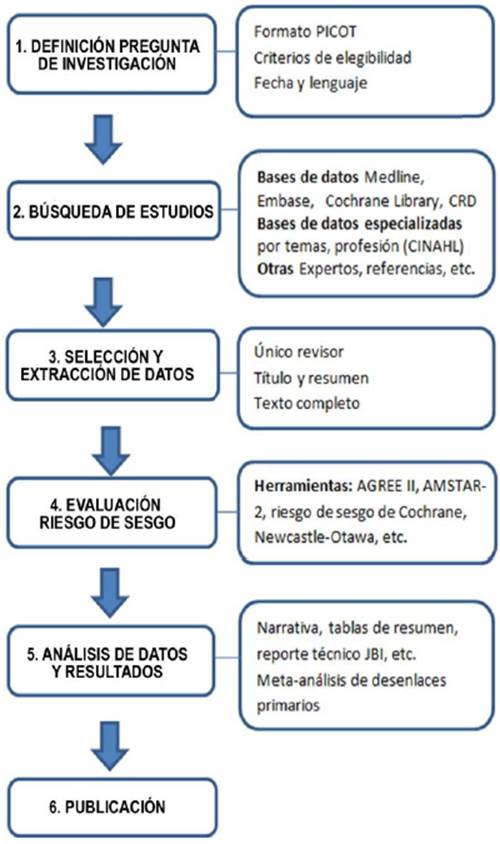
Se realizaron quince resúmenes de evidencia aplicando la metodología de RS-R orientada a contestar 16 preguntas de interés clínico relacionadas con las alternativas farmacológicas para el tratamiento de personas con sospecha o infección por SARS-CoV-2. El proceso para el desarrollo de las RS-R propuesto se resume en la figura 1. La evidencia disponible se presenta como síntesis cualitativa a través de un breve resumen de evidencia.
La metodología utilizada en detalle se encuentra disponible en el Manual de RS-R del Instituto Global de Excelencia Clínica Keralty8.
Las bases de datos y fuentes consultadas fueron Medline, Embase, Scopus, Cochrane Library, Clinical trials y Google Scholar entre marzo y julio de 2020. También se consultaron algunas páginas web de sociedades científicas, agencias de tecnología sanitaria y organismos gubernamentales de salud.
Los términos de búsqueda utilizados fueron COVID-19, coronavirus, SARS-CoV-2, severe acute respiratory syndrome coronavirus 2, acute respiratory distress syndrome, ARDS, ibuprofen, non steroidal antiinflammatory drugs, angiotensin-converting enzyme inhibitors, angiotensin receptor antagonists, dexamethasone, glucocorticoids, lopinavir-ritonavir drug combination, lopinavir, nelfinavi r, oseltamivir, remdesivir, ribavirina, teicoplanina, umifenovi r, arbidol, favipiravi r, Avigan, T-705, Avifavir, tocilizumab, Interleukin-6, ivermectin, convalescent plasma.
Los tipos de estudios incluidos fueron guías de práctica clínica (GPC), consensos de sociedades científicas, revisiones sistemáticas de la literatura (RSL), metaanálisis y estudios primarios como ensayos clínicos controlados, estudios observacionales analíticos tipo cohorte, casos y controles y en algunos casos estudios descriptivos observacionales como estudios de corte transversal y series de casos que incluyeran información que aportara a responder cada una de las preguntas de interés clínico.
Resultados
Pregunta 1: ¿Está indicado el uso de antiinflamatorios no esteroideos como el ibuprofeno en el manejo de pacientes confirmados con COVID-19?
Resumen de la evidencia
La búsqueda realizada no encontró ninguna evidencia sobre el uso de ibuprofeno en el manejo específico de pacientes con COVID-19 y, tal como lo afirma la Agencia Española del Medicamento, «No existen datos que asocien el uso de AINES con agravamiento de la infección por COVID-19»9.
Sin embargo, existe evidencia indirecta derivada de estudios clínicos:
Un estudio controlado aleatorizado, factorial, de grupo paralelo pragmático abierto, que evalúa estrategias de analgesia e inhalación de vapor para infecciones del tracto respiratorio en pacientes mayores de 3 años con infecciones agudas del tracto respiratorio tratados en atención primaria en el Reino Unido. La investigación evidencia que los pacientes con infecciones respiratorias con manifestaciones como tos, resfriados y dolor de garganta a los que su médico de cabecera les recetó ibuprofeno en lugar de paracetamol tenían más probabilidades de sufrir enfermedades o complicaciones graves10.
Un estudio de cohorte prospectiva que evalúa si la exposición a los AINES antes del ingreso hospitalario en pacientes con neumonía adquirida en la comunidad (NAC) está asociada con el desarrollo de complicaciones pleurales o un absceso pulmonar. En análisis multivariados, dos factores se asociaron independientemente con el desarrollo de complicaciones pleuroparenquimatosas: ingesta de AINES (Odds Ratio [OR] = 2,57 [1,02-6,64]; p = 0,049) y abuso de alcohol (OR = 2,68 [1,27-5,69]; p = 0,01). Lo cual sugiere que los AINES utilizados en pacientes jóvenes y sanos pueden empeorar el curso de la NAC, retardando el inicio del tratamiento y generando una mayor tasa de complicaciones pleuropulmonares11.
Una revisión sistemática rápida hecha por la OMS y publicada en abril 19 de 2020 encontró que no había asociación entre el consumo de AINES y el agravamiento de la infección respiratoria. Se incluyeron 73 estudios (28 estudios en adultos, 46 estudios en niños y un estudio en adultos y niños). Todos los estudios se ocuparon de las infecciones respiratorias virales agudas o las afecciones causadas comúnmente por virus respiratorios, pero ninguno abordó específicamente el COVID-19, el SARS o el MERS. La revisión mostró pruebas de muy baja certeza sobre la mortalidad en adultos y niños. No están claros los efectos de los AINES en el riesgo de accidente cerebrovascular isquémico y hemorrágico y de infarto de miocardio en adultos con infecciones respiratorias agudas. Las pruebas de certeza moderada a alta mostraron poca o ninguna diferencia entre el ibuprofeno y el acetaminofén (paracetamol) entre los niños con fiebre con respecto a los efectos sobre la muerte por todas las causas, la hospitalización por cualquier causa, la insuficiencia renal aguda y la hemorragia gastrointestinal aguda. No hubo pruebas relativas a los efectos del uso de AINES en la utilización de la atención sanitaria aguda, las medidas explícitas de calidad de vida o la supervivencia a largo plazo12.
NICE, de Reino Unido, en una revisión rápida deduce, igual que la OMS, que no hay evidencia de efecto deletéreo de los AINES y concluyen que «las pruebas disponibles indican que, aunque los efectos antiinflamatorios de los AINES reducen los síntomas agudos (como la fiebre), es posible que no tengan ningún efecto en los resultados a largo plazo o que los empeoren, posiblemente ocultando los síntomas del empeoramiento de la infección aguda de las vías respiratorias. Se necesitan más pruebas para confirmar esto, y para determinar si estos resultados también se aplican a infecciones como la COVID-19» 13.
En una revisión sistemática de Yousefifard et al. (2020) se encontró que los AINES podrían tener un efecto positivo en el manejo de las infecciones respiratorias «Se incluyeron seis ensayos clínicos, ninguno sobre infecciones respiratorias por COVID-19, Síndrome Respiratorio Agudo Severo y Síndrome Respiratorio del Medio Oriente. Los estudios muestran que el ibuprofeno y el naproxeno no sólo tienen efectos positivos en el control de los síntomas del resfriado, sino que tampoco causan efectos secundarios graves en las infecciones por rinovirus. Además, se comprobó que la combinación de claritromicina, naproxeno y oseltamivir da lugar a una disminución de la tasa de mortalidad y de la duración de la hospitalización en los pacientes con neumonía causada por la gripe»14.
En una revisión sistemática de Sodhi et al. (2020) se encontró que los AINES se asociaban a complicaciones en todos los casos de neumonía tanto de niños como de adultos. Se incluyeron diez estudios, entre ellos cinco estudios de casos y controles anidados, dos estudios de casos y controles basados en la población, y tres estudios de cohortes. En total, se incluyeron 59.724 adultos de cuatro de los estudios (rango 57-59.250) y 1.217 niños de cinco estudios (rango 148-540). Todos los estudios informaron acerca de una asociación positiva entre el uso de AINES y el riesgo de complicaciones asociadas a la neumonía, incluyendo estudios tanto en poblaciones pediátricas (rango de OR/RR: 1,9-6,8) como adultas (rango de OR/RR: 1,8-8,1) 15.
Recomendaciones
Para la fecha de esta revisión no existen datos que soporten la asociación entre ibuprofeno y exacerbación de la infección por COVID-9; no obstante, existe evidencia indirecta de que en pacientes con infección respiratoria o NAC, el uso de AINES puede retrasar la identificación de los síntomas y estar asociado a complicaciones.
Está descrito que el ibuprofeno puede enmascarar los síntomas en otras infecciones, retrasando su diagnóstico.
El perfil de seguridad (renal, hepática, gastrointestinal, cardiovascular) es determinante de la selección para el manejo sintomático de esta infección.
Para la fecha de esta revisión no hay pruebas sólidas de que el ibuprofeno pueda empeorar los desenlaces en el contexto de COVID-19. Sin embargo, hasta que se tenga más información, las personas deben tomar paracetamol o acetaminofén para tratar los síntomas del coronavirus, a menos que su médico señale cualquier contraindicación.
Recomendaciones para los pacientes
Se recomienda de manera preferencial el uso de paracetamol o acetaminofén para tratar los síntomas asociados con COVID-19 en las dosis indicadas por su médico.
No se recomienda el uso o la autoformulación de AINE (por ejemplo: ibuprofeno, diclofenaco, naproxeno, entre otros), en razón a los efectos secundarios tanto renales como gastrointestinales, particularmente en personas con factores de riesgo.
Pregunta 2: ¿Se deben suspender los IECA o los ARA en pacientes con alto riesgo de infección por coronavirus COVID-19?
Pregunta 3: ¿Se deben suspender los IECA o los ARA en pacientes con infección respiratoria con alta probabilidad de COVID-19?
Resumen de la evidencia
No hay evidencia que soporte el suspender o cambiar los medicamentos IECA o ARA II en pacientes con alto riesgo de infección por coronavirus COVID-1916,17. No hay datos experimentales ni clínicos que demuestren desenlaces benéficos ni adversos con el uso previo de estos agentes en pacientes con COVID-19.
Los clínicos pueden considerar el uso de medicamentos alternativos que controlen la tensión arterial en pacientes con alta probabilidad de estar infectados con coronavirus; sin embargo, no hay evidencia, a la fecha, que indique que suspender los IECA o los ARA II mejore los resultados en salud de los pacientes con infección respiratoria con alta probabilidad de ser COVID-1916-18.
Existe evidencia en usar como potencial blanco farmacológico el receptor de la enzima convertidora de angiotensina para el tratamiento de infecciones causadas por coronavirus18-21. En la medida en que se tengan resultados de investigación, las afirmaciones y recomendaciones incluidas en este resumen de evidencia requerirán actualizarse o modificarse.
Recomendaciones
Para la fecha de esta revisión no existen datos que soporten la suspensión o cambio sistemático a todos los pacientes que usan de forma rutinaria los IECA o ARA II, como método de prevención de infección respiratoria por coronavirus COVID-1916,17. Se recomienda continuar estos tratamientos en pacientes que los tengan indicados según las guías de práctica clínica establecidas, en virtud de sus beneficios en insuficiencia cardíaca, hipertensión o cardiopatía isquémica.
Para la fecha de esta revisión no existen datos que soporten la suspensión o cambio sistemático a todos los pacientes que usan de forma rutinaria los IECA o ARA II y que están en tratamiento de infección respiratoria por coronavirus COVID-19. Se recomienda en estos casos tomar la decisión de manera individualizada de acuerdo con la evaluación clínica, la severidad y su estado hemodinámico. No se sugiere iniciar o suspender tratamientos con IECA o ARA, excepto como parte de las acciones basadas en la práctica clínica estándar.
Recomendaciones para los pacientes
Si se encuentra en tratamiento con medicamentos tales como IECA (enalapril, lisinopril o perindopril, ramipril, fosinopril, quinapril, entre otros) o ARA II (por ejemplo, losartán, candesartán, ibesartán, valsartán, telmisartán, entre otros), NO existe ninguna razón basada en la evidencia científica que disponemos para que cambie su tratamiento en relación con el riesgo de infección por el coronavirus COVID-19.
Debe continuar su tratamiento para el manejo de hipertensión arterial u otra enfermedad cardiovascular tal y como ha sido formulado.
Pregunta 4: ¿Cuál es la evidencia sobre el uso de dexametasona en pacientes con diagnóstico de COVID-19?
Resumen de la evidencia
El Recovery Trial22,23 es un ensayo clínico aleatorizado controlado que compara dexametasona 6 mg administrada una vez al día, durante un máximo de diez días, con el cuidado habitual en pacientes hospitalizados con COVID-19. El resultado primario fue la mortalidad a los 28 días. Se asignaron al azar 2104 pacientes a recibir dexametasona, y se compararon con 4321 pacientes asignados simultáneamente a la atención habitual. La mortalidad fue menor en el grupo con dexametasona que en el grupo control entre pacientes con ventilación mecánica (29,3% vs. 41,4%, RR 0,64, IC 95% 0,51-0,81) y entre pacientes recibiendo oxígeno sin ventilación mecánica (23,3% vs. 26,2%, RR 0,82, IC 0,72-0,94).
No hubo beneficio en mortalidad (y el resultado es consistente con posible daño) entre pacientes que no recibían oxígeno suplementario (17,8% vs. 14,0%, RR 1.19, IC 0,91-1,55). Debe anotarse que, en el Reino Unido, donde se llevó a cabo el estudio, se recomienda oxígeno suplementario cuando la oximetría de pulso es menor de 92-94%.
Los pacientes que recibieron ventilación mecánica en el momento de la aleatorización eran en promedio 10 años más jóvenes que los que no recibieron soporte respiratorio y tenían síntomas durante 7 días más. Los pacientes con mayor duración de síntomas tuvieron mayor beneficio al recibir dexametasona sobre la mortalidad, y los pacientes con síntomas de al menos 7 días (cuando el daño pulmonar inflamatorio es más probable) obtuvieron disminución de mortalidad, pero no se observó beneficio en pacientes con síntomas de menor duración.
El estudio tiene algunas limitaciones, incluyendo el hecho de que los pacientes y el personal de atención conocían la asignación del tratamiento. El 18% de los pacientes reclutados debió excluirse del estudio por falta de disponibilidad de dexametasona o porque el médico a cargo consideraba que los corticoides estaban definitivamente indicados o contraindicados.
El estudio concluye que en los pacientes hospitalizados con COVID-19, la dexametasona redujo la mortalidad a los 28 días entre los pacientes que recibieron ventilación mecánica invasiva u oxígeno, pero no entre los pacientes que no recibieron asistencia respiratoria.
A partir de los resultados del ensayo clínico Recovery, organismos de salud como el National Institute of Health (NIH)24, la Organización Mundial de la Salud25 y L'Institut national d'excellence en santé et en services sociaux de Québec26 recomiendan el uso de dexametasona a dosis bajas y por menos de 10 días en pacientes con diagnóstico confirmado de COVID-1 9 que requieren oxígeno suplementario.
La consulta en clinical trials encontró 12 estudios clínicos en curso que incluyen la evaluación de dexametasona en pacientes con diagnostico de COVID-19, todos sin resultados preliminares a la fecha de esta revisión27.
El efecto adverso más frecuentemente comunicado por los pacientes después del uso de dexametasona es la presencia de insomnio, seguido de acné, indigestión, aumento de peso, aumento del apetito, anorexia, náuseas, vómitos, agitación y depresión28. Asimismo, se ha informado de supresión suprarrenal, arritmias, cambios espermatogénicos, glaucoma, hipocaliemia, edema pulmonar, pseudotumor cerebri, y aumento de la presión intracraneal29.
El uso de dexametasona está contraindicado si los pacientes tienen enfermedades latentes como las infecciones fúngicas (candidiasis, criptococosis, neumocistosis), parasitarias (toxoplasmosis, amebiasis, estrongiloidiasis) y bacterianas (Mycobacterium, nocardiosis), ya que pueden activarse debido a la supresión del sistema inmunológico. También se contraindica su uso si hay hipersensibilidad a la dexametasona, paludismo cerebral o administración simultánea de vacunas vivas o vivas atenuadas. Hay que tener especial cuidado al recetar dexametasona a las poblaciones con mayor riesgo de osteoporosis, en pacientes con infarto de miocardio reciente, cirrosis, diverticulitis, miastenia grave, insuficiencia renal, úlcera péptica, colitis ulcerosa o embarazo28,30.
Recomendaciones
La dexametasona en pacientes con COVID-19 diagnosticado está restringida en cuanto a su uso; se debe evitar en pacientes con enfermedad temprana y leve y restringirla a aquellos en las categorías más severas. Solo se debe usar en pacientes hospitalizados y que estén en manejo con oxigenoterapia. El mayor beneficio se encuentra en pacientes que requieren ventilación mecánica.
El uso de la dexametasona requiere una planeación cuidadosa de la atención integral del paciente incluyendo antecedentes y medicamentos que se formulan de manera conjunta, para prevenir, detectar y manejar los efectos indeseables de la dexametasona.
El uso de la dexametasona en pacientes con COVID-19 diagnosticado debe adherirse a las guías de manejo institucionales.
Se recomienda el uso de dexametasona a una dosis de 6 mg intravenosa o por vía oral por día durante un máximo de 10 días en pacientes adultos con COVID-19 que están ventilados mecánicamente.
Se recomienda el uso de dexametasona a una dosis de 6 mg intravenosa o por vía oral por día durante un máximo de 10 días en pacientes con COVID-19 que requieren oxígeno suplementario debido a trastorno de oxigenación documentado, con más de 7 días de evolución de síntomas, y que se consideran con mayor riesgo de desarrollar insuficiencia respiratoria.
Antes de prescribir dexametasona, deben evaluarse de manera individualizada los riesgos y contraindicaciones para su uso, y considerar el uso de desparasitación con ivermectina. Durante su uso debe vigilarse la posibilidad de efectos indeseados de los corticoides.
En menores de 18 años con COVID-19 se puede usar la dexametasona en pacientes ventilados. Se sugiere una evaluación individual de la pertinencia para los menores que requieren oxígeno suplementario debido a trastorno de oxigenación documentado.
No es claro el beneficio de otros corticoides como la prednisona, la metilprednisolona o la hidrocortisona en pacientes con COVID-19. Sin embargo, si la dexametasona no está disponible, el NIH recomienda el uso de estos corticoides a dosis equivalentes a los 6 mg de dexametasona (prednisona 40 mg, metilprednisolona 32 mg e hidrocortisona 160 mg). La dexametasona es de acción prolongada y se administra una vez al día; la prednisona y la metilprednisolona, ambos agentes de acción intermedia, pueden administrarse una vez al día o en dos dosis divididas diariamente; la hidrocortisona es de acción corta y se administra en dos a cuatro dosis divididas diariamente24.
Actualmente, no hay pruebas sólidas de que el uso crónico de corticosteroides orales o inhalados para enfermedades autoinmunes, inflamatorias o alérgicas genere un beneficio o daño potencial para las personas expuestas o infectadas por SARS-CoV-2. Las personas que toman corticosteroides orales a largo plazo no deben dejar de usarlos, ya que existe el riesgo de un síndrome de abstinencia agudo (una crisis de Addison). Aquellos que usan corticosteroides inhalados preventivos a largo plazo para el asma también deben continuarlos si obtienen beneficios preventivos. Si tienen dudas, deben buscar consejo médico.
Recomendaciones para la comunidad
La dexametasona es un medicamento que puede generar un beneficio en las personas con infección por SARS-CoV-2 que requieren hospitalización y suplencia de oxígeno. No se recomienda en personas con infecciones leves que no requieren oxígeno. Se debe tener precaución con la automedicación.
Pregunta 5: ¿Está indicado el uso de lopinavir/ritonavir para el tratamiento de pacientes con infección respiratoria por SARS-CoV-2 (COVID-19)?
Resumen de la evidencia
Al momento de la presente revisión, no hay evidencia científica de alta calidad que compruebe la eficacia y seguridad del uso de lopinavir/ritonavir en pacientes con infección por S ARS -CoV-2 (COVID-19).
Una revisión sistemática de la literatura incluyó dos ensayos aleatorizados que evaluaron el uso de antivirales en pacientes con COVID-19. El primer estudio comparó el uso de lopinavir/ritonavir más tratamiento estándar vs. tratamiento estándar en 199 pacientes con COVID-19 y trastorno de oxigenación. Los resultados no demostraron beneficio en el tiempo de mejoría clínica, ni en la detección de RNA viral. La mortalidad fue similar en los dos grupos, aunque numéricamente menor en quienes recibieron lopinavir/ritonavir (19,2% vs. 25,0%) pero sin significancia estadística; en un análisis post hoc, en el subgrupo de pacientes tratados en los primeros 12 días se observó mayor diferencia a favor de quienes recibieron la combinación antiviral31. El segundo estudio incluyó pacientes con COVID-19 leve/moderado y comparó los resultados de 21 pacientes con uso de lopinavir/ritonavir contra 16 pacientes en manejo con arbidol y 7 pacientes sin terapia antiviral; en este ensayo el lopinavir/ritonavir no demostró beneficio alguno en cuanto a negativización de la prueba PCR ni en la progresión a enfermedad grave. Para ambos ensayos revisados la calidad de la evidencia fue baja por el riesgo de sesgo, por imprecisiones en el estudio y por falta de cegamiento de los investigadores. Además, se analizaron 12 estudios observacionales en donde no hay evidencia clara de beneficio del uso de lopinavir/ritonavir31.
Otra revisión sistemática de la literatura que evaluó la eficacia y seguridad de diferentes terapias antivirales para COVID-19 analizó tres estudios que evaluaron el uso de lopinavir/ritonavir. Se encontró evidencia de baja calidad de un leve beneficio en cuanto a mortalidad con el uso de lopinavir/ritonavir en pacientes con cuadro grave de COVID-19 evidenciado por una diferencia de riesgo de 2,4% menos muertes que en pacientes sin uso de lopinavir/ ritonavir; además un beneficio en relación con la estancia en Unidad de Cuidados Intensivos (UCI), con una diferencia de riesgo de 5 días menos (95% IC 0-9 días), y en la estancia hospitalaria una diferencia de riesgo de un día menos (95% IC 0-2 días). Se encontró además evidencia de moderada calidad en cuanto al aumento de diarrea, náuseas y vómito con el uso de lopinavir/ritonavir32.
Recomendación
No se recomienda el uso de lopinavir/ritonavir en pacientes con infección por SARS-CoV-2 porque hasta la fecha de la presente revisión, no hay evidencia de buena calidad que soporte su uso.
Pregunta 6: ¿Es eficaz la administración de nelfinavir en el manejo de pacientes con COVID-19?
Resumen de la evidencia
La búsqueda realizada no encontró ninguna publicación sobre el uso de nelfinavir en pacientes con COVID-19. La eficacia probada de este antiviral solo está documentada en pacientes con VIH33 y en pacientes con neumonía por SARS-CoV34.
Recomendación
Para la fecha de esta revisión no existe evidencia que soporte el uso de nelfinavir en pacientes con infección respiratoria por COVID-19.
Pregunta 7: ¿Está indicado el uso de oseltamivir como terapia adyuvante para el manejo de pacientes adultos hospitalizados por infección respiratoria COVID-19?
Resumen de la evidencia
La búsqueda realizada no encontró ninguna publicación sobre el uso de oseltamivir en pacientes con COVID-19. La eficacia probada de oseltamivir solo está documentada en pacientes con infección por el virus de la influenza35,36. En este momento hay un ensayo clínico en curso de terapia antiviral (que incluye oseltamivir) en pacientes con neumonía por SARS-CoV-237.
Recomendación
Para la fecha de esta revisión no existe evidencia que soporte el uso de oseltamivir en pacientes con infección respiratoria por COVID-19.
Pregunta 8: ¿Hay evidencia de uso del remdesivir en pacientes probables o confirmados COVID-19?
Resumen de la evidencia: En un ensayo clínico multinacional, doble ciego, aleatorizado y controlado por placebo realizado por Beigel et al. (2020), se incluyeron 1063 pacientes hospitalizados por COVID-19. Resultados preliminares de 1059 pacientes (538 asignados a remdesivir [200 mg de dosis de carga en el día 1, seguido de 100 mg diarios por 9 días adicionales] y 521 a placebo) indicaron que los que recibieron remdesivir tuvieron una mediana de tiempo de recuperación de 11 días (intervalo de confianza [IC] del 95%, 9 a 12), en comparación con 15 días (IC del 95%, 13 a 19) en los que recibieron el placebo (cociente de tasas de recuperación, 1,32; IC del 95%, 1,12 a 1,55; P<0,001). Las estimaciones de Kaplan-Meier de la mortalidad a los 14 días fueron del 7,1% con el remdesivir y del 11,9% con el placebo (cociente de riesgos para la muerte, 0,70; IC del 95%, 0,47 a 1,04). Se notificaron efectos adversos graves en 114 de los 541 pacientes del grupo de remdesivir que se sometieron a la aleatorización (21,1%) y en 141 de los 522 pacientes del grupo de placebo que se sometieron a la aleatorización (27,0%)38.
En otro ensayo clínico aleatorizado, doble ciego, controlado por placebo y multicéntrico en diez hospitales de Hubei, China, conducido por Wang et al. (2020), no se encontró evidencia de mejoría con el uso del remdesivir. Los pacientes elegibles fueron adultos hospitalizados con infección por SARS-CoV-2 confirmada por laboratorio, con un intervalo desde el inicio de los síntomas hasta el ingreso de 12 días o menos, una saturación de oxígeno del 94% o menos en el aire de la habitación o una relación entre la presión parcial de oxígeno arterial y el oxígeno inspirado fraccionado de 300 mm Hg o menos, y una neumonía confirmada radiológicamente. Los pacientes fueron asignados aleatoriamente en una proporción de 2:1 al remdesivir intravenoso (200 mg en el día 1 seguido de 100 mg en los días 2-10 en infusiones diarias únicas) o el mismo volumen de infusiones de placebo durante 10 días. A los pacientes se les permitió el uso concomitante de lopinavir-ritonavir, interferones y corticosteroides. El criterio de valoración primario fue el tiempo hasta la mejoría clínica hasta el día 28, definido como el tiempo (en días) desde la aleatorización hasta el punto de un descenso de dos niveles en una escala ordinal de seis puntos del estado clínico (de 1=descargado a 6=muerte) o dado de alta vivo del hospital, lo que ocurriera primero. El análisis primario se hizo en la población con intención de tratamiento (ITT) y el análisis de seguridad se hizo en todos los pacientes que comenzaron su tratamiento asignado. Entre el 6 de febrero de 2020 y el 12 de marzo de 2020, 237 pacientes fueron reclutados y asignados al azar a un grupo de tratamiento (158 a remdesivir y 79 a placebo); un paciente del grupo de placebo que se retiró después de la aleatorización no fue incluido en la población ITT. El uso de remdesivir no se asoció con una diferencia en el tiempo de mejoría clínica (proporción de riesgo 1-23 [IC del 95%: 0,87 a 1,75]). Aunque no es significativo, los pacientes que recibieron remdesivir tuvieron un tiempo numéricamente más rápido para la mejoría clínica que los que recibieron placebo entre los pacientes con una duración de los síntomas de 10 días o menos (cociente de riesgos instantáneos 1-52 [0,95 a 2,43]). Se notificaron eventos adversos en 102 (66%) de 155 receptores de remdesivir frente a 50 (64%) de 78 receptores de placebo. Se suspendió el remdesivir antes de tiempo debido a eventos adversos en 18 (12%) pacientes versus cuatro (5%) pacientes que suspendieron el placebo antes de tiempo39.
En un estudio aleatorizado abierto realizado por Goldman et al. (2020) en el que participaron pacientes hospitalizados con infección confirmada de SARS-CoV-2, saturación de oxígeno del 94% o menos mientras respiraban aire ambiental y pruebas radiológicas de neumonía, se concluyó que sí hay mejoría en los pacientes con remdesivir; sin embargo, en el estudio no hay controles. En el estudio publicado los pacientes fueron asignados al azar en una proporción de 1:1 para recibir remdesivir intravenoso durante 5 o 10 días. Todos los pacientes recibieron 200 mg de remdesivir el día 1 y 100 mg una vez al día en los días siguientes. El punto final primario fue el estado clínico en el día 14, evaluado en una escala ordinal de 7 puntos. En total, 397 pacientes se sometieron a un tratamiento aleatorio y comenzaron a recibirlo (200 pacientes durante 5 días y 197 durante 10 días). La duración media del tratamiento fue de 5 días (rango inter-cuartil, 5 a 5) en el grupo de 5 días y de 9 días (rango intercuartil, 5 a 10) en el grupo de 10 días. Al inicio, los pacientes asignados al azar al grupo de 10 días tenían un estado clínico significativamente peor que los asignados al grupo de 5 días (P = 0,02). Para el día 14, una mejora clínica de 2 puntos o más en la escala ordinal se produjo en el 64% de los pacientes del grupo de 5 días y en el 54% del grupo de 10 días. Después de ajustar el estado clínico inicial, los pacientes del grupo de 10 días tuvieron una distribución en el estado clínico al día 14 que fue similar a la de los pacientes del grupo de 5 días (P = 0,14). Los eventos adversos más comunes fueron náuseas (9% de los pacientes), empeoramiento de la insuficiencia respiratoria (8%), nivel elevado de alanina aminotransferasa (7%) y estreñimiento (7%)40.
Las agencias de medicamentos en EUA y Europa41,42, así como algunos organismos de salud como el National Institute of Health (NIH)43 y NICE44, coinciden en indicar el uso de remdesivir en pacientes hospitalizados por COVID-19 con requerimiento de oxígeno suplementario, pero que no lo requerían en alto flujo al iniciar el remdesivir.
Recomendaciones
Para los pacientes con COVID-19 que requieren oxígeno de alto flujo, ventilación no invasiva, ventilación mecánica o ECMO, no hubo diferencias entre los grupos que recibieron remdesivir o placebo en el tiempo de recuperación o tasa de mortalidad, por lo cual no se recomienda su uso en estas circunstancias (NIH 2020).
Se recomienda el uso de remdesivr durante 5 días en pacientes con COVID-19 que reciben oxígeno suplementario pero que no requieran oxígeno de alto flujo, ventilación mecánica no invasiva o invasiva o ECMO (NIH, 2020).
Si un paciente que está en tratamiento con oxígeno suplementario mientras recibe remdesivir progresa y requiere oxígeno de alto flujo, ventilación mecánica no invasiva o invasiva, o ECMO, el tratamiento con remdesivir debe ser completado (NIH, 2020).
En pacientes que no han mostrado mejoría clínica después de 5 días de tratamiento con remdesivir, se sugiere extender la duración total del tratamiento hasta 10 días (NIH, 2020).
Recomendaciones para los pacientes
El manejo del COVID-19 está en evolución; el remdesivir no es aún una alternativa de tratamiento rutinario y solamente está autorizado durante estudios de investigación.
Pregunta 9: ¿Es eficaz la administración de ribavirina en el manejo de pacientes con COVID-19?
Resumen de la evidencia
Se ha reportado en la literatura que el virus del SARS es la cepa más cercana a la del virus del COVID-19 y la Comisión Nacional de Salud en China sugirió su uso por vía intravenosa ante la falta de un tratamiento para COVID-1945, por lo que se piensa que podría ser usado como una opción para el tratamiento de esta enfermedad.
Se encontraron 14 documentos, de los cuales dos respondían la pregunta de interés. Estos fueron estudios de acoplamiento molecular, ambos realizados por Elfiky, 202045,46. En el primer estudio se presenta un modelo para las proteínas de la ARN polimerasa dependiente del ARN (RdRp) para COVID-19, el cual permite su prueba en silico. Ambos estudios coindicen en sugerir la potencial eficacia de ribavirina para el manejo de enfermedad COVID-19 debido a que para el COVID-19 RdRp, el porcentaje de identidad de secuencia contrastado con SARS es de 90,2%, con MERS es de 56,8%, con OC43 es de 55,1%, con NL63 es de 48,8%, con 229E es de 48,5% y con cepas HKU1 de HCoV es de 48,2%.
Actualmente se están desarrollando dos ensayos clínicos aleatorizados para evaluar la seguridad y la eficacia de combinaciones de medicamentos para COVID-19; uno de ellos incluye la ribavirina dentro de las intervenciones (NCT04276688) y se encuentra en proceso de reclutamiento de participantes47.
Recomendaciones
Para la fecha de esta revisión no existe evidencia que soporte el uso de ribavirina en pacientes con neumonía por COVID-19. Los hallazgos encontrados hasta la fecha son un potencial insumo para desarrollos farmacológicos.
Pregunta 10: ¿Hay un uso potencial de la teico-planina en pacientes probables o confirmados COVID-19?
Resumen de la evidencia
Hay evidencia de que la teicoplanina puede ser útil en pacientes con enfermedades por corona-virus48-50. No hay datos experimentales ni clínicos que demuestren desenlaces benéficos ni adversos con el uso previo de estos agentes en pacientes con COVID-19. Según Zhou y sus colegas, en los coronavirus, la teicoplanina actúa en el primer paso del ciclo de vida del virus inhibiendo la ruptura de la proteína de punta del virus por la catepsina L en los endosomas tardíos, de manera que impide la liberación del ARN genómico viral y la continuación del ciclo de replicación del virus. Un estudio reciente de los mismos autores mostró que esta actividad se conservaba en el SARS-CoV-2 (la secuencia objetivo que sirve como sitio de división de la catepsina L se conserva entre la proteína punta del SARS-CoV). La concentración de teicoplanina necesaria para inhibir el 50% de los virus (IC50) in vitro fue de 1,66 µM, que es muy inferior a la concentración alcanzada en la sangre humana (8,78 µM para una dosis diaria de 400 mg). Hay evidencia de efectividad in vitro de la teicoplanina en el manejo de infecciones por SARS-CoV48,51.
Recomendaciones
Al momento de la presente revisión no existen datos que soporten el uso de teicoplanina para el tratamiento rutinario de COVID-19.
No está aprobado el uso de teicoplanina para el tratamiento de COVID-19, pero sí para el manejo de infecciones por microorganismos gram-positivos susceptibles.
La teicoplanina puede ser usada de acuerdo con criterio del médico tratante como parte del tratamiento del COVID-19.
La teicoplanina tiene un perfil de seguridad conocido.
La evidencia del uso de la teicoplanina para el tratamiento está en proceso de cambio y evolución, y se debe continuar su monitoreo como otra potencial alternativa para el manejo de los pacientes con COVID-19.
Recomendaciones para los pacientes
El manejo del COVID-19 está en evolución; la teicoplanina no es una alternativa de tratamiento rutinario para infección por SARS-CoV-2, pero sí puede ser usada por su médico de acuerdo con las indicaciones autorizadas.
Pregunta 11: ¿Hay evidencia de uso del umifenovir (arbidol) en pacientes probables o confirmados COVID-19?
Resumen de la evidencia
Hay evidencia controversial de que el umifenovir es útil en pacientes con enfermedades por distintos tipos de virus, en especial los cuadros respiratorios de origen viral52,53. Hay datos clínicos iniciales que demuestran desenlaces de resultados no concluyentes con el uso previo de umifenovir en pacientes con COVID-1952-54. En un estudio de cohorte retrospectivo se le comparó en una terapia combinada con lopinavir+ritonavir versus lopinavir+ritonavir solo, teniendo mejores resultados lopinavir+ritonavir55.
En una revisión sistemática realizada por Huang et al. (2020) se encontró que no hay evidencia que permita recomendar el uso del umifenovir para el tratamiento de COVID-19. Un total de 12 estudios con 1052 pacientes fueron incluidos. En comparación con el grupo de control, el umifenovir se asoció con una mayor tasa negativa de PCR el día 14 (RR: 1,27; IC del 95%: 1,04 a 1,55). Sin embargo, el umifenovir no se relaciona con el tiempo de conversión negativo de los ácidos nucleicos (DM: 0,09; IC del 95%: -1,48 a 1,65), la tasa negativa en el día 7 (RR: 1,09; IC del 95%: 0,91 a 1,31), la incidencia del criterio de valoración compuesto (RR: 1,20; IC del 95%: 0,61 a 2,37), la tasa de alivio de la fiebre el día 7 (RR:1,00; IC del 95%: 0,91 a 1,10), la tasa de alivio de la tos el día 7 (RR: 1,00; IC del 95%: 0,85 a 1,18), o la duración de la estancia hospitalaria (DM:1,34; IC del 95%: -2,08 a 4,76). El umifenovir fue seguro en los pacientes con COVID-19 (RR para la incidencia de eventos adversos: 1,29; IC del 95%: 0,57 a 2,92). Los resultados del análisis de sensibilidad y del análisis de subgrupos fueron similares a los resultados agrupados. No hay pruebas que apoyen el uso de umifenovir para mejorar los resultados importantes en los pacientes con COVID-1956.
Recomendaciones para los pacientes
El manejo del COVID-19 está en evolución; el umifenovir no es una alternativa de tratamiento rutinario.
Pregunta 12: ¿Es eficaz y segura la administración de favipiravir en el manejo de pacientes con COVID-19?
Resumen de la evidencia
El favipiravir, un análogo de ácido nucleico de purina y un potente inhibidor de la ARN polimerasa dependiente de ARN (RdRp) indicado en el manejo de la influenza y el ebola, se considera para uso compasivo en COVID-19. La Administración Nacional de Productos Médicos (NMDA) de China dio aprobación de emergencia para este medicamento57. El 30 de mayo de 2020 el Ministerio de Salud de Rusia aprobó una versión genérica del favipiravir llamada avifavir para el tratamiento de COVID-19. En marzo de 2020, Italia aprobó el fármaco para su uso experimental contra COVID-19. Sin embargo, la Agencia Farmacéutica Italiana ha recordado al público que las pruebas existentes en apoyo de este fármaco son escasas y preliminares58.
Al momento de esta revisión, se han publicado dos ensayos clínicos; uno de ellos, de Qingxian Cai59, publicado en marzo de 2020, ha sido retirado temporalmente. Está disponible el estudio de Chang Chen60, un ensayo clínico aleatorizado, etiqueta abierta, de superioridad y multicéntrico, que comparó favipiravir con arbidol.
No hubo diferencias entre los grupos de tratamiento para la tasa de recuperación clínica en siete días correspondiente al desenlace principal. En resultados secundarios se reportó menor tiempo de síntomas como la fiebre y la tos.
En análisis post hoc del desenlace principal por estadio de la enfermedad, se encontró que para pacientes con enfermedad moderada la tasa de recuperación clínica al día 7 fue de 55,9% en el grupo de comparación y de 71,4% en el grupo de favipiravir (P = 0,0199). Mientras que, para pacientes con enfermedad crítica, la tasa de recuperación clínica al día 7 fue nula en el comparador y de 5,6% en el grupo de favipiravir (P = 0,47).
Respecto a la seguridad, se reportaron eventos adversos no serios en ambos grupos: pruebas de función hepática (ALT, AST) anormales, elevación de ácido úrico en suero, reacciones de síntomas psiquiátricos, reacciones del tracto digestivo.
Al evaluar el riesgo de sesgo del ensayo clínico se encontró que
No se reporta el método de generación de la secuencia de asignación, ni las estrategias para el ocultamiento de la misma, lo que conlleva sesgo de selección, manifiesto en la carencia de distribución homogénea de las características de los participantes entre los grupos de comparación.
No se realiza cegamiento de la intervención a ningún nivel.
Aunque hubo pérdida de participantes (sesgo de desgaste), esta fue reportada con el motivo.
Al momento de esta revisión, se encuentran en curso 16 ensayos clínicos fase 3 y 4 sin resultados preliminares61.
Recomendaciones
El uso del favipiravir en el manejo del COVID 19 no tiene evidencia de calidad suficiente que permita recomendar su uso. Se considera en el contexto de estudios clínicos aprobados por autoridad sanitaria y adecuadamente supervisados.
Recomendaciones para comunidad
El favipiravir es un medicamento con un riesgo de toxicidad, y solo puede usarse en estudios clínicos autorizados.
Pregunta 13: ¿Cuál es la evidencia sobre el uso de tocilizumab en pacientes con COVID -19?
Resumen de la evidencia
A junio 18 de 2020, se identificaron dos revisiones sistemáticas, tres series de casos y una revisión rápida hecha por la Organización Panamericana de la Salud (PAHO, por sus siglas en inglés).
La revisión sistemática de Antwi-Amoabeng et al. (2020) incluyó 11 estudios observacionales con 29 pacientes de China, Estados Unidos, Francia e Italia. El 82,8% (24) eran hombres y la hipertensión era la comorbilidad más común (16 [48,3%]). En un promedio de 5,4 días de hospitalización, el criterio de valoración primario se produjo en 6 pacientes (20,7%). Entre los pacientes supervivientes, en alrededor del 10% empeoró la enfermedad, mientras que el 17% se recuperó. La complicación más común fue el síndrome de dificultad respiratoria aguda (8 [27,6%]). El nivel de IL-6 fue significativamente más alto después de la iniciación del tocilizumab con una mediana (IQR) de 376,6 (148-900,6) pg/ml en comparación con la línea de base de 71,1 (31,9-122,8) pg/ml (p=0,002). Los niveles medios (SD) de la proteína C reactiva (PCR) se redujeron significativamente después del tratamiento 24,6 (26,9) mg/l en comparación con la línea de base de 140,4 (77) mg/l (p< 0,0001) 62.
En un estudio de Toniati et al. (2020) se analizó una serie prospectiva de 100 pacientes consecutivos ingresados en el Hospital Universitario Civili Spedali de Brescia (Italia) entre el 9 y el 20 de marzo con neumonía COVID-19 confirmada y SDRA que requería asistencia respiratoria para determinar si la administración intravenosa de tocilizumab (TCZ), un anticuerpo monoclonal que ataca al receptor de la interleucina 6 (IL-6), se asociaba a una mejora en el resultado. El tocilizumab se administró en una dosis de 8 mg/kg mediante dos infusiones intravenosas consecutivas con 12 h de separación. Una tercera infusión era opcional en función de la respuesta clínica. La medida del resultado fue una mejora de la insuficiencia respiratoria aguda evaluada mediante la puntuación de la gravedad respiratoria de Brescia COVID (BCRSS 0 a 8, con puntuaciones más altas que indicaban una mayor gravedad) a las 24-72 h y 10 días después de la administración de tocilizumab. De 100 pacientes tratados (88 M, 12 F; edad mediana: 62 años), 43 recibieron TCZ en la Unidad de Cuidados Intensivos (UCI), mientras que 57 en la sala general, ya que no había camas disponibles en la UCI. De estos 57 pacientes, 37 (65%) mejoraron y suspendieron la ventilación no invasiva (VNI) (mediana BCRSS: 1 [IQR 0-2]), 7 (12%) permanecieron estables en la VNI, y 13 (23%) empeoraron (10 murieron, 3 fueron ingresados en la UCI). De los 43 pacientes tratados en la UCI, 32 (74%) mejoraron (a 17 de ellos se les retiró el respirador y se les dio de alta en la sala), 1 (2%) permaneció estable (BCRSS: 5) y 10 (24%) murieron (todos ellos tenían BCRSS>7 antes de TCZ). En general, a los 10 días, la condición respiratoria mejoró o se estabilizó en 77 (77%) pacientes, de los cuales 61 mostraron un aclaramiento significativo de las opacidades bilaterales difusas en la radiografía de tórax y 15 fueron dados de alta del hospital. La condición respiratoria empeoró en 23 (23%) pacientes, de los cuales 20 (20%) murieron. Todos los pacientes presentaron linfopenia y altos niveles de proteína C reactiva (PCR), fibrinógeno, ferritina e IL-6 que indicaban un síndrome hiperinflamatorio (HIS). Durante el seguimiento de 10 días, se registraron tres casos de eventos adversos graves: dos pacientes desarrollaron un shock séptico y murieron, uno tenía una perforación gastrointestinal que requería una cirugía urgente y estaba vivo al día 10. En conclusión, la serie de casos demostró que la neumonía COVID-19 con SDRA se caracterizó por un HIS. La respuesta a la TCZ fue rápida, sostenida y asociada a una mejora clínica significativa63.
Sciascia et al. (2020) 64 publicaron un estudio piloto prospectivo abierto y multicéntrico de un solo brazo sobre el uso del tocilizumab (TCZ) en cuatro hospitales de la ciudad de Turín, con 63 pacientes adultos hospitalizados (56 varones, de 62,6±12,5 años) con COVID-19 grave. No se registraron acontecimientos adversos de moderados a graves atribuibles al TCZ. Se observó una mejora significativa en los niveles de ferritina, proteína C reactiva, dímero D. La relación entre la presión parcial de oxígeno (PaO2) y la fracción de oxígeno inspirado (FiO2) mejoró (media±SD PaO2/FiO2 en el ingreso: 152±53; en el día 7: 283,73±115,9, en el día 14: 302,2±126, p<0,05). La mortalidad general fue del 11%; el nivel de dímero D en la línea de base, pero no los niveles de IL-6, fue predictor de mortalidad. La administración de TCZ dentro de los 6 días de la admisión en el hospital se asoció con una mayor probabilidad de supervivencia (HR 2,2 95%CI 1,3-6,7, p<0,05). En pacientes adultos hospitalizados con COVID-19 grave, el TCZ podría ser una opción segura. Se observó una mejora en los parámetros respiratorios y de laboratorio64.
Morena et al. (2020) 65 en la ciudad de Milán adelantaron un estudio prospectivo abierto en el que se describen las características clínicas y el resultado de 51 pacientes hospitalizados con neumonía COVID-19 confirmada y grave, tratados con tocilizumab por vía intravenosa. Todos los pacientes tenían un nivel elevado de plasma de IL-6 (>40 pg/ml) y una saturación de oxígeno menor de 93% en el aire ambiente. Los resultados clínicos, el soporte de oxígeno, los datos de laboratorio y los eventos adversos se recogieron a 30 días. Cuarenta y cinco pacientes (88%) recibieron suplementos de oxígeno de alto flujo, seis de ellos con ventilación invasiva. Desde la línea de base hasta el día 7 después del tocilizumab, se observó una dramática caída de la temperatura corporal y del valor de proteína C reactiva con un aumento significativo en el recuento de linfocitos (p<0,001). En un tiempo medio de seguimiento de 34 días desde el tocilizumab, 34 pacientes (67%) mostraron una mejora en su clase de gravedad clínica; 31 fueron dados de alta; 17 (33%) mostraron un empeoramiento de su estado clínico (14 de estos murieron [27%]). La tasa de mortalidad se asoció significativamente con la ventilación mecánica en la línea de base (83,3% frente al 20% de los pacientes con soporte de oxígeno no invasivo; p=0,0001). Los efectos secundarios más frecuentes fueron un aumento de las enzimas hepáticas (29%), trombocitopenia (14%) e infecciones bacterianas y fúngicas graves (27%). El tocilizumab ejerce un efecto rápidamente beneficioso sobre la fiebre y los marcadores inflamatorios, aunque no se puede inferir ningún impacto significativo en el resultado clínico. Los pacientes en estado crítico parecen tener un alto riesgo de infecciones graves con este fármaco65.
En una revisión y metaanálisis, sin revisión de pares, realizados por Coomes y Haghbayan (2020) 66, se mostró que las concentraciones medias de IL-6 eran 2,9 veces superiores en los pacientes con COVID-19 complicada en comparación con los pacientes con enfermedad no complicada (seis estudios; n = 1302; IC del 95%, 1,17-7,19; I2 = 100%). Un único estudio no aleatorio de un solo brazo evaluó el tocilizumab en pacientes con COVID-19 grave, demostrando la disminución de las necesidades de oxígeno, la resolución de las anomalías radiográficas y la mejoría clínica. No se reportaron eventos adversos o muertes66.
En una revisión rápida realizada por la PAHO (2020), del 16 de junio de 2020, se encontró que tras revisar 11 estudios no se podía llegar a ninguna conclusión dada la baja calidad de las investigaciones67.
Conclusiones
Se dispone de evidencia con alto riesgo de sesgo y baja calidad para considerar el tolicizumab como tratamiento en pacientes hospitalizados con COVID-19.
El tocilizumab se ha utilizado para tratar el síndrome de liberación de citoquinas debido a la terapia con células CAR-T; no obstante, en el contexto de infección por SARS-CoV-2/ COVID-19 es experimental y no existen datos concluyentes de seguridad y eficacia.
Existe heterogeneidad de criterios para el diagnóstico de síndrome de tormenta de citoquinas asociado a COVID-19, lo cual limita el análisis de desenlaces.
Recomendaciones
El uso de tolicizumab en el manejo del COVID-19 no tiene evidencia de calidad suficiente que permita recomendar su uso de manera regular, excepto en el contexto de ensayos clínicos aprobados por los comités de investigación y ética.
Recomendaciones para la comunidad
El tocilizumab es un medicamento con riesgo de toxicidad y solo puede usarse bajo estudios de investigación.
Pregunta 14: ¿Cuál es la evidencia sobre el uso de ivermectina en pacientes con COVID 19?
Resumen de la evidencia
Se encontraron dos estudios observacionales del mismo autor principal, Patel et al. 68,69, que fueron clasificados por la PAHO como de sesgo moderado a alto, y calidad de evidencia baja70. En el primer estudio observacional de ivermectina (150 mcg/kg una vez iniciada la ventilación mecánica) vs. sin ivermectina se informó un beneficio de supervivencia para el grupo de ivermectina: tasa de mortalidad 18,6% vs. 7,7%; CRI 0,18, IC del 95% (0,07-0,48), rango logarítmico (MantelCox) p<0,001; duración de la estancia hospitalaria 10,9 +/- 6,1 días vs. 15,7 +/-8,1 días, y la estancia en la UCI fue de 6,0 +/- 3,9 días vs. 8,2 +/- 6,2 días, ambas p<0,001.
El segundo estudio, aún no avalado por una revisión de pares, se trata de un estudio multicéntrico observacional de casos y controles, en el cual se evaluaron 704 pacientes tratados con ivermectina (dosis media 150 mcg/kg) a discreción de sus médicos tratantes, y se compararon con un número similar de pacientes hospitalizados no tratados con ivermectina, emparejados por medio de un índice de propensión de acuerdo con edad, sexo, raza, comorbilidades, índice de severidad qSOFA y uso de otros medicamentos. En los pacientes que necesitaron ventilación mecánica, un menor número de pacientes murieron en el grupo de ivermectina (7,3% frente al 21,3% del grupo control) y las tasas de mortalidad general fueron menores con la ivermectina (1,4% vs. 8,5%) con un HR de 0,20 (IC 95% 0,11-0,37) (Patel 2020). El estudio podría dar una señal de beneficio de la ivermectina en pacientes con COVID 19, pero los datos no son conclusivos debido a que el diseño del estudio no permite excluir el sesgo por potenciales confusores, y para dar soporte a una hipótesis de beneficio se requeriría un estudio clínico aleatorizado.
Pregunta 15: ¿Cuál es la evidencia del efecto de la ivermectina sobre el virus SARS-CoV-2?
Hay evidencia in vitro de que la actividad inhibidora del transporte nuclear de la ivermectina puede ser eficaz contra el SARS-CoV-2, afectando la replicación viral71.
En el artículo de Caly et al. 72 se infectaron células Vero/hSLAM con el aislado del SARS-CoV-2 Australia/VIC01/2020 a un MOI de 0,1 durante 2 h, seguido de la adición de 5 µM ivermectina. El sobrenadante y los gránulos de células se recogieron los días 0 a 3 y se analizaron mediante RT-PCR para la replicación del ARN del SARS-CoV-2 (figura 1 A/B). A las 24 h, hubo una reducción del 93% del ARN viral presente en el sobrenadante (indicativo de viriones liberados) de las muestras tratadas con ivermectina en comparación con el vehículo DMSO. De forma similar, se observó una reducción del 99,8% del ARN viral asociado a las células (indicativo de viriones no liberados y no empaquetados) con el tratamiento con ivermectina. En 48 h este efecto aumentó a una reducción de ~5000 veces el ARN viral en las muestras tratadas con ivermectina en comparación con las muestras de control, lo que indica que el tratamiento con ivermectina dio lugar a la pérdida efectiva de esencialmente todo el material viral en 48 h.
Según Bray et al. 71, las posibilidades de uso de la ivermectina y otros medicamentos similares son amplias puesto que el blanco directo de la ivermectina en las células de mamíferos no es un componente viral, sino una proteína del huésped importante en el transporte intracelular73. La reducción de la carga viral, incluso en una cantidad modesta, en las primeras etapas de la infección puede ser la clave para que el sistema inmunológico del cuerpo comience a montar la respuesta antiviral completa antes de que la infección tome el control71.
Las concentraciones de ivermectina en el estudio de Caly et al. 72 que logran la inhibición del SARS-CoV-2 en el plasma son 35 veces más altas que las que se pueden alcanzar con la dosis usual de ivermectina cuando se administra en ayunas74. Por lo anterior es limitada la posibilidad de que se pueda obtener con la ivermectina efectos terapéuticos medibles en el tratamiento del SARS-CoV-2.
Recomendaciones para la comunidad
La ivermectina es un medicamento con riesgo de toxicidad, no está indicada en el manejo de infección por SARS-CoV-2/COVID-19 y solo puede usarse por prescripción médica en las indicaciones aprobadas.
Pregunta 16: ¿Hay evidencia de la efectividad del plasma convaleciente sobre el virus SARS-CoV-2?
Resumen de la evidencia
Una revisión sistemática de Pimenoff et al. 75 incluyó diez estudios con 61 pacientes hospitalizados con COVID-19 tratados con plasma convaleciente, de China, Korea y EUA. El 72% (44/61) de los pacientes tenían SDRA. La mayoría de los pacientes recibieron terapia antiviral concomitante con arbidol, lopinavir/ritonavir o interferón alfa 1b y el 75% recibió corticoides. Cerca de la mitad de los pacientes (28) no tenían condiciones médicas de base, mientras que 25 (45%) tenían al menos hipertensión o diabetes. El resto tenían otros antecedentes como asma, hipotiroidismo, hiperlipidemia, inmunosupresión, y enfermedades pulmonares o cardiovasculares. Los donantes del plasma convaleciente se habían recuperado de COVID-19 y fueron invitados a donar plasma al menos 10 días después de la recuperación. Los resultados de los análisis mostraron que la mitad de los pacientes se recuperaron dentro de la primera semana (la mayoría pacientes menores de 60 años), y 39,3% entre los 8 y 29 días después de la trasfusión. Del 9,8% restante no se tuvo información. Los pacientes mayores de sesenta años con COVID-19 que recibieron tratamiento con plasma tuvieron una prevalencia de recuperación prolongada, casi dos veces mayor, de más de una semana, comparados con los pacientes con COVID-19 más jóvenes. No se observaron efectos adversos graves.
Los estudios sobre plasma convaleciente para el tratamiento de COVID-19 están limitados por la falta de representación de los pacientes en la fase temprana de la infección, así como por la confusión de múltiples terapias superpuestas y un pequeño número de pacientes75.
En la base de datos de Cochrane se publicó una revisión rápida (Valk et al., 2020) que incluye publicaciones del 01 enero hasta el 23 abril 2020, la cual indica que se identificaron ocho estudios (siete series de casos y un estudio de intervención de un solo brazo planificado prospectivamente) con un total de 32 participantes (rango de 1 a 10). La mayoría de los estudios evaluaron los riesgos de la intervención; informaron de dos eventos adversos (potencialmente de grado 3 o 4), uno de los cuales fue un evento adverso grave. No se sabe a ciencia cierta si el plasma de convalecencia es eficaz para las personas ingresadas en el hospital con COVID-19, ya que los estudios informaron los resultados de manera inconsistente, lo que dificulta la comparación de los resultados y la extracción de conclusiones. Se identificaron pruebas de muy baja certidumbre sobre la eficacia y la seguridad del tratamiento con plasma de convalecientes para las personas con COVID-19; todos los estudios tenían un alto riesgo de sesgo y la calidad de los informes era baja. No se han realizado ECA o estudios controlados no aleatorios que evalúen los beneficios y los daños del plasma de convalecientes. Hay 47 estudios en curso que evalúan el plasma de convalecientes, de los cuales 22 son ECA, y un ensayo que evalúa la inmunoglobulina hiperinmune. Esta revisión se actualizará como una revisión sistemática en vivo, basada en búsquedas mensuales en las bases de datos y los registros mencionados anteriormente. Es probable que estas actualizaciones muestren resultados diferentes a los que se informan aquí76.
En relación con los ensayos clínicos en curso, se encuentran algunos datos preliminares próximos a ser publicados.
Por otra parte, los centros de evaluación de tecnología y agencias regulatorias consultados77-81 coinciden en afirmar que, aunque los resultados de las observaciones no controladas son prometedores, la incertidumbre acerca de la eficacia y la seguridad de este tratamiento no apoya el uso generalizado de plasma convaleciente en pacientes con diagnóstico de COVID-19. Los datos disponibles hasta la fecha se limitan a informes de series de casos y estudios de baja calidad. Se esperan datos adicionales de los ensayos clínicos en curso.