Introducción
El coronavirus 2019-SARS-Cov-2 es un nuevo virus causante de infección de humanos cuyo brote se originó en un mercado de mariscos de la ciudad de Wuhan en China, pero que por su alta contagiosidad se convirtió en una pandemia. Hasta el 7 de abril de 2020, ha habido más de 1.500.000 casos diagnosticados y cerca de 95.000 muertes confirmadas en el mundo. Rápidamente s e descubrió s u genoma y se conoce su patogénesis, aunque no absolutamente1-7.
Si bien este conocimiento, y los previos adquiridos de sus primos causantes de SARS de 2003 y del MERS (Middle East Respiratory Syndrome) de 2012, como también del flavivirus del ebola, ha permitido generar varias propuestas de tratamiento, en la actualidad no hay muchas opciones disponible s con suficiente nivel de evidencia o poder epidemiológico para recomendarlos como únicos y altamente eficaces7-9. Cada vez aprendemos más acerca de los fenómenos patogénico s que están involucrados en la morbilidad y la mortalidad de este virus.
Gracias a los investigadores la disponibilidad de la secuencia del genoma del virus, su estructura morfológica, e interacción del patógeno con el huésped definitivo, así como su similitud con el CoV causante del SARS responsable de la epidemia de 2003, se han podido lograr importantes avances en la investigación para estrategias de contención de salud pública y avanzar firmemente en la terapéutica hacia la sublimación de la enfermedad9-12.
Sin duda alguna es esencial desarrollar vacunas, moléculas pequeñas y terapias biológicas para combatir específicamente al virus.
Se han escrito más de 600 artículos con ensayos clínicos, algunos con buenos resultados; sin embargo, aún la evidencia es insuficiente, tal como la concebimos ahora. Los centros clínicos y de investigación se han unido de manera conjunta para elaborar ensayos controlados con medicamentos que pueden mostrar utilidad desde la fisiopatología, la patogénesis y los estudios in vitro.
Adelante revisaremos algunas posibles alternativas terapéuticas, describiendo incialmente aspectos de la viropatogénesis, y el desarrollo de terapias, y finalmente resumiremos las opciones terapéuticas basados en hechos clínico-farmacológicos.
Viro-patogénesis e interacciones virus-huésped y tratamientos posibles dirigidos contra el patógeno
El SARS-CoV-2 comparte una identidad de secuencia de genoma del 82% con el coronavirus relacionado con el síndrome respiratorio agudo del 2003 y más del 90% de identidad de secuencia de codificación en varias enzimas esenciales. Algunos investigadores piensan que lo que hemos aprendido de varios estudios sobre el manejo del SARS-CoV y el síndrome respiratorio del Medio Oriente (MERS-CoV) puede usarse directamente para ayudarnos a tratar la COVID-19 (Coronavirus Infectous Disease 19) 6,10-12. El SARS-CoV utiliza proteínas de pico o Spike que están unidas a la estructura lipídica de su pared, para ligarse a un receptor de la superficie de la célula huésped y lograr la entrada a la misma (Figura 1); de la misma forma el SARS-Cov-210-13.
Para el desarrollo de la COVID-19, este receptor es la enzima convertidora de angiotensina 2 (ECA2)14,15.
Después de la entrada del virus en la célula huésped, libera su RNA genómico positivo por su orientación semihelicoidal en el sentido del giro de las manecillas del reloj, el cual se une directamente al ribosoma del huésped para la transducción de dos poliproteínas coterminales grandes que son procesadas por proteólisis en componentes para empacar nuevos viriones.
Dos proteasas que participan en este proceso de proteólisis son la proteinasa principal del coronavirus (3CLpro) y la proteasa tipo papaína (PLpro). Para replicar el genoma de RNA, el CoV-2 codifica una replicasa que es una RNA polimerasa dependiente de RNA (RdRp). Estas cuatro proteínas son esenciales para el patógeno, en su replicación y la producción de enfermedad9,12,16. Ver Figura 1.
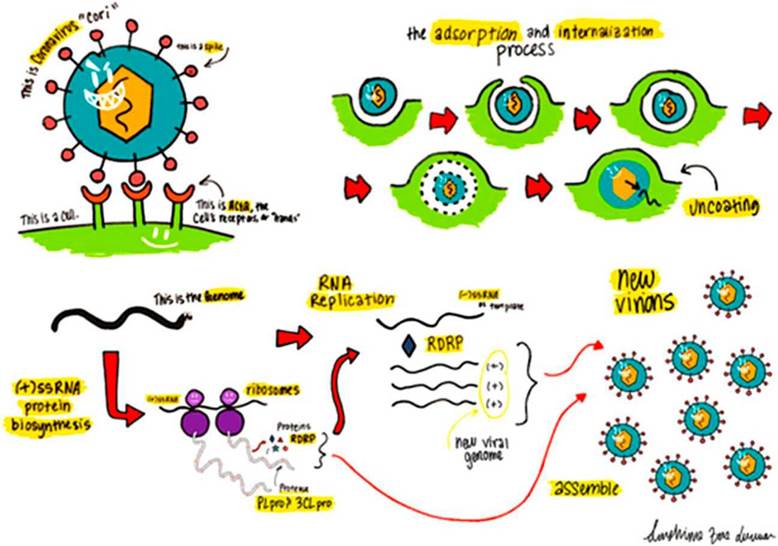
Figura 1 Ciclo de vida de un coronavirus que ingresa a una célula huésped y se replica dentro. El ARN trenzado (+) se libera tras la entrada viral; esto inicia el proceso de generar la capa viral y replicar el genoma de ARN.
Actualmente, la terapéutica está dirigida, entre otras, a la proteína de SPIKE, RdRp, 3CLpro y PLpro para posibles tratamientos de la COVID-19, en lo específicamente relacionado con el patógeno13,16.
Como hasta ahora se sabe poco sobre la virulencia de este virus, también discutiremos las interacciones entre la proteína de pico y la ECA2 que podrían desafiar la visión actual de que el SARS-CoV-2 es menos virulento que el SARS-CoV debido a interacciones más débiles entre el pico y el ECA2; sin embargo, su capacidad de contagio puede ser altamente mayor: de allí su peligrosidad10,13.
Proteínas de ensamble de la corona proteínas de espiga o spike: Tanto SARS-CoV-2 como SARS-CoV codifican una gran proteína de pico llamada de SPIKE. La identidad de secuencia de esta proteína entre los dos virus es del 76%. Existe una gran variación entre cada una de los proteínas SPIKE en el extremo N de cada una. La SPIKE tiene dos regiones, S1 y S2. Para el SARS-CoV, existe un dominio de unión al receptor (RBD) en la región S1 que interactúa con ECA2 con alta afinidad11,12,14. El SARS-CoV-2 también involucra este RBD para unir ECA2 que facilita la entrada en su célula huésped humana11,12,14,16.
Los nuevos anticuerpos y péptidos terapéuticos que interactúan de manera potente con el RBD del S ARS -CoV-2 pueden usarse para bloquear s u interacción con ECA214,15,17-22.
Varios grupos de investigación han desarrollado método s para construir bibliotecas de péptidos macrocíclicos y aplicarlos para la identificación rápida de ligando s de péptidos macrocíclicos con objetivos farmacológicos, cosas que aún están en investigación.
De lo aprendido de trabajos con el SARS-CoV, una posible alternativa es el uso directo de péptidos derivados del SARS-CoV-2-RBD y ECA2. Los péptidos derivados tanto del SARS-CoV RBD como de ECA2 se han desarrollado como nuevas terapias contra la infección por SARS-CoV al bloquear la unió n del SARS -CoV- RBD-ACE2 de manera competitiva. Por ejemplo, un péptido que se superpone a la secuencia RBD puede bloquear específicamente la unión de ECA2 al SARS-CoV-RBD e inhibir la entrada de virus a la célula blanco, que ahora son fundamentalmente las células pulmonares16. También en este sentido moléculas solubles semejantes a ECA2 pueden ligarse previamente al virus inhabilitando su entrada a la célula huésped antes de unirse al receptor de ECA214-17,23.
Proteasas 3CLpro y PLpro: 3CLpro y PLpro son dos proteasas que procesan el producto de transducción de polipéptidos del RNA genómico a los componentes de proteínas estructurales y no estructurales vitales para la replicación y el empaquetamiento de una nueva generación de virus. PLpro también sirve como una deubiquitinasa que funciona para desubiquilar las proteínas de la célula huésped, como el factor regulador de interferón 3 (IRF3), así como para inactivar la vía para el factor nuclear K-cadena ligera-potenciador de las células B activadas (NF-KB). Esto conduce a la supresión inmune en las células del huésped infectado por el virus. Debido a que ambas proteasas son vitales para la replicación del virus, y el control de la célula huésped, son objetivos viables para los agentes antivirales. Similares a la proteína RdRp, SARS-CoV-2 y SARS-CoV comparten una notable identidad de secuencia del 96% en 3CLpro. Es posible que investigaciones sobre agentes de moléculas pequeñas que inhiben potentemente el SARS-CoV 3CLpro funcionen de manera similar en la 3CLpro del SARS-CoV-216.
A diferencia de 3CLpro, estos dos virus en cuanto a PLpro comparten solamente el 83% de identidad de secuencia. Es posible que un inhibidor desarrollado para el SARS-CoV PLpro también funcione para el SARS-CoV-2 PLpro13,16.
En las últimas dos décadas, gran parte de la investigación sobre el SARS-CoV se ha centrado en el desarrollo de inhibidores como moléculas pequeñas, péptido s y peptidomiméticos de 3CLpro y PLpro, que pueden aplicarse simultáneamente en la clínica y que facilitan sinergias importantes para el tratamiento de la COVID-1916.
Tanto 3CLpro como PLpro son cisteína proteasas; por lo tanto, los inhibidores covalentes con altas potencias podrían potencialmente tener actividad.
Recientemente, Simmons y sus colaboradores desarrollaron una clase de posibles inhibidores covalentes de la cisteína proteasa que se dirigen específicamente a la entrada de CoV. No se estableció una relación directa con 3CLpro y PLpro; sin embargo, esta clase de molécula pequeña de vinilsulfona pudo inhibir la replicación del virus. El grupo de Simmons descubrió que la inhibición de las serinas proteasas (mediante el uso de un camostato) y la cisteína proteasa (mediante el uso de sus inhibidores de la proteinasa de vinilsulfona) puede combatir el SARS-CoV. Dada su alta potencia contra el SARS-CoV, es posible que sean igualmente potentes contra SARS-CoV-2.
Inhibidores de la proteasa de vinilsulfona de plomo que evitan la entrada de CoV y, en combinación con el camostato, aumentan la tasa de supervivencia de ratones infectados con SARS-CoV14.
Otros inhibidores de las proteasas como lopinavir y ritonavir han sido utilizados en pacientes y sus hallazgos reportados en estudios no controlados, con resultados prometedores, pero deben ser sometidos a mayor rigor en trabajos controlados. Sin embargo, dada la urgencia, se han administrado en pacientes con enfermedad moderada y severa, en donde al parecer han sido de utilidad24,25. En un trabajo publicado por Sheahan et al.26, se comparó la combinación de lopinavir/ritonavir e interferón beta con remdesivir, con resultados más favorables para el último27.
RNA polimerasa dependiente de RNA: Aunque el SARS CoV-2 y el SARS-CoV comparten una identidad de secuencia del 82% a su nivel de RNA genómico, sus proteínas de RNA dependiente de RNA polimerasa (RdRp) comparten una identidad de secuencia notable del 96%16. RdRp se plantea como sitio activo para la polimerización de RNA. Los residuos que muestran variaciones entre los RdRp SARS CoV-2 y el SARS-CoV son en su mayoría distales a este sitio activo11,12,14,16. Esta alta semejanza de secuencia entre las dos enzimas hace que sea muy probable que cualquier agente potente desarrollado para el SRS-CoV-RdRp exhiba la misma potencia y eficacia para el SARS-Co V-2-RdRp. Aunque no se explora extensamente, existen varios agentes que se dirigen al SARS-CoV-RdRp o su proceso de polimerización catalizada. Uno de dichos compuestos que mostró actividad antiviral fue el ácido aurintricarboxílico (ATA), que es un polímero aniónico que ha demostrado que se une a una variedad de objetivos de proteínas, incluida la gp120 de VIH-1 y la VIH-2, y que in vitro previene la replicación del SARS-CoV. A pesar de los modelos computacionales validados contra objetivos ATA conocidos que predicen RdRp como el objetivo vinculado, ninguna evidencia experimental ha demostrado esta relación, por lo cual simplemente la mencionamos como hecho anecdótico16.
Más allá de esta excepción, los inhibidores restantes de RdRp han sido análogos de nucleósidos, y estos proporcionan la vía más prometedora para interrumpir la replicación viral de RNA. Análogos de nucleósido como ribavirina (RBV) se han probado contra SARS-CoV y en pacientes infectados con SARS y MERS6,16. En el mejor de los casos, la eficacia con RBV no fue concluyente, y algunos estudios mostraron un empeoramiento de los resultados de los pacientes (según lo revisado por Stockman, et al. 2006). Se ha verificado que la actividad de exonucleasa por la enzima nsp14 es capaz de eliminar análogos de nucleósido sin corporados, y la inactivación de la actividad de exonucleasa de nsp14 aumenta la eficacia de nucleósidos como RBV28. Para desarrollar análogos de nucleósidos e inhibir eficazmente la replicación del RNA viral, el nucleósido debe evadir la detección por la exonucleasa o debe superar la actividad de la exonucleasa. Remdesivir es un excelente ejemplo de esto último. Un profármaco análogo de adenosina con un 1'-nitrilo mostró una potente eficacia contra el SARS y el MERS en modelos de células epiteliales de las vías respiratorias27. También se registró una actividad de amplio espectro contra varios coronavirus de murciélago. La susceptibilidad de CoV a remdesivir aumentaba en cepas con actividad de exonucleasa inactivada. Se estudió la resistencia de CoV al remdesivir en el modelo P-coronavirus. Los ratones infectados con este SARS-CoV resistente tuvieron títulos virales pulmonares significativamente más bajos 4 días después de la infección. En resumen, se ha demostrado que remdesivir supera la capacidad que confiere resistencia y por ende atenúa la virulencia. Varios trabajos clínicos no controlados han colocado a remdesivir como fármaco de primera línea en el manejo de la enfermedad moderada y severa por SARS-CoV-226,27,29-32.
Opciones de tratamiento: de la fisiopatología y la viropatogénesis a la clínica
Macrólidos: De los macrólidos, la azitromicina ha demostrado tener eficacia en trabajos experimentales para disminuir la replicación viral en modelos de Zika, así como en estudios no controlados en clínica, al igual que en otras infecciones respira-torias33,34. Estudios no controlados asociados a antimaláricos han mostrado utilidad tal como se menciona en el Consenso colombiano de atención, diagnóstico y manejo de la infección por SARS-CoV-2/COVID-19 en establecimientos de salud (2020).
Su mecanismo de acción también tiene que ver con la modulación de la expresión de citoquinas proinflamatorias33-36.
Los antimaláricos: PH endosomal y regulación de la respuesta inflamatoria: Uno de los elementos requeridos para los procesos enzimáticos en la integración de estos virus a la célula huésped tiene que ver con el PH endosomal de la célula misma37,38.
Como medicamentos usados en otras infecciones virales como influenza H5N1 y en enfermedades parasitarias, los antimaláricos mostraron eficacia en disminuir la replicación viral en SARS-CoV, y MERS (síndrome respiratorio del Medio Oriente), aunque en este último los resultados clínicos fueron controversiales37,39. En pacientes con COVID-19, por este mecanismo, se han reportado resultados aparentemente prometedores40-42. Los antimaláricos se han utilizado con resultados beneficiosos en estudios aún no controlados o con muy pocos pacientes, en Francia y en China. Un mecanismo de acción que mejora los resultados clínicos en pacientes que reciben antimaláricos tiene que ver con la modulación de citoquinas, que es un factor determinante en la reducción de lo que ha sido llamado la «tormenta de citoquinas» causante de la gran explosión mórbida de respuesta inflamatoria, que empeora los resultados clínicos32,38,40-44.
En una revisión sistemática de la literatura publicada en Journal of Critical Care por Andrea Cortegiani et al. (2020)45, se menciona que con cloroquina existe suficiente evidencia preclínica y muy racional para recomendar su uso; sin embargo, observan que es necesario esperar mejores resultados de estudios controlados.
Modulación de la respuesta inflamatoria: Uno de los retos más importantes en el manejo de los pacientes con respuesta inflamatoria alterada, -severa, como sucede en esta patología COVID-19-es entender y modular dicha respuesta inmunológica, para que a la vez que se controla la replicación del patógeno, el huésped no se autoagreda46.
De allí la importancia de regular la respuesta inmune en lo que se ha llamado la «tormenta de citoquinas»47. Previamente mencionamos los antimaláricos en este fenómeno patológico; ahora hablaremos de otros agentes terapéuticos:
Corticoides: Sobre corticoides se ha descrito beneficio en aquellos pacientes con síndrome de «tormenta de citoquinas». La metilprednisolona ha sido útil en estos casos; sin embargo, no son recomendados de rutina, tal como lo refiere la guía de manejo de la Organización Mundial de la Salud (OMS). Su utilidad es controversial. Sin embargo, con dosis bajas de esteroides en pacientes de UCI mostraron, en un estudio retrospectivo de análisis de cohorte, un resultado satisfactorio. No obstante, en otro trabajo realizado en Wuhan, en una muestra pequeña, los resultados no fueron fuertes para la evaluación. De acuerdo con las guías de la Comisión Nacional de Salud de China, los esteroides deben usarse con precaución46-49.
Interferones: Los interferones han mostrado inhibir la replicación viral en infeccione s por virus como el causante del MERS o el SARS -CoV y los ensayos clínicos con SARS-CoV-2 parecen ser interesantes y prometedores, además de modular la respuesta inflamatoria; al parecer pueden ser más efectivos en combinación con antivirales; pero también hace falta tener más evidencia al respecto28.
Tocilizumab: Este anticuerpo específico contra el receptor de la interleukina 6 (IL-6), usado en el manejo de enfermedades autoinmunes, y al cual se liga, ha mostrado ser un inmunomodulador importante, que ha mejorado el pronóstico de los pacientes, sobre todo en aquellos casos en los cuales se desarrolla «tormenta de citoquinas». Recientes trabajos han mostrado que la IL-6 en ascenso es un marcador ominoso, por lo cual la utilidad de este medicamento es importante en estos casos. Por otro lado, tocilizumab ha demostrado efectividad en bloquear las vías de señales para el factor de crecimiento de granulocitos y monocitos (GM.CSF), reduciendo la respuesta inflamatoria. Un estudio controlado para evaluar su eficacia y registrado con el número ChiCTR2000029765 espera para ser revisado. Mientras tanto los estudios no controlados son la base de la evidencia actual46.
Anticuerpos específicos neutralizantes : El desarrollo de anticuerpos específicos neutralizantes de proteínas antigénicas del virus se ha usado en infecciones como SARS-CoV, y ebola. En corona-virus estos anticuerpos, algunos dirigidos contra los receptores de dominio de proteínas de espiga (SPIKE) en una de sus subunidades S1, han mostrado in vitro inhibir al SARS-CoV-2; sin embargo, su desarrollo es aún complejo, más aun teniendo en cuenta que los anticuerpos monoclonales son específicos contra un epítopo, y que no es fácil conseguirlos y posteriormente desarrollar estudios controlados21,22,50,51.
Inmunidad pasiva: plasma de convalecientes: Con plasma de convelecientes, varios ensayos clínicos en ebola52, pero sobre todo en MERS y SARS-CoV, demostraron eficacia; de igual manera con influenzas como H1N1, H5N7.
Su mecanismo de acción se basa en la trasmisión de anticuerpos provenientes de plasma de convalecientes, por el mecanismo de inmunización pasiva, que permite que anticuerpos neutralizantes de proteínas específicas y antigénicas del virus bloqueen a estas, las inhiban e incluso las destruyan en el huésped que aún no tiene la competencia suficiente de su sistema inmune para ello, con la consecuente disminución de la viremia, lo cual se ve reflejado en la drástica disminución de la carga viral.
Se está investigando el manejo con plasma de convalecientes y hay cerca de 10 estudios controlados en curso para COVID-19.
Los trabajos prelimiares en China han mostrado eficacia en reducción de la mortalidad de manera significativa, mejoría en los marcadores inflamatorios, enzimas cardiacas, disminución significativa de la carga viral, mejoría radiológica y de parámetros de ventilación mecánica y reducción de los tiempos de estancia en UCI, lo que genera un beneficio importante toda vez que se requieren camas para el manejo de pacientes complejos. Sin embargo, aún hace falta evaluar algunos efectos adversos. Cabe anotar que el plasma es usado ampliamente en medicina transfusional para otras patologías con suficiente seguridad53-57.
En nuestro país ya existen instituciones capaces de ofrecer estas terapias de manera eficiente.
Inmunidad activa, las vacunas: Las vacunas son esenciales, sobre todo si se logran obtener en el tiempo inmediato. La dificultad ha estado en obtener epítopos con alta precisión y similitud genética con las estructuras virales capaces de inducir una respuesta inmune segura y eficaz.
Se ha estudiado la proteína S1 del virus como objetivo para ello.
Hasta el momento 15 candidatos para vacuna se vienen investigando; sin embargo, hasta marzo de 2020 no hay aún resultados concluyentes, y tal vez se tarden varios meses16,51,58-61.
Otras medidas terapéuticas
Anticoagulación: Recientemente, en trabajos de autopsias y con marcadores clínicos de respuesta inflamatoria, se ha demostrado una gran disfunción endotelial y fenómenos trombóticos severos, que explican la morbilidad y mortalidad asociada a esta patología, más allá de los componentes respiratorios. La anticoagulación se fundamenta como ayuda terapéutica para reducir la mortalidad, pues el 20% de los casos tienen severos trastornos de la coagulación de tipo procoagulante. Aunque no hay experiencia relevante, los pacientes que no tienen contraindicación para recibir anticoagulación pueden recibirla para la prevención de tromboembolia pulmonar.
Conclusión
La enfermedad por SARS-CoV-2 sigue siendo el más grande desafío que presenta la humanidad. Es una urgencia para la comunidad científica encontrar tratamientos eficaces, eficientes, y conocer más el desarrollo de vacunas que permitan la erradicación del virus de la especie humana; pero también que la enfermedad se pueda enfrentar en su desarrollo de tal manera que se disminuya la morbilidad y mortalidad asociada, y que se reduzca grandemente el impacto que tiene esta patología sobre la población, los sistemas de salud y la economía mundial.
En este artículo hemos revisado la mayoría de las opciones terapéuticas para COVID-19. Creemos que se debe avanzar aún más en la búsqueda fuerte y más expedita de la evidencia para cada una de ellas; pero definitivamente existen opciones terapéuticas disponibles en el «armamatario». Cada vez conocemos más acerca de esta enfermedad y hoy en día creemos que deben individualizarse los casos para aplicar las medicaciones con el suficiente rigor clínico y obtener los mejores resultados en cada paciente, eligiendo las mejores combinaciones de medicamentos.
En la opinión de los autores, el inicio oportuno de las terapias de manera individual a la luz de la evidencia existente puede determinar el pronóstico.















