Introducción
El 31 de diciembre de 2019, se identificaron 27 casos de neumonía de etiología desconocida en la ciudad de Wuhan, provincia de Hubei en China1 el agente causal se identificó a partir de muestras de hisopos de garganta realizadas por el Centro Chino para el Control y la Prevención de Enfermedades (CDC) el 7 de enero de 2020, y posteriormente se denominó Coronavirus 2 del Síndrome Respiratorio Agudo Severo (SARS-CoV-2). La enfermedad fue nombrada COVID-19 por la Organización Mundial de la Salud (OMS)2.
Los pacientes suelen presentar fiebre y síntomas respiratorios; entre lo que más se reconoce está el daño alveolar difuso y la insuficiencia respiratoria aguda. Estas son las características principales de COVID-19; sin embargo, algunos pacientes también tienen manifestaciones de pérdida de función renal3, creatinina sérica basal elevada, BUN basal elevada, proteinuria, hematuria4, gastrointestinales con diarrea, vómitos y dolor abdominal5. Los estudios han identificado el ARN del SARS-CoV-2 en muestras de hisopos anales/rectales6 y muestras de heces7-9 de pacientes con Covid-19, incluso después de la eliminación del virus en el tracto respiratorio superior6.
Por otra parte, la enfermedad renal crónica (ERC) se encuentra con frecuencia en la población general y representa un riesgo de aumento de la morbilidad viral. Se estima que aproximadamente el 15% de los adultos estadounidenses (37 millones de personas) tienen ERC10.
Además, se ha descrito que la enzima convertidora de angiotensina 2 (ACE2) es receptora del SARS-CoV-2. Dicha enzima se expresa en las células epiteliales gastrointestinales y en células renales, entre otras células11, lo que hace a estas células un blanco de los efectos patológicos del SARS-CoV-2 que en la actualidad aún no se han esclarecido por completo12.
De lo anterior, se puede deducir que los pacientes con enfermedades renales crónicas (ERC) se encuentran entre los grupos más vulnerables al SARS-CoV-2. En efecto, el riñón es uno de los órganos que se puede afectar por la infección y conducir así a una baja inmunidad, por lo que los informes de la Organización Mundial de la Salud (OMS) y el Ministerio de Salud colocan a las personas que tienen una de las ERC entre las más susceptibles a COVID-1913.
Por lo anteriormente mencionado, resulta importante un levantamiento del conocimiento del mecanismo fisiopatológico de la infección por COVID-19 que compromete los riñones y el sistema digestivo.
Metodología
Fue realizada una búsqueda en las siguientes bases de datos: PubMed y Web of Science, además fue usado el motor de búsqueda bibliográfico Google Scholar. Los términos buscados fueron: COVID-19 infection, SARS-CoV-2, COVID-19, Coronavirus nephropathy, pathophysiology of SARS-CoV-2 viral infection, y Gastrointestinal symptoms.
Genoma
El SARS-CoV-2 es un virus de ARN monocatenario de sentido positivo y es taxonómicamente miembro del género Betacoronavirus que cuenta actualmente con 1 5 miembros, del subgénero Sarbecovirus con dos miembros (coronavirus agudo severo relacionado con el síndrome respiratorio y coronavirus agudo severo del síndrome respiratorio 2). Se estima el tamaño del genoma en 29,9 kb y porcentaje de GC 38,0, contando con 11 genes y 12 proteínas (poliproteína orf1ab, poliproteína orf1a, glucoproteína de superficie, ORF3a, proteína de envoltura [E], glicoproteína de membrana [M], ORF6, proteína ORF7a, ORF7b, ORF8, [N] fosfoproteína de nucleocápside, proteína ORF10)14.
Hasta la fecha, el modelo molecular ha revelado por la tecnología de secuenciación de próxima generación que 2019-nCoV comparte aproximadamente el 79% de la secuencia identificada con SARS-CoV, indicativo de estos 2 linajes B p-coronavirus altamente homólogos y enzima convertidora de angiotensina II (ACE2), anteriormente conocido como un receptor de entrada para el SARS-CoV, se confirmó exclusivamente en la infección 2019-nCoV a pesar de las mutaciones de aminoácidos en algunos dominios clave de unión al receptor15.
Es ampliamente aceptado que la transmisibilidad y la patogénesis humana del coronavirus dependen principalmente de las interacciones, que incluyen la unión del virus, el reconocimiento del receptor, la escisión de proteasas y la fusión de membranas, de su dominio de unión al receptor de glicoproteína (proteína S) del segmento transmembrana, receptores celulares específicos (ACE2) y serina proteasa transmembrana celular huésped (TMPRSS), con afinidad de unión 2019-nCoV aproximadamente el 73% del SARS-CoV16.
El análisis bioinformático sobre los datos de transcriptómicas de células individuales disponibles del pulmón humano y el sistema gastrointestinal normales mostró intensa expresión de ACE2, y reveló que ACE2 no solo se expresa altamente en las células AT2 del pulmón, sino también en las células epiteliales estratificadas superiores y estratificadas del esófago y en los enterocitos absorbentes del íleon y el colon17.
Por otro lado, debido al aumento de la permeabilidad de las paredes gastrointestinales al patógeno, los síntomas entéricos como la diarrea se producirán por la malabsorción de enterocitos invadidos, lo que en teoría indica que el sistema digestivo podría ser vulnerable a la infección por COVID-19.
Sin embargo, el mecanismo exacto del síntoma gastrointestinal inducido por COVID-19 es en gran medida difícil de entender. Con base en estas consideraciones, las estrategias basadas en ACE2 contra COVID-19, como las proteínas de fusión ACE2 y los inhibidores TMPRSS2, deben acelerarse en la investigación y el desarrollo clínico para el diagnóstico, la profilaxis o el tratamiento5.
Diagnóstico
El diagnóstico se basa principalmente en factores epidemiológicos (antecedentes de contacto), manifestaciones clínicas y exámenes de laboratorio (hemograma, tomografía computarizada de tórax y examen virológico)18. Cabe destacar que se han desarrollado varios ensayo s de detección de ácido nucleico COVID-19; utilizan la reacción en cadena de la polimerasa fluorescente, las técnicas de polimerización de anclaje de sonda, y la secuenciación genética también se ha utilizado. La Organización Mundial de la Salud ha designado laboratorios de referencia en diferentes países19.
Igualmente, en Singapur se ha desarrollado una prueba serológica que permitió la detección20 y aún en todo el mundo se continúan desarrollando métodos de detección más sensibles y convenientes.
Ahora bien, la confirmación de casos sospechosos de infección por SARS-CoV-2 se realiza mediante la detección de secuencias virales con pruebas de amplificación de ácido nucleico como la reacción en cadena de la polimerasa con transcriptasa inversa (RT-PCR, del inglés Reverse transcription polymerase chain reaction)21.
Se ha utilizado el primer forward dirigido al gen que codifica la proteína E de la envoltura viral, la cual es común para el subgénero Sarbecovirus; el segundo utiliza dos fuegos de iniciadores dirigido al gen RdRp que codifica la ARN polimerasa dependiente de ARN que es utilizado por el virus para la retrotranscripción, y el tercero se dirige al gen de la nucleocápside (N)21. Recientemente, se ha desarrollado un nuevo ensayo de rRT-PCR dirigido a una región diferente del gen RdRp/Hel del SARS-CoV-2 que mostró una mayor sensibilidad y especificidad que el ensayo de RdRp-P222.
Se encuentra disponible en el mercado y validada una oferta variada de test para el uso diagnóstico in vitro (GeneFinderTM COVID-19 Plus RealAmp Kit [OSANG Healthcare Co., Ltd, Corea del Sur]; coronavirus PCR en tiempo real genesig® [COVID-19] [genesig, Reino Unido]; Ensayo AllplexTM 2019-nCoV [Seegene, Corea del Sur), etc.], en tanto que el contar con diagnósticos altamente sensibles y específicos es clave para la identificación de casos, el rastreo de contactos, la identificación de la fuente animal y la implementación de medidas de control para detener la pandemia23-25.
Nefropatía por coronavirus
Se ha descrito que el trastorno renal es común en pacientes infectados con coronavirus26,27, lo que ha sido confirmado por estudios como el realizado por Li y colaboradores27. Estos observaron la función renal en 59 pacientes infectados con COVID-19; 28 fueron diagnosticados como casos graves y tres murieron. Este estudio informó proteinuria en el 63% de pacientes, valores elevados de creatinina, nitrógeno ureico en suero en el 27% de los pacientes, y la tomografía de los riñones de 27 pacientes mostró inflamación y edema del parénquima renal en todos pacientes (100%)3.
Asimismo, una investigación en corte de 701 sujetos con coronavirus positivos ingresados en un hospital en Wuhan (2020) mostró la presencia de proteinuria en el 43,9%, creatinina en suero en el 14,4%, hematuria en el 26,7%, nitrógeno ureico en sangre elevado (BUN) en el 13,1%, tasa de filtración glomerular estimada (TFGe) menor de 60 ml/ min/1,73 m2 en el 13,1% y lesión renal aguda en el 5,1% de individuos infectados de pacientes4,28.
Por otra parte, en un estudio de caso clínico de pacientes infectados por COVID-19 en Barranquilla, Colombia, se halló que uno de ellos presentaba antecedentes de síndrome de Prader Willi asociado a retraso mental, obesidad, diabetes no controlada, asma e hipotiroidismo; los demás pacientes mostraron una disminución de linfocitos al tercer de estar (4,1%), BUN 32 mg/dl, urea 68,48 mg/dl y creatinina de 4,1 mg/dl; en cuanto a la evolución, se presentó oliguria e hiperazoemia, por lo que se adicionó al tratamiento metilprednisolona y aporte de líquidos endovenosos por falla hepática con solución salina hipotónica al 0,45% más bicarbonato por el estado de acidosis metabólica29.
Compromiso renal en la infección por COVID-19
En las infecciones por SARS y MERS-CoV, la lesión renal aguda (IRA) se desarrolló en 5 a 15% de los casos y tuvo una alta tasa de mortalidad (60-90%), en tanto que para la infección por SARS-CoV-2 los primeros informes sugieren una menor incidencia (39%) de la infección respiratoria aguda (IRA)30-32.
Sin embargo, algunos informes han mostrado una mayor frecuencia de anomalías renales, como lo evidencia un estudio en 59 pacientes con COVID-19, donde se encontró que el 34% de los enfermos desarrollaron albuminuria masiva el primer día de ingreso; el nitrógeno ureico en sangre se elevó en un 27% en general; la tomografía computarizada de los riñones mostró una densidad reducida, lo que sugiere inflamación y edema; el 63% desarrolló proteinuria durante su estadía en el hospital, y dos tercios de los pacientes murieron3.
Por su parte, Cheng y colaboradores realizaron un análisis de supervivencia de 701 pacientes con enfermedad renal e infección por COVID-19, donde se demostró que la insuficiencia renal tenía un mayor riesgo para la mortalidad en pacientes infectados con el COVID-19; a su vez, el modelo de regresión de Cox mostró que la lesión renal aguda, la proteinuria, la hematuria, la creatinina plasmática elevada y el nitrógeno ureico fueron factores de riesgo independientes para predecir la mortalidad de los pacientes4.
En cuanto a los mecanismos patológicos que se asocian a un mal pronóstico para pacientes con enfermedad renal y COVID-19, se encuentran el equilibrio electrolítico que puede estar afectado por la diarrea y la fiebre o la disminución de la ingesta de líquidos en personas mayores; asimismo, la deshidratación tiene varias consecuencias en el riñón, principalmente la reducción de la tasa de filtración glomerular y la lesión renal aguda.
Aunque la deshidratación es reversible, la isquemia persiste como shock, y la necrosis tubular aguda puede ocurrir, así como otros mecanismos propuestos que comprenden sepsis por COVID-19, que puede inducir el síndrome de tormenta de citoquinas; y los complejos inmunes y anormalidades inmunológicas específicas inducidas por virus son posibles33. Otro mecanismo que puede explicar la insuficiencia renal en pacientes con infección por COVID-19 es el uso inapropiado de medicamentos antiinflamatorios no esteroideos34.
Adicionalmente, los mecanismos citopáticos como la rabdomiólisis y la hipoxia también son posibles, debido a los efectos citopáticos de la infección viral al riñón en las células tubulares y el intersticio o glomérulos, como se describió previamente11,35.
Los estudios arriba mencionados han mostrado el tropismo viral del COVID-19 y, además, revelan que este puede ingresar a las células renales a través de los receptores ACE2 (angiotensina que convierte la enzima II). Estos receptores ACE2 se presentan ampliamente en las células renales; igualmente, se expresan en varias partes del tracto gastrointestinal como el duodeno y el intestino delgado; en cuanto al tracto pulmonar, han mostrado que allí su expresión es casi 100 veces mayor (Figuras 1 y 2).
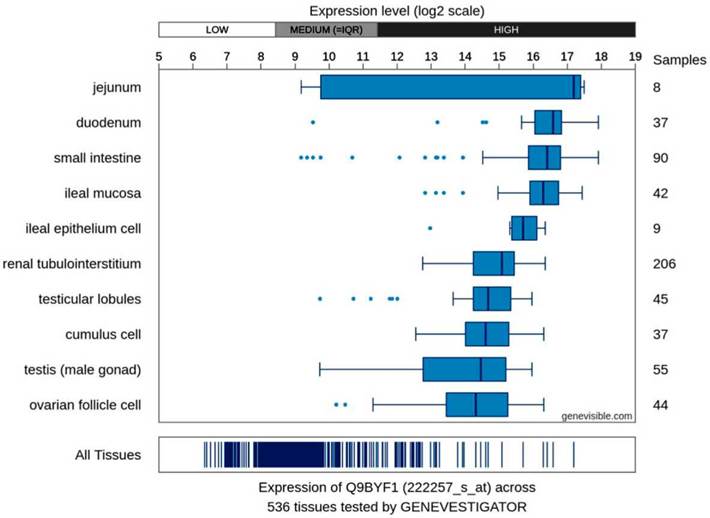
Figura 1 Niveles de expresión de ARNm del gen, enzima convertidora de angiotensina 2 (expresados en escala logarítmica: yeyuno, duodeno, intestino delgado, mucosa ileal, células epiteliales ileales, intersticio renal, lóbulos testiculares, células del cúmulo, testículos [gónada masculina], célula del folículo ovárico y todos los tejidos), la cual puede interactuar con la glicoproteína de superficie del COVID-19 (tomado de https://genevisible.com/tissues/HS/UniProt/Q9BYF1).

Figura 2 Cadena A (6acj), B (verde), C (rosa) de glicoproteína de superficie del COVID-19 (QHD43416) y cadena D: región extracelular del receptor humano ACE2 (Q9BYF1).
En resumen, la afectación renal en la COVID-19 (coronavirus-nefropatía) tiene una etiología compleja; sin embargo, la lesión renal aguda en la COVID-19 es fuertemente asociada con una mayor mortalidad y morbilidad y es un indicador que tiene que ser valorado para la supervivencia con infección por coronavirus28.
Los resultados de estudio de histopatológicos en riñón en pacientes infectados por COVID-19 mostraron lesión aguda prominente del túbulo proximal, manifestada como la pérdida del borde del cepillo, la degeneración vacuolar, la dilatación de la luz tubular con restos celulares y en ocasiones, incluso, necrosis franca y desprendimiento del epitelio con la membrana basal tubular desnuda observada36.
La mayoría de las vacuolas en el citoplasma eran de tamaño variable; sin embargo, la vacuolización fina isométrica focal no estaba frecuentemente asociada con terapia con manitol o inmunoglobulina intravenosa36.
De acuerdo con los hallazgos patológicos correspondientes en sus pulmones, se observó pielonefritis aguda con múltiples focos de bacterias y cilindros polimorfonucleares difusos en la luz de los túbulos37.
Así mismo, han observado infiltraciones en arteria arqueada con numerosas células inflamatorias, lo que probablemente representa una reacción a la infección bacteriana. La agregación difusa de eritrocitos y la obstrucción estuvieron presentes en las asas capilares peritubulares y glomerulares sin una fragmentación clara de los eritrocitos o plaquetas o trombos de fibrina36.
Por su parte, la tinción de CD31 para células endoteliales mostró una oclusión casi completa de las luces capilares peritubulares y al dirigir una tinción a ACE2, han revelado el patrón alterado de ACE236; la expresión de ACE2 fue prominente en las células tubulares proximales, particularmente en áreas con lesión tubular aguda (ATI) severa. Además, estaba presente la tinción focal fuerte de las células epiteliales parietales, así como la tinción de podocitos más débil y ocasional36.
La tinción inmunofluorescente (IF) directa describe la presencia de atrapamiento no específico de IgM y C3; en biopsia mostró IgG capilar granular segmentaria como en otras infecciones virales38; en algunos casos mostraron tinción de IgA en el área mesangial, así como en la pared capilar, asociada con los depósitos mesangiales y subendoteliales co-rrespondientes36.
Opciones terapéuticas de la COVID-19 para pacientes con enfermedad renal
Durante los primeros 2 meses de la emergencia epidemiológica, se notificó ERC en el 4,3% de los pacientes chinos infectados con COVID-19 con presentación grave. Los pacientes con enfermedad renal en etapa terminal son un grupo altamente susceptible con una tasa de infección del 16%, que excede lo observado en otras poblaciones39.
En el contexto de la epidemia o pandemia de la COVID-19, la medicación para pacientes con ERC y/o ESKD no está muy clara. Por lo tanto, los médicos deben ser conscientes de los posibles ajustes de dosis y los eventos adversos renales de estos medicamentos en este grupo de pacientes (Tabla 1).
Tabla 1 Opciones de tratamiento farmacológico para el COVID-19: daño renal potencial y ajuste toma de dosis en pacientes con ERC40 (https://www.kidney-international.org/article/S0085-2538(20)30349-5/fulltext)
| 2019-nCoV Estado | Dosis de acuerdo con la tasa de filtración glomerular | Eventos adversos renales | |
|---|---|---|---|
| Análogos de nucleósidos | |||
| Favipiravir | Fase II | * No informado | No informado |
| Remdesivir | Fase III | ||
| Galidesivir | Animal | Toxicidad mitocondrial potencial | |
| Azvudine | Fase II | ||
| Ribavirin (in combination) | Fase II | Ajuste de la dosis de acuerdo con la recomendación estándar | No informado |
| El medicamento puede administrarse independientemente del programa de hemodiálisis | Hiperuricemia por anemia hemolítica | ||
| Neuraminidase inhibitors | |||
| Oseltamivir (in combination) | Fase IV | Ajuste de la dosis de acuerdo con la recomendación estándar | No informado |
| El medicamento debe administrarse después de la sesión de diálisis para evitar la pérdida del medicamento. | |||
| Fusión peptide inhibitor | |||
| EK1 | Cultivo de células | - | - |
| inhibidores de la proteasa HIV | |||
| Lopinavir/ Ritonavir | Fase IV/III | El medicamento debe administrarse a la dosis normal e independientemente del horario de hemodiálisis. | Reversible AKI |
| Danoprevir (en combinación) | Fase IV | * No informado | No informado |
| Darunavir + Cobicistat | Fase II/III | El medicamento puede administrarse a una dosis normal e independientemente del programa de hemodiálisis. | Nefrolitiasis |
| Falso aumento del nivel de creatinina | |||
| Membrane fusion inhibidor | |||
| Umifenovir | Fase IV | * No informado | No informado |
| Aminoquinoline | |||
| Cloroquina | Fase IV | Ajuste de la dosis de acuerdo con la recomendación estándar | Lipidosis renal que simula la enfermedad de Fabry |
| Hidroxicloroquina | Fase III | El medicamento puede administrarse independientemente del programa de hemodiálisis | Lipidosis renal que simula la enfermedad de Fabry |
| Falsa proteinuria | |||
| Inmunoterapia | |||
| Camrelizumab | Fase II | * No informado | Aún no informado |
| Potencial ligando PDL-1 como toxicidad renal | |||
| anticuerpo monoclonales | |||
| Adalimumab | Fase IV | El medicamento debe administrarse a la dosis normal* | GN autoinmune (MN, IgA, lupus, vasculitis ANCA). AIN granulomatoso |
| Tocilizumab | Fase IV | No informado | |
| Bevacizumab | Fase II/III | El medicamento debe administrarse a la dosis normal. e independientemente del horario de hemodiálisis | HT, proteinuria, TMA, GN, NI |
| IFX-1 Anti C5a | Fase II | * No informado | No informado |
| Leronlimab | Fase II | ||
| REGN-3048, REGN-3051 | Fase I | ||
| VelocImmune | Fase I | ||
| Otros | |||
| Tenofovir Alafenamide | Fase IV | Ajuste de la dosis de acuerdo con la recomendación estándar | AKI. Proximal renal tubular acidosis |
| Thalidomide | Fase II | El medicamento puede administrarse independientemente del programa de hemodiálisis | Hipercalcemia |
| Inmunoglobulina | Fase II/III | El medicamento debe administrarse a la dosis normal. | AKI Nefrosis osmótica |
| En ausencia de datos de aclaramiento de hemodiálisis, El medicamento puede administrarse independientemente del programa de hemodiálisis | |||
| Pirfrnidone | Fase III | * No informado | No informado |
| Tranilast | Fase IV | No informado | |
| Fingolimod | Fase II | El medicamento debe administrarse a la dosis normal. e independientemente del horario de hemodiálisis | TMA |
| Leflunomide | Fase III | Anti GBM GN | |
| HT | |||
| Tubular renal acidosis | |||
| TMA (en combinación con metotrexato) | |||
| Artemisinina Piparequine | Fase IV | * No informado | AKI Insuficiencia hepatorrenal aguda fatal |
Abreviaturas: ERC, enfermedad renal crónica; AKI, lesión renal aguda; GN, glomerulonefritis; AIN, nefritis intersticial aguda; HT, hipertensión; TMA, microangiopatía trombótica; GBM, membrana basal glomerular.
Síntomas gastrointestinales de pacientes con COVID-19
Si bien los pacientes con COVID-19 generalmente presentan una enfermedad respiratoria, algunos informaron síntomas gastrointestinales, como diarrea, vómitos y dolor abdominal durante el curso de la enfermedad. El primer caso reportado con estos síntomas de COVID-19 en Estados Unidos fue un hombre de 35 años7, quien presentó un historial de 2 días de náuseas y vómitos al ingreso al hospital, seguidos de diarrea y molestias abdominales en el segundo día de hospitalización. El ARN del SARS-CoV-2 se detectó en las heces del paciente mediante la reacción en cadena de la polimerasa con transcriptasa inversa (RT-PCR)7.
De manera similar, un grupo de familias con COVID-19, durante el inicio de la epidemia, describió diarrea en dos adultos jóvenes (de 36 y 37 años) de los seis pacientes, con deposiciones reportadas de hasta ocho veces al día41.
Corroborando lo anterior, cohortes posteriores han informado de forma sistemática síntomas gastrointestinales entre pacientes con COVID-19, como lo hizo un gran estudio que recolectó datos de 1.099 pacientes de 552 hospitales en China; en efecto, informó náuseas o vómitos en 55 pacientes (5,0%) y diarrea en 42 (3,8%). Otras cohortes han reportado frecuencias de diarrea que van del 2,0 al 10,1%, y náuseas y/o vómitos que van del 1,0 al 10,1%18.
En una cohorte de 140 pacientes con COVID-19 en Wuhan, se describieron síntomas gastrointestinales en el 39,6% de los pacientes20, incluyendo náuseas en 24 (17,3%), diarrea en 18 (12,9%) y vómitos en 7 (5,0%). Del mismo modo, la tasa de diarrea fue del 35,6% en una cohorte de 73 pacientes42.
Estas tasas fueron más altas que en algunas otras cohortes y destacaron la variabilidad de las presentaciones clínicas. Por otro lado, el dolor abdominal o las molestias se describieron con moderación 4, y se informaron en 2,2-5,8% en las cohortes de pacientes16,20. Similar a los adultos, se observaron síntomas gastrointestinales en una cohorte de 171 pacientes pediátricos con COVID-1943.
En un estudio llevado a cabo en 745 niños de quienes se sospechaba que tenían la infección por COVID-19, se observaron diarrea y vómitos en 15 (8,8%) y 11 (6,4%) de ellos, respectivamente. Aunque se han propuesto diferentes características clínicas, en el curso de enfermedad, los síntomas respiratorios en niños, al parecer, son más leves y se presentan menos; los síntomas gastrointestinales parecen ser similares, aunque se necesitan más datos clínicos para llegar a tal conclusión44.
La diarrea puede ser un síntoma inicial e incluso puede ocurrir antes que la pirexia o los síntomas respiratorios en algunos casos45, y es un síntoma muy común durante el brote de SARS del 200346. Entre los pacientes con SARS en Hong Kong, aproximadamente el 20% tenía diarrea en la presentación de la enfermedad47. La duración media de la diarrea fue de 3,7 días, y la mayoría fue autolimitada47. Hubo tasas más altas de diarrea durante el curso de la enfermedad, hasta el 73% de pacientes con SARS47; en comparación con estas cifras, los síntomas gastrointestinales en la COVID-19 parecen ser menos comunes.
Mecanismos de afectación del tracto gastrointestinal
Aunque la neumonía es característica de la infección por COVID-19, la evidencia de estudios previos de COVID-19 indicó que el coronavirus tiene tropismo en el tracto gastrointestinal, lo cual hace probable que produjese infección entérica como el MERS-CoV; otro fenómeno observado en el MERS-CoV y que puede darse en la COVID-19 es la alta tasa de replicación en las células epiteliales intestinales48.
Este tropismo gastrointestinal puede explicar la frecuente aparición de diarrea en la infección por coronavirus. La microscopía electrónica en muestras de biopsia y autopsia seleccionó replicaciones virales activas en el intestino delgado y grueso11,49.
En cuanto a los efectos descritos en pacientes infectados por COVID-1926, se encuentran los niveles plasmáticos de citocinas más altos (interleucina [IL] -2, IL-7, IL-10, factor estimulante de colonias de granulocitos, proteína inductora de interferón, proteína quimioatrayente de monocitos 1, proteína inflamatoria de macrófagos-1a, factor de necrosis tumoral a), que estuvieron presentes en pacientes que requerían ingreso en la unidad de cuidados intensivos. Informes limitados sugieren que las complicaciones graves son poco frecuentes en los niños (https://www.cdc.gov/coronavirus/2019-ncov/faq.html?CDC_AA_refVal=https%3A%2F%_2F www.cdc.gov%2Fcoronavirus%2F2019-ncov%2F prepare%2Fchildren-faq.html).
Patogénesis hipotética
Con base en la literatura publicada y las observaciones clínicas de pacientes con COVID-19, proponemos hipótesis razonables sobre la patogénesis de la infección por SARS-CoV-2 en humanos y las describimos de la siguiente forma:
El virus puede pasar a través de las membranas mucosas, especialmente la mucosa nasal y laríngea, luego ingresa a los pulmones a través del tracto respiratorio, en tanto que los primeros síntomas más comunes de infección son fiebre y tos18.
El virus puede ingresar a la sangre periférica desde los pulmones, causando viremia, y luego atacaría a los órganos objetivo que expresan ACE2, como los pulmones, el corazón, el riñón y el tracto gastrointestinal50.
El SARS-Co V-2 detectado en las muestras fecales18 es más probable porque el virus ingresa a la sangre desde los pulmones y luego viaja desde la sangre a los intestinos.
Dawei Wang y colaboradores encontraron que la mediana del tiempo desde el inicio de los síntomas hasta el SDRA fue de aproximadamente 8 días30; especulamos que de esta manera el virus comienza un segundo ataque, causando que la condición del paciente se agrave alrededor de 7 a 14 días después del inicio.
Durante el proceso de infección, el recuento de glóbulos blancos en la sangre periférica en la etapa temprana de la enfermedad es normal o ligeramente bajo, y se observa linfopenia en pacientes.
Se ha especulado que la reducción de linfocitos B puede ocurrir de forma temprana en la enfermedad, lo cual puede afectar la producción de anticuerpos en el paciente; especialmente en pacientes de tipo grave, los linfocitos se redujeron significativamente. Lo que aún no está claro es cómo ocurre esta disminución de linfocitos en pacientes de tipo grave con COVID-19. Además, los factores inflamatorios asociados con enfermedades que contienen principalmente IL-651 aumentan significativamente, lo que también contribuye a agravar la enfermedad alrededor de 7 a 14 días después del inicio. Los no sobrevivientes tenían niveles más altos de neutrófilos, D-Dimero, nitrógeno ureico en sangre y creatinina que los sobrevivientes30.
Con base en los supuestos anteriores, la fase clínica se divide en tres: la fase de viremia, la fase aguda (fase de neumonía) y la fase de recuperación. Si la función inmune de los pacientes en la fase aguda (fase de neumonía) es efectiva, y no hay más enfermedades básicas, el virus puede suprimirse de manera efectiva y luego entrar en la fase de recuperación. Si el paciente es mayor, o está en un estado de inmunodeficiencia, combinado con otras enfermedades básicas como la hipertensión y la diabetes, el sistema inmunitario no puede controlar eficazmente el virus en la fase aguda (fase de neumonía); entonces el paciente se convertirá en un tipo grave o crítico. Como se ha mencionado en la hipótesis sobre las células T, las células B se redujeron aún más, mientras que las citocinas inflamatorias y el Dímero D continuaron aumentando en pacientes de tipo grave, por lo que se requiere mejorar la función inmune de los pacientes e inhibir la tormenta de factores inflamatorios52.
Conclusión
Los mecanismos patológicos causados en el tejido renal y en el intestino por la infección por SARS-CoV-2 son propios del tropismo viral y de los mecanismos citopáticos de la etapa lítica de la infección; adicionalmente, el resultado de la respuesta inmune más la liberación descontrolada de citoquina proinflamatoria y la liberación continua de viriones favorece el ambiente inflamatorio que puede conducir a infección en el intestino y en el riñón; la inmunoprecipitación y los procesos inflamatorios pueden disminuir la función renal al reducir la tasa de filtración glomerular. Pero aún falta por esclarecer los mecanismos inmunológicos que favorecen la aparición de estas alteraciones tanto en el sistema excretor como en el sistema digestivo; esos mecanismos, al parecer, juegan un papel importante en las patologías observadas en dichos sistemas.














