Introducción
La enfermedad renal crónica (ERC) se define como la presencia de anomalías en la estructura o la función del riñón por más de 3 meses con implicaciones para la salud1,2. Dentro de los marcadores de daño renal que deben estar presentes por más de 3 meses están:
Albuminuria (albuminuria ≥30 mg/24 horas; relación albuminuria/creatinuria ≥30 mg/g)
Anormalidades del sedimento urinario
Anormalidades de electrolitos y otras debido a trastornos tubulares
Anormalidades detectadas mediante histología
Anormalidades estructurales detectadas a través de imágenes diagnósticas
Historia de trasplante de riñón
Tasa de filtración glomerular (TFG) < 60 mL/min/1,73 m2.
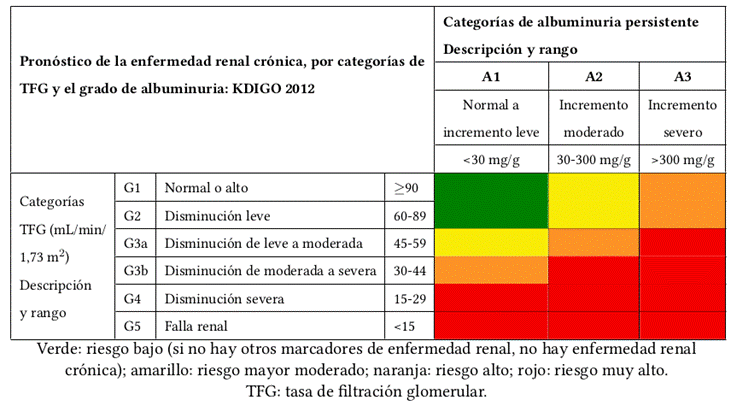
La ERC se clasifica según la severidad del daño y su riesgo de progresión o mortalidad con base en la TFG y el grado de albuminuria, tal como se presenta en la Tabla 1 1,2:
Los pacientes con ERC en estadio 4 y 5 y en cualquier rango de albuminuria son el grupo de pacientes en donde hay mejor evidencia sobre las intervenciones nutricionales para prevenir el progreso de la enfermedad1,2.
Objetivos del tratamiento de la ERC avanzada
En todos los grados de ERC la prioridad es controlar la causa desencadenante (diabetes, enfermedad glomerular, enfermedad autoinmune, etc.) y, en segunda estancia, controlar los factores de progresión como la hipertensión arterial, la dislipidemia, la enfermedad vascular, la obesidad, entre otros. De forma paralela, se recomienda evaluar el uso de inhibidores de la enzima convertidora de angiotensina o antagonistas de los receptores de la angiotensina II cuando está indicado el manejo de las complicaciones propias de la enfermedad (sobrecarga, anemia, enfermedad mineral ósea, etc.) y la intervención integral en riesgo cardiovascular1,2.
En los estadios avanzados de ERC se recomienda un manejo integral en grupos multidisciplinarios que incluya nefrólogos, psicólogos, enfermeras, nutricionistas con experiencia en cuidado renal y trabajadores sociales. Además, está indicado realizar evaluación de trasplante renal anticipado en pacientes con filtración persistentemente <20 mL/min/1,73 m2, así como preseleccionar la modalidad de terapia de remplazo renal con decisión compartida con el paciente y su familia1-3.
Es importante precisar que los objetivos de estos tratamientos son mitigar la mortalidad prematura cardiovascular y por cualquier causa en pacientes con ERC; mantener una adecuada calidad de vida para los pacientes con ERC; evitar la progresión de la enfermedad renal y el ingreso a cualquier tipo de terapia de remplazo renal, y evitar hospitalizaciones relacionadas.
Necesidades nutricionales y dieta ideal en pacientes con ERC avanzada sin diálisis
La malnutrición relacionada con enfermedades crónicas genera consecuencias muy negativas, tanto en los resultados de los pacientes como en los costos de su tratamiento, especialmente en los gastos de ingreso y reingreso hospitalario4.
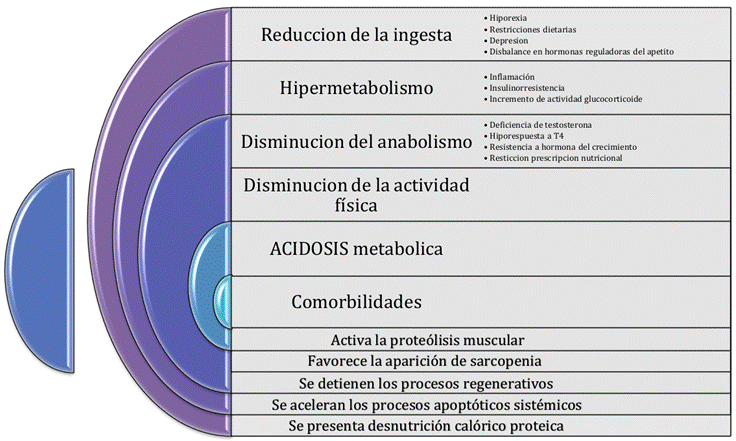
El estudio canadiense que demostró que los pacientes renales son los de mayor complejidad tuvo dentro de uno de sus aspectos de análisis justamente este tópico, pues el paciente renal, por la conjunción de su toxicidad sistémica resultante de las toxinas urémicas, se ve inmerso en lo que hoy se denomina desgaste proteico energético (DPE)4.
Los pacientes renales son una paradoja nutricional, pues el DPE es causado por la enfermedad, y este a su vez es causa de progresión de la misma; además, si se interviene con un soporte hiperprotéico para buscar reconstituir las perdidas, la TFG se deteriorará aún más por la carga proteica. Por tanto, los estudios siempre (y paradójicamente) recomiendan hacer restricción proteica.
La Figura 1 sintetiza las causas de DPE:
Objetivos del manejo nutricional en pacientes con ERC
Los principales objetivos del manejo nutricional en pacientes con ERC son mantener o mejorar el estado nutricional, reducir la progresión de la ERC y retrasar el inicio de la terapia renal, y la principal estrategia para lograrlos es individualizar al paciente, además el manejo como tal incluye múltiples componentes como calorías, proteínas, vitaminas, sodio, potasio, calcio, fosforo, líquidos y oligoelementos4,5.
Teniendo en cuenta los objetivos expuestos, el presente trabajo se centra en el manejo proteico: para adultos con ERC sin diabetes y sin diálisis, y con TFG<50 mL/min se recomienda restricción proteica desde 0,6 a 0,8 gr/kg/día; cuando la tasa es extremadamente baja (<20 mL/min) y el paciente es susceptible de un plan nutricional muy bajo en proteína (0,3-0,6 mg/kg/día), se recomienda suplementación de alfa-cetoanálogos, con lo cual se garantiza un aporte calórico adecuado (30-35 kcal/kg/día), más la suplementación de vitaminas y minerales necesaria para evitar el DPE4.
La restricción en pacientes diabéticos debe ser mucho menor debido al alto riesgo de hipoalbuminemia4,5. Pero en cualquiera que sea el caso, si se hace restricción proteica, el cuidado y el acompañamiento por los clínicos (nefrólogo, nutricionista y enfermera) deben ser intensivos y frecuentes.
Es de extremada relevancia considerar las comorbilidades que acompañan a los pacientes con ERC y el impacto en sus requerimientos nutricionales tales como insuficiencia cardiaca congestiva, lupus eritematoso sistémico, enfermedad pulmonar obstructiva crónica, diabetes mellitus tipo 2, etc., debido a que lo que se recomendaría para una comorbilidad podría complicar el estado nutricional general si coexiste con ERC5.
Con base en lo anterior, la meta principal es mantener un óptimo aporte calórico, de alrededor de 35 kcal/k/día3, que reduce el recambio proteico y que para muchos casos se convierte en un verdadero reto por la lucha contra la hiporexia frecuente de este tipo de pacientes4.
Alfa-cetoanálogos de aminoácidos
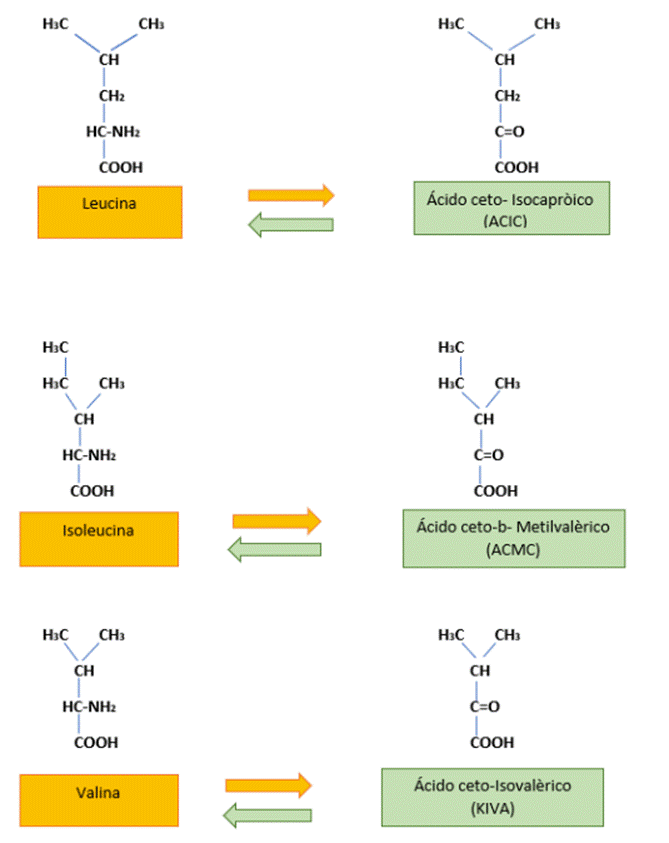
Los alfa-cetoanálogos de aminoácidos son análogos estructurales de su aminoácido esencial, excepto que el grupo amino (NH2) que está unido al segundo carbono alfa del aminoácido es reemplazado por un grupo ceto (C=O). Asimismo, son cadenas de carbono simples carentes de cualquier grupo amino que, como no contienen nitrógeno, no generan co-productos nitrogenados, pero al mismo tiempo son aceptores de grupos amino y pueden ser reconstruidos por sus aminoácidos correspondientes en el organismo, logrando así un aporte adecuado de aminoácidos esenciales6. En la Figura 2 se presenta la estructura de los alfa-cetoanálogos.
Los alfa-cetoanálogos también son sintetizados de los aminoácidos de cadena ramificada leucina, valina, isoleucina y fenilalanina, y dentro de sus propiedades farmacológicas se incluyen la inhibición directa de la ureagénesis, la estimulación de la síntesis de proteínas y la inhibición de la degradación proteica; además, comparado con otros aminoácidos a nivel experimental, los cetoanálogos no ejercen efectos estimulantes sobre la hiperfiltración a nivel renal7.
En la práctica clínica la dosis usual de suplementación de alfa-cetoanálogos de aminoácido en una dieta de 0,3 gr/kg/día es de 0,125 g/kg de peso seco ideal al día según las recomendaciones de manufactura.
Materiales y métodos
El 29 de enero de 2020 se realizó una revisión sistemática rápida de la literatura con estudios publicados hasta la fecha con el fin de encontrar evidencia que respondiera a unas preguntas de investigación con estructura PICOT definidas previamente (Anexo 1). La búsqueda de la evidencia se realizó en las bases de datos Medline y Embase con las siguientes estrategias:
Medline: ketoanalogues OR ketosteril OR ketoanalog OR keto-aminoacids OR ketodiet OR Diet OR very low protein diet OR low protein diet OR nutritional status OR Ketoanalogs OR nutritional therapy OR ketoacids OR Keto OR alpha-ketoacid) AND (kidney failure, chronic OR advance renal failure OR renal insufficiency, chronic OR chronic kidney disease OR CKD.
Embase: ketoanalogues OR 'ketosteril'/exp OR ketosteril OR ketoanalog OR 'keto aminoacids' OR ketodiet OR 'diet'/exp OR diet OR 'very low protein diet' OR (very AND low AND ('protein'/exp OR protein) AND ('diet'/exp OR diet)) OR 'low protein diet'/exp OR 'low protein diet' OR (low AND ('protein'/exp OR protein) AND ('diet'/exp OR diet)) OR 'nutritional status'/exp OR 'nutritional status' OR (nutritional AND status) OR ketoanalogs OR 'nutritional therapy'/exp OR 'nutritional therapy' OR (nutritional AND ('therapy'/exp OR therapy)) OR ketoacids OR keto OR 'alpha ketoacid'/exp OR 'alpha ketoacid') AND ('kidney failure, chronic'/exp OR 'kidney failure, chronic' OR (('kidney'/exp OR kidney) AND failure, AND chronic) OR 'advance renal failure' OR (('advance'/exp OR advance) AND renal AND ('failure'/exp OR failure)) OR 'renal insufficiency, chronic'/exp OR 'renal insufficiency, chronic' OR (renal AND insufficiency, AND chronic) OR 'chronic kidney disease'/exp OR 'chronic kidney disease' OR (chronic AND ('kidney'/exp OR kidney) AND ('disease'/exp OR disease)) OR ckd.
En ambas bases se limitó la búsqueda a metaanálisis y revisiones sistemáticas de la literatura (RSL) realizados en seres humanos adultos. No se establecieron límites por idioma ni por fecha de publicación. Finalmente, se consultaron expertos clínicos para rastrear otros artículos.
Los desenlaces se dividieron en de efectividad, seguridad y adherencia. El desenlace mayor de efectividad fue mortalidad por cualquier causa y el secundario, calidad de vida. El desenlace de efectividad renal incluyó progresión de enfermedad renal, necesidad de terapia de reemplazo renal (TRR) o trasplante de riñón y muerte por causa renal. Para el desenlace de seguridad se tuvo en cuenta la malnutrición, la hipoalbuminemia y los efectos adversos al medicamento. El desenlace de adherencia se midió en proporción de abandono a la terapia.
Los artículos se seleccionaron a partir de título y resumen; los considerados de potencial elección se revisaron a texto completo verificando que fueran estudios secundarios tipo RSL y/o metaanálisis de ensayos clínicos aleatorizados o cohortes prospectivas cuya población de estudio fueran adultos (>18 años) con diagnóstico de ERC estadio 4 o 5. La intervención de interés correspondió a la dieta baja o muy baja en proteínas y soportada con cetoanálogos comparado con terapia estándar. La calidad metodológica fue evaluada con la herramienta A measurement Tool to Assess Systematic Review (AMSTAR-2, por siglas en inglés) modificada cuyo resultado también fue un criterio de elegibilidad, de tal manera que las conclusiones se basaron en la mejor y más actualizada evidencia disponible8. La síntesis de la evidencia se presenta de manera descriptiva y con tablas de resumen.
Resultados
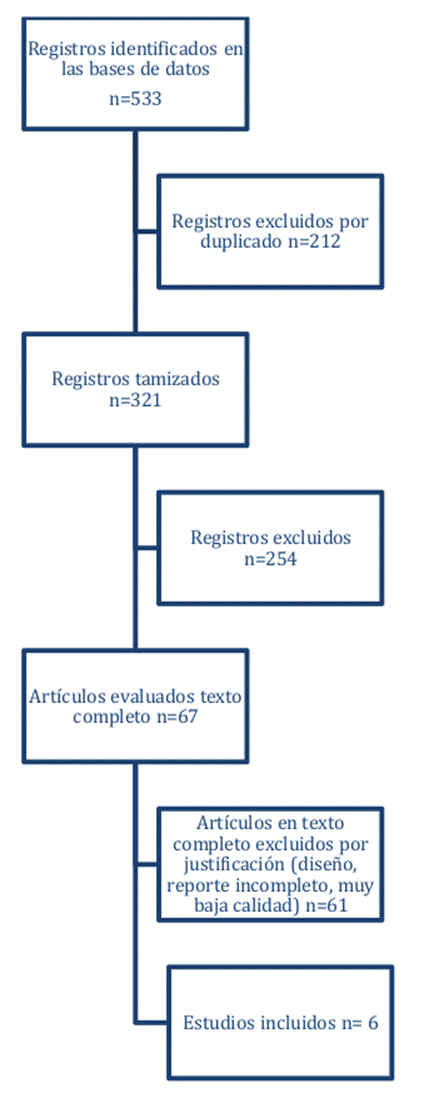
Se encontraron 533 referencias, de las cuales se eliminaron 212 por duplicado; la tamización por título y resumen se realizó para las 321 referencias restantes y de estas se excluyeron 254 por no cumplir con los criterios de elegibilidad. 77 referencias fueron revisadas a texto completo, excluyendo 61 por no cumplir con los criterios de inclusión, por lo que finalmente se tomaron 6 RSL y/o metaanálisis (Figura 3).
Características de los estudios incluidos
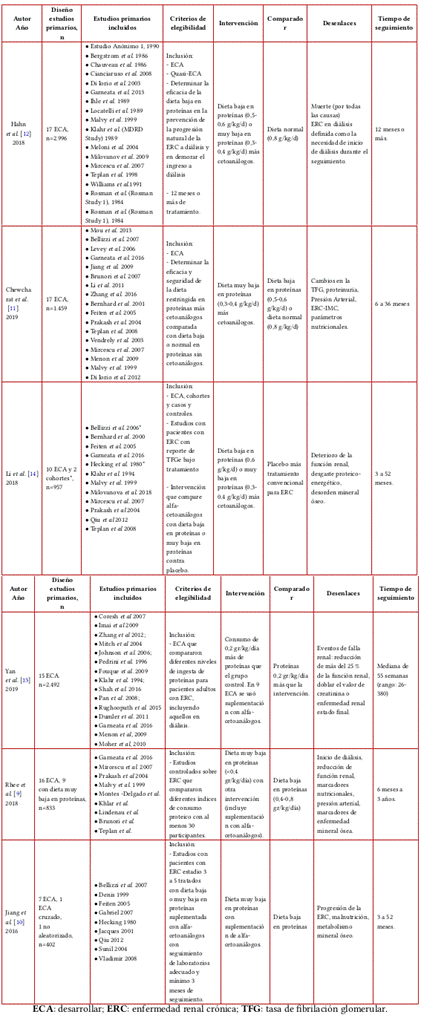
En la Tabla 2 se presentan los artículos incluidos en la presente investigación, estas seis RSL, que se publicaron entre 2016 y 2019 y obtuvieron una calificación de calidad media y alta según la herramienta AMSTAR-2 modificada, se basaron en ensayos clínicos aleatorizados o cohortes prospectivas, incluyendo entre 10 y 17 ensayos clínicos controlados; una revisión sistemática también incluyó estudios de cohortes publicados entre 1990 y 2018.
La verificación de la calidad de los estudios aleatorizados evaluados se realizó con la herramienta de evaluación de riesgo de sesgo de Cochrane9,10y la escala Jadad modificada11-13, y la calidad de las dos RSL que incluyeron estudios no aleatorizados se calificó con la escala de Newcastle-Otawa13,14. Todos los metaanálisis fueron calificados con moderada calidad según AMSTAR 2, y el principal motivo de incumplimiento fue la ausencia de reporte de protocolo preestablecido. También es importante mencionar que los estudios de Li et al.14 y Jiang et al.10 no mencionan la razón de incluir estudios no aleatorizados y comparar dichos resultados directamente con ensayos clínicos aleatorizados. Solo una revisión sistemática fue calificada como de muy baja calidad, por lo que se excluyó para la extracción de datos.
Calidad de vida
No se documentaron estudios sobre calidad de vida.
Desenlaces secundarios de efectividad
Ingreso a diálisis, trasplante renal o muerte por causa renal
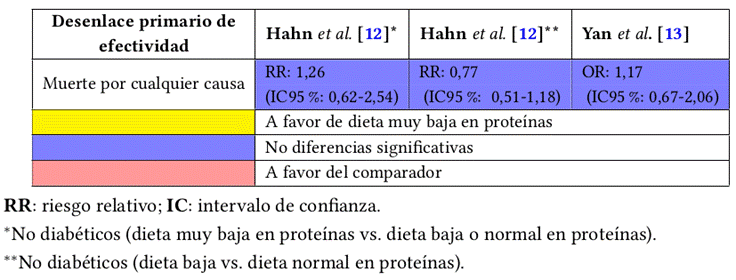
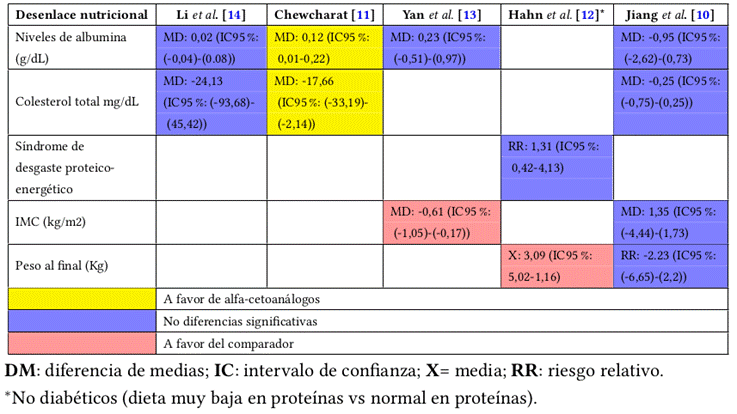
Tres de los metaanálisis incluidos analizan el desenlace de ingreso a diálisis o trasplante en pacientes con ERC estado 4 y 5 no diabéticos: tal como lo muestra el estudio de Hahn et al.12, la dieta muy baja en proteínas con suplencia de cetoanálogos comparada con la dieta normal reduce el riesgo de progresión de enfermedad renal en un 36 %, lo cual no es válido para dieta baja en proteínas comparada con dieta normal. Igualmente, el metaanálisis de Yan et al.13 no muestra beneficio en ingreso a diálisis o trasplante. En este último estudio se incluyó un desenlace definido como evento de falla renal que corresponde a una reducción del 25 % de la TFGc, duplicación de los niveles de creatinina o ingreso a diálisis o trasplante renal, el cual tiene un resultado positivo a favor de la dieta muy baja en proteínas con suplementación de aminoácidos esenciales. Asimismo, el estudio de Rhee et al.9 muestra un desenlace a favor de la dieta muy baja en proteínas con suplencia de alfa-cetoanálogos.
Función renal
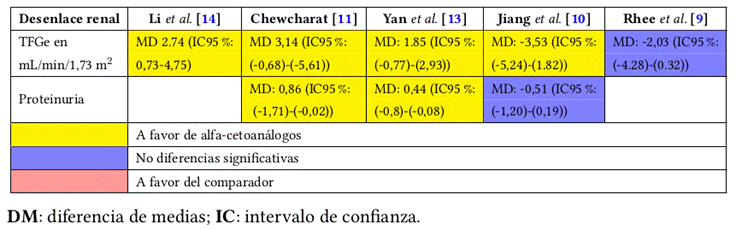
La mayoría de los estudios le dan alto valor al desenlace renal, además los resultados son consistentes en demostrar que hay una menor reducción promedio de la función renal en pacientes con dieta muy baja en proteínas y suplementación de cetoanálogos en comparación con dieta normal. Igualmente, dos metaanálisis muestran una reducción mayor de proteinuria en el grupo de intervención.
Metabolismo mineral óseo
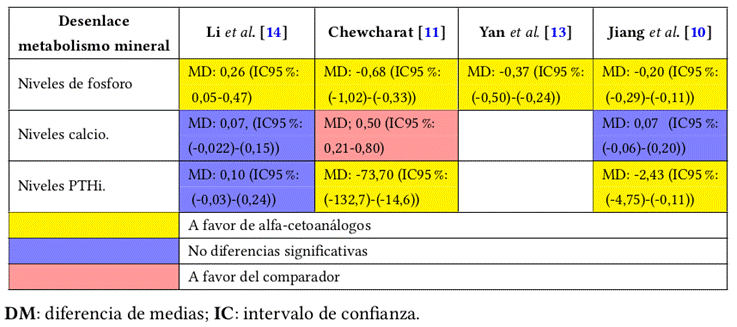
En el grupo de intervención se aumentan los niveles de calcio, sin embargo no es explícito si se elevan a tal punto de riesgo de seguridad o a la normalidad esperada. De igual forma, hay una consistente reducción de los niveles de fósforo y dos revisiones sistemáticas muestran una reducción significativa en los niveles de PTHi.
Desenlaces de seguridad
Estado nutricional, malnutrición y marcadores nutricionales
Tres de cuatro estudios no muestran cambios significativos en el valor de albumina en suero y uno no muestra diferencias en el diagnóstico de síndrome de DPE. Sin embargo, está descrita una reducción de peso o el subrogado de índice de masa corporal (IMC) en el grupo de intervención, lo que se asume como un desenlace negativo para la intervención.
Efectos adversos al medicamento
Puntualmente, no se evidenció un apartado que analizase este desenlace dentro de las RSL incluidas en el estudio, por lo cual los autores consideran que es un punto relevante de investigación y que por ahora la vigilancia de riesgo de complicaciones queda explícita en los puntos sobre desenlaces en estado nutricional y niveles de calcio.
Adherencia
Abandono de la terapia
En ninguna de las RSL fue posible establecer el desenlace de abandono de la terapia de manera independiente debido a la ausencia de reportes en los ensayos clínicos; sin embargo, se procedió a revisar los ensayos clínicos incluidos en búsqueda de la tasa de “drop out” y se evidenció una tasa de abandono del 3 %15 que la subestima, pues se denotan dificultades en asumir la intervención de dieta muy baja en proteínas ya que solo el 42 % de los pacientes solicitados aceptó seguir la dieta y solo el 14 % logró cumplirarla15,16. Por tanto, se requiere de un estudio de la vida real para reconocer la adherencia a la terapia.
¿Cuál es la dieta recomendada para los pacientes con ERC que usan alfa-cetoanálogos?
Para dar respuesta a esta pregunta de investigación se tomaron los datos de la dieta prescrita en los estudios incluidos y la recomendación de los expertos clínicos, a partir de lo cual se realizó un análisis mediante el cual se concluyó que los desenlaces fuertes renales son para los casos en que se usa dieta muy baja en proteínas: 0,3-0,4 gr/kg/día. La energía de la dieta aportada en la mayoría de los estudios fue de 30 kcal/kg/día de peso.
A continuación, se expone un ejemplo práctico de la dieta para un hombre de 70 kg peso, 1,70 m de estatura e IMC de 24kg/m2, quien tenía restricción proteica de 0,45 gr/kg/día y 30 kcal/kg/d:
Calorías totales: 2.001 kcal/día; proteínas: 35 gr/día (7 % del valor calórico total (VCT)) con 43 % de alto valor biológico; grasas: 78 gr/día (35 % del VCT) con 6 % de ácidos grasos saturados; Carbohidratos: 287 gr/día (57 %) con 9 % de carbohidratos simples; sodio: 550 mg/día; potasio: 2 267 mg/día, y fósforo: 613 mg/día
Tabla 3. Ejemplo práctico de una dieta para un paciente con restricción proteica.
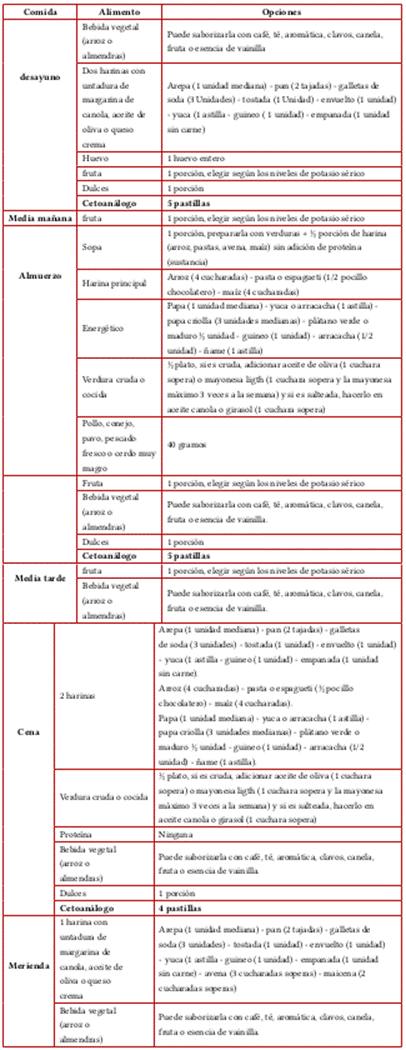
Fuente: elaboración propia.
¿Qué grupo de pacientes con ERC avanzada se pueden ver más beneficiados con el uso de alfa-cetoanálogos acompañados de una dieta de proteínas restringida?
Para dar respuesta a esta pregunta se tomaron los criterios de inclusión de los estudios primarios presentados en las RSL analizadas: clásicamente estos criterios suelen ser demasiado rígidos y un poco utópicos, por lo que en la vida real se requieren estudios de cohortes para dar una respuesta válida a esta pregunta15,17-20.
Los criterios de selección de pacientes con mejor beneficio de la terapia son los siguientes:
ERC con TFGc <30 mL/min/1.73 m2
Función renal estable por al menos 12 semanas
Reducción de TFGc <4 ml/min por año
Relación proteína/creatinina en orina aislada <1
Adecuado estado nutricional definido con evaluación global subjetiva A/B y albumina en suero ≥3.5 g/dL
Buen potencial de adherencia a la dieta y a un seguimiento médico adecuado
Buen potencial de adherencia a la suplementación con cetoanálogos.
¿Con qué frecuencia y cómo se monitorean los pacientes con tratamiento de alfa-cetoanálogos y dieta muy baja en proteínas?
La recomendación es evaluar semanalmente la adherencia a la dieta prescrita y a los suplementos por un mes y luego mensualmente. Una manera objetiva de confirmar el consumo proteico diario es evaluar la excreción de urea en orina y aplicar la fórmula de Maroni, igualmente se sugiere realizar un registro diario de comidas por tres días para evaluar que el aporte energético sea adecuado21. Los parámetros de seguimiento de la ERC recomiendan hacer control mensual de función renal, calcio, fósforo, estado acido-base, hemograma, marcadores bioquímicos nutricionales, sodio y potasio. Las medidas antropométricas y la valoración global subjetiva se deben monitorear de manera mensual inicialmente y máximo cada tres meses en estado estable15.
¿Cuándo está contraindicado usar alfa-cetoanálogos como parte del tratamiento de pacientes con ERC avanzada?
Finalmente, para dar respuesta a esta pregunta se tomaron datos de los estudios primarios donde se anotaron las contraindicaciones o exclusiones de pacientes y su explicación, adicionalmente el panel de expertos anotó sus recomendaciones finales15,17-20. Los criterios de exclusión para pacientes en los ensayos clínicos y para acercamiento a la exclusión en la vida real son los siguientes:
Mayor de 80 años (relativo), dependiente de la evaluación geriatría integral
Comorbilidades relevantes (diabetes mellitus, falla cardiaca, enfermedad hepática activa, neoplasias, malabsorción intestinal), especialmente si están inestables
Hipertensión arterial no controlada (relativo y modificable)
Uremia
Anorexia
Proteinuria >3 g (relativo); en un ensayo clínico se plantea proteinuria >5 g en 24 horas17
Uropatía obstructiva inestable o no tratada
Embarazo17.
Discusión
La dieta hipercalórica muy baja en proteínas en pacientes con ERC avanzada ha sido una aproximación terapéutica conocida desde hace más de tres décadas; esta es producto de estudios experimentales en los que la hiperfiltración, con su consecuente daño glomerular, aparece como resultado del alto consumo proteico, especialmente en escenarios donde la ERC ya está instaurada18,21. Sin embargo, estos estudios experimentales no han sido trasladados de manera consistente al ámbito clínico, lo cual ha generado gran controversia debido a que una buena parte de la evidencia nace de estudios observacionales y no de experimentos clínicos. A pesar de ello, en la última década se ha publicado cada vez más literatura que da razón de potenciales efectos benéficos del uso de una dieta muy baja en proteínas suplementada con cetoanálogos; algunas de estas publicaciones se incluyen en la presente investigación.
Uno de los potenciales efectos más importantes de este tipo de terapia es el retraso al ingreso a diálisis en pacientes no diabéticos metabólicamente estables a quienes se les prescribe una dieta muy baja en proteínas suplementada con cetoanálogos. La reducción del riesgo de ingreso a diálisis reportada en esta revisión fue de hasta el 36 %. Al respecto, Pedrini et al.22, en la década de los noventa, reportaron que la dieta baja en proteínas definida como una ingesta proteica entre 0,4 y 0,6 gr/kg/día puede reducir el riesgo relativo (RR) de falla renal avanzada o muerte en pacientes no diabéticos (RR: 0,67, IC: 0-0,77). Posteriormente Fouque et al.23, Fouque et al.24 y Fouque et al.25 reportaron reducciones del riesgo de ingreso a diálisis que oscilan entre el 32 % y el 40 % cuando se comparan dietas muy bajas en proteínas con dietas con ingesta proteica estándar. Mircescu et al.19 evidenciaron una reducción de la necesidad de diálisis en los pacientes sometidos a dietas muy bajas en proteínas (4 % vs. 27 %) aunque sin cambios en la TFGe después de 48 semanas de seguimiento; asimismo, Garnearta et al.15 compararon una dieta muy baja en proteínas suplementada con cetoanálogos versus una dieta baja en proteínas y en su desenlace primario compuesto (necesidad de diálisis o reducción >50 % de la TFGe) reportaron diferencias significativas (13 % vs. 42 %, p<0,001).
En cuanto a la TFGe, solo la revisión de Cochrane12 no la reporta como desenlace de eficacia, el resto de las revisiones4,5,7,9,10,15,18,22,21reportan mejorías significativas en esta nuevamente cuando se compraran dietas muy bajas en proteínas con la dieta estándar. Al respecto, es importante mencionar que los estudios recientes reportan una disminución importante de la tasa de progresión de la TFGe en pacientes en manejo con dietas muy bajas en proteínas suplementadas con cetoanálogos, que son capaces de seguir la dieta después de un periodo de prueba y que además tienen adherencia a la terapia, hallazgo que puede estar relacionado con la menor necesidad de diálisis; sin embargo, en el estudio de Garneata et al.15 la diferencia no alcanza la significancia estadística.
En cuanto a marcadores del metabolismo mineral óseo, parece haber un mejor control de los niveles de fósforo cuando se restringe de manera importante la proteína en la dieta. En teoría, una dieta baja en proteínas también tiene un bajo contenido de fósforo y, además, cuando se suplementa con cetoanálogos, estos, que son sales cálcicas, podrían funcionar como quelantes del fósforo. Asimismo, estas dietas tienen un alto contenido de vegetales, lo que hace que haya una menor absorción intestinal de fosforo dado que este se encuentra en su forma de fitato. Así, el fósforo permanece no disponible para el hombre y animales monogástricos debido a que estos no están provistos de suficiente actividad de fosfatasas endógenas, contribuyendo a la menor absorción intestinal. La disminución del nivel de fósforo es un efecto temprano que puede alcanzar una reducción del 12 % y que se observa sin necesidad de adicionar quelantes26; esta reducción puede ser mayor cuando se utilizan dietas vegetarianas27. En cuanto a los niveles de PTH, dos de las revisiones8,13reportaron disminuciones significativas en los niveles de hormona paratiroidea; sin embargo, estas reducciones se han reportado en pacientes con enfermedad renal más avanzada y solo en pacientes con elevaciones no severas de la hormona paratiroidea25-28.
Una de las barreras del uso de las dietas muy bajas en proteínas ha sido el riesgo de malnutrición al que se pueden exponer los pacientes con ERC cuando se les restringe de manera importante la ingesta proteica. Aunque la albumina no es el mejor marcador nutricional, se ha establecido que sus niveles se mantienen estables, sin cambios significativos e incluso en ocasiones pueden mejorar cuando se realiza restricción severa de proteínas. De hecho, Klahr et al.28 no reportaron variaciones significativas en los niveles de albumina en el brazo de dieta muy baja en proteínas. Por otro lado, pocos estudios han establecido la presencia de síndrome de desgaste proteico calórico y solo una de las revisiones29 no reporta efectos deletéreos del uso de las dietas muy bajas en proteínas. Sin embargo, el uso de la dieta hipoprotéica suplementada con cetoanálogos es recomendada por Kovesdy et al.29 como parte del manejo del síndrome de desgaste proteico calórico en pacientes que toleren una restricción proteica moderada.
Aunque se reporta una disminución de peso y un efecto negativo sobre el IMC, Chauveu et al.30, en un estudio de composición corporal con absorciometria dual de rayos X (DEXA de sus siglas en ingles), no reportaron cambios significativos en la masa grasa o el porcentaje de masa grasa en pacientes que recibieron dietas muy bajas en proteínas suplementadas; los autores también informaron que después de un descenso inicial de la masa magra en el primer trimestre, esta se estabilizó al sexto mes, luego de lo cual tuvo un aumento significativo hasta el segundo año de seguimiento. Más recientemente, Milovanova et al.31 reportaron también una disminución del IMC, sin presencia de signos de desgaste proteico calórico, al suministrar dietas bajas en proteínas.
Conclusiones
Según los hallazgos, hacen falta más estudios con diseños metodológicos adecuados para poder evaluar la presencia o no de desgaste proteico calórico con las dietas muy bajas en proteínas. No obstante, se pudo establecer que una dieta muy baja en proteínas suplementada con alfa-cetoanálogos retrasa el ingreso a diálisis, tiene un efecto positivo sobre la progresión de la TFGe, disminuye los niveles de fosforo y puede tener efectos sutiles en los niveles de PTH en pacientes con enfermedad renal avanzada. Además, estas dietas no parecen afectar de manera negativa los niveles de albumina, pero se requieren estudios con mejores marcadores nutricionales que evalúen el estado nutricional de los pacientes con ERC. Asimismo, se necesitan más estudios que evalúen calidad de vida, adherencia y efectos adversos asociados al consumo de los cetoanálogos.
Recomendaciones de investigación
Se requieren ensayos clínicos aleatorizados con ciego, idealmente comparados contra placebo, para confirmar los resultados de prolongación del tiempo de ingreso a diálisis o trasplante renal. Los desenlaces intermedios basados en tasa de filtración glomerular deben ser confirmados con una medida de filtración no basada en creatinina, tipo estándar de oro o equivalente como el aclaramiento de iotalamato, iohexol, DTPA o Cr- EDTA debido al sesgo de reducción del valor de creatinina en suero con la dieta baja en proteínas. Adicionalmente, en los desenlaces se debe incluir la evaluación de calidad de vida, efectos adversos y adherencia.
Consideraciones éticas
Los autores declaran que los procedimientos seguidos se realizaron conforme a las normas éticas del comité de experimentación humana responsable y de acuerdo con lo establecido por la Asociación Médica Mundial en la Declaración de Helsinki; que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes, y que han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo.
Conflicto de intereses
RR, GA y CAGG pertenecen a la junta directiva 2018-2020 de la Asociación Colombiana de Nefrología e Hipertensión arterial. CAGG ha recibido honorarios por conferencias realizadas para Medtronics y Baxter SA. JAG ha recibido honorarios por conferencias realizadas para Fresenius Kabi, Abbott laboratorios, Laboratorios Abbvie, Fresenius kabi Latin American Export.
Financiación
La elaboración de este documento contó con el patrocinio económico de Ketosteril de Fresenius Kabi Colombia. El recurso se usó para pagar los honorarios de los epidemiólogos y costear reuniones presenciales.
Contribución de los autores
Roberto Ramírez Marmolejo: coordinó la guía, la revisión y al grupo de expertos; Adolfo Pertuz Pinzón, Javier Galeano, y Álvaro Mercado hicieron parte del grupo de expertos; Camilo González fue el asesor epidemiológico y metodológico senior, y Juan Manuel Collazos fue el asesor epidemiológico junior.