Introducción
La lesión renal aguda (LRA) se define como aquella pérdida abrupta de la función renal que resulta en la retención de urea y otros productos de desecho nitrogenados y está asociada a la desregulación del volumen extracelular y electrolitos1. Cuando este tipo de lesión ocurre durante el embarazo o puerperio se denomina LRA relacionada con el embarazo (Emb-LRA)1, y aunque en la mayoría de estos casos las causas son leves debido a motivos prerrenales como la depleción de volumen, otras causas como abortos sépticos o microangiopatías trombóticas (MAT) pueden ser potencialmente mortales y requieren tratamiento de diálisis urgente2. La Emb-LRA está asociada con resultados maternos y fetales adversos en términos de progresión a enfermedad renal en etapa terminal y aumento de la mortalidad materna, así como mayor incidencia de prematuridad y muerte perinatal2,3.
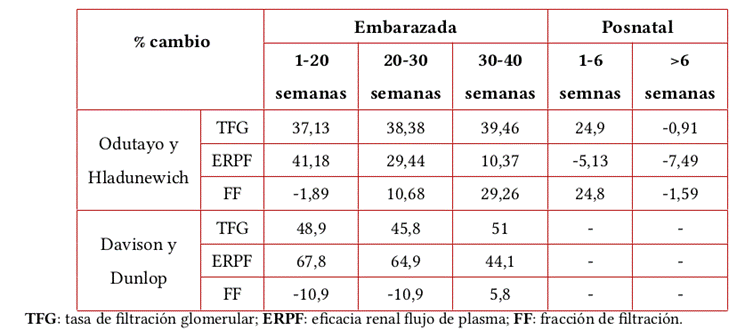
Los criterios actuales para el diagnóstico y la estadificación de LRA proponen una definición única que incluye uno de los de los siguientes enunciados: aumento de la creatinina sérica ≥0,3 mg/dL (≥26,5 mmol/L) en 48 horas; aumento de la creatinina sérica >1,5 veces el valor basal, que se sospeche se haya producido dentro de los 7 días previos, o volumen de orina <0,5 mL/kg/hora durante 6 horas4. No obstante, esta definición no es perfecta en la población de mujeres embarazadas debido a que en el período gestacional el aumento del flujo sanguíneo renal conduce a una hiperfiltración glomerular que se acompaña de un nivel más bajo de creatinina sérica3. Además, los valores de tasa de filtración glomerular (TFG) normal varían durante el embarazo, tal como se resume en la Tabla 1.
Materiales y métodos
Se realizó una revisión narrativa de la literatura a través de una búsqueda avanzada con los términos DeCS y MeSH: “Insuficiencia renal”, “Preeclampsia”, “Mujeres Embarazadas” y “Diálisis”. Se utilizaron los motores de búsqueda Clinical Key, Embase, PubMed y Ovid. La búsqueda inicial arrojó un total de 91 resultados, entre artículos originales, reportes de casos, y revisiones, de los cuales, según su relevancia para este escrito, se seleccionaron 32 que fueron utilizados para la elaboración de la presente revisión.
Epidemiología
La LRA es considerada una complicación rara pero grave durante el embarazo, y se asocia con un aumento de riesgo de mal pronóstico6,7. Además, la morbilidad y la mortalidad por esta causa se han mantenido relativamente altas durante las últimas seis décadas8. Las diferencias observadas entre países desarrollados y en vía de desarrollo en el patrón epidemiológico de LRA incluyen los individuos afectados, su etiología, el entorno en el que ocurre y las modalidades de terapia de reemplazo renal (TRR) disponibles y sus resultados9,10.
Estudios anteriores informaron que la incidencia de LRA durante el embarazo ha disminuido de 1/3.000 a 1/20.000 en países desarrollados, lo cual se atribuye a la mejora en la atención prenatal y la disminución del aborto séptico6. Sin embargo, la carga y el perfil de riesgo relacionado con el embarazo en los países desarrollados pueden ser diferentes a los del mundo en desarrollo6: la incidencia notificada de LRA durante embarazo en países en desarrollo como India y Pakistán osciló entre el 0,02% y el 11,5%, pero estos estudios estuvieron limitados por tamaños de muestra pequeños y poblaciones altamente seleccionadas6. Por otro lado, la incidencia de LRA relacionada con el embarazo en los países desarrollados es del 1-2,8%. En los países en desarrollo, la incidencia sigue siendo del 9-25%, principalmente debido a la derivación tardía de las complicaciones relacionadas con el embarazo11.
De otra parte, datos recientes de Canadá muestran una incidencia creciente de LRA relacionada con el embarazo que pasó de 1,66/10.000 entre 2003 y 2004, a 2,68/10.000 entre 2009 y 201012. El hecho de que estas tasas de incidencia sigan siendo bastante bajas es preocupante y podría deberse a varios factores como el mayor uso de la tecnología de reproducción asistida que permite a las mujeres quedar embarazada a edades más avanzadas; una incidencia creciente de hipertensión y de trastornos del embarazo, y un aumento en los índices de obesidad12.
En 2016 Liu et al.6 realizaron un estudio multicéntrico a gran escala que incluyó 25 centros de salud de China y abarcó una amplia gama de enfermedades y niveles de gravedad de estas. En dicha investigación se incluyeron mujeres de edad fértil (14 a 50 años) con al menos dos pruebas de creatinina sérica (SCr) dentro de cualquier ventana de 7 días durante la hospitalización. Los objetivos de ese estudio fueron determinar el efecto del embarazo sobre el riesgo de IRA entre las mujeres en edad fértil para describir la incidencia, los factores de riesgo y los resultados de la IRA en mujeres embarazadas hospitalizadas en China. Los investigadores encontraron que, entre 110.873 mujeres en edad fértil, las embarazadas (n=10.920) tenían un 51% más de riesgo de desarrollar IRA que las no embarazadas (n=99.953). La LRA adquirida en la comunidad y en el hospital se produjo en el 3,6% (n=393) y el 3,7% (n=402) de las embarazadas, respectivamente, dando lugar a una incidencia global de LRA del 7,3%. Los tres principales factores de riesgo de LRA durante embarazo fueron trastornos hipertensivos asociados al embarazo (21,1%), hígado graso agudo (HGA) (13,5%) y enfermedad renal crónica (ERC) (6,2%)6.
La LRA, la preeclampsia (PE) y la ERC están intrínsecamente relacionadas y el daño renal puede representar el vínculo común13. Hoy en día se está acumulando una gran cantidad de evidencia sobre el efecto de todo tipo de LRA como ente causante de ERC a futuro13.
La evidencia del efecto a largo plazo de la Emb-LRA en el desarrollo futuro de ERC es limitada. Sin embargo, hay un número creciente de estudios dirigidos a describir la relación entre la PE, los trastornos hipertensivos del embarazo, el desarrollo de enfermedades cardiovasculares y el desarrollo de ERC13.
Aunque la Emb-LRA es una entidad infrecuente, constituye un desafío clínico y produce lesiones renales que son lo suficientemente graves como para requerir diálisis durante el embarazo14,15. El manejo eficaz de la enfermedad renal en el embarazo o puerperio exige una comprensión clara de la etiología y antecedentes de la lesión renal y la implementación de un tratamiento específico para su diagnóstico, junto con cuidados generales de apoyo y diálisis14. Es frecuente que las embarazadas con problemas renales pidan información sobre sus condiciones clínicas, posibles resultados y pronósticos; sin embargo, es imposible dar una respuesta satisfactoria sin datos clínicos precisos y actuales dada la falta de evidencia11,14,16.
Cambios renales fisiológicos en el embarazo
Durante el embarazo ocurren un sin número de cambios dinámicos y adaptaciones renales que tienen como protagonista el riñón y que contribuyen a modificaciones anatomofisiológicas de la madre y el feto3; en la Figura 1 se observan algunos de estos cambios.
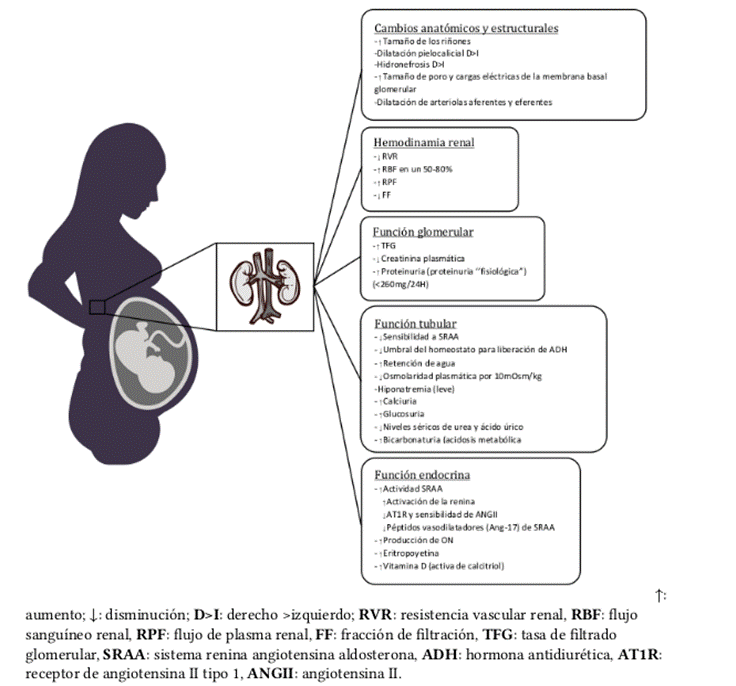
Fuente: elaboración con base en Vinturache et al.5.
Figura 1. Cambios fisiológicos renales durante embarazo.
De igual forma, durante la gestación ocurren cambios inmunológicos y hemodinámicos significativos que, por lo general, son adaptativos y tolerados dependiendo de la fase y la etapa del embarazo12. Los principales cambios hemodinámicos incluyen el aumento del volumen plasmático, la disminución de la resistencia vascular sistémica y el aumento del ritmo cardíaco12.
Durante esta etapa también hay un aumento de los niveles sistémicos de vasodilatadores, como el óxido nítrico y la relaxina, un péptido producido por el cuerpo lúteo que contribuye al aumento del flujo sanguíneo y de la TFG y a la depuración de solutos2. La TFG aumenta aproximadamente un 50% y el flujo sanguíneo renal un 80%12, lo que ocasiona una reducción fisiológica de la creatinina sérica en el contexto de hiperfiltración; en la Figura 2 se resumen los diferentes cambios fisiológicos que ocurren durante el embarazo . La creatinina sérica normal durante el embarazo está en el rango de 0,4 a 0,6 mg/dL (Tabla 2). Asimismo, la combinación de relajación del músculo liso debido a la progesterona y a la compresión mecánica por parte del útero agrandado puede causar hidronefrosis y retención de orina en el sistema colector durante el embarazo.
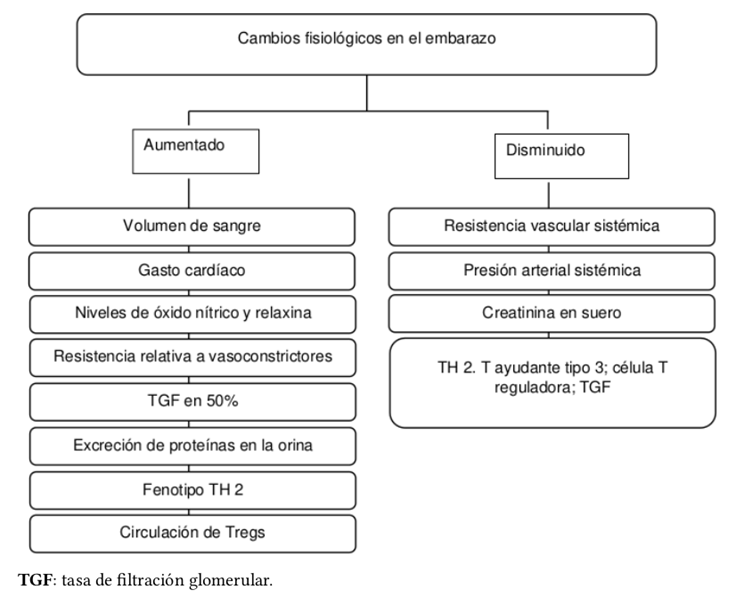
Fuente: elaboración con base en González-Suarez et al.12.
Figura 2. Cambios fisiológicos durante el embarazo.
Tabla 2. Efectos de los cambios fisiológicos gestacionales sobre los parámetros de laboratorio en mujeres embarazadas.

Fuente: elaboración con base en Acharya17.
Otros cambios producidos durante el embarazo consisten en que el agua corporal total aumenta de 6 a 8 litros, de los cuales 4 a 6 son extracelulares y representan el edema durante el embarazo; esta expansión de volumen depende de la activación del sistema renina-aldosterona-angiotensina2. La excreción de proteínas en orina aumenta de 60-90 mg/día a 180-250 mg/día. Anatómicamente no se puede dejar atrás la importancia del epitelio tubular renal, ya que es muy sensible a hipoxia y factores procoagulantes que conducen a necrosis tubular y necrosis cortical renal. Las causas de daño tubular incluyen hipovolemia por hiperemesis gravídica/hemorragia posparto, abolición de la hiperfiltración en la PE debido a endoteliosis glomerular y oclusión de la vasculatura renal por detritos amnióticos2.
Por último, hay varios cambios en la función de los sistemas inmunológicos innatos y adaptativos en el embarazo que pueden tener un impacto importante en el comportamiento de las enfermedades autoinmunes: el embarazo normal se caracteriza por un cambio de una TH 1 (inmunidad mediada por células) a una TH 2 (mediada por inmunidad humoral), el cual es importante para la tolerancia a los antígenos fetales, la invasión de trofoblasto y la formación de placenta. Además, el número de células T reguladoras (Tregs) que promueven la tolerancia inmune aumenta, contribuyendo aún más a establecer tolerancia fetal, tal como se describe en la Tabla 2. En enfermedades autoinmunes, como el lupus eritematoso sistémico (LES), las alteraciones en el número y la función de las células Tregs pueden correlacionarse con un mayor riesgo para las complicaciones del embarazo, como la PE y los malos resultados fetales y maternos12.
Factores de riesgo
En un estudio de cohorte prospectivo realizado en pacientes obstétricas, Tyagi et al.18 observaron durante toda la estancia en la unidad de cuidados intensivos (UCI) la presencia o ausencia de varios factores de riesgo de LRA como trastornos hipertensivos del embarazo; hemorragia ante y post parto; HGA; hemólisis; síndrome de enzimas hepáticas elevadas; plaquetas bajas (HELLP); sepsis puerperal; coagulopatía intravascular diseminada; conmoción; trauma; cirugía anterior reciente; exposición a fármacos nefrotóxicos o agentes de radiocontraste; diabetes mellitus; comorbilidades preexistentes o anemia. Las comorbilidades incluían enfermedades crónicas del corazón, pulmón o hígado18. Vale la pena mencionar que Makusidi et al.19 demostraron que el 5% de todos los ingresos hospitalarios y el 30% de los pacientes ingresados a UCI se atribuyen a LRA.
Posteriormente, en un estudio realizado en 2019, Liu et al.6 establecieron que la edad materna avanzada no es un factor significativo de riesgo para el desarrollo de Emb-LRA. En dicho estudio, los investigadores estimaron fracciones atribuibles a la población (FAP) de los factores de riesgo para evaluar su contribución a la LRA durante el embarazo y encontraron que, en general, los tres principales factores de riesgo para el desarrollo de LRA durante el embarazo, clasificados en orden de FAP decreciente, fueron trastornos hipertensivos del embarazo (21,2%), HGA (13,5%) y ERC (6,2%)6. El perfil de riesgo de Emb-LRA se presenta en la Tabla 3.
Tabla 3. Factores de riesgo de lesión renal aguda en mujeres embarazadas.
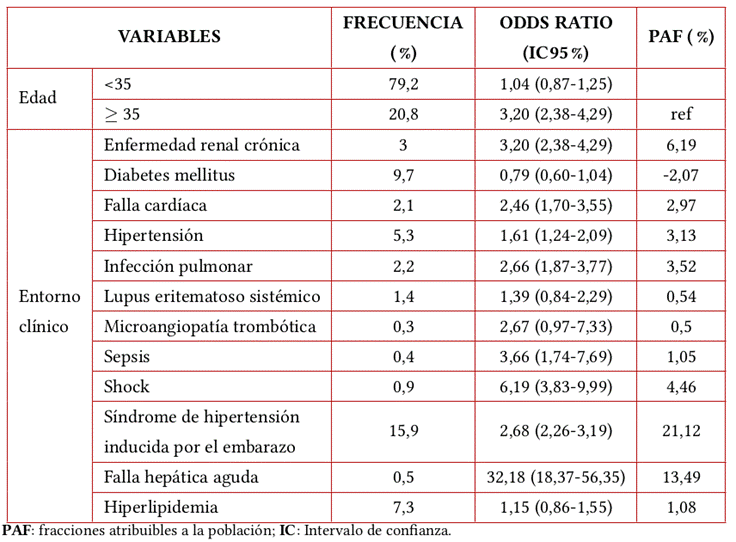
Fuente: elaboración con base en Liu et al.6.
Lesión renal aguda en situaciones específicas
Nefritis lúpica
Los embarazos en mujeres con LES, especialmente nefritis lúpica, son de alto riesgo y necesitan planificación previa a la concepción y un cuidado específico2. La activación del lupus durante la gestación se asocia con una mayor incidencia de efectos adversos maternos y fetales, incluidos abortos espontáneos, PE, restricción del crecimiento intrauterino y parto prematuro2,20. La concepción debe evitarse durante al menos 6 meses luego de un brote de lupus anterior y al menos 9 meses desde un brote previo de nefritis lúpica2. Un brote de nefritis lúpica durante el embarazo puede ser difícil de diferenciar de la PE debido a características comunes como empeoramiento de la hipertensión, proteinuria, trombocitopenia y empeoramiento de la función renal; sin embargo, la caída del complemento sérico y el aumento de los niveles de ADN anti-bicatenario son pistas útiles para el diagnóstico diferencial (Tabla 4)2.
Tabla 4. Signos y síntomas de síndromes superpuestos de lesión renal aguda durante el embarazo.
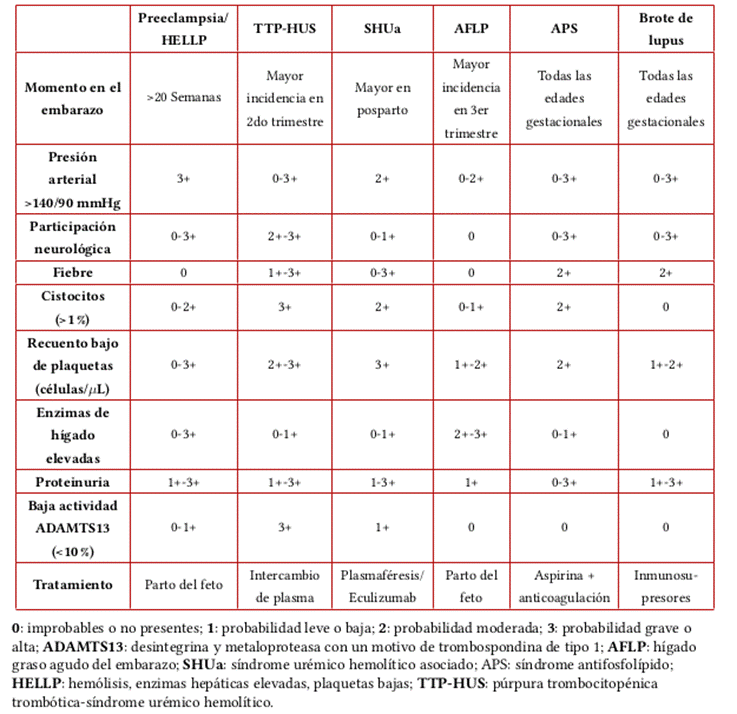
Fuente: elaboración con base en Vijayan et al.2.
Microangiopatías trombóticas
Las microangiopatías trombóticas renales comprenden trastornos como la purpura trombocitopénica trombótica (PTT) y el síndrome hemolítico urémico y sus características comunes son la oclusión diseminada de arteriolas y capilares con fibrina y posiblemente plaquetas aglutinadas que resultan en la destrucción mecánica de glóbulos rojos y disminución del recuento de plaquetas21. A pesar de que su ocurrencia durante el embarazo es rara, se asocian con una alta morbimortalidad materna y fetal. La deficiencia de ADAMTS-13, un von Willebrand proteasa que escinde el factor, es la responsable de la mayoría de los casos de PTT que ocurren, principalmente, en el segundo y tercer trimestre de los embarazos21.
El embarazo, en sí mismo, es un desencadenante de PTT, especialmente en los entornos de la deficiencia de ADAMTS-13, debido a que es un estado procoagulante21.
Hígado graso agudo en embarazo
El HGA durante el embarazo es raro (1:20.000 embarazos), pero constituye una emergencia obstétrica potencialmente fatal, con una mortalidad materna y neonatal del 2% y 10%, respectivamente21. Las mutaciones en la enzima 3-hidroxiacil-CoA deshidrogenasa de cadena larga materna y fetal dan como resultado la acumulación de ácidos grasos de cadena larga, lo que causa hepatotoxicidad en la madre21. La Emb-LRA asociada a HGA es común y ocurre con diversos grados de gravedad en el 50-75% de los pacientes con HGA21. Similar a los hallazgos de patología hepática, una serie de autopsias informó de la deposición de ácidos grasos libres en el epitelio del túbulo renal en algunos casos de HGA21.
Preeclampsia/ HELLP
La PE se asocia en un 30-40% de los casos con la reducción del flujo sanguíneo renal y de la TFG en comparación con un embarazo normal; la Emb-LRA es una manifestación poco común (1%), a menos que la PE sea grave o esté asociada con HELLP21.
El síndrome HELLP asociado con Emb-LRA se clasifica como un continuo de PE/eclampsia en el 7-36% de los casos, aunque el 20% no tiene antecedentes de hipertensión arterial o proteinuria21,22.
Diagnóstico
El diagnóstico oportuno de Emb-LRA se basa en una historia clínica completa y en pruebas de laboratorios complementarias. Es importante que a todas las mujeres embarazadas con sospecha diagnóstica de Emb-LRA se les monitoree de forma metódica el ingreso y egreso de líquidos, además se les deben evaluar los niveles de urea, creatinina, electrolitos, hemograma, uroanálisis y pruebas de función hepática como parte del estudio inicial. Los pasos para el enfoque inicial de la paciente con Emb-LRA se resumen en la Figura 3.
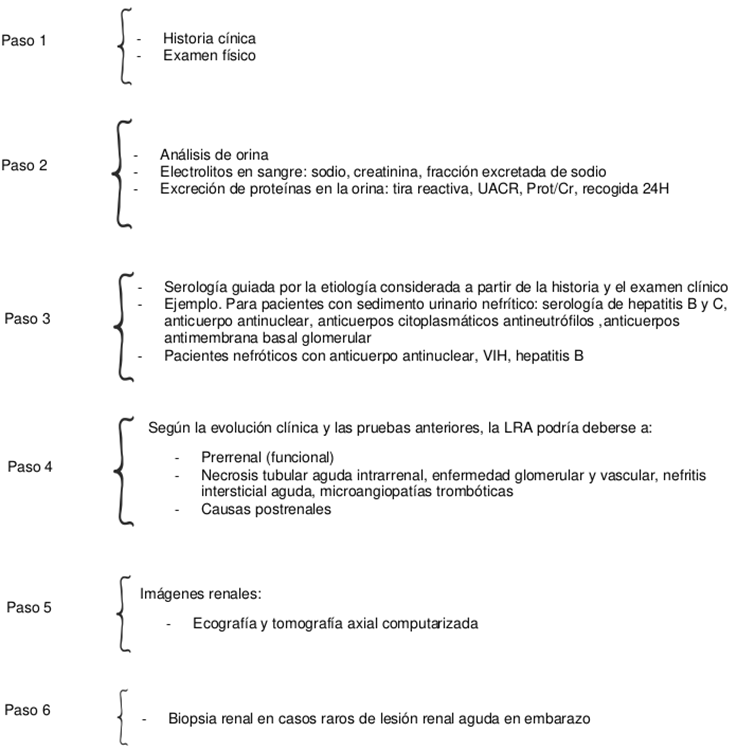
Fuente: Elaboración con base en Acharya et al.17
Figura 3. Pasos para el enfoque de pacientes con lesión renal aguda relacionada con el embarazo.
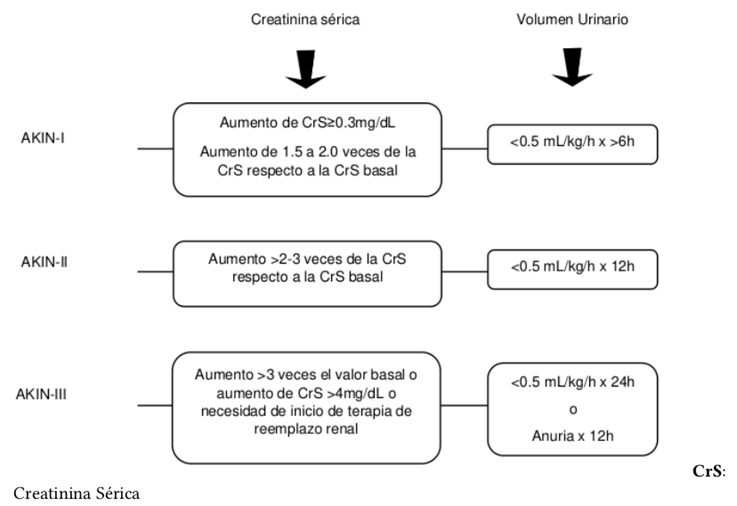
En la población general, los criterios RIFLE y AKIN se usan comúnmente para definir y clasificar la LRA, pero no están bien validados en el embarazo21 debido a que durante esta etapa las mujeres sufren múltiples cambios, algunos ampliamente conocidos, como aumento de volumen plasmático y masa eritrocitaria, con un aumento mayor del primero que ocasiona la conocida anemia relativa o diluciones del embarazo. Otros cambios son de tipo anatómico, tales como el agrandamiento del riñón y la pelvis, y la dilatación del uréter que produce una obstrucción relativa asociada a estasis o reflujo, lo que explica la alta incidencia de hidronefrosis (de predominio derecho) en las ecografías renales en embarazadas; esta última es una herramienta importante para descartar la obstrucción como causa. El tamaño renal es una medida adicional útil, ya que los riñones pequeños bilaterales pueden indicar una ERC subyacente23. Otro cambio significativo consiste en el aumento de volumen plasmático y gasto cardíaco, que predisponen al incremento de flujo plasmático renal y ocasionan un estado de hiperfiltración, dando como resultado un aumento de 40-50% en la TFG, lo que se traduce en que la creatinina sérica que se encuentra dentro del rango normal para la población general podría reflejar un compromiso significativo de la función renal en mujeres embarazadas24.
Hay que tener en cuenta que si bien la oliguria puede indicar el desarrollo de LRA, existen determinadas condiciones del embarazo donde esta es una respuesta renal compensatoria a la depleción de volumen intravascular, tal como ocurre en la PE y en otras circunstancias como el dolor23. No obstante, la anuria nunca se puede considerar como normal y se debe tratar como una emergencia23. En la Figura 4 se pueden observar los criterios diagnósticos de AKI aplicables para población general; sin embargo, diversos estudios han demostrado que la mayoría de los casos de Emb-LRA pertenecen a la categoría de estadio 1 de AKIN y que una categoría RIFLE más alta se asocia con peores resultados.
El uso de la TFG como marcador de la función renal tiene ventajas sobre la creatinina sérica, ya que la primera puede disminuir incluso cuando la segunda es normal25. El cálculo de la TFGe no es exacto durante el embarazo: Smith et al.26 compararon la fórmula del estudio MDRD con el aclaramiento de inulina y creatinina mediante recolección de orina de 24 horas y Alper et al.27 compararon la ecuación MDRD con la ecuación de Cockcroft-Gault y el aclaramiento de creatinina por recolección de orina de 24 horas en mujeres con PE y ambos concluyeron que las fórmulas MDRD y Cockcroft-Gault eran inexactas para medir la TFG, ya que la fórmula MDRD subestima y la fórmula de Cockcroft-Gault sobreestima dicha tasa durante el embarazo. De esta forma, el aclaramiento de creatinina mediante recolección de orina de 24 horas sigue siendo el método estándar de oro para estimar la TFG en el embarazo25.
Evaluación de la proteinuria en mujeres embarazadas
Al igual que en la población no embazada, el método de elección para medir la proteinuria es a través de la recolección de orina en 24 horas17. No obstante, la utilidad del ratio albumina/creatinina (RAC) en orina también ha sido validada en la Emb-LRA con muy buena predicción diagnóstica, por lo cual puede usarse con seguridad como alternativa al estándar de oro28; de hecho, en la actualidad se posiciona como un reemplazo rápido a las pruebas con tira reactiva29. Por todos los beneficios antes mencionados, se podría utilizar de forma rutinaria la medición del RAC teniendo en cuenta su sencillez y su bajo costo17.
Biomarcadores de LRA temprana durante el embarazo
Wang & Gu30 demostraron que NGAL y KIM-1 son biomarcadores de lesión tubular renal aguda que podrían ser útiles durante el embarazo y, a su vez, permitir evaluar la recuperación funcional del riñón luego del parto.
Respecto a la Cistatina C, Bellos et al.31 publicaron un metaanálisis donde revisaron 27 estudios observacionales, con un total de 2.320 mujeres embarazadas, y evidenciaron que los niveles de esta proteína eran mayores en mujeres preeclámpticas, con una sensibilidad de 85% y especificidad de 84%, siendo útil como biomarcador de detección de PE durante el tercer trimestre del embarazo. Por su parte, Kreepala et al.32 investigaron los efectos de la proteinuria aislada sobre la TFG basada en Cistatina C en el tercer trimestre del embarazo y encontraron que el nivel de proteína tiene una sensibilidad inadecuada para estimar la TFG en mujeres embarazadas, y que además existe una disminución significativa en la TFG en presencia de proteinuria, lo que propone a la Cistatina C como un marcador temprano de Emb-LRA. Finalmente, Tyagi et al.18 estudiaron la utilidad de TIMP-2 y IGFBP7 y encontraron que, a pesar de que estos biomarcadores predicen con éxito la LRA temprana en población general, no son aplicables a las pacientes obstétricas.
Por lo anterior, es de vital importancia realizar un diagnóstico temprano de Emb-LRA, pues se considera como una complicación grave relacionada con una importante morbimortalidad materno-fetal y la prolongación de estancia hospitalaria, y todo lo que esto conlleva. De esta forma, se vuelve imperativo validar tanto los criterios de AKIN, como los biomarcadores ya existentes en las pacientes embarazadas.
Tratamiento
Cuando se enfrenta una Emb-LRA es importante recordar que se trata de dos vidas: materna y fetal, por lo que el nivel de complejidad de dicha atención se vuelve un desafío doble. Por tanto, el manejo exitoso de este cuadro requiere un enfoque multidisciplinario que incluya neurólogos, obstetras, internistas, intensivistas, entre otros21,33. Con fines prácticos el tratamiento se debe enfocar en dos pilares: el primero será el tratamiento propio de la Emb-LRA y el segundo, el tratamiento de la causa subyacente del cuadro.
Dentro de las medidas generales para tratar la Emb-LRA se incluye prevención de lesiones adicionales, reanimación con volumen, terapia farmacológica e inicio de TRR de manera oportuna11.
Medidas generales
Una vez establecido el diagnóstico de Emb-LRA, se debe realizar una búsqueda exhaustiva de la posible etiología, descartar la presencia de procesos infecciosos e indagar la administración de agentes nefrotóxicos y sus respectivas dosis, en especial antiinflamatorios no esteroideos, antibióticos aminoglucósidos y medios de contraste23. Fármacos como el sulfato de magnesio, ampliamente usado como piedra angular en la prevención de convulsiones en pacientes con PE, es excretado por vía renal, por lo que presenta alto riesgo de toxicidad e hipermagnesemia en pacientes con LRA17.
Balance hidroelectrolítico
La reposición del volumen intravascular es crucial y tiene como objetivos principales restaurar y mantener la percusión renal para limitar en lo posible un daño mayor23. Determinar la causa de la posible hipovolemia permitirá definir el tipo de soluciones a utilizar; los cristaloides son los de elección para la mayoría de pacientes, no obstante es necesario reponer hemoderivados en las pacientes que lo requieran25.
Cabe resaltar que esta estrategia debe llevarse a cabo bajo estricta monitorización del balance hídrico para evitar el daño ocasionado por sobrecarga de volumen, tal como el desarrollo de edema pulmonar12. La adecuada corrección de volumen restablece la circulación uteroplacentaria adecuada y asegura el bienestar fetal25.
Las complicaciones de la Emb-LRA se manejan de forma similar a como se hace en pacientes no embarazadas: la hiperpotasemia se trata de forma segura con insulina e infusión de glucosa25; no obstante, también pueden usarse resinas de intercambio catiónico21. La acidosis metabólica se corrige tratando la causa específica de la lesión renal, pero también pueden utilizarse soluciones alcalinas25. En la sobrecarga de volumen, los diuréticos de Asa son seguros, y en caso de anemia de origen renal se debe transfundir cuando esté indicado y los agentes estimulantes de la eritropoyetina puedan utilizarse; sin embargo, requerirán dosis más altas en comparación con pacientes no embarazadas25.
Terapia farmacológica
La presión arterial debe ser una variable a controlar en todas las mujeres embarazadas, más aún en las que cursan con Emb-LRA para poder minimizar la progresión de un daño renal mayor25. Muchos de los fármacos antihipertensivos usados comúnmente están contraindicados en el embarazo debido a su efecto teratógeno, como es el caso de los inhibidores de la enzima convertidora de angiotensina y antagonistas de receptores de angiotensina 212, por lo cual los medicamentos de primera línea son alfa-metildopa y labetalol34.
Anteriormente se utilizaba una infusión de dopamina a dosis bajas (3 mcg/kg/min) como prevención y tratamiento de la LRA para que a través de su efecto vasodilatador sobre las arteriolas renales la perfusión renal aumentara23. Sin embargo, en la actualidad se conoce su efecto nulo en la progresión de la LRA y en el requerimiento de TRR, por lo cual no se recomienda su uso rutinario35,36.
En cuanto a los diuréticos de Asa en el tratamiento de la LRA, su uso es común a nivel mundial para convertir la LRA oligúrica en no oligúrica; no obstante, hasta el momento no existe evidencia que demuestre beneficio sobre el pronóstico renal con el uso de diuréticos37. A pesar de esto, la implementación temprana de la terapia diurética (<48 horas) rara vez es perjudicial y podría ayudar en el manejo de la sobrecarga hídrica en pacientes seleccionadas23.
TRR
La incidencia general de mujeres embarazadas en TRR sigue siendo baja: los datos sugieren una cifra <1% de la población38. Asimismo, estudios de países en desarrollo como Nigeria, India y Marruecos reportan una tasa de requerimiento de diálisis de 3,8 por cada 1.000 partos14, 1,78 por cada 1.000 partos39 y de 2,0 por 1.000 partos40, respectivamente. Sin embargo, la incidencia promedio de TRR en mujeres embarazadas en países desarrollados se mantiene <1 por cada 20.000 partos41,42.
Una revisión sistemática reciente y un metaanálisis de estudios publicados entre 2000 y 2008 en el que se evaluaron 543 pacientes embarazadas en TRR mostró una mortalidad materna perinatal muy baja (0,4%) y una tendencia hacia mejores resultados con una mayor frecuencia y duración de las sesiones de hemodiálisis12.
El objetivo de las TRR es disminuir los efectos adversos de la uremia en la paciente y el feto (polihidramnios, retraso en crecimiento, parto pretérmino, etc.)17 y las indicaciones principales para inicio de TRR en Emb-LRA son similares a la de para población no embarazada y se resumen en la Tabla 5.
Tanto la hemodiálisis como la diálisis peritoneal (DP) se han descrito en mujeres embarazadas12,43,44; sin embargo, la incidencia de trastornos fetales, como pequeño para la edad gestacional o bajo peso al nacer, es mayor en las mujeres que reciben DP11. La selección de la modalidad de TRR depende de las condiciones clínicas de la paciente; es así como las terapias de reemplazo renal continuas se consideran de elección en las mujeres críticamente enfermas debido a sus beneficios teóricos de menores cambios hemodinámicos y de volumen17.
De igual forma, existen otras modalidades como la hemodiálisis convencional y las terapias de soporte renal prolongadas intermitentes que también pueden ser utilizadas en las mujeres embarazas45,46. Estas han venido ocupando un lugar importante en el manejo de dichas pacientes debido al beneficio de poder utilizarse sin administración de heparina, evitando así complicaciones hemorrágicas asociadas. No obstante, hacen falta ensayos clínicos que permitan aclarar el beneficio real de este tipo de terapias en las pacientes obstétricas.
Tratamiento de las causas subyacentes
El tratamiento específico de la entidad nosológica causante de Emb-LRA es un pilar fundamental en el manejo de este tipo de pacientes. De este modo, hay que reconocer las etiologías probables según el trimestre de embarazo y, con base en esto, definir la conducta a seguir. En la Figura 5 se resume el manejo médico recomendado para la Emb-LRA en situaciones específicas según el tiempo de presentación17.
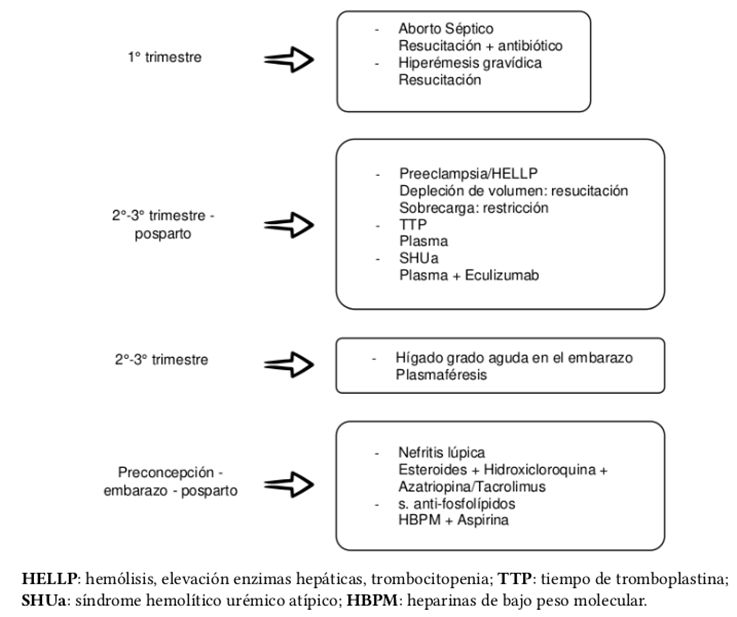
Fuente: Elaboración con base en Acharya et al.17
Figura 5. Tratamiento para mujeres embarazadas con lesión renal aguda en situaciones específicas según el tiempo de presentación.
Conclusiones
La LRA en mujeres embarazadas es una condición relativamente infrecuente, pero que, sin duda, empeora los desenlaces maternos y fetales. Por tanto, la rápida identificación del deterioro de la función renal, su posible causa y su tratamiento oportuno evitará la progresión de la enfermedad y, por ende, la aparición de complicaciones urémicas, hidroelectrolíticas, metabólicas y acido base.
Consideraciones éticas
Los autores declaran que los procedimientos seguidos se realizaron conforme a las normas éticas del comité de experimentación humana responsable y de acuerdo con lo establecido por la Asociación Médica Mundial en la Declaración de Helsinki; que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes, y que han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo.
Contribución de los autores
María Monterrosa Robles: conceptualización, curaduría de los datos e investigación; Jorge Rico Fontalvo: escritura (manuscrito original, revisión y edición); Rodrigo Daza Arnedo: escritura (manuscrito original, revisión y edición; José Pérez Olivo: escritura (revisión y edición), conceptualización e investigación; María Cardona Blanco: escritura (revisión y edición), conceptualización, investigación y elaboración de gráficas y tablas; Nehomar Pájaro Galvis: escritura (manuscrito original, revisión y edición), Christian Pérez Calvo: escritura (manuscrito original, revisión y edición); Lácides Caparroso Ramos: metodología, software, validación y conceptualización; Víctor Leal Martínez: escritura (revisión y edición), conceptualización, investigación y elaboración de gráficas y tablas; Emilio Abuabara Franco: Investigación, conceptualización y escritura (revisión y edición); Isabella Uparella Gulfo: elaboración de tablas y gráficas; María Mendoza García: conceptualización, curaduría de los datos e investigación; José Correa Guerrero: conceptualización, curaduría de los datos e investigación.