Introducción
La hiperamonemia como causa de encefalopatía es una condición usualmente relacionada con cirrosis hepática y un marcador de pobre pronóstico1. La hiperamonemia no cirrótica es una entidad rara, por lo cual requiere una confirmación de la muestra para evitar falsos positivos2, además es una de las indicaciones de diálisis no renal cuando se observan valores de amonio elevados en forma persistente y con refractariedad al manejo médico3.
Las causas de hiperamonemia se pueden clasificar en dos grupos: en el primero se encuentran las causas relacionadas con el incremento de la producción de amonio, en las que se incluye infecciones, desórdenes hematooncológicos, catabolismo aumentado, entre otros, y en el segundo se incluyen las condiciones relacionadas con disminución en la eliminación del amonio, tales como errores innatos del metabolismo de la urea y shunts portosistémico e inducidos por medicamentos4. Del mismo modo, diversos tumores han sido relacionados con hiperamonemia, entre los que se encuentra el carcinoma hepático fibrolamelar (FL-CHC), un tumor hepático primario no relacionado con enfermedad hepática previa o cirrosis que es típico de personas jóvenes y causa hasta un 9 % de los carcinomas hepatocelulares5.
A continuación, se reporta el caso raro de una mujer de 35 años con alteración del estado de conciencia asociado a ictericia e hiperamonemia severa con hallazgos de masa hepática, a quien se le indicó diálisis hasta resolución de la causa luego de un trasplante hepático.
Presentación del caso
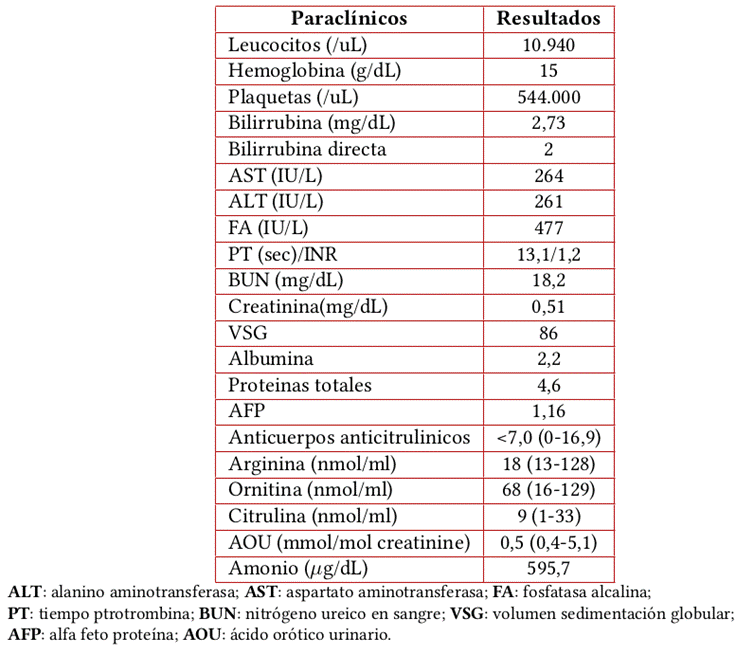
Paciente femenina de 35 años de edad con antecedente de masa abdominal en estudio y parto sin complicaciones 3 meses atrás, quien ingresó al servicio de urgencias por cuadro clínico consistente en alteración del estado de conciencia dado por episodio convulsivo. Al ingreso, la paciente se encontraba con estabilidad hemodinámica, estuporosa, afebril con ictericia y hepatomegalia. Dentro de los paraclínicos se evidenció hiperbilirrubinemia de predominio directo, elevación de transaminasas e hiperamonemia (Tabla 1). Sus familiares refirieron historia clínica negativa para infecciones y consumo de alcohol, medicamentos o tóxicos, pero mencionaron la presencia de una masa abdominal que apareció nueve meses antes. Debido al deterioro del estado de conciencia, se decidió asegurar vía aérea con intubación orotraqueal e iniciar manejo en unidad de cuidado intensivo (UCI) con equipo multidisciplinario y lactulosa, rifaximina, L- arginina y L- aspartato (LOLA).
Dada la evaluación de la paciente, se ordenaron otros exámenes como detección de virus de hepatitis B y C y virus de inmunodeficiencia humana, perfil de autoinmunidad y marcadores tumorales como alfafetoproteína, siendo todos negativos o en rango normal (Tabla 1).
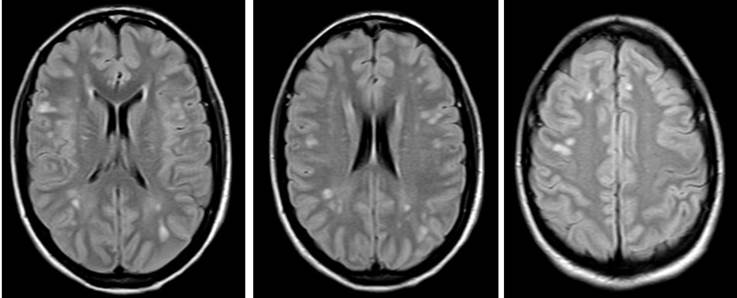
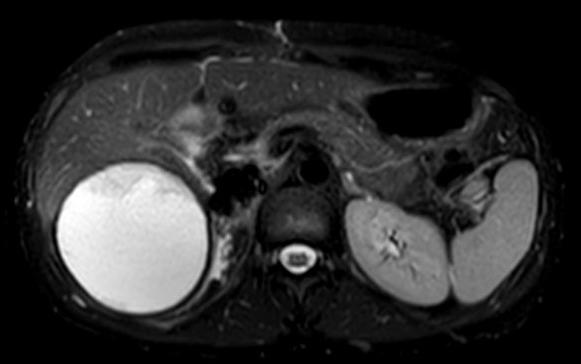
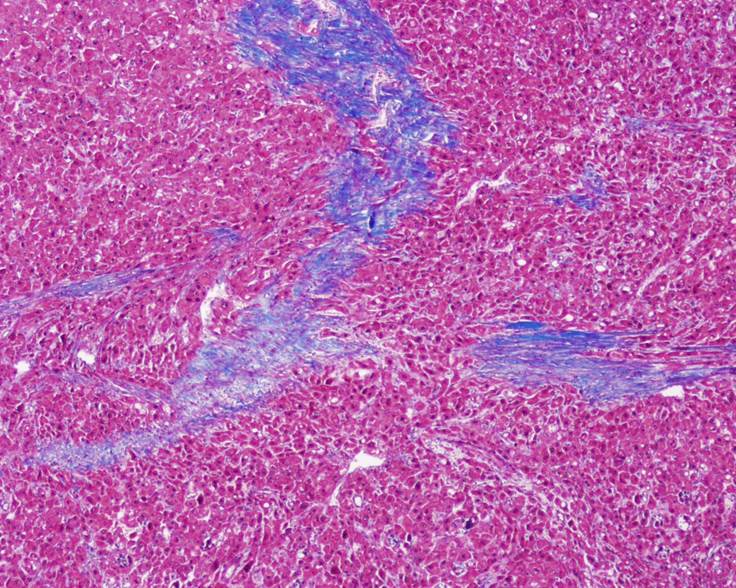
Respecto a las ayudas imagenológicas, se realizó una tomografía simple de cráneo que evidenció lesiones focales hipodensas en sustancia blanca periventricular de aspecto inespecífico sin efecto de masa (Figura 1); dado que estos hallazgos no descartaron neuroinfección, se llevó a cabo un estudio de líquido cefalorraquídeo que no reportó alteraciones. Posteriormente, se ordenó una resonancia magnética nuclear de abdomen que detectó hígado aumentado de tamaño y disminución de la intensidad de señal de manera difusa por infiltración de grasa hepática; además, en el segmento VIII se observó lesión focal hepática hipervascular de contornos lobulados, forma irregular y diámetro de 13x11x13 cm, con compresión de venas suprahepáticas, vena cava inferior y vena porta intrahepática izquierda con compresión de la vía biliar intrahepática (Figura 2). Dado el hallazgo de masa hepática, se decidió tomar biopsia de la lesión, cuyo reporte histopatológico fue compatible con FL-CHC (Figura 3).
Fuente: documento obtenido durante la realización del estudio.
Figura 1 Tomografía simple de cráneo en paciente con hiperamonemia y carcinoma fibrolamelar.
Fuente: documento obtenido durante la realización del estudio
Figura 2 Resonancia magnética de abdomen con hiperamonemia y carcinoma fibrolamelar.
Fuente: documento obtenido durante la realización del estudio
Figura 3 Biopsia hepática de carcinoma fibrolamelar.
Durante la estancia en la UCI, la hiperamonemia persistió y no hubo mejoría del estado de conciencia, por lo cual la paciente fue evaluada en conjunto por los servicios de nefrología y genética, quienes decidieron solicitar nuevos estudios para descartar defectos de metabolismo de la urea, encontrando aminoácidos limitantes del ciclo de la urea normales y niveles de ácido orótico urinario normales (Tabla 1).
Debido a la persistencia de los valores elevados de amonio (>500 µg/dL) a pesar de manejo médico, se indicó terapia de reemplazo renal en modalidad hemodiálisis continua, con lo que se logró mejoría del estado de encefalopatía y valores de amonio <100 µg/dL; esta terapia se suspendió al cuarto día gracias a los buenos resultados. Dos días después de la suspensión de la diálisis se observó reincidencia de síntomas de encefalopatía con nuevos valores de amonio en 320 µg/dL, por lo cual se decidió reinstaurarla de manera permanente hasta esclarecer diagnóstico.
En conjunto con hepatología y teniendo en cuenta los hallazgos imagenológicos, histopatológicos y paraclínicos, se llegó a la conclusión de que la paciente era candidata a trasplante hepático. La mujer continuó en diálisis hasta que recibió el trasplante, a partir de lo cual sus niveles de amonio se estabilizaron y la terapia de reemplazo renal fue suspendida. Debido a lo anterior, y al descartar errores innatos del ciclo de la urea, se atribuyó como causa de la hiperamonemia de origen no cirrótico al shunt portosistémico por masa hepática compatible con FL-CHC, esto gracias a la respuesta satisfactoria de corrección de hiperamonemia luego del trasplante hepático, constituyendo la diálisis una indicación infrecuente de causa no renal.
Discusión
El amonio es una molécula orgánica correspondiente a la forma catiónica del amoniaco, además es un derivado de la urea procedente de la dieta y digestión de las proteínas; este componente es conducido por la circulación portal hasta el hígado, en donde sufre un proceso metabólico de transaminación y desaminación oxidativa para posteriormente ser excretado por el riñón2,6. Cuando se presenta acumulación de amonio, ya sea por mayor producción o por defecto en su eliminación, en el sistema nervioso central se ha evidenciado una toxicidad por acumulación de glutamina, proceso dado por inhibición de una enzima llamada glutaminasa7.
Los efectos clínicos de la elevación del amonio tienen un amplio espectro de presentación, e incluyen cambios del sueño, confusión, letargia, cambios de personalidad, confusión, convulsiones y estado de coma. Por lo antes mencionado, es de vital importancia identificar de manera temprana la hiperamonemia para así evitar posibles noxas cerebrales que llevan consigo alteración de la homeostasis del agua cerebral y pueden producir cambios metabólicos, edema cerebral y hasta hipertensión endocraneal8. En el enfoque inicial de un paciente con alteración del estado de conciencia se deben descartar mimetizadores como el síndrome de Wernicke-Korsakoff, las alteraciones del sodio, la hipoglicemia, la alcalosis metabólica, el hematoma subdural crónico y el estatus epiléptico no convulsivo1.
La paciente reportada debutó con síndrome convulsivo asociado a niveles elevados de amonio y no presentaba antecedentes de consumo crónico de alcohol ni estigmas de hepatopatía crónica o electrolitos, además su perfil metabólico era normal; sin embargo, llamaron la atención los cambios estructurales a nivel de tomografía cerebral concordantes con los cambios fisiopatológicos que ejerce el amonio en el cerebro.
En el abordaje diagnóstico de un paciente con encefalopatía sin patología hepática previa el nivel de amonio elevado debe considerarse la posibilidad de alteración en el ciclo de la urea, en el cual su abordaje diagnóstico debe hacerse con medición de niveles de aminoácidos séricos, aminoácidos urinarios, ácido orótico urinario y ácidos orgánicos urinarios5,9. En la paciente reportada los test realizados para diagnóstico de posibles errores innatos relacionados con el ciclo de la urea fueron negativos, por lo cual el diagnostico se tornó más difícil.
Como ya se mencionó, las etiologías de hiperamonemia de origen no cirrótico se clasifican en dos grupos, uno en el que se incluyen las causas relacionadas con el incremento de la producción de amonio: infección por bacterias productoras de urea (Proteus mirablis, Klebsiella species, Escherichia coli, Morganella morganii, Providencia rettgeri, diphtheroids, Mycobacterium genavense, Herpes simplex), desordenes hematooncológicos, quimioterapia, trasplante de órganos, aumento de consumo de proteínas o aumento en su catabolismo como es el caso en ejercicio intenso, trauma, convulsiones, sangrado gastrointestinal, uso de esteroides y nutrición parenteral, y otro en el que se incluyen las causas relacionadas con la disminución en la eliminación del amonio: ureterosigmoidostomía, shunt portosistémicos, medicamentos (ácido valproico, carbamazepina, rivabirin y salicilatos) y errores innatos del metabolismo9. En el caso reportado se descartaron uno a uno los diagnósticos, quedando la opción de un shunt portosistémico.
Las causas de un shunt portosistémico pueden estar relacionadas con su ubicación intrahepática o extrahepática, pero en su mayoría son congénitas con manifestaciones tempranas. Otras causas incluyen lesión hepática hipervascular con o sin efecto oclusivo venoso, para lo cual la biopsia hepática en el abordaje diagnóstico descarta cirrosis, esquistosomiasis o granulomas9. El FL-CHC es un tipo histológico del carcinoma hepatocelular (CHC) que representa el 1 % de tumores primarios hepáticos, con incidencia de 0,02 casos por cada 100.000 habitantes10, y es causado por la mutación DNAJB1-PRKACA en el cromosoma 19 con delección de 8 genes, siendo los más comunes MUC4 (asociado a otros tumores gastrointestinales) y GOLCA6L2. El mecanismo de tumorigénesis en el FL-CHC ha sido un misterio desde su identificación inicial en 1956; sin embargo, se han logrado avances importantes tras el descubrimiento de la mutación DNAJB1-PRKACA hecho por Honeyman et al.11 en 2014. La prevalencia de esta mutación en prácticamente todas las muestras de FL-HCC, junto con un genoma relativamente estable, sugiere fuertemente que la proteína de fusión es un impulsor primario de este tipo de cáncer10. Su presencia es mayor en adultos jóvenes con edad media de presentación a los 25 años, sin diferencia de género y con marcadores tumorales negativos; además, es responsable de hasta el 9 % de los tumores hepáticos con compromiso del 66 % del lóbulo hepático izquierdo y con descripción de asociación con hiperamonemia5,12,13.
En el proceso de entender la fisiopatología de la hiperamonemia, el FL-HCC se relaciona con el efecto de una lesión hepática hipervascular grande con presencia de shunt que disminuye el aclaramiento de productos nitrogenados8,12. En la presentación del caso reportado se observa una masa con gran ocupación del lóbulo hepático derecho y presencia de oclusión venosa como causa de hiperamonemia debido a shunt portosistémico, lo cual se evidenció al descartarse las otras etiologías y al evidenciarse la mejoría luego del trasplante hepático.
Dentro de las terapias para hiperamonemia se incluye tratamiento de presión intracraneal con manitol, hiperventilación e inducción de hipotermia; además, para el control de la producción endógena de amonio se usa lactulosa, dieta, antibióticos y limitación de la actividad muscular, y para su eliminación se emplea diálisis, benzoato de sodio y LOLA, suplemento de sustratos de ciclo de la urea con arginina y L- carnitina, y, por última, instancia el trasplante hepático9,13. La hiperamonemia es una de las indicaciones de diálisis no renal, y puede ser usada como de primera línea cuando los niveles de amonio son >500 µg/dL, pero también puede ser utilizada en valores entre 250 µg/dL y 500 µg/dL si la terapia médica no está disponible o si el paciente presenta refractariedad al mismo, pudiendo ser suspendida cuando se alcancen valores <200 µg/dL. Este tratamiento puede ser reforzado con la administración de arginina5.
Conclusión
Se presenta un caso raro de un FL-CHC que generó hiperamonemia severa asociada a encefalopatía. En el primer abordaje se realizaron estudios metabólicos y test de errores innatos de ciclo de urea que resultaron normales. Posteriormente se documentó la presencia de lesión hipervascular que condicionaba la compresión venosa llevando a un shunt portosistémico responsable de la refractariedad al manejo médico, el cual se resolvió con diálisis y tratamiento quirúrgico consistente en trasplante hepático.
Consideraciones éticas
Los autores declaran que los procedimientos seguidos se realizaron conforme a las normas éticas del comité de experimentación humana responsable y de acuerdo con lo establecido por la Asociación Médica Mundial en la Declaración de Helsinki; que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes, y que han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo.