Introducción
La toxoplasmosis es una enfermedad causada por el parásito Toxoplasma gondii que infecta a humanos y otros animales de sangre caliente en todo el mundo, y cuya prevalencia y gravedad clínica varían según el área geográfica1 - 3. De igual forma, Fernández-Sabé et al.4 afirman que la prevalencia global de esta zoonosis en pacientes con trasplante de órganos sólidos es de 0,14 %, siendo para trasplante cardiaco del 54,5 %, para trasplante renal del 27,2 % y para trasplante hepático del 18,2 %. En dicho estudio los autores también encontraron que la enfermedad diseminada se documentó en el 22,7 % de los casos y que la tasa de mortalidad bruta fue del 13,6 % (3 de 22 pacientes)4. Después de la infección primaria, el parásito persiste toda la vida dentro de los quistes de tejido latente. La transmisión a los humanos ocurre principalmente por la ingestión de alimentos o agua contaminada con ooquistes de heces de felinos infectados o quistes presentes en la carne poco cocida5.
Aunque en la mayoría de los casos la toxoplasmosis es asintomática, esta es una infección oportunista potencialmente mortal en pacientes inmunocomprometidos de todas las edades. Similar a la neumonía por Pneumocystis, la toxoplasmosis se diagnostica con mayor frecuencia en pacientes con VIH que reciben terapia inmunosupresora6 , 7; sin embargo, los pacientes con trasplantes también son una población de alto riesgo para contraer esta enfermedad.
En los receptores de trasplante, tanto de órgano sólido como de células madre hematopoyéticas, la toxoplasmosis puede ser el resultado de la reactivación de una infección latente pasada o de una infección primaria adquirida a través de alimentos contaminados o de un órgano trasplantado que contiene quistes latentes8. Contrario a lo que sucede con la incidencia en pacientes infectados por el VIH, la incidencia de toxoplasmosis entre los receptores de trasplantes está poco documentada y los estudios publicados que informan series de pacientes son escasos9 - 11, además la literatura consiste principalmente en reportes de casos.
Teniendo en cuenta lo anterior, la profilaxis y el seguimiento cuidadoso son indispensables para la supervivencia de pacientes con trasplante de órgano sólido y toxoplasmosis12.
Presentación del caso
Se presenta el caso de un paciente masculino de 29 años, con antecedente de diabetes mellitus tipo 1, con enfermedad renal crónica estadio 5 secundaria a enfermedad renal diabética que requirió de trasplante renal de donante vivo en el año 2000 y en tratamiento inmunosupresor con prednisolona, tacrolimus y micofenolato desde dicho procedimiento, quien ingresó al servicio de urgencia de una institución de cuarto nivel por crisis epiléptica focal con generalización secundaria.
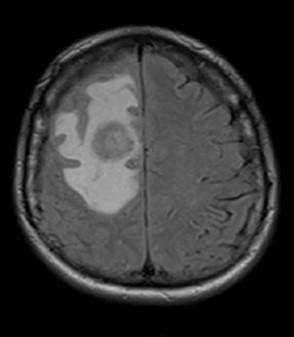
Se realizó una tomografía axial computarizada de cráneo simple que mostro área hipodensa con gran edema en región frontal derecha sin efecto de masa. De igual forma, se practicó una resonancia magnética nuclear cerebral que evidenció una pequeña lesión nodular aislada en cabeza del núcleo caudado izquierdo y cortico subcortical frontal derecha rodeada por importante edema vasogénico condicionando herniación subfalcina que en el contexto clínico podría representar neuroinfección (Figura 1). También se realizó prueba de anticuerpos IgG y se encontró toxoplasma IgG: 942 (0-10 Ui/ml) y IgM: 6,4 (índice de cut off >0,865) (Tabla 1).
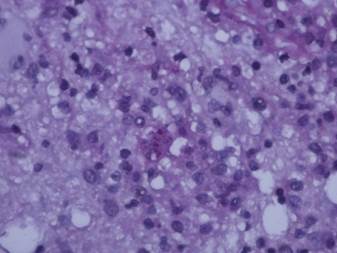
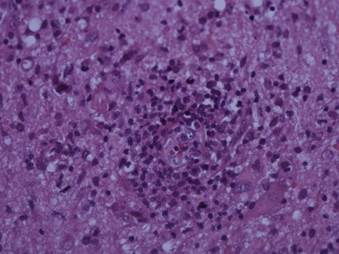
El paciente fue valorado por el servicio de neurocirugía, el cual ordenó la resección de una lesión ocupante de espacio con alta sospecha de neoplasia primaria del sistema nervioso central. Durante dicho procedimiento se extrajo una masa de aspecto granulomatoso localizada hacia la línea media con plano de clivaje mal definido y edema adyacente con extensión al ventrículo derecho, la cual fue enviada a estudio histopatológico, en donde se estableció compatibilidad con toxoplasmosis cerebral (Figura 2 y Figura 3). Dados los hallazgos, se instauró tratamiento con trimetropim/sulfametoxazol endovenoso por 10 días, logrando mejoría clínica de los síntomas neurológicos.
Discusión
El enfoque diagnóstico de la toxoplasmosis cerebral en pacientes inmunocomprometidos es un reto clínico debido a la gran variabilidad de signos y síntomas asociados en esta población y a la alta frecuencia de complicaciones, lo cual puede confundir el diagnostico.
En la literatura está registrado que, de 20 pacientes inmunocomprometidos en contacto con toxoplasma, solo en dos se desarrolla toxoplasmosis cerebral, un evento raro que complica la inmunosupresión después del trasplante renal 13. Las manifestaciones y los resultados de los laboratorios en pacientes con toxoplasmosis cerebral son inespecíficos, además puede coexistir infección con otros organismos oportunistas, lo que a su vez puede enmascarar un cuadro de rechazo agudo 14, 15. Sin embargo, la fiebre es el síntoma más común y temprano, seguido del compromiso pulmonar, neurológico y, en menor frecuencia, hematológico con leucopenia y trombocitopenia 16.
Fuente: documento obtenido durante la realización del estudio
Figura 1 T2 resonancia magnética nuclear cerebral corte transversal.
Fuente: documento obtenido durante la realización del estudio.
Figura 2 Estructuras granulares que parecen corresponder a trofozoitos de tooplasma.
Fuente: documento obtenido durante la realización del estudio.
Figura 3 Acúmulos de células linfocíticas y neutrófilos en espacios de Virchow-robin que muestran los efectos de neuroinfección.
El presente reporte describe cómo se realizó el enfoque diagnóstico de un caso de toxoplasmosis en un paciente trasplantado renal que presentó síntomas neurológicos, y en el que si bien las imágenes ayudaron a establecer un diagnostico preliminar y la serología correspondió con este diagnóstico, fue necesario realizar biopsias excisionales para descartar coexistencias de otras lesiones neoplásicas. La serología sigue siendo una de las principales ayudas diagnósticas7, tal como ocurrió en el paciente reportado, quien tuvo IgM e IgG positivas, lo que permitió confirmar el diagnostico sin realuzar prueba RT-PCR para T. gondii, e instaurar un tratamiento para evitar progresión y complicaciones.
A pesar del riesgo relacionado con la reactivación endógena o el trasplante de un órgano que contiene quistes, las políticas de prevención parecen heterogéneas alrededor del mundo; por ejemplo, la detección serológica de donantes de órganos para detectar T. gondii, aunque no es obligatoria en todos los países, parece ser una práctica general, probablemente como resultado de las recomendaciones de las sociedades nacionales de trasplante.
Por otra parte, las prácticas de manejo con respecto a la quimioprofilaxis basada en los resultados serológicos del donante y del receptor varían sustancialmente, en particular para los pacientes con trasplante de riñón e hígado. De hecho, en el estudio de Chehrazi-Raffle et al.17 solo 35 (50 %) de 70 receptores habían recibido quimioprofilaxis, aunque estaba indicado, y solo 4 (36 %) de 11 pacientes con trasplante de órganos sólido con resultados serológicos D + / R- habían recibido quimioprofilaxis; estos 4 pacientes estaban vivos 6 meses después del trasplante. Los datos anteriores hablan de la heterogeneidad de la quimioplrofilaxis en los pacientes trasplantados renales, además es importante mencionar que se desconoce la prevalencia de toxoplasmosis cerebral en esta población.
El diagnóstico de toxoplasmosis en enfermos inmunosuprimidos no-sida puede ser difícil de realizar; de hecho, en el 30 % de los casos de esta entidad en pacientes con trasplante renal e inmunodeprimidos con lesiones cerebrales se diagnostica en la autopsia. Las principales causas de esta enfermedad son infecciosas o neoplásicas, siendo los organismos causantes más frecuentes Aspergillus, Nocardia, Cryptococcus, Listeria, Tuberculosis y Toxoplasma5.
Conclusiones
La toxoplasmosis después del trasplante renal se asocia con una alta mortalidad (65 % de los receptores)14,18, lo que puede deberse tanto a la falta de conocimiento clínico, como a las dificultades para confirmar el diagnóstico. Los síntomas de esta enfermedad suelen ser inespecíficos, pero los pacientes generalmente presentan trastornos neurológicos o neumonitis; los síntomas y signos constitucionales como fiebre y malestar general son variables. Aunque no es común, los pacientes también pueden desarrollar coriorretinitis, miocarditis, anemia hemolítica y pancitopenia relacionada con hemofagocitosis19,20.
Durante la toxoplasmosis, la infección concomitante con otro patógeno es común y puede aumentar la confusión diagnóstica18, por lo que las pruebas de diagnóstico incluyen serología, aislamiento del parásito de los tejidos infectados y amplificación de ácido nucleico por PCR. Sin embargo, los títulos de anticuerpos pueden ser difíciles de identificar en pacientes inmunocomprometidos y la interpretación correcta de las pruebas de PCR es dificultosa debido a los diferentes resultados de sensibilidad y especificidad informados por los laboratorios que usan las mismas sondas21. Por lo tanto, el diagnóstico de toxoplasmosis requiere un alto índice de sospecha, ya que el reconocimiento rápido y el tratamiento temprano son clave para aumentar la supervivencia del paciente.
Consideraciones éticas
Los autores declaran que los procedimientos seguidos se realizaron conforme a las normas éticas del comité de experimentación humana responsable y de acuerdo con lo establecido por la Asociación Médica Mundial en la Declaración de Helsinki; que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes, y que han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo.