Introducción
La enfermedad renal crónica (ERC) es un síndrome caracterizado por anomalías renales persistentes a nivel estructural o funcional, con implicaciones para la salud del individuo1. El término uremia describe la enfermedad que acompaña a la insuficiencia renal debido a la acumulación de productos de desecho orgánicos que normalmente son eliminados por los riñones, toxinas urémicas, con una variada producción de signos y síntomas2. La urgencia dialítica se presenta en pacientes con enfermedad renal aguda y crónica que requieren del pronto inicio de terapia renal sustitutiva como única opción de tratamiento, ya que presentan trastornos en el volumen extracelular, cambios en las concentraciones de iones inorgánicos o alteraciones del equilibrio ácido-base que amenazan la vida3. La ERC compromete significativamente la fisiología del sistema hemostático4-8con la coexistencia de dualidad hemorragia-trombosis, cuya severidad depende del estadio evolutivo de la ERC.
En la actualidad, no hay estudios que indiquen la frecuencia de presentación de la urgencia dialítica. Según el US Renal Data System (USRDS) para el 2012, 114.813 pacientes se diagnosticaron con enfermedad renal terminal, de los cuales al 97,3 % se les inició algún tipo de diálisis9. Para Colombia, los datos de la Cuenta de Alto Costo (CAC) reportan, para el 2017, 37.409 casos de ERC estadio 5, con una prevalencia de 76 casos/100.000 habitantes y una incidencia ajustada por la edad de ocho casos/100.000 habitantes. En los 3.930 casos nuevos reportados para el 2017, el 94,6 % de ellos estaba recibiendo algún tipo de terapia de reemplazo renal, de los cuales 57 % estaban en hemodiálisis (HD), 31 % en diálisis peritoneal (DP) y seis personas recibieron trasplante10.
Para el inicio de diálisis por urgencia dialítica es necesario el implante de catéteres con alto riesgo de complicaciones trombo-hemorrágicas. No existen investigaciones simples para evaluar la hemostasia alterada en pacientes con enfermedad renal11,12. Por tanto, el uso de ensayos globales de la coagulación como la tromboelastografía (TEG) como prueba enfocada en la cabecera del paciente (point-of-care o POC) podría direccionar el uso de medidas preventivas (por ej. desmopresina, hemoderivados) con el objetivo de disminuir riesgos. Hasta el momento, no hemos encontrado en Colombia ningún estudio sobre el uso de TEG en ERC y urgencia dialítica. El objetivo del presente trabajo es describir los trastornos de la coagulación más frecuentes en este grupo de pacientes por medio de TEG y pruebas tradicionales.
Materiales y métodos
Se desarrolla una serie de casos de adultos mayores de 18 años que ingresaron al Hospital San José de Bogotá, entre el 01 de junio del 2013 y el 31 de enero del 2017. Los criterios de inclusión fueron el requerimiento de diálisis en los siguientes escenarios: ERC estadio 5, lesión renal aguda KDIGO 3 o ERC con lesión renal aguda sobreagregada. Los criterios de exclusión fueron el uso de más de dos antiagregantes y de anticoagulantes durante los últimos siete días; aquellos con diagnóstico de alteración primaria o déficits congénitos de la coagulación, sangrado de causa médica o quirúrgica, previo al ingreso de etiología y claramente diferente al origen urémico en los últimos siete días; presencia de infección activa que cursara con patología oncológica y que no produjera obstrucción de vías urinarias; aquellos a los que no se les realizó TEG y a los que no se les realizaron los estudios requeridos.
Previo al implante de catéter e inicio de diálisis, a cada paciente se le realizó hemograma de 4ta generación, tiempo de tromboplastina parcial (aPTT), tiempo de protrombina (PT), BUN, creatinina y tiempo de sangría por método de Ivy13. Para la TEG se tomaron muestras de sangre venosa con citrato sodio 3,2 % 1:9 y fueron procesadas en un TEG®5000 Haemoscope Corporation, IL, USA, en un tiempo inferior a 90 minutos desde la toma de prueba. Previa reversión de anticoagulación de la muestra con ClCa 0,2M y usando como activador kaolín, se introdujeron 0,36 cc de la muestra a 37 °C en una copa la cual oscila 4° 45” cada 4,5 segundos sobre un pin que a su vez se encuentra unido a un cable de torsión. A medida que la sangre se coagula, se modifica la resistencia del pin, siendo esto registrado por un transductor electromecánico, lo cual documenta en un trazado las distintas etapas de la coagulación.
De acuerdo con los resultados de TEG y por decisión del nefrólogo tratante, se determinó la aplicación de hemoderivados o desmopresina. Posteriormente, se llevaron a implante de catéter de HD o catéter de DP. Se describieron complicaciones trombóticas y hemorrágicas durante la hospitalización.
Definición de variables
En la TEG se evaluaron los siguientes parámetros: tiempo de reacción (R), tiempo de formación (K), velocidad de formación (ángulo alfa-α), máxima amplitud (MA), porcentaje de lisis a los 30 minutos (LY30), parámetro G (máxima firmeza) e índice de coagulación global (IC). Los valores de referencia son definidos por el fabricante: R de cinco a diez minutos, K de uno a tres minutos, ángulo-α de 53 a 72 º, MA de 50 a 70 mm, LY30 de 0 a 8 %, G de 4,5 a 11 dinas/seg e IC de -3 hasta +3.
Los resultados de TEG se valoraron en forma individual y global. En la valoración individual los parámetros se consideraron normales, elevados o disminuídos según los rangos de referencia y se interpretaron según las fases de la hemostasia representadas. En la interpretación global del trazado de TEG se realizó una valoración visual y en conjunto de todos los parámetros; se consideraba normal cuando todas y cada una de las variables estaban en los rangos de referencia. El trazado hipercoagulable se definió cuando dos o más parámetros estaban alterados en el sentido de la hipercoagulabilidad: tiempo R y tiempo K cortos, ángulo-α y MA aumentados. El trazado hipocoagulable se definió con dos o más parámetros alterados en el sentido de la hipocoagulabilidad: tiempo R y tiempo K prolongados, ángulo-α y MA disminuidos14. La hiperfibrinolisis se definió con LY30 > 8 %.
El conteo plaquetario se consideró normal entre 150.000 y 450.000 cels/mm3. Se definió anemia con hemoglobina (Hb) < 10 g/dl. Los tiempos de coagulación se consideraron normales cuando eran de hasta cinco segundos por encima o por debajo del valor control del día. El valor normal del tiempo de sangría comprendía entre tres y nueve minutos según el valor de referencia del laboratorio de la institución.
Análisis estadístico
Se construyó una base de datos en Excel 2007. El análisis estadístico se realizó en STATA12. La normalidad de los datos se comprobó a través de la prueba de Shapiro-Wilk. Las variables cualitativas se analizaron con frecuencias absolutas y relativas. Se calculó la correlación de las variables tiempo R con el aPTT y recuento plaquetario con MA, mediante el coeficiente de correlación de Spearman.
Consideraciones éticas
El estudio fue aprobado por el comité de ética de investigación en seres humanos de la Fundación Universitaria Ciencias de la Salud (FUCS) y del Hospital San José. Es una investigación sin riesgo ya que solo se emplean técnicas y métodos de investigación documental sin ninguna intervención o modificación intencionada de los individuos que participan en el estudio. Todas las medidas tomadas en los pacientes hacen parte del manejo institucional para dicha patología y no requirió toma de muestras adicionales.
Resultados
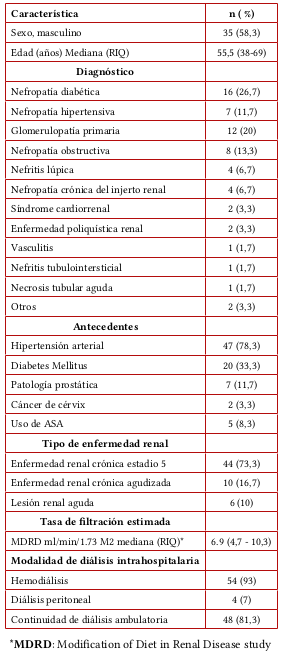
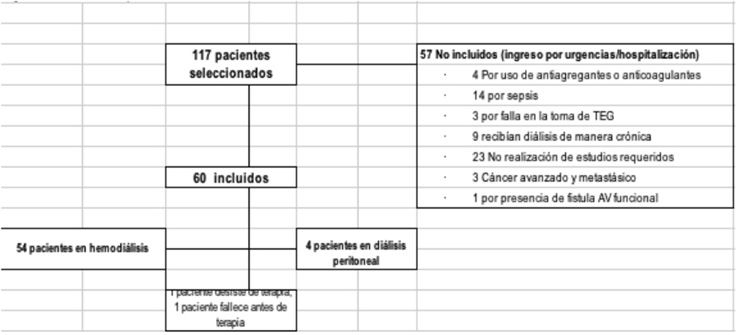
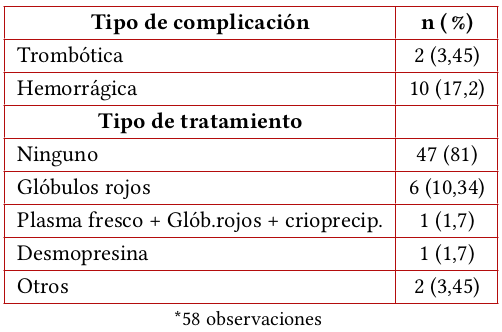
De los 117 pacientes elegibles, 60 cumplieron criterios de inclusión (figura 1). El 58,3 % eran hombres. La mediana de edad fue de 55,5 años (RIQ 38-69), la etiología más frecuente de ERC fue nefropatía diabética en 26,7% de los casos. El diagnóstico con indicación de diálisis más frecuente fue ERC estadio 5 (73,3 %). Previa consecución de acceso, 93 % de los casos iniciaron terapia dialítica en HD y 7 % en DP. De los 58 pacientes que iniciaron terapia dialítica, seis fallecieron en la estancia hospitalaria. A los 30 días pos-hospitalización, 48 pacientes continuaban en terapia dialítica en la Unidad Renal Hospital San José (cuatro casos fueron enviados a otra unidad renal ambulatoria) (tabla 1). Dos pacientes contribuyeron con datos clínicos y de TEG pero no recibieron diálisis (un caso por desistimiento, un caso por fallecimiento) (figura 1).
El 60 % de los pacientes cursaba con anemia, con mediana de Hb de 9,15 g/dl (RIQ 7,6-11,05). El conteo plaquetario estuvo en rangos de normalidad en el 90 % y presentó trombocitopenia en 6,6 % de los casos. El PT fue normal en toda la población. El aPTT fue normal en el 71 % y prolongado en 23,7 % de los casos. La mediana del tiempo de sangría fue 5,58 minutos (RIQ 4,07-9) estando prolongado en el 20,9 % de los casos (tabla 2).
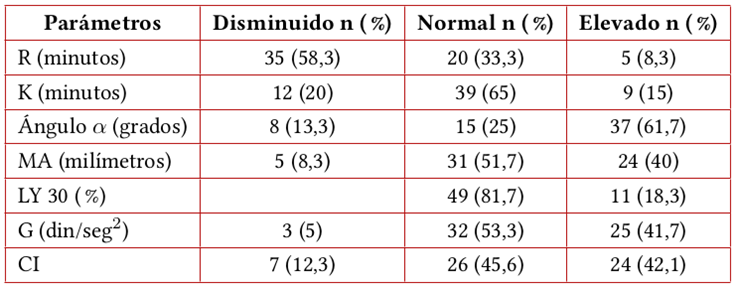
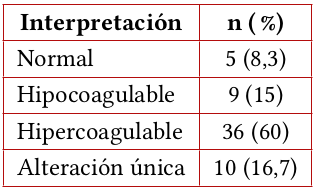
En el análisis individual de variables de TEG se encontró que el parámetro con mayor alteración fue el ángulo-α, seguido por el tiempo R. La inclinación del ángulo-α estaba aumentada en 61,7 % de los casos. El tiempo R estaba acortado en 58,3 % y prolongado en 8,3 %, siendo normal en 33 %. Los parámetros MA y G se encontraron elevados en 40 % y 41,7 %, respectivamente, y estaban en rangos de normalidad en 51,7 % y 53,3 %. El parámetro LY30 era normal en 81,7 % de los casos (tablas 2 y 3). En el análisis global del trazado de TEG, el 60 % de los casos fue interpretado como hipercoagulable, seguido del 15 % como hipocoagulable y solo 8,3% como normal. En el 16,7% de los trazados de TEG se encontraron alteraciones en un solo parámetro (tabla 4).
Dos pacientes presentaron complicaciones trombóticas que fueron fatales (uno por infarto agudo de miocardio fatal y el otro por hipertensión endocraneana secundaria a ACV isquémico masivo, en territorio de arteria cerebral media izquierda). En el primer caso la TEG indicó hipocoagulabilidad; en el segundo caso hipercoagulabilidad. No se describieron trombosis del acceso vascular.
Tabla 2 Características de los paraclínicos y frecuencia de sus alteraciones
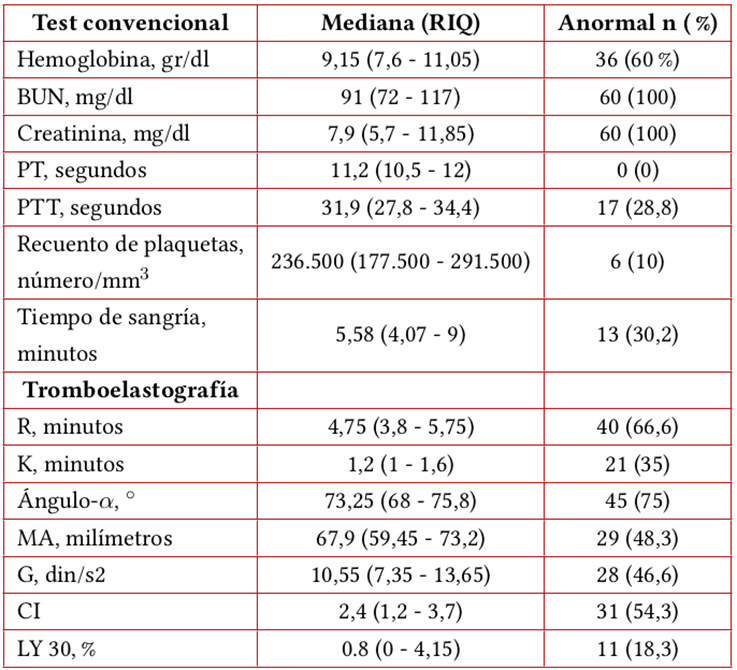
Fuente: elaboración propia.
Las complicaciones hemorrágicas observadas fueron menores en la mayoría de los casos, obedeciendo a sangrado no severo por el sitio de inserción del catéter que cede con medios físicos y compresión local. En 10 casos se presentaron complicaciones hemorrágicas relevantes con trazados indicativos de hipercoagulabilidad en siete de ellos. Se usaron hemoderivados en siete de estos 10 casos (glóbulos rojos en seis casos y politrasfusional en uno), y en un caso se usó desmopresina. En tres casos las complicaciones hemorrágicas implicaron intervención quirúrgica adicional (taponamiento pericárdico por pericarditis urémica, hemoneumotórax posterior a implante de dispositivo intravascular de hemodiálisis, y hematoma expansivo cervical posterior a implante de dispositivo intravascular de hemodiálisis). En dos de estos tres casos la TEG indicaba hipercoagulabilidad.
Se encontró que en los pacientes que tuvieron sangrado, la mediana de BUN era mayor (106,5 mg/dl) a la mediana de BUN de los que no presentaron sangrado (96 mg/dl). Así mismo, en los pacientes que tuvieron sangrado, la mediana de Hb era menor (8,8 g/dl) a la mediana de aquellos pacientes que no tuvieron sangrado (9,4 g/dl). No se logró demostrar correlación entre la presentación de sangrados con el valor de tiempo de sangría. No se logró demostrar correlación entre el análisis global del trazado de TEG con la presencia o no de complicaciones.
Se exploró el grado de correlación entre aPTT y el tiempo R, y entre recuento de plaquetas y MA, pero no se halló correlación (coeficiente de correlación rho de Spearman: 0,05 y 0,25 respectivamente).
Discusión
Este es un estudio descriptivo de serie de casos en pacientes con ERC con indicación de diálisis urgente, en quienes se evaluó el estado hemostático con pruebas convencionales y TEG previo al implante del catéter vascular o peritoneal.
En la disfunción hemostática urémica11,12,15,16,17,18,19,20,21,22se describe normalidad en los tiempos de coagulación12,23y el recuento plaquetario suele presentar trombocitopenia, la cual es leve15. No existe una buena correlación entre los azoados y el sangrado clínico21. En nuestro estudio se encontró que el PT fue normal en toda la población, el aPTT estaba prolongado en 23,7 % de los casos y se presentó trombocitopenia en 6,6 % de los casos (ningún paciente con plaquetas <100.000/mm3). El tiempo de sangría ha sido considerado el mejor test de laboratorio para predecir el sangrado clínico causado por la uremia15,21,24, estando prolongado en la mayoría de los pacientes urémicos16,17. Es un test con alta variabilidad y pobre reproducibilidad, siendo afectado por factores que involucran la hemostasia primaria, y por factores como la calidad y la temperatura de la piel11,25.
En nuestro estudio, la mediana del tiempo de sangría fue de 5,58 minutos, estando prolongado solo en el 20,9 % de los casos. No se logró demostrar correlación entre la presentación de sangrados con el valor de tiempo de sangría.
Se encontraron diferencias en los valores medidos de BUN y Hb en aquellos pacientes que sangraron con los que no, estando más alterados en el primer grupo, confirmando observaciones previas en las que se asocia la presencia de sangrado a mayor severidad de la uremia, pero siempre con una naturaleza multifactorial (desnutrición, presencia y grado de anemia, severidad de la instauración de la ERC, medicaciones, experticia médica para procedimientos invasivos, etc.).
La posible solución para la evaluación de las complejas alteraciones de la hemostasia en la ERC podrían ser los ensayos globales de coagulación como la TEG23,26. La TEG es una prueba que mide las propiedades viscoelásticas del coágulo, en forma global y dinámica, proporcionando información en tiempo real sobre la integridad de la cascada de la coagulación, la función plaquetaria, las interacciones plaquetas-fibrina y la fibrinolisis27,28,29,30,31. Su aplicación es cada vez mayor en diversos campos clínicos como ensayo POC32.
En una revisión sistemática Cochrane33 se evaluó el riesgo-beneficio de la trasfusión guiada por test viscoelásticos (TEG®/(ROTEM®) en comparación a la trasfusión guiada por cualquier otro método, encontrando que el uso de estos test parece reducir la mortalidad general y la proporción de pacientes trasfundidos. Es de anotar la ausencia de datos provenientes de pacientes con ERC estadio 5. La TEG ha revelado hipercoagulabilidad en varios grupos de pacientes: cáncer de próstata, cáncer de mama, cáncer colorrectal, tumores del sistema respiratorio, tromboembolismo venoso y embarazo26. En una revisión sistemática de la literatura sobre la posibilidad de predecir la trombosis con TEG, la sensibilidad y la especificidad variaron entre 0 % y 100 % y entre 62 % y 92 %, respectivamente, con OR reportados entre 1,5 y 27,7, lo que impidió el metanálisis34. A pesar de tan notables ventajas y potenciales aplicaciones, el uso de la TEG fuera de los escenarios de cirugía cardíaca y trasplante hepático está limitado por la falta de estandarización28,35.
Realizamos una interpretación de los parámetros de TEG en forma individual y global14,28. Se encontraron alteraciones en todas las fases del trazado, estando la alteración más frecuente en la fase enzimática, revelando acortamiento y aceleración tanto en la iniciación como en la potenciación de los factores enzimáticos para el fortalecimiento del coágulo, a través de polimerización del fibrinógeno disponible. Las alteraciones en la fuerza global del coágulo también estuvieron presentes reflejando que la unión plaquetaria a la fibrina formada sugiere estar normal o alterada en el sentido de hiperactivación-hiperagregabilidad plaquetarias. En la valoración global del trazado de TEG describimos el estado hipercoagulable como la alteración más frecuente, con resultados similares a los reportados por Holloway, Nunns y Meier36,37,38. La hiperfibrinolisis fue el hallazgo más infrecuente.
Holloway et al.36 analizaron muestras de TEG en sangre total y activada por celita de 23 sujetos con ERC avanzada, encontrando trazados con tiempos R normales, pero valores de ángulo-α y MA elevados, a pesar de tiempos de sangría prolongados. Nunns et al.37 analizaron muestras de rapid-TEG en sangre total de 84 sujetos con ERC (estadios 3, 4 y 5 en terapia dialítica que iban a construcción de fístula), encontrando ángulo-α y MA elevados indicativos de hipercoagulabilidad, siendo esta diferencia más notable para los pacientes que no estaban en diálisis. Por el contrario, Darlington et al.39 evaluaron 70 pacientes con ERC estadio 5 en HD a través de catéter tunelizado, a quienes se les realizó TEG en muestra citratada activada por kaolín, con sujetos con enfermedad arterial coronaria como controles. Los valores de R fueron más altos en pacientes con ERC sin diferencias en MA. En esta cohorte de pacientes, el 70 % tenían al menos una anomalía en el trazado, siendo el trastorno más frecuente el estado hipocoagulable (definido por tiempo R prolongado) en 42,9 % de ellos.
El estado hipercoagulable puede ser inducido por las comorbilidades como la diabetes mellitus36. También puede explicarse porque se grafica un comportamiento in vitro, el cual no necesariamente se manifiesta clínicamente. La diferencia entre la hemostasia in vivo y la coagulación in vitro en la copa de TEG es la ausencia de pared vascular, por ende, la TEG “no ve” la endoteliopatía de la ERC36,37. Esto puede llevar a una sobreestimación de la trombosis, ya que la unión de la plaqueta a la pared vascular puede reducirse debido a la disminución de la unión de la plaqueta al fvW (factor vonWillebrand), o alternativamente haber una subestimación si hay daño endotelial y aumento de la activación plaquetaria37. Otra posibilidad es que la hipercoagulabilidad y la mayor firmeza de coágulo, vistas en la TEG de sujetos urémicos, sea compensatoria a la disfunción de la interacción plaqueta-pared vascular37,38, lo que se apoyaría en mecanismos como la hiperfibrinogenemia (ello explicaría la alta frecuencia del ángulo-α elevado encontrado) y la hiperagregabilidad plaquetaria.
El uso de TEG en la ERC no es nuevo. Se ha usado en la valoración de hipercoagulabilidad de enfermedades glomerulares vinculadas a mayor riesgo de tromboembolismo venoso como la glomerulopatía membranosa40,41. En relación al uso de TEG en ERC avanzada, los datos existentes en la literatura son escasos con poblaciones que no son comparables a la nuestra por varias razones: uso de una definición abarcativa no reproducible de ERC (ERC definida por filtración glomerular < 90 cc/min por Cockroft-Gault38); poblaciones con ERC no avanzada42; pacientes prevalentes en terapia dialítica o portadores de catéter de HD que van a construcción de acceso vascular definitivo36,37,39,43; diferencias en el tipo de muestra, activador o tipo de ensayo de TEG realizado36,37,43; interpretaciones no reproducibles de los trazados (hipocoagulabilidad definida por único parámetro -tiempo R prolongado-, concepto de hiperagregabilidad en TEG estándar activado por kaolín39) y uso de controles no sanos39.
Al igual que con todos los ensayos globales, es difícil compararlos a las pruebas de laboratorio estándar. En un estudio de correlación de TEG con test convencionales, se encontró como la correlación más significativa a la existente entre MA y fibrinógeno en población normal (R de correlación por Pearson 0,380) y entre MA con conteo plaquetario y MA con concentración de fibrinógeno en una población hipercoagulable (R de correlación por Pearson 0,357 y 0,412, respectivamente). También se describe una correlación significativa entre aPTT y el tiempo R (r = 0,49)30,31. Como se pueden observar, los datos reportados en la literatura de correlación son bajos. En nuestro estudio no encontramos correlación entre parámetros del TEG con test convencionales; tampoco logramos establecer una correlación del análisis global de TEG con eventos clínicos, dado que el hallazgo más frecuente fue el estado hipercoagulable y los eventos fueron en su mayoría hemorrágicos (10 pacientes con complicaciones hemorrágicas, de los cuales siete cursaron con TEG hipercoagulable, uno de ellos con TEG hipocoagulable, y dos pacientes con complicaciones trombóticas, uno de ellos con TEG hipercoagulable).
Por último, Chapman et al.43 establecen una reflexión sobre los patrones tromboelastográficos complejos. Analizaron los trazados de rapid-TEG de pacientes con ERC estadio 5 que iban a construcción de acceso de HD y pacientes con politraumatismo que requirieron transfusión masiva, buscando realizar una categorización taxonómica para la interpretación de TEG algorítmica y como base para la creación de un futuro software de soporte de decisiones clínicas para ensayos viscoelásticos en pacientes con múltiples problemas médico-quirúrgicos.
Los resultados de la TEG en este estudio evidencian un patrón global de hipercoagulabilidad en la mayoría de los pacientes, que es explicado en mayor proporción por alteraciones en la fase enzimática más que en la fase celular, postulando una hipótesis alterna a lo que tradicionalmente ha sido descrito en la fisiopatología.
Este estudio aporta un significativo número de casos con el común denominador de estar en urgencia dialítica, el cual es un escenario frecuente en nuestros servicios de urgencias, con alto riesgo de complicaciones clínicas y con pocos datos descritos en la literatura. Asimismo, se enfatiza el análisis de los trazados de TEG en forma individual y global, así como las precisiones sobre el tipo de TEG realizada, tipo de muestra y activador usados que son igualmente importantes44. Por otra parte, la alta exclusión impide la generalización de sus resultados, toda vez que algunas exclusiones no necesariamente implican ausencia de aspectos de coagulopatía por uremia (por ejemplo: uso de anticoagulantes y antiagregantes o paciente con infección).
El corto seguimiento impidió la descripción de complicaciones tales como la trombosis del acceso vascular, así como la posibilidad de poder establecer correlaciones entre el análisis global del trazado de TEG con los eventos clínicos (por ejemplo: trazado hipocoagulable y desenlaces adversos). No contamos con controles sanos por edad y género, lo cual deberá ser tenido en cuenta para futuras publicaciones sobre TEG en ERC, dada la no estandarización de la prueba. A pesar de las estrategias empleadas para la recolección, quedaron 23 pacientes excluidos, a los cuales no se les realizó TEG, ni otros estudios necesarios para la inclusión al estudio, ya que no fueron captados por nuestro servicio por diferentes razones.
El uso correcto y la aplicación continua de la TEG en los distintos escenarios de la práctica clínica diaria de la nefrología en nuestra institución, así como la articulación con nuevas tecnologías (TEG6s)45 y estudios con mayor fortaleza epidemiológica, nos permitirán establecer a la TEG como prueba enfocada en el POC en la valoración de la hemostasia en la ERC.