Introducción
El trasplante renal es la mejor opción terapéutica para el tratamiento de la enfermedad renal crónica terminal. De acuerdo con el USRDS (United States Renal Data System), los trasplantados presentan una menor mortalidad que los que permanecen en diálisis. En Estados Unidos para el año 2015, la tasa ajustada de mortalidad para diálisis fue de 166/1000 pacientes/año y para trasplante renal fue de 29/1000 pacientes/año (1); además, se ofrece mejor calidad de vida y es más eficiente(2, 3); sin embargo, a los 10 años de trasplante con donante cadavérico, la probabilidad de pérdida del injerto es de 52,4 %, de retorno a diálisis es de 33,4 % y de muerte es de 36,5 % y con donante vivo es de 38,4 %, 25,1 % y de 22,2 % respectivamente (4).
En una cohorte retrospectiva de 1317 pacientes con trasplante renal, Zoghby et al. (5) describieron 330 (25 %) injertos perdidos. La muerte con injerto funcionante y la no función primaria del injerto representaron el 53 % de los casos y entre los 153 restantes: 37 % de los casos fue atribuible a enfermedad glomerular de novo o recurrente, 31 % a fibrosis intersticial/atrofia tubular (IF/TA, interstitial fibrosis and tubular atrophy) (asociada a nefropatía por polioma, rechazo agudo recurrente, pielonefritis recurrente, pobre calidad del injerto, estenosis ureteral y toxicidad por anticalcineurínicos), 16 % a complicaciones médicas o quirúrgicas, 12 % a rechazo agudo y 5 % de causa desconocida.
De acuerdo con el consenso español de disfunción renal en el paciente con trasplante renal, la disfunción crónica del injerto es: “la culminación de un deterioro progresivo de origen multifactorial, caracterizado por un descenso de la tasa de filtración glomerular (TFG) y la presencia de IF/TA, pero pueden verse otros tipos de lesiones, ninguna específica. Es un diagnóstico de exclusión” (6). En la figura 1 se encuentran los principales factores relacionados con la pérdida del injerto, describiendo algunos de riesgo pretrasplante y eventos agudos (aparición temprana con deterioro rápido de la TFG) y crónicos (aparición tardía con deterioro lento de la TFG). La intervención de estos factores de riesgo permitiría aumentar la sobrevida del injerto.
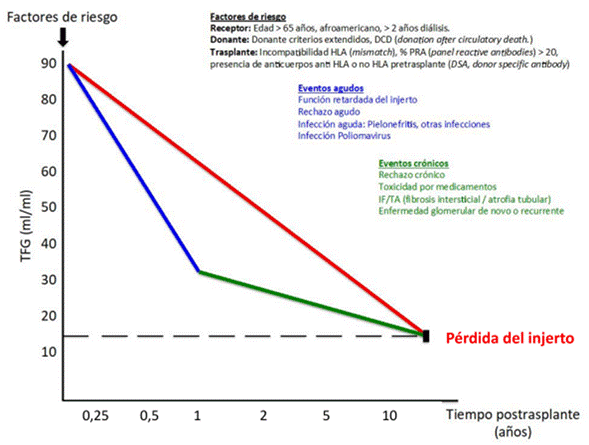
Notas aclaratorias: los eventos agudos se suelen presentar temprano, generando un deterioro rápido de la TFG (color azul); los eventos crónicos se suelen presentar tarde, generando un deterioro lento de la TFG (color verde) y la combinación de ambos tipos de evento lleva a la pérdida del injerto (color rojo).
Fuente: elaboración propia.
Figura 1 Factores de riesgo, eventos agudos y crónicos relacionados con disfunción crónica del injerto
Colombiana de Trasplantes es un programa que cuenta con una red de cuatro centros de trasplante ubicados en las ciudades de Bogotá, Barranquilla y Rionegro en Colombia, donde se realiza alrededor del 21 % de la actividad trasplantadora del país.
Entre mayo del 2003 y marzo del 2019 se han realizado 2118 trasplantes renales, 1945 realizados en Bogotá y 173 en Barranquilla, 1512 (71,28 %) han sido de donantes cadavéricos y 605 (28,56 %) han sido de donantes vivos. De enero del 2016 a diciembre del 2018, en 319 pacientes con trasplante renal se realizaron 130 biopsias renales por indicación, encontrando en el primer año de trasplante, de acuerdo con los hallazgos en la biopsia, una incidencia del 6,92 % de disfunción crónica del injerto y, en este grupo, se encontró C4d positivo en el 22 % de los casos, ensanchamiento mesangial y desdoblamiento de la membrana basal en el 22 % y presencia de esclerosis severa del 44 % (7).
Dichos resultados fueron contrastados a los descritos por Loupy et al. (8) en una muestra de 1037 pacientes a quienes se les realizó una biopsia por protocolo a un año de trasplante, entre los pacientes con rechazo mediado por anticuerpos (ABMR,antibody-mediated rejection) subclínico hay una frecuencia de capilaritis del 100 %, C4d positivo del 34 % y de esclerosis severa del 20 %.
El factor de riesgo más relevante para el desarrollo de disfunción crónica del injerto es el desarrollo de anticuerpos de donantes específicos (DSA, donor specific antibodies) y de ABMR (9).
Materiales y métodos
Como es muy poco lo que se ha avanzado en la prevención y el tratamiento de esta patología, se requiere profundizar en la comprensión de los mecanismos que la ocasionan para diseñar tratamientos efectivos (10), por lo tanto, se hará énfasis en el rechazo crónico mediado por anticuerpos (cABMR) y en otros eventos crónicos asociados: rechazo crónico mediado por células (cTCMR), IF/TA y toxicidad por medicamentos. Se excluye la enfermedad glomerular de novo o recurrente al considerar su revisión en otro capítulo.
Resultados
Fisiopatología del rechazo crónico mediado por anticuerpos
Los DSA son generados frente a cualquier péptido (antígeno) del donante, principalmente dirigidos frente al complejo mayor de histocompatibilidad (HLA, human leukocyte antigen) y otros, denominados no HLA: antígenos A y B sanguíneos (ABO), receptores acoplados a proteínas G (GPCR, protein coupled receptors) como AT1R (Angiotensin II type 1 receptor) y ETAR (Endothelin type A receptor), MICA (Major Histocompatibility Complex Class I Chain related Gene A) y otros antígenos expresados en la superficie de las células endoteliales como miosina, vimentina, colágeno V y tubulina Kα1(11, 12).
La sensibilización es la generación de DSA frente a los antígenos (anti-HLA y no anti-HLA) del donante. Su severidad está relacionada directamente con la antigenicidad (probabilidad que un antígeno sea reconocido como extraño por el sistema inmune) e inmunogenicidad (probabilidad de generar una respuesta inmune destructiva) (11). El riesgo de sensibilización aumenta con la exposición previa a antígenos, por ejemplo: embarazo, transfusión sanguínea y trasplantes anteriores, e incompatibilidad HLA (mismatch o discordancia). La presencia de DSA antes y después del trasplante se asocia a mayor riesgo de ABMR, desarrollo de disfunción crónica del injerto y disminución en la sobrevida del injerto (13-16). Los DSA antiC1q (17) e IgG3 (18) se asocian a un mayor riesgo de disfunción del injerto.
Las técnicas para la medición de DSA se pueden dividir en dos grupos (19):
Ensayos celulares: la utilización del suero del receptor y las células del donante permite establecer la presencia de DSA. Se puede realizar por medio de la citotoxicidad dependiente del complemento (CDC) o por medio de citometría de flujo (CF) y se utiliza para la determinación del PRA (panel reactive antibodies) y la prueba cruzada necesaria pretrasplante.
Ensayos no celulares (fase sólida): la utilización del suero del receptor y las esferas “beads” (Luminex®), recubiertas cada una con un antígeno diferente (molécula HLA), permite establecer la presencia de DSA específicos. Es una técnica de alta sensibilidad (detección de DSA en bajas concentraciones) y alta especificidad (determinan la presencia de DSA anti-HLA tipo I y tipo II, DSA no HLA y DSA no fijadores del complemento) que se utiliza para la determinación de DSA pre y postrasplante, indispensables para el diagnóstico de ABMR.
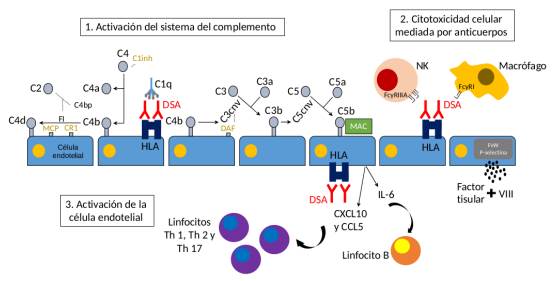
Las funciones efectoras de los DSA para la generación de inflamación vascular y la consecuente lesión tisular crónica pueden dividirse en las relacionadas con el complemento y no relacionadas con el complemento (figura 2):
La activación del sistema del complemento (20), conjunto de proteínas normalmente inactivas que al interactuar producen una cascada proteolítica que estimula la inflamación y la lisis celular, usualmente por la vía clásica, genera la fijación de C4b (C4b se inactiva posteriormente por escisión en C4c y C4d, el último fragmento contiene el enlace covalente al tejido que permanece en el sitio de activación del complemento) (21), asegurando que la actividad se realice en un complejo inmune o sobre la superficie celular y la liberación de C3a y C5a, atrayendo leucocitos para aumentar la permeabilidad vascular y la expresión de moléculas de adhesión en el endotelio, para finalmente producir el complejo de ataque a membrana (MAC, membrane attack complex) que causa la lisis celular (22).
Pueden facilitar la citotoxicidad celular mediada por anticuerpos al unirse a los FcR (Crystallizable fragment of immunoglobulin Receptor). Los DSA al unirse en las células asesinas naturales (células NK) al receptor FcγRIIIA (CD16) y en macrófagos o neutrófilos al FcγRI (CD64), dada la alta afinidad por IgG1 e IgG3, generan que estos fagocitos actúen (23-25).
Activan a la célula endotelial (CE) para la expresión de moléculas de adhesión y migración de leucocitos (linfocitos, monocitos y células NK) a sitios de inflamación (26). Los DSA antiHLA tipo I inducen la liberación del contenido de los cuerpos de Weibel-Palade de las CE: P-selectina y factor de von Willebrand (FvW). La P-selectina favorece la migración de monocitos y el FvW facilita trombosis por la unión de FvW al factor VIII y fibrosis por la exposición de colágeno (27). Los DSA anti-HLA tipo I también aumentan la expresión de IL-6, CXCL8, CXCL10 y CCL5, favoreciendo la adhesión, el reclutamiento, la activación y la diferenciación de leucocitos (28). Los DSA anti-HLA tipo II generan un aumento de la secreción de IL-6, disminuyendo así la expansión de linfocitos T reguladores (Treg) y promoviendo la expansión de linfocitos Th 17, llevando a una respuesta no controlada por parte de linfocitos T CD4+ (29) e inhibiendo la liberación de trombomodulina, contribuyendo a un estado protrombótico (30). La CE también aumenta la expresión de E-SEL, P-SEL y D2-40 que estimula linfangiogénesis (31), fenómeno asociado a un mayor riesgo de progresión a IF/TA.
Hay una asociación clínico-patológica entre la inflamación del endotelio vascular (glomerulitis, capilaritis periglomerular y endarteritis) y el desarrollo de lesiones crónicas (glomerulopatía del trasplante, membrana basal capilar peritubular con múltiples capas (multilayering) y arteriopatía del trasplante) (32). Wiebe et al. reportan que el 61 % de los pacientes con glomerulitis desarrollaban glomerulopatía del trasplante en un promedio de 15 meses (33).
Como consecuencia de la estimulación hecha por los DSA, las CE se activan atípicamente con modulación inadecuada de la respuesta aloinmune y probablemente la activación subclínica de las CE precede el desarrollo del rechazo crónico mediado por anticuerpos (26), sin embargo, se desconoce el mecanismo entre la aparición de la inflamación endotelial y las lesiones crónicas que caracterizan el cABMR.
Hay que tener en cuenta que también se puede presentar cABMR en ausencia de DSA detectables. La secreción de anticuerpos es sin duda una función clave de los linfocitos B, pero estos también intervienen en el rechazo crónico independientemente de la producción de anticuerpos al mejorar las respuestas de las células T (34, 35).
Finalmente, para el diagnóstico de cABMR activo se requieren los criterios de The Banff 2017 (los tres deben estar presentes) (36): evidencia histológica de lesión tisular crónica, evidencia de inflamación actual en el endotelio vascular ocasionada por anticuerpos y evidencia serológica de DSA. En el caso de no encontrar evidencia de inflamación actual se descarta la actividad. La razón para hacer esta distinción es la oportunidad de brindar un tratamiento efectivo.
Fisiopatología del rechazo crónico mediado por células T
El rechazo mediado por células T (TCMR, T cell-mediated rejection) es ocasionado por diversas células inflamatorias, principalmente por linfocitos T citotóxicos (CD8+).
En medio de la heterogeneidad de causas de fibrosis intersticial y atrofia tubular, el hallazgo de inflamación en áreas con IF/TA (i-IF/TA) se asocia a un proceso mediado por células T que sugiere un proceso crónico de lesión renal, el cual aumenta el riesgo de pérdida del injerto y es independiente de todos los demás procesos de lesión (incluido ABMR) (37-39). En i-IF/TA se ha demostrado un predominio de linfocitos T citotóxicos de memoria que exhiben un bajo umbral de activación y que son resistentes al bloqueo de la coestimulación convencional (40, 41), pero aún se desconoce el mecanismo para la progresión hacia lesiones crónicas.
Para el diagnóstico de rechazo crónico activo mediado por células T (cTCMR), de acuerdo con la clasificación de The Banff 2017 (36), se requiere: inflamación intersticial en más del 25 % de la corteza total con más del 25 % de esclerosis del parénquima cortical, tubulitis moderada a severa y arteriopatía crónica del injerto (hialinosis arteriolar).
Fisiopatología de la fibrosis intersticial/atrofia tubular (IF/TA)
La fibrosis intersticial es la formación y la acumulación de matriz extracelular (MEC), principalmente por las células mesenquimales locales (fibroblastos, pericitos y miofibroblastos). La atrofia tubular es la disminución en el número y el tamaño de las células tubulares, acompañada del engrosamiento de la membrana basal tubular. En el trasplante renal, la fibrosis intersticial y la atrofia tubular (IF/TA) suelen suceder juntas y su presencia se asocia a un peor pronóstico. La frecuencia y la severidad de los eventos inflamatorios se relacionan directamente con el desarrollo de IF/TA (42).
La fibrosis afecta a los glomérulos (glomeruloesclerosis), al tubulointersticio (fibrosis intersticial) y a la vasculatura renal (arteriosclerosis) (43). Es el desenlace patológico común de la inflamación ocasionada por diversas causas: eventos agudos como función retardada del injerto, rechazo agudo, infección aguda local o sistémica, infección por BK virus y eventos crónicos como el desarrollo de DSA (aún en ausencia de ABMR) (44), rechazo crónico mediado por anticuerpos, toxicidad por medicamentos y enfermedad glomerular de novo o recurrente (45). Cuando la lesión es grave o persistente, se puede alcanzar un punto de no retorno que afectará la función renal esperada (46).
La inflamación se caracteriza por el reclutamiento y la activación de leucocitos y diversas células del parénquima renal. Los leucocitos (ya sean residentes o infiltrantes), principalmente los macrófagos, promueven la progresión a IF/TA a través de la producción de citocinas profibróticas que tienen efectos paracrinos en fibroblastos, pericitos y células epiteliales adyacentes (47, 48). Tanto los leucocitos como las CE producen no solo mediadores proinflamatorios sino también profibróticos como TFG-B (Transforming growth factor Beta), CTGF (Connective tissue growth factor), PDGF (Platelet-derived growth factor), EGF (Epidermal growth factor) y FGF-2 (Fibroblast growth factor-2), los cuales generan diferenciación mesenquimal y epitelial. Las células mesenquimales (células mesangiales, fibroblastos y pericitos) y posiblemente también células epiteliales (tubulares y endoteliales) se diferencian para convertirse en miofibroblastos contráctiles que producen MEC. La matriz extracelular está compuesta principalmente de colágeno tipo I y III, también de IV y V, fibronectina, laminina, perlecán y heparán (42, 43).
Fisiopatología de la toxicidad por medicamentos
La ciclosporina (CsA) en el riñón trasplantado genera una disminución en la tasa de filtración glomerular (TFG) por vasoconstricción renal eferente (49). Se describió arteriolopatía o hialinosis arteriolar (reemplazo de las células musculares lisas necróticas por depósitos circulares de proteínas) y en las células tubulares proximales expuestas a CsA hay vacuolización isométrica, necrosis, cuerpos de inclusión (mitocondrias gigantes) y microcalcificaciones (50).
Usualmente, el hallazgo de IF/TA sin lesiones específicas adicionales se atribuía a toxicidad por inhibidores de calcineurina (CNI). En el año 2003, Ojo et al. (51) en una cohorte de 69 321 pacientes que recibieron un trasplante sólido no renal, describieron que el 16,5 % de estos pacientes presentaron enfermedad renal crónica estadio 5, probablemente asociada al uso de CNI. Ese mismo año, Nankivell et al. (52) en pacientes tratados con altas dosis de ciclosporina reporta IF/TA en 65 % a los 5 años y 95 % a los 10 años; sin embargo, los protocolos libres de CNI no han mostrado una menor proporción de hallazgos patológicos (glomerulopatía de trasplante, IF/TA) en biopsias de protocolo y la utilización de CNI no genera en todos los casos los cambios atribuibles a toxicidad, por lo que se considera que es sobrestimado el efecto nefrotóxico de los CNI (53). Adicionalmente, la utilización de menor dosis de CNI y el uso de tacrolimus en lugar de ciclosporina no han disminuido esta proporción (54, 55), por lo tanto, no es posible atribuir únicamente a los CNI el desarrollo de disfunción del injerto y es adecuado considerar que el desarrollo de IFTA es la sumatoria de múltiples lesiones inflamatorias.
Discusión
Tratamiento
En respuesta a la estimulación antigénica específica, los linfocitos B pueden diferenciarse en plasmablastos, células plasmáticas y linfocitos B de memoria. Los plasmablastos son células productoras de anticuerpos, de corta vida, y las células plasmáticas son de larga vida. Los linfocitos B de memoria recirculan y se pueden diferenciar en plasmablastos al interactuar con linfocitos T CD4+ afines (56). Los linfocitos B son clave en la inmunidad humoral y pueden influir en la inmunidad celular a través de la presentación de antígenos y la secreción de citoquinas. Los DSA producidos por los linfocitos B generan citotoxicidad celular al formar el MAC o al unirse a los FcR y activan células endoteliales para favorecer inflamación. Por lo tanto, la terapéutica del cABMR se centra en los linfocitos B, los anticuerpos o los mecanismos relacionados con la activación endotelial y la inflamación consecuente.
El cABMR no tiene un tratamiento efectivo (tabla 1). A pesar de resultados favorables reportados en estudios observacionales (57, 58), la depleción de linfocitos B con rituximab en ensayos clínicos no ha demostrado ser efectiva para el tratamiento del cABMR, ni sola (59), ni en conjunto con inmunoglobulina (60), ni tampoco en conjunto con plasmaféresis e inmunoglobulina (61). La utilización de fotoféresis extracorpórea (62) puede ser efectiva, pero aún no hay ensayos clínicos que demuestren su efectividad.
Otras alternativas terapéuticas no han demostrado ser efectivas en el tratamiento de cABMR.
El uso de bortezomib no previene la progresión de la disfunción del injerto ni reduce las características de la actividad de la enfermedad en el cABMR (63). La utilización de tocilizumab (64) y eculizumab (65) en pacientes con cABMR generan estabilización en TFG, sin embargo, aún no hay ensayos clínicos que demuestren su efectividad. La utilización de daratumumab (66) puede ser efectivo, pero aún no hay ensayos clínicos que demuestren su efectividad.
Tabla 1 Estudios prospectivos para el tratamiento del rechazo humoral crónico
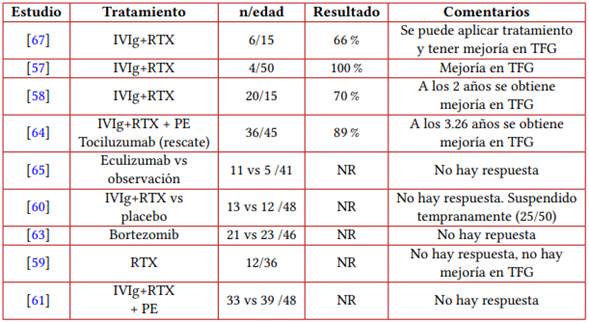
Notas aclaratorias: IVIg: inmunoglobulina, RTX: rituximab, PE: plasmaféresis, NR: no reportado.
Fuente: elaboración propia.
Encontrar un tratamiento es apremiante, mientras tanto se debe evitar la exposición a los factores de riesgo y hacer un diagnóstico y un tratamiento oportunos de los eventos agudos y crónicos cuando sea posible.
Conclusión
La disfunción crónica causa un deterioro lento y progresivo de la función renal. Aunque su origen puede ser multifactorial, el rechazo crónico mediado por anticuerpos es la causa más frecuente de la disfunción crónica del injerto en pacientes trasplantados renales.
Existen factores de riesgo agudos y crónicos cuya combinación conduce a la pérdida del injerto, aunque las alternativas terapéuticas no han demostrado ser efectivas en el tratamiento del rechazo crónico mediado por anticuerpos. Es por esto que se recomienda evitar la exposición a los factores de riesgo y hacer un diagnóstico y un tratamiento oportunos de los eventos agudos y crónicos cuando sea posible.