Introducción
La amiloidosis es una enfermedad rara y potencialmente mortal que se presenta cuando las proteínas presentan plegamiento y depósito anormal en tejidos y órganos. Con frecuencia, se diagnostica en fases tardías de su evolución, siendo en estos casos altamente mortal. Actualmente, se han descrito más de 30 tipos de proteínas tóxicas tipo amiloide, que al acumularse en los tejidos originan una alteración de la función de los órganos comprometidos (1). Entre los tipos de amiloidosis más frecuentes se encuentran: amiloidosis de cadenas livianas de inmunoglobulinas (AL), amiloidosis secundaria reactiva (AA) y amiloidosis por transtiretina (ATTR), las cuales explican el 90 % de los casos de esta entidad (2).
La presentación clínica de la amiloidosis es muy variada, por lo que puede confundirse con otras enfermedades y se dificulta su diagnóstico temprano. Adicionalmente, el compromiso de ciertos órganos se relaciona con el tipo de amiloide depositado, la AA se asocia principalmente con enfermedades infecciosas crónicas, patologías inflamatorias sin tratamiento o de difícil control y, en algunas ocasiones, su origen es desconocido. Este tipo de amiloidosis se debe a la producción de la proteína A amiloide sérica, que afecta con frecuencia los riñones en forma de síndrome nefrótico con deterioro progresivo de la función renal (3), lo cual empeora su pronóstico.
A continuación se presenta el caso de un paciente con amiloidosis AA secundaria que evoluciona a un proceso inflamatorio crónico grave abdominal, en el cual la espectrometría de masas ayudó a aclarar el diagnóstico.
Presentación del caso
Hombre de 53 años, natural de Barranquilla y procedente de Mocoa, Putumayo, con antecedentes de hipertensión arterial y laparotomía exploratoria en 1985, sin conocerse detalles de la cirugía de esa época, la cual fue causada por herida de un arma de fuego en el área abdominal. En 2017, el paciente ingresó a una institución hospitalaria en Florencia, Caquetá, por un cuadro clínico de obstrucción intestinal complicado con peritonitis, por lo cual requirió múltiples intervenciones quirúrgicas para lavado de la cavidad abdominal (> 10 en total a lo largo de tres meses).
El paciente presentó como complicaciones una fístula enterocutánea de alto débito y una desnutrición grave con requerimiento de nutrición parenteral, por lo cual fue remitido al Hospital Pablo Tobón Uribe de la ciudad de Medellín para manejo multidisciplinario. Al ingreso se encontró un paciente crónicamente enfermo, desnutrido, en gran anasarca, con deterioro de la función renal y fístula enterocutánea activa. Se requirió inicio de nutrición parenteral total y múltiples tratamientos enfocados a la disminución de la producción de la fístula.
Los exámenes de laboratorios reportaron deterioro de la función renal, proteinuria masiva, hipoalbuminemia y dislipidemia, se hizo un diagnóstico de síndrome nefrótico con proteinuria masiva y deterioro grave de la tasa de filtración glomeular y los estudios complementarios infecciosos e inmunológicos fueron negativos (tabla 1). Se descartó gammapatía monoclonal (inmunofijación en sangre y orina negativas, cadenas livianas libres en suero ligeramente elevadas con una relación kappa/lambda conservadas; biopsia de médula ósea negativa para malignidad, mielograma normal y citometría de flujo en médula ósea sin alteraciones) (tabla 1). La tomografía toracoabdominal y un PET-CT no documentaron enfermedad de tipo neoplásica y los estudios endoscópicos fueron negativos para enfermedad inflamatoria intestinal. También, la biopsia renal documentó material amiloide en glomérulos y arteriolas, con inmunotinción fuertemente positiva para amiloide A e inmunofluorescencia positiva para cadenas ligeras kappa, concluyendo la coexistencia de amiloidosis AA y AL (figura 1).
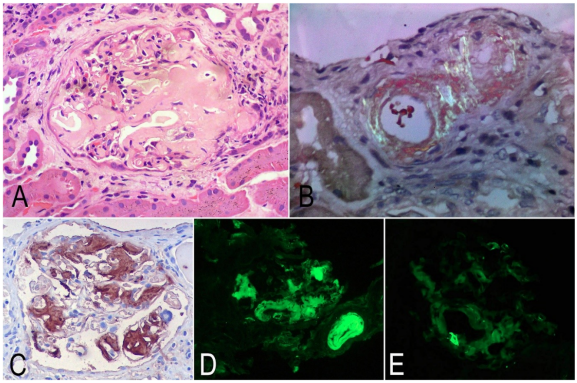
Notas aclaratorias: A: glomérulo con arquitectura distorsionada por material amorfo, acelular, eosinofílico, ocupando gran parte del mesangio y algunas paredes capilares. B: depósito amorfo en arterias, con tinción de rojo congo con luz polarizada que demuestra birrefringencia verde indicando que se trata de amiloide. C: inmunotinción para amiloide A fuertemente positivo, demostrando positividad en los depósitos glomerulares. D: inmunofluorescencia para cadenas ligeras kappa, donde se evidencia inmunotinción fuerte en los depósitos glomerulares y en una arteriola. E: inmunofluorescencia para cadenas ligeras lambda negativas (todas las imágenes con aumento original X400).
Fuente: cortesía del doctor Luis F. Arias del Departamento de Patología, de la Facultad de Medicina, de la Universidad de Antioquia, Medellín, Colombia.
Figuras 1 Biopsia renal
Tabla 1 Exámenes de laboratorio
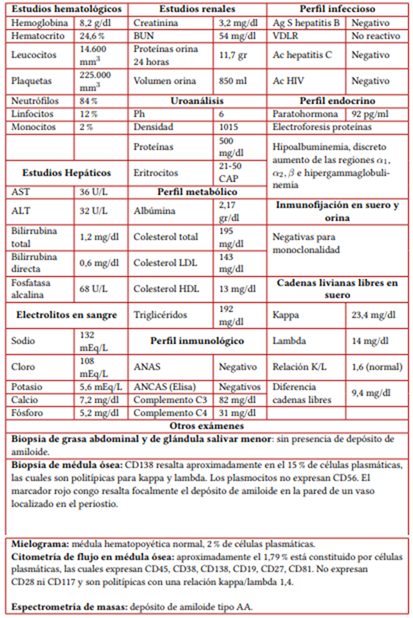
Nota aclaratoria: ALT: alanino transaminasa; AST: aspartato transaminasa; ANAS: anticuerpos antinucleares, ANCAS: anticuerpos anticitoplasma de neutrófilos, BUN: nitrógeno ureico; AgS: antígeno de superficie, Ac: anticuerpos.
Fuente: elaboración propia.
Tabla 2 Indicaciones de espectrometría de masas para la tipificación de amiloide en biopsias renales

Fuente: modificada de 13.
Se descartó amiloidosis en otros sitios (biopsia de glándula salivar menor y grasa abdominal negativas para la presencia de depósito de material amiloide; resonancia magnética cardiaca normal). Ante la necesidad de diferenciar si se trataba de amiloidosis AA, amiloidosis AL o la coexistencia de ambas, se realizó una espectrometría de masas, dado que de tratarse de amiloidosis AL se podría ofrecer trasplante de medula ósea o si por el contrario se trataba de amiloidosis AA se daría tratamiento a su condición clínica de base (fistula enterocutánea y recuperación nutricional), la espectrometría confirmó el diagnóstico de amiloidosis AA.
El paciente presentó deterioro clínico sin respuesta al manejo de la fístula enterocutánea de alto débito, con abdomen bloqueado sin posibilidad de nuevas cirugías, con la situación clínica empeorada por el síndrome nefrótico con proteinuria masiva e hipoalbuminemia grave, con múltiples procesos infecciosos relacionados a su condición (celulitis, infección urinaria, sepsis por catéter de nutrición), complicándose posteriormente con lesión renal aguda KDIGO 3 anúrica con criterios de urgencia dialítica, pero el paciente se negó a su realización, razón por la cual falleció dos meses después del ingreso hospitalario.
Discusión
La amiloidosis es el término utilizado para referirse al depósito de fibrillas en el tejido extracelular, las cuales se componen por subunidades de bajo peso molecular de una variedad de proteínas que han sufrido cambios conformacionales y que conducen a la adopción de una configuración en lámina, predominantemente antiparalela beta plegada. Muchas de estas proteínas circulan como constituyentes del plasma y estos depósitos pueden dar lugar a una amplia gama de manifestaciones clínicas, dependiendo de su tipo, ubicación y de la cantidad de depósito (3).
Se debe sospechar amiloidosis en pacientes que presentan las siguientes características clínicas y que no pueden ser explicadas por otras causas: astenia y adinamia profundas, pérdida de peso, disnea de esfuerzo, síndrome nefrótico, síndrome de túnel del carpo (bilateral), neuropatía periférica, neuropatía autonómica (hipotensión postural, disfunción eréctil/vejiga/intestinal), hepatomegalia con imágenes normales, macroglosia o púrpura periorbitaria. En el caso clínico reportado, el paciente presentó un síndrome nefrótico con proteinuria masiva asociado a un deterioro de la función renal en el contexto de una patología inflamatoria crónica abdominal y se descartaron otras causas.
Las formas principales de amiloidosis son: AL, ATTR y AA (4). Adicionalmente, en los últimos años se ha descrito un tipo de amiloidosis secundaria al factor quimiotáctico de leucocitos 2 (ALECT2) y que se ha convertido en la tercera causa de amiloidosis renal después de AL y AA. La amiloidosis ALECT2 tiene una mediana al diagnóstico de 62 años, pero no se asocia con compromiso cardiaco o neuropatía y se presenta en pacientes del sur de Asia, norte de África, Oriente Medio y Latinoamérica (5).
La amiloidosis AL es un trastorno sistémico que se presenta en pacientes con diagnóstico de neoplasia de células plasmáticas, el cual es secundario al depósito de proteínas derivadas de los fragmentos de la cadena ligera de inmunoglobulina. Para su diagnóstico, se requiere la presencia de una proteína monoclonal, la cual se puede detectar mediante electroforesis de proteínas, inmunofijación, tanto en sangre como en orina, o mediante la medición de cadenas livianas (kappa-lambda) (6, 7). En el paciente descrito, se sospechó de amiloidosis AL a partir del estudio de proteinuria en rango nefrótico y los hallazgos en la biopsia renal, donde se observó inmunofluorescencia positiva para cadenas ligeras kappa en los depósitos glomerulares y en una arteriola, sin embargo, no se documentó un pico monoclonal ni en sangre ni en orina y el estudio de la médula ósea fue normal.
En la amiloidosis AA se presenta una sobreproducción sostenida de amiloide sérico A (SAA-SerumAmyloid A, por sus siglas en inglés), el cual es un reactante de fase aguda que se produce a nivel hepático y extrahepático (adipocitos, membrana sinovial, pared arterial). Este tipo de amiloidosis se presenta como respuesta a la elevación plasmática de citoquinas (IL-1, IL-6, TNF-α) y TLRs (8), por lo cual puede observarse en el contexto de enfermedades crónicas con inflamación continua o recurrente como artritis reumatoide, espondiloartropatías, enfermedad inflamatoria intestinal, infecciones crónicas como tuberculosis, osteomielitis y síndromes de fiebre periódica hereditaria (3, 9). En el paciente mencionado, la biopsia renal documentó inmunotinción fuerte para amiloide A, demostrando positividad en los depósitos glomerulares.
En la amiloidosis AA, la presencia de síndrome nefrótico y enfermedad renal crónica progresiva son las manifestaciones clínicas más tempranas y que deberían generar sospecha de amiloidosis AA en pacientes con patologías inflamatorias o infecciosas crónicas. La hepatomegalia y la insuficiencia suprarrenal pueden complicar el curso de la enfermedad. Otras manifestaciones como la neuropatía periférica, la miocardiopatía restrictiva y el compromiso de piel y tejidos blandos son poco frecuentes, en comparación con otros tipos de amiloidosis sistémica como la amiloidosis AL (10, 11). En el paciente descrito, la amiloidosis se presentó solo con compromiso renal sin afectar otros sitios.
El diagnóstico de amiloidosis AA se basa en la afectación clínica de los órganos y la demostración histológica de los depósitos de amiloide (12) que aparecen como material hialino amorfo en microscopia óptica: las fibrillas se unen al rojo congo, lo que conduce a una birrefringencia verde bajo luz polarizada. El diagnóstico de amiloidosis AA puede confirmarse mediante tinción de depósitos de inmunoperoxidasa positiva usando anticuerpos monoclonales contra la proteína amiloide AA. Este fue el caso del paciente, donde la biopsia renal mostró tinción fuerte para amiloide A en los depósitos glomerulares.
La coexistencia y la deposición conjunta de dos o más proteínas de fibrillas amiloides en el mismo paciente, e incluso en el mismo depósito de amiloide, complica la clasificación inmunohistoquímica de amiloide; lo que hizo que el estudio proteómico por espectrometría de masas tuviera una gran importancia en este caso y cuyas indicaciones se especifican en la tabla 2.
Este estudio consiste básicamente en la identificación y la cuantificación completas del proteoma. La espectrometría de masas se considera superior a todas las otras técnicas de caracterización de amiloide, ya que no depende de la disponibilidad de anticuerpos contra el antígeno amiloide (13). En el paciente presentado, la biopsia renal mostró tinción tanto para amiloide A como para cadenas kappa y la espectrometría de masas aclaró que el tipo de amiloide que tenía el paciente era amiloide A.
El tratamiento de la amiloidosis se basa en la identificación precisa de la proteína que causa esta patología y los métodos actuales utilizados para la tipificación de la amiloidosis, como la inmunohistoquímica, tienen baja especificidad y sensibilidad. En el caso de nuestro paciente se combinó el muestreo específico por microdisección láser (LMD) y el poder analítico del análisis proteómico basado en espectrometría de masas (MS), lo cual permitió un diagnóstico preciso de este caso. Actualmente, existe una gran evidencia con respecto a la utilidad del análisis proteómico basado en LMD y MS para tipificar la amiloidosis, dado que la prueba ofrece una alta sensibilidad y especificidad en muestras de biopsia incluidas en parafina. El ensayo supera muchos de los problemas que presentan otros métodos que se utilizan actualmente para la tipificación de la amiloidosis al combinar la precisión de LMD con el poder analítico de la MS.
El uso de la MS en el diagnóstico de la amiloidosis ha mejorado notablemente la capacidad para tipificar con precisión los depósitos de amiloide en muestras de biopsia y, de esta manera, se mejora la atención de los pacientes con amiloidosis (1).
Una vez se ha detectado la presencia de amiloide AA, la supresión a largo plazo de los niveles circulantes de SAA es vital para mejorar los resultados mediante el tratamiento agresivo de la enfermedad subyacente, con el objetivo de controlar la respuesta inflamatoria y mejorar la supervivencia (3, 14). Adicionalmente, aquellos pacientes con amiloidosis renal que progresan a enfermedad renal crónica terminal pueden ser tratados con diálisis o trasplante renal. Para la realización del trasplante renal se requiere una evaluación exhaustiva, buscando previamente contraindicaciones para el mismo, adicionalmente es necesario un adecuado control de la enfermedad inflamatoria causante de la amiloidosis AA; sin embargo, se debe tener en cuenta que existe la posibilidad de recurrencia de la amiloidosis AA en el injerto renal, la cual se puede manifestar con proteinuria progresiva, síndrome nefrótico o deterioro de la tasa de filtración glomerular, donde la realización de biopsia renal es fundamental para aclarar el diagnóstico (15).
Al paciente mencionado se le ofreció diálisis pero no aceptó y en su momento tenía contraindicado el trasplante renal porque no tenía la patología inflamatoria abdominal controlada.
Conclusiones
Las patologías infecciosas o inflamatorias crónicas pueden provocar amiloidosis AA, la cual se manifiesta principalmente con síndrome nefrótico y enfermedad renal crónica progresiva, en la cual, el tratamiento está dirigido a la etiología desencadenante de la misma. Por otro lado, en la amiloidosis AL siempre se debe realizar una búsqueda exhaustiva de monoclonalidad, dado que el tratamiento oportuno (quimioterapia, trasplante autólogo de progenitores hematopoyéticos) impactará en el pronóstico del paciente. Teniendo en cuenta esta observación, la distinción de amiloidosis AA y amiloidosis AL reviste de gran importancia cuando nos enfrentamos a un diagnóstico patológico que muestra su coexistencia, ganando gran relevancia en este caso el uso de la espectrometría de masas.















