Introducción
En Pediatría, la lesión renal aguda ha suscitado un gran interés en la comunidad médica a nivel mundial por el aumento en su incidencia y prevalencia. La lesión renal aguda en la mayoría de los casos afecta a pacientes hospitalizados en centros de baja y de alta complejidad, lo que sugiere una etiología multicausal asociada a enfermedades primarias, concomitantes o relacionadas con el tratamiento (1).
El avance en las técnicas de radiología ha mejorado enormemente la práctica de la medicina, en especial el uso de medios de contraste (MC) que son sustancias capaces de resaltar determinadas estructuras anatómicas normales y patológicas, con el fin de tener una mayor precisión al momento del diagnóstico o como estrategia terapéutica, ya que su uso se ha ampliado y se administran con frecuencia para tomografías axiales computarizadas (TAC), angiografías, procedimientos de urología, resonancias magnéticas, entre otros (2).
El uso de los MC en la población pediátrica ha ido en aumento, así como también la injuria renal asociada a este, ya que se estima que la lesión renal aguda asociada a medios de contraste es la tercera causa de lesión renal adquirida en el hospital (3). En la actualidad existen pocos estudios acerca del manejo y la prevención de la lesión renal aguda asociada a contraste en la población pediátrica, lo que en el tiempo ha obligado a que se extrapolen recomendaciones de la población adulta a la práctica clínica pediátrica (1).
Materiales y métodos
Tipo de estudio y población
Se realizó una revisión de la literatura de nefropatía inducida por contraste en pacientes pediátricos, con énfasis en la definición, factores de riesgo, enfoque clínico y medidas preventivas.
Criterios de inclusión, exclusión y restricciones empleadas en la búsqueda
Se realizó una búsqueda de la literatura en las siguientes bases de datos: Pubmed/Medline, Science Direct, Scopus, Embase, Bireme, Redalyc y SciELO. Las palabras utilizadas para realizar la búsqueda fueron: ((acute kidney failure) AND(contrast induced) OR (contrast associated) OR (contrast-induced nephropathy)). En cuanto a las restricciones empleadas en la búsqueda, se limitó la búsqueda de la literatura a humanos, publicaciones de los últimos diez años y restricción de idiomas a inglés y español.
Definiciones
Históricamente se definía la nefropatía inducida por contraste (NIC) como la lesión renal aguda que ocurría 48 horas luego de la administración de MC y la exclusión de otros factores nefrotóxicos. Esta definición fue problemática debido a que la exclusión de estos factores nefrotóxicos no era posible en la mayoría de los casos y sobreestimaba los casos verdaderamente relacionados al uso de los MC (4).
Desde el año 2015, la American College of Radiology (ACR) ha adoptado nuevos términos para definir la lesión renal aguda en el contexto de uso de MC, con el fin de lograr una definición global que pueda ser aplicada en el contexto clínico y en el desarrollo de protocolos de estudio (5). Los términos propuestos son los siguientes:
Lesión renal aguda asociada a contraste (CA-AKI): cualquier lesión renal aguda que ocurre 48 horas después de la administración de MC, la cual puede o no ser causada directamente por este. No implica que haya una verdadera relación causal, lo que no excluye que el deterioro en la función renal pueda ser originado por otras posibles etiologías que no se han estudiado exhaustivamente. Este término puede ser aplicado a eventos documentados en protocolos de estudio que tienen ausencia de una cohorte o grupo control (6).
Lesión renal aguda inducida por contraste (CI-AKI): es un subtipo de la CA-AKI que tiene una relación causal de deterioro de la función renal, con la administración del medio de contraste. Anteriormente este término se conocía como nefropatía inducida por contraste. El uso de este término puede ser aplicado en estudios con grupo control que puedan establecer la potencial relación causal (6).
Discusión
Epidemiología
La incidencia de la CA-AKI varía ampliamente entre los diferentes estudios, debido a que depende de las definiciones usadas, la población y los factores de riesgo de base de los pacientes. Alrededor del 60 % de los pacientes críticamente enfermos desarrollan lesión renal aguda durante su estancia hospitalaria, llevando a altas tasas de mortalidad, morbilidad y mayor riesgo de enfermedad renal crónica a largo plazo (7).
Existe poca información acerca de la incidencia, los factores de riesgo y el impacto en el pronóstico de la CA-AKI en la población pediátrica, en gran parte debido a la falta de una definición de consenso en los estudios publicados (8-9).
Cantais et al. realizó un estudio de cohorte retrospectiva donde incluyeron a 233 pacientes menores de 16 años en cinco unidades pediátricas del Hospital Universitario St-Etienne en Francia, entre 2005 y 2014 (3). A la población de estudio se le realizó una tomografía con contraste, de los cuales 24 (10,3 %) desarrollaron CI-AKI (3). Se identificó además CI-AKI como factor independiente de pobres desenlaces a 30 días (readmisión, admisión a UCI o mortalidad). Davenport et al. (5), en un estudio prospectivo en menores de 18 años, encontró una incidencia de 4,6 % de CA-AKI, pero no había una diferencia significativa respecto al grupo de no expuestos al MC.
En Latinoamérica existen pocos datos acerca de la incidencia en la población pediátrica. En Colombia se realizó un estudio prospectivo y descriptivo en el año 2014, en pacientes entre 1 mes y 14 años que se sometieron a TAC contrastada con una incidencia de CA-AKI del 18 % (10). Este valor es similar al reportado por Bello (11) en un estudio descriptivo entre 2011 y 2012, realizado para estimar la frecuencia y la severidad de la nefrotoxicidad en pacientes pediátricos expuestos a medios de contraste en UCI, donde se encontró que el 10 % de los pacientes que se sometieron a este estudio diagnóstico cumplieron con la definición de CA-AKI.
Fisiopatología
La fisiopatología de la CA-AKI es compleja y la información que se ha obtenido viene de estudios realizados en animales (12).
Los medios de contraste son sustancias o una combinación de sustancias que introducidas en el organismo permiten resaltar estructuras anatómicas normales y patológicas. Existen diferentes tipos de contrastes, los cuales se diferencian en cuanto a sus características químicas, osmolalidad, tipo de imagen que generan y su vía de administración (11). Los MC se derivan de bencenos triyodados, que están en forma iónica o no iónica. Los MC iónicos tienen una alta osmolalidad en sangre y se asocian con la deformación de los eritrocitos, la vasodilatación sistémica, la vasoconstricción renal y la toxicidad tubular directa (iotalamato de sodio). Los no iónicos (iopamidol) tienen una baja osmolalidad en sangre, sin embargo, sigue siendo hiperosmolares al plasma y los iso-osmolares tienen una osmolaridad similar a la del plasma (iodixanol), lo que los hace más seguros, por lo que en la actualidad solo se usan los agentes que cumplen con esta característica (12).
Los MC tienen una vida media de distribución de 2 a 30 minutos, una unión a proteínas plasmáticas de 1 a 3 % y una vía de eliminación preferencialmente renal sin metabolización, la cual en un paciente con función renal normal puede tomar hasta 24 horas para eliminar el 100% (12).
Luego de haber sido filtrado en la barrera de filtración, no se reabsorbe en el túbulo, lo que genera aumento en la concentración tubular a medida que avanza, llevando a una mayor viscosidad y prolongando la exposición del MC a las células tubulares, lo cual potencia los efectos tóxicos y determina el impacto de la lesión, especialmente en pacientes con un estado de hidratación no óptimo (12-13).
Los dos mecanismos principales descritos con el uso de los MC son los mecanismos citotóxicos y hemodinámicos que resultan en una disminución en la tasa de filtración glomerular, debido a la hipoperfusión renal (13). Los medios de contraste generan la síntesis de radicales libres que son tóxicos para el endotelio y las células epiteliales tubulares y estos inducen a un aumento en la síntesis de sustancias como endotelina, angiotensina II, adenosina y tromboxano A2 y una reducción en la síntesis de sustancias vasodilatadoras como el óxido nítrico (14). Al tener la liberación de todas estas sustancias, la vasa recta (sitio de la nefrona con baja presión de oxígeno y susceptible a isquemia) y los capilares a nivel glomerular y peritubular sufren vasoconstricción, generando una disfunción de la microcirculación renal y llevando a una isquemia distal (15). La isquemia a su vez induce la liberación y la formación de los radicales libres (O2-, OH-, H2O2) (13), lo que perpetúa la lesión celular y se convierte en un círculo vicioso (10).
Aparte de los procesos de hipoperfusión e isquemia, el otro mecanismo propuesto es la inducción de apoptosis, mediante la activación de la caspasa 3, 9 y bcl 2, lo que determina una redistribución proteica, una fragmentación del ADN y una potenciación de la muerte celular por exceso en el influjo de calcio (12).
Factores de riesgo
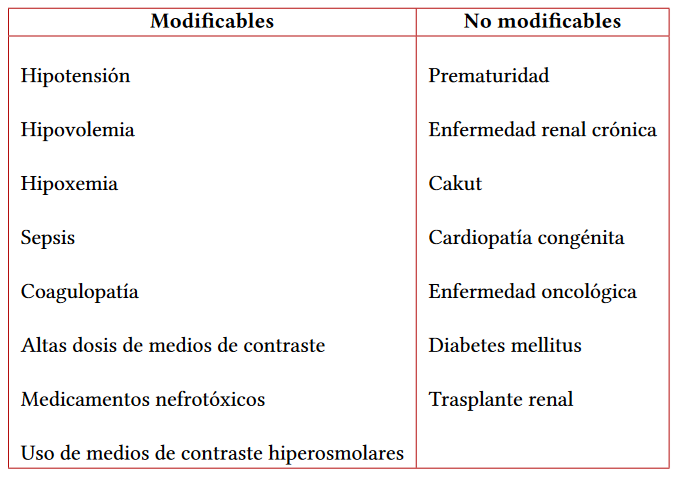
Existen diferentes factores de riesgo que predisponen a los pacientes para el desarrollo de una lesión renal aguda como son la enfermedad renal crónica (ERC), la lesión renal aguda concomitante, la hipotensión y la depleción de volumen (16). Los factores mencionados tienen una plausibilidad biológica que ha sido establecida en estudios experimentales, sin embargo, factores estrictamente relacionados en estudios en la población pediátrica no han sido establecidos, lo que ha llevado a que muchos de estos datos se extrapolen de la población adulta (7).
Los factores de riesgo presuntivos que pudieran tener un efecto en el aumento en la posibilidad de CA-AKI, se pueden clasificar en modificables y no modificables (tabla 1).
Manifestaciones clínicas y diagnóstico
La evaluación clínica de un paciente en riesgo de CA-AKI que va a ser sometido a un procedimiento con MC debe comenzar con la historia clínica, con lo cual se establecerá el diagnóstico, los factores de riesgo, el procedimiento y el MC a utilizar. En el examen físico es importante evaluar la estabilidad hemodinámica (es mayor el riesgo en niños con inestabilidad hemodinámica), los signos vitales y si hay manifestaciones sistémicas de una condición primaria.
Es importante estimar la tasa de filtración glomerular (TFGe) basal del paciente en los últimos siete días o máximo en los últimos tres meses, lo cual puede ser calculado a partir de la creatinina sérica (17, 18) mediante la fórmula de Schwartz o Schwartz modificado (7).
En el año 2005, basados en los criterios de RIFLE, se adoptó como definición de nefropatía inducida por contraste (en este tiempo no se hablaba de CA-AKI) como el aumento de la creatinina sérica en 0,5 mg/dL o un 25 %, o disminución de la TFGe en más del 25 % respecto a la basal. En el año 2012 con la definición de la guía KDIGO (19), se adoptó la definición de lesión renal aguda para determinar el diagnóstico de CA-AKI (tabla 2).
Tabla 2 Definición de lesión renal aguda según guías KDIGO*
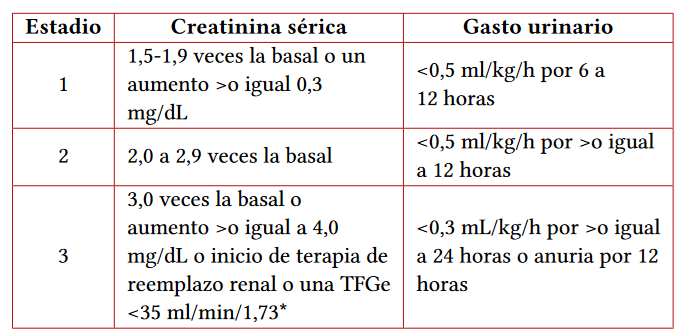
Nota aclaratoria: *aplica para menores de 18 años
Fuente: (19).
La creatinina sérica es un marcador imperfecto para el diagnóstico de CA-AKI, es por ello que se han estudiado otros posibles biomarcadores, candidatos para el diagnóstico de esta condición, los cuales incluyen la gelatinasa asociada a lipocalina de neutrófilos (NGAL), la molécula de lesión renal 1 (KIM-1), la interleucina 18 (IL-18) y la proteína de unión a ácidos grasos tipo hepática (L-FABP) (20). Hirsch et al. determinaron en 91 niños que la NGAL tenía un aumento significativo luego de dos horas de la administración del MC, usando un valor de corte de 100 ng/mL con una sensibilidad del 73 % y especificidad del 100 %, lo que lo convierte en una adecuada alternativa (21).
En un estudio en Corea con 26 niños sometidos a cateterismo cardiaco, los autores evidenciaron un aumento de KIM-1 y L-FABP, los cuales fueron irrelevantes cuando se ajustaron a la excreción urinaria de creatinina, pero concluyen que el L-FABP puede ser un biomarcador para detección subclínica de CA-AKI (22).
Un estudio prospectivo de 123 niños y adolescentes, en el que 58 fueron llevados a angiografía con MC yodado y 65 a resonancia magnética con gadolinio, determinó que la predicción de lesión renal aguda determinada por KIM-1 tenía resultados convincentes (sensibilidad de 83,3 %, especificidad de 54,2 %, área bajo la curva de 0,76); sin embargo, otros biomarcadores como la NGAL no lograron predecir de forma precisa CA-AKI (23, 24). El uso de biomarcadores propuestos para CA-AKI es controversial y se requieren de más estudios con mayor tamaño muestral para un mejor entendimiento, sin embargo, la creatinina sérica es el marcador en el cual nos debemos limitar actualmente (25).
El inicio de la lesión renal aguda ocurre probablemente minutos luego de la exposición a los MC, sin embargo, la elevación de la creatinina sérica puede tomar uno o dos días en presentarse.
Se han descrito tres formas clínicas de presentación de la CA-AKI (7, 19):
Elevación temprana y leve de la creatinina sérica: usualmente se presenta entre 24 y 48 horas después de la exposición al medio de contraste, suele ser leve y empieza a disminuir hasta su basal en los siguientes tres a siete días.
Forma no oligúrica: puesto que la lesión renal aguda casi siempre es leve, en los casos (raros) que se desarrolla oliguria, esta se presenta inmediatamente después del procedimiento.
Oligúrica o lesión renal aguda grave con elevaciones significativas de la creatinina: se puede presentar en los pacientes que tienen de base una enfermedad renal crónica de moderada a grave.
Dentro de estas presentaciones podemos ver sedimento urinario consistente con necrosis tubular aguda (NTA), con cambios característicos de NTA como cilindros granulosos o de células epiteliales, hipostenuria o fracción excretada de sodio o de urea elevadas, aunque la ausencia de estos hallazgos no descarta una CA-AKI. Secundario a la lesión renal aguda, se pueden presentar alteraciones hidroelectrolíticas y de ácido base, como por ejemplo hiperkalemia, acidosis e hiperfosfatemia (26).
Medidas preventivas
No existen guías basadas en la evidencia de para la prevención de CA-AKI en el paciente pediátrico, pero en la población de adultos sí existe un gran número de estudios y protocolos que guían la prevención de CA/CI-AKI; por lo que las estrategias de prevención son extrapoladas de estudios de adultos y de ellas se supone que tienen una plausibilidad biológica, proveen un grado de protección y no son lesivas.
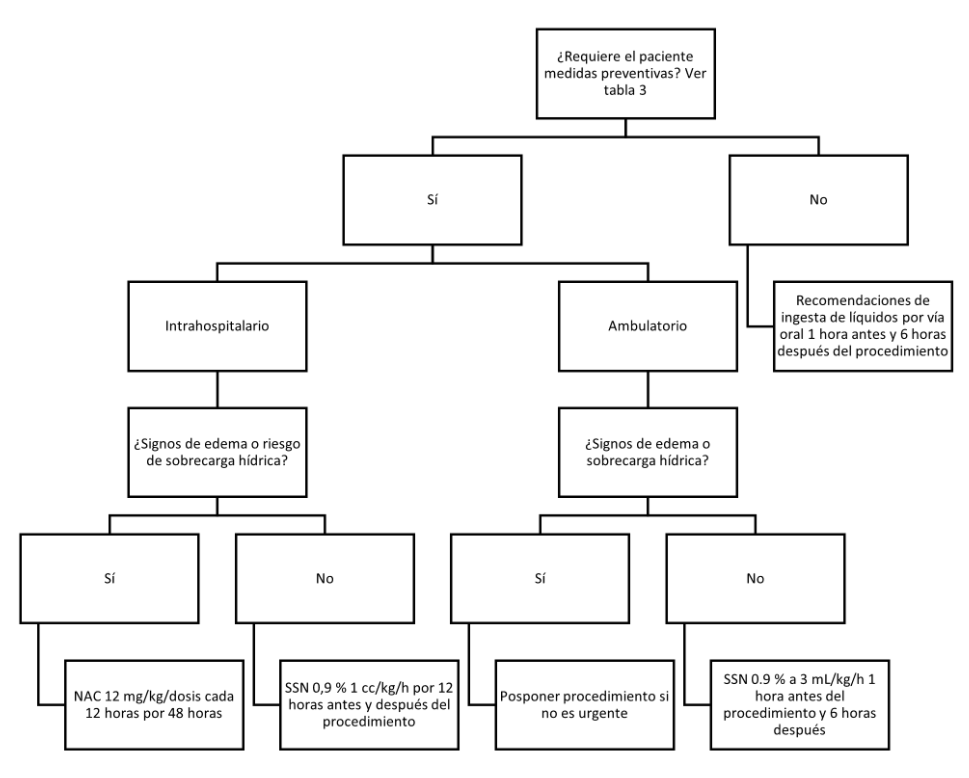
El primer paso es identificar qué paciente se beneficia de las medidas preventivas de CA-AKI (tabla 3), teniendo en cuenta los diagnósticos, estado clínico y los factores de riesgo individuales de cada paciente, lo que determina un enfoque individualizado.
Tabla 3 Indicaciones de inicio de estrategias de prevención según las diferentes recomendaciones de las guías en adultos
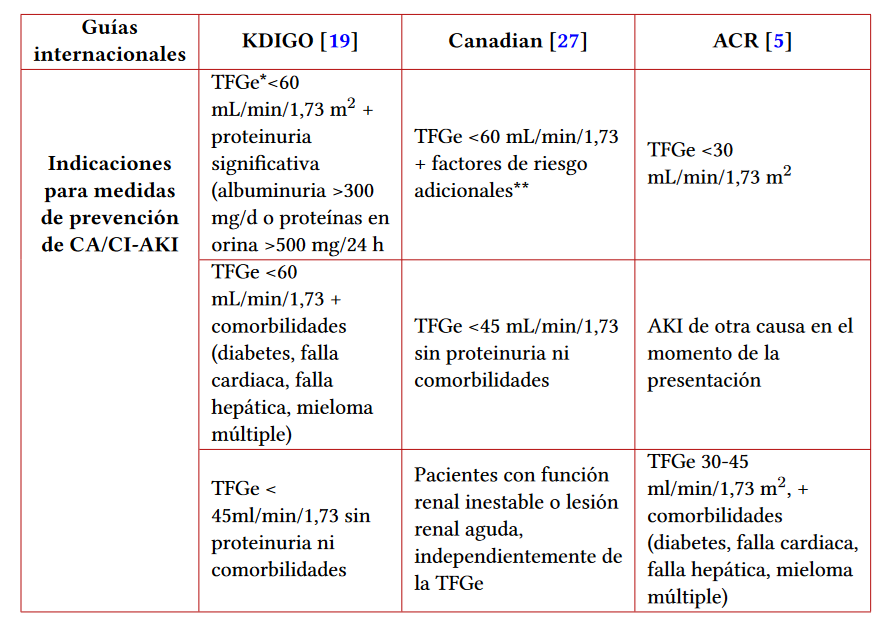
Notas aclaratorias: indicaciones de inicio de medidas de prevención para CA/CI-AKI según las diferentes guías de manejo. En nuestro medio se aplican las guías KDIGO. *TFGe: Tasa de filtración glomerular estimada. **Factores de riesgo adicionales: diabetes mellitus, sepsis, hipotensión, deshidratación, quimioterapia previa, trasplante de órgano, enfermedad vascular, medicamentos nefrotóxicos, VIH, enfermedad de colágeno.
Pero en los últimos años, el beneficio de las medidas preventivas en adultos ha sido cuestionado por dos ensayos clínicos denominados AMACING y PRESERVE (28), donde se evidencia un bajo riesgo de CI-AKI en cohortes de alto riesgo.
A continuación, se enumerarán cada una de las medidas preventivas y su evidencia:
Tipo de contraste: ha habido una tendencia creciente en la disminución de la osmolaridad de los agentes de contraste hasta valores fisiológicos como los agentes iso-osmolares (IO) como el iodixanol (29-30). En un estudio de cohorte italiano de intervención coronaria percutánea no hubo diferencias en el riesgo ajustado de CA-AKI entre los cuatro agentes de baja osmolaridad (31). Zo’o et al. realizaron un ensayo en el que compararon iobitridol con iodixanol en 128 niños (edad 8,7 +/- 4,7 años) a quienes se les realizó un TAC y no hubo diferencias significativas en las tasas de AKI (32).
Volumen de contraste: la cantidad del medio de contraste usado es frecuentemente citado como un factor independiente para el desarrollo de CI-AKI. La relación entre la cantidad del MC y la lesión renal se ha evidenciado con la administración de MC intraarteriales y no tanto con los MC intravenosos (19).
El volumen del MC debe ser determinado por el tamaño del niño, el estudio de imagen a realizar y la estimación de la TFG (1). Los volúmenes de MC recomendados para neonatos y lactantes son usualmente 1,5-2 ml/kg (33). Es prudente entonces limitar el volumen de contraste basados en el riesgo individual, en el cual la calidad de la imagen tampoco se ponga en riesgo. Una revisión propone el acrónimo Alara (as low as reasonably achievable, por sus siglas en inglés) como recomendación (7).
Vía de administración: la mayoría de los estudios de CA-AKI son en cardiología, donde la vía de administración de la angiografía coronaria es intraarterial. Esto predispone a que los riñones sean expuestos a una dosis más alta de MC y al desprendimiento de émbolos de colesterol, consecuente con mayor riesgo de CA-AKI, según lo descrito en estudios; sin embargo, McCullough et al. en una gran cohorte de pacientes reportaron un riesgo similar de AKI después de la administración de MC intravenoso e intraarterial (11 % vs. 9,9 %) (16). A pesar de ello, los pacientes que reciben MC intraarterial deben ser monitoreados con mayor atención, debido al riesgo de AKI posterior al contraste.
Expansión de volumen: la administración de volumen incrementa el flujo urinario, reduce la concentración del MC en el túbulo, favorece la eliminación y limita la exposición de los túbulos a los efectos deletéreos del MC (34). Diferentes soluciones han sido probadas para buscar disminuir la presentación de CA-AKI en los pacientes en riesgo, aunque la mayoría se han estudiado en población adulta y no en los pacientes pediátricos, por lo que la mayoría de la información se toma de dichos estudios. Las principales estrategias se describen a continuación:
Solución salina 0,9 %: la solución salina ha sido la estrategia de intervención más utilizada a lo largo del tiempo. No existen estudios en población pediátrica que hayan evaluado su efecto, pero en adultos como en el estudio de Jurado-Román et al. en 408 pacientes con STEMI (infarto de miocardio con elevación del ST), quienes fueron llevados a PCI (intervención coronaria percutánea), se les administró SSN a 0,9 % a 1 mL/kg/h por 24 horas vs. no administración de SSN a 0,9 %. El grupo de SSN a 0,9 % presentó una incidencia de AKI de 10,8 % vs. 21 % en el grupo sin SSN a 0,9 % (35). Por otra parte, en el estudio AMACING con 660 adultos con ERC estadio 3, la hidratación preventiva con SSN a 0,9 % falló en demostrar un beneficio en términos de AKI, pero reportó 4 % de falla cardiaca sintomática en el grupo de tratamiento. Liu et al. observaron un aumento del riesgo de CA-AKI y muerte en pacientes con ERC con excesiva hidratación, calculada por el peso (36).
Actualmente se recomienda para pacientes hospitalizados el uso de SSN a 0,9 % a 1 mL/kg/hora por 12 horas antes y después del procedimiento. Para pacientes que tengan el procedimiento el mismo día se administra SSN a 0,9 % o bicarbonato a 3 mL/kg/h 1 hora antes del procedimiento y 6 horas después del procedimiento (27).
Bicarbonato de sodio: un estudio reciente, el PRESERVE trial, ensayo clínico aleatorizado, doble ciego, controlado, con 5177 pacientes adultos de alto riesgo de CI-AKI llevados a angiografía, encontró que el bicarbonato de sodio a 1,26 % no fue superior a la SSN a 0,9 % en la prevención de CI-AKI y la N-acetilcisteína (NAC) no fue mejor que el placebo (28).
Las estrategias óptimas de expansión de volumen, el tipo, la cantidad, el tiempo y la duración permanecen hasta el momento sin resolver, ya que no hay protocolos establecidos en la población pediátrica.
Diuresis forzada: se basa en el principio de limitar la exposición de los MC debido a la generación de un alto flujo urinario sin causar hipovolemia. En adultos, el estudio P.R.I.N.C. E (37), realizado en 98 personas seleccionadas para angiografía electiva y ERC estadio 3-4 donde se midió el estado de volumen del paciente con un catéter Swan-Ganz en el grupo de intervención y todos los participantes tuvieron catéter vesical. El mantenimiento de un buen gasto urinario (150 mL/h), seguido a la administración del MC, se asoció con reducción del riesgo de AKI, pero su carácter invasivo y no estudios en niños hace que sea poco reproducible.
El RenalGuard® system (38, 39) es una nueva estrategia con un dispositivo de reemplazo de solución en tiempo real en partes iguales con el gasto urinario para mantener la euvolemia, para la prevención de la CA-AKI. El posicionamiento de un catéter vesical y la falta de evidencia en niños hace que esta estrategia no sea aún recomendada.
Estrategias farmacológicas: basados en los mecanismos de acción y evidencia en adultos, se han probado algunas estrategias farmacológicas para la prevención de CI-AKI en pediatría, pero aún no son ampliamente aprobadas. Estas se presentan a continuación:
N-acetilcisteína (NAC): es un antioxidante, quelante de radicales libres con una amplia evidencia en adultos como agente preventivo de CI-AKI. Tepel et al. (40-42) con 83 pacientes con ERC, a quienes se les debía hacer TAC con agente de contraste no iónico o de baja osmolaridad, fueron aleatorizados a recibir NAC y SSN a 0,45 % vs. placebo y SSN a 0,45 %. En el grupo de intervención hubo un RR 0,1 IC 95 % (0,02-0,9).
La dosis recomendada por expertos es de 12 mg/kg/dosis cada 12 horas por 48 horas, asegurando una dosis previa a la infusión del MC. El uso de este medicamento se ha puesto en duda, luego de los resultados del estudio PRESERVE donde no hubo beneficio en adultos con ERC. Algunos autores avalan su uso en conjunción con estrategias de expansión de volumen por su buen perfil de seguridad y experiencia en algunos centros, aunque no haya una evidencia contundente que la apruebe en niños (43).
Acetazolamida: es un inhibidor de la anhidrasa carbónica que ha sido propuesto como agente para prevención de CA-AKI. Un estudio con 96 pacientes pediátricos con ERC (media de TFG 52 mL/min/1,73m2), quienes iban a estudios con MC, recibieron acetazolamida 5 mg/kg 2 horas antes y 12 horas después del MC. La incidencia de CA-AKI fue del 0 % vs. 8,8 % en el grupo control (P = 0,049). Aunque prometedor, no hay evidencia que confirme este hallazgo en la población pediátrica (44, 45).
Dexmedetomedina: alfa 2 agonista con mayor uso para sedación consciente en el contexto de unidad de cuidados intensivos. Bayram et al. (45) desarrollaron un estudio controlado y aleatorizado en 60 niños con cardiopatía congénita que iban a ser llevados a angiografía. Se les administró una dosis de 1 ug/kg en 10 min. seguido de infusión 0,5 ug/kg/h; los autores encontraron que la tasa de CA-AKI en el grupo de intervención fue de 10 % comparado con 36,7 % en el grupo control. No hubo diferencia significativa en la tasa de efectos adversos. Ensayos futuros deben ser realizados para determinar la efectividad del medicamento en la prevención de CA-AKI (46-50).
Las múltiples intervenciones acá mencionadas sugieren que no hay una única intervención para prevenir CA-AKI, resaltando que en pediatría muchas de estas intervenciones no han sido probadas en ensayos clínicos aleatorizados. Se propone entonces el siguiente algoritmo a la luz de la evidencia actual, para definir la intervención individualizada de cada paciente (figura 1).
Notas aclaratorias: NAC: N-acetilcisteína, SSN: solución salina. *Signos de sobrecarga hídrica: edema en extremidades, edema en regiones declive o escrotal, aumento de peso > 10 % respecto a peso basal, crépitos y sospecha de edema pulmonar o derrame pleural, hepatomegalia, ingurgitación yugular.
Historia natural y pronóstico
En la mayoría de los casos de CA-AKI, la reducción de la TFGe es autolimitada y tiene una mejoría entre 3 y 7 días. Menos del 1 % de los casos de CA-AKI requiere diálisis (7). La tasa de desenlaces desfavorables en pacientes pediátricos con CI-AKI fue determinada por Cantais et al. (3) en un estudio de cohorte retrospectiva de 346 pacientes pediátricos. En este grupo de pacientes, 10,8 % desarrollaron CI-AKI y de estos el 45,8 % presentaron desenlaces desfavorables definidos como: necesidad de readmisión hospitalaria, necesidad de ingreso a Unidad de Cuidados Intensivos o mortalidad a los 30 días (3).
Conclusión
La lesión renal aguda inducida por contraste en Pediatría es una condición cuya incidencia ha venido en aumento en los últimos años, siendo la tercera causa de lesión renal aguda adquirida en el hospital. Existe poca información y estudios en la población pediátrica acerca de su prevalencia, incidencia, factores de riesgo y protocolos de tratamiento.
Con esta revisión queda claro que se necesitan estudios adicionales que permitan evaluar la validez de las recomendaciones extrapoladas de los estudios en población adulta a la pediátrica y es necesario establecer protocolos pediátricos de nefroprotección y aumentar la concientización en el personal de salud en altos niveles de complejidad, para el reconocimiento y el tratamiento preventivo oportuno de esta complicación entre los pacientes sometidos a ayudas diagnósticas con contraste.