Introducción
El cáncer es la segunda causa de mortalidad y morbilidad en los pacientes de postrasplante renal después de la enfermedad cardiovascular (1). En general, los receptores de trasplante de riñón tienen un aumento en la incidencia de neoplasias en comparación con la población general, la cual es directamente proporcional al tiempo del trasplante; posterior al trasplante renal la incidencia de cáncer aumenta al 5 % a los 5 años, al 10 % después de 10 años y más del 25 % después de 20 años (2).
La mayor incidencia se observa con el sarcoma de Kaposi (con una incidencia de hasta 300 veces mayor que la de individuos sanos), cánceres de piel no melanomas (incidencia de 2-40 veces), trastornos linfoproliferativos postrasplante (incidencia de 4-16 veces) y cánceres urogenitales (2).
Los factores de riesgo más importantes para desarrollar cáncer postrasplante de riñón incluyen: edad, etnia, género, tabaquismo, historia previa de cáncer, tiempo del trasplante, diálisis previa al trasplante, factores relacionados con el trasplante y manejo inmunosupresor (2) (tabla 1).
Los mecanismos principalmente descritos que aumentan el desarrollo de cáncer postrasplante incluyen cánceres asociados a enfermedad renal crónica como el mieloma, el cáncer renal o urotelial o también los tumores asociados a virus oncogénicos y el manejo inmunosupresor a largo plazo (3).
El sarcoma de Kaposi es un trastorno angioproliferativo, principalmente relacionado a la infección por el virus del herpes humano tipo 8 (4). Este se clasifica en cuatro tipos según las circunstancias clínicas en las que se desarrolla: clásico; endémico; asociado a síndrome de inmunodeficiencia, ya sea iatrogénico (asociado con la terapia de medicamentos inmunosupresores) o asociado al SIDA (5). La piel es el sitio más común para el desarrollo de malignidad, sin embargo puede comprometer mucosas y órganos viscerales principalmente ganglios linfáticos, tracto gastrointestinal y pulmones (6).
La mayoría de los casos de sarcoma de Kaposi relacionados con el trasplante de órganos se han producido en personas de ascendencia mediterránea, judía, árabe, caribeña o africana (7). En un estudio de cohorte de Sudáfrica, el sarcoma de Kaposi fue el cáncer más común detectado en receptores de trasplante renal en personas de raza africana (7). Por el contrario, en Estados Unidos, de 244.964 receptores de trasplantes entre 1987 y 2014, solo 163 (0,07 %) desarrollaron sarcoma de Kaposi (8). Los hombres, las razas no blancas y los receptores de trasplante de pulmón tenían un mayor riesgo de este tipo de neoplasia (8).
Presentación del caso
Paciente femenina de 47 años de vida, con antecedente de enfermedad renal crónica, de etiología desconocida, a quien se le realizó trasplante renal con donante cadavérico en el 2004, con pérdida de este por rechazo crónico mediado por anticuerpos, sensibilizada con Single Bed Antigen Clase I y II, positivo con MFI mayor a 2000 canales para múltiples antígenos. Fue llevada a nuevo trasplante renal con donante vivo el 9 de noviembre del 2017, su donante fue el hermano, con un mismatch de 0/0 incluyendo el DQ, estatus de citomegalovirus del donante IgG positivo, receptor IgG positivo, estatus de Epstein Barr virus IgG positivo y receptor IgG positivo. Se realizó terapia de inducción con timoglobulina de 6 mg/kg de peso, dosis total acumulada (75 mg por 4 dosis), mantenimiento con tacrolimus (protocolo institucional con manejo de niveles entre 5 y 10 ng/ml), micofenolato mofetilo (2 gr/día) y prednisolona (1 mg/kg/día), así como profilaxis con valganciclovir durante los primeros tres meses del trasplante, con evolución favorable en el postrasplante, una función inmediata del injerto renal y una biopsia renal de protocolo al tercer mes (protocolo Banff) sin hallazgos de importancia en la microscopía de luz, sin evidencia de rechazo celular, también se realizaron: estudio de inmunofluorescencia y ultra estructura con depósitos de C3 mesangial electrónica sin depósitos de complejos inmunes, sin dobles contornos glomerulares, ni multilaminación de la membrana basal del capilar peritubular, biopsia sin cambios por nefropatía por C3 con protocolo inespecífico.
En junio del 2018 presentó aumento de tamaño y dolor en amígdala izquierda asociado a cambios en diámetro y textura (figura 1), asociado a pérdida de peso no voluntario, odinofagia y adenopatías cervicales bilaterales mayores a 1 cm de diámetro, de consistencia firme y no dolorosas; por dichos hallazgos se sospechó de enfermedad linfoproliferativa postrasplante, carcinoma escamocelular o enfermedad por citomegalovirus. Se realizaron estudios complementarios, carga viral para CMV negativa, tomografía de cuello con hallazgos de adenomegalias cervicales bilaterales (figura 2), tomografía de tórax sin lesiones evolutivas en parénquima pulmonar, ni otras alteraciones (figura 3).
Debido a hallazgos clínicos y paraclínicos fue llevada a biopsia ganglionar cervical por cirugía de cabeza y cuello con reporte de patología de sarcoma de Kaposi con estudios de inmunohistoquímica, los cuales muestran reactividad en la población de células neoplásicas para CD34 y HHV-8. El índice de proliferación medido con Ki67 es del 30-40 %. No hay reactividad para antígeno común leucocitario, desmina, actina de músculo liso, s100, coctel de queratinas ni CD 117 (figuras 3 y 4).
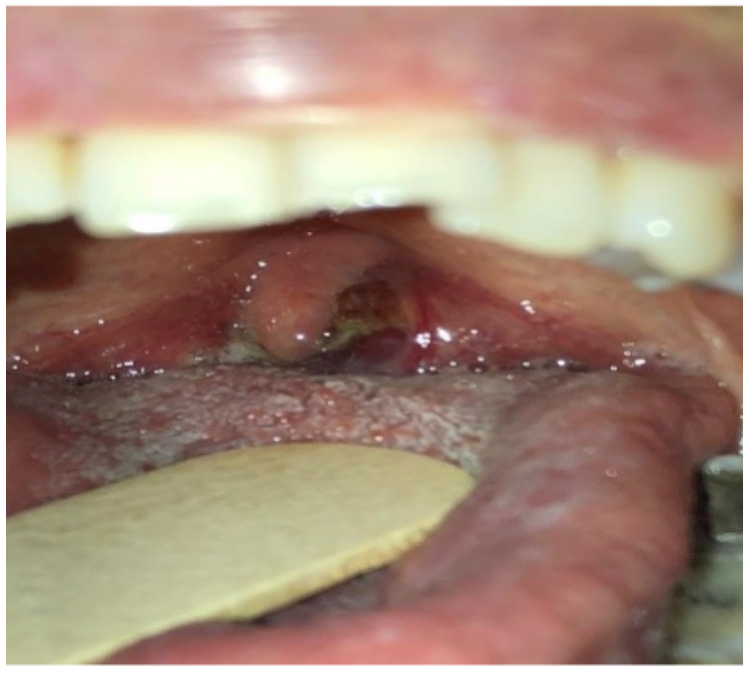
Fuente: archivo de Radiología e Imágenes, Clínica Universitaria Colombia.
Figura 1 Crecimiento amigdalino con cambios en coloración
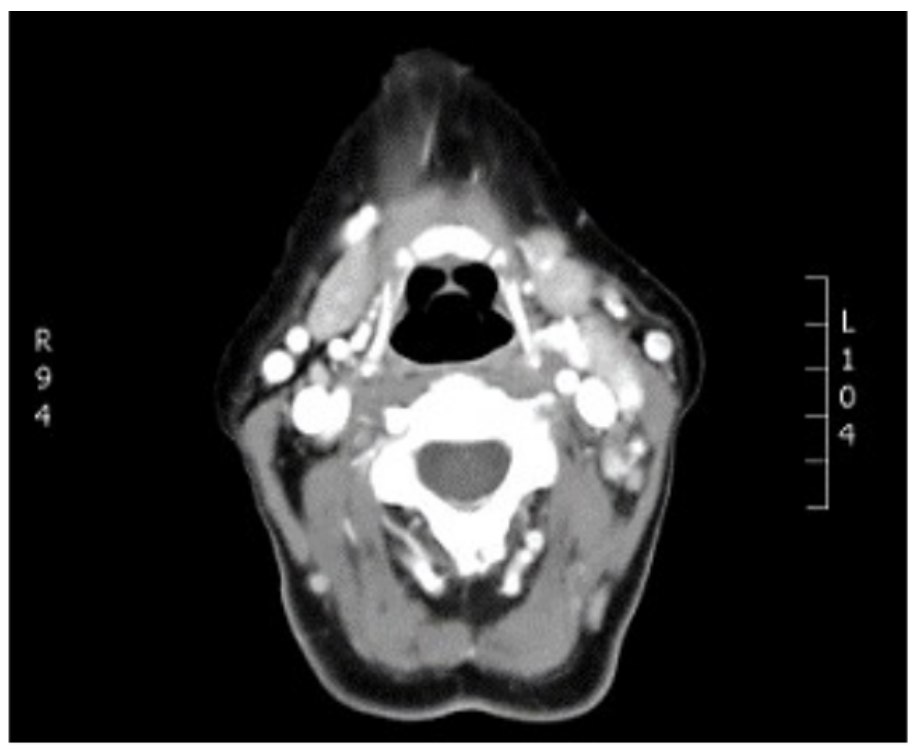
Fuente: archivo de Radiología e Imágenes, Clínica Universitaria Colombia.
Figura 2 Tomografía de cuello: adenomegalias cervicales
Fuente: archivo de Radiología e Imágenes, Clínica Universitaria Colombia.
Figura 3 Tomografía de tórax con adenomegalias
Se realizó el diagnóstico de sarcoma de Kaposi con compromiso amigdalino y ganglionar, por tal motivo se decidió realizar ajuste en el manejo inmunosupresor de base, se suspendió el tacrolimus y el micofenolato, y se inició manejo con belatacept de 250 mg endovenoso mensual y everolimus 1 mg oral cada 12 horas, previa toma de IgG para EBV por VCA y por EBNA, el cual es positivo y PPD de 0 mm.
La paciente fue valorada en conjunto por Oncología y por el grupo de trasplante, donde se decidió no adicionar manejo con quimioterapia o radioterapia. En el seguimiento a las 12 semanas se evidenció una resolución de la lesión en amígdala y de las adenopatías cervicales. Actualmente, la paciente completó dos años de seguimiento posterior al diagnóstico, sin evidencia de recurrencia tumoral y con función renal con creatinina de 0,9 mg/dl, proteinuria de 190 mg en 24 horas, SBA clase I y II negativos, y continúa en esquema con belatacept y everolimus (niveles del everolimus por protocolo institucional de 3-8 ng/ml).
Discusión
Existe un mayor riesgo de una amplia variedad de neoplasias asociadas con el trasplante de órganos sólidos. Uno de ellos es el sarcoma de Kaposi, el cual tiene un tiempo medio de aparición de 13 a 21 meses después del trasplante (8). En el caso de nuestra paciente se presentaron síntomas a los 8 meses después del trasplante, con compromiso a nivel amigdalino y con presencia de ganglios cervicales. Aunque la presentación clínica del sarcoma de Kaposi clásico se manifiesta como lesiones angiomatosas que afectan predominantemente la piel, la incidencia varía según la población, aproximadamente el 90 % de los pacientes tienen lesiones cutáneas o en mucosas, mientras que el 10 % tiene una enfermedad que se limita a las vísceras (9). En los últimos años se ha comenzado a reportar la afectación en la orofaringe del sarcoma de Kaposi asociado a inmunosupresión (10). La afectación de mucosas es frecuente a nivel oral y puede ser la manifestación inicial del sarcoma de Kaposi hasta en un 15 % de los casos, como nuestra paciente (10).
Dentro de los factores de riesgo evidenciados en el caso, encontramos la presencia del virus del herpes humano tipo 8 (HHV-8), detectado por inmunohistoquímica en el tejido tumoral de la biopsia de ganglio cervical. Un estudio de pacientes con trasplante de riñón en Arabia Saudita evidenció una incidencia más alta de anticuerpos antivirus del herpes tipo 8 específicos en pacientes con sarcoma de Kaposi en comparación con aquellos sin sarcoma de Kaposi (92 % vs. 28 %) (4). En un informe de 400 receptores de trasplantes de riñón consecutivos, 32 tenían anticuerpos contra el virus del herpes tipo 8 al momento del trasplante, tres años después de la cirugía, el 28 % de los pacientes con anticuerpos positivos había desarrollado sarcoma de Kaposi en comparación con ningún caso en los pacientes con anticuerpos negativos (12). Adicionalmente, hay pruebas convincentes de transmisión del virus del herpes tipo 8 del donante al receptor de trasplante renal y cardiaco (13, 14).
La infección por virus del herpes tipo 8 es necesaria pero no suficiente para el desarrollo del sarcoma de Kaposi. La disfunción inmunológica relacionada con el trasplante es un factor contribuyente importante (15). El HHV-8 tiene la capacidad de generar angiogénesis mediada por la vía vascular y el factor de crecimiento endotelial, al igual que modifica la regulación de la inmunidad antiviral y altera el crecimiento celular a través de oncogenes virales y proteínas antiapoptóticas, produce principalmente una interleucina-6 análoga que se une a los receptores celulares de IL-6 humana generando inflamación y angiogénesis (16).
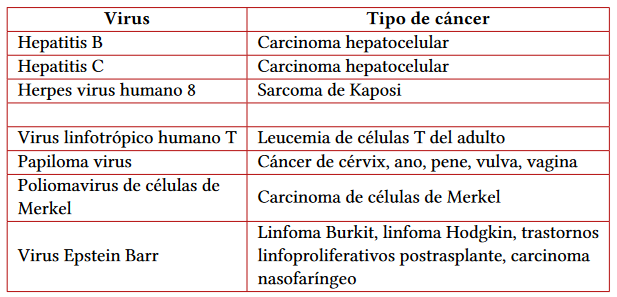
Existen otros virus que pueden ser carcinógenos en pacientes trasplantados, principalmente el virus de Epstein Barr (EBV), virus del papiloma humano y poliomavirus de células de Merkel (tabla 2).
Otra de las complicaciones comunes de los pacientes postrasplante tiene relación con los trastornos linfoproliferativos, muchos de estos relacionados con la infección por virus del Epstein Barr. Dicha infección es común en la mayor parte del mundo, ya que aproximadamente del 90 al 95 % de los adultos muestran evidencia serológica para virus del Epstein Barr (17).
La infección aguda conduce a una expansión policlonal de las células B que albergan el virus. En individuos inmunocompetentes, los antígenos virales expresados por estas células B provocan una respuesta de células T citotóxicas que elimina la gran mayoría de las células B infectadas, tal respuesta del huésped a menudo se asocia con el síndrome clínico de mononucleosis aguda; sin embargo, una pequeña subpoblación de células B infectadas regula negativamente la expresión del antígeno viral y escapa de la vigilancia inmunitaria. Estas células B latentemente infectadas persisten durante toda la vida y si disminuye la inmunidad de las células T, pueden dar lugar a trastornos linfoproliferativos (18). Varias proteínas codificadas por EBV impulsan eventos de señalización que contribuyen directamente al crecimiento y la supervivencia de las células B.
Dos proteínas de membrana, la proteína de membrana latente 1 y la proteína de membrana latente 2A, transmiten señales que imitan ciertos aspectos de la activación de células B mediada por antígenos (18). Otras dos proteínas nucleares del virus, EBNA-2 y EBNA-LP, son reguladores de la transcripción de genes del huésped (18). En conjunto, estos y otros factores codificados por el virus transforman las células B en células linfoblastoides inmortalizadas.
En el caso de otros virus, como el virus del papiloma humano (VPH), su mecanismo cancerígeno aún no está bien documentado, sin embargo, el VPH se ha detectado con mayor frecuencia en piel lesionada que no lesionada en receptores de trasplantes de órganos con cáncer escamocelular (90 % vs. 11-32 % de las muestras positivas para virus del papiloma humano) (19). Los subtipos del virus del papiloma humano, como VPH 5, VPH 8 y VPH 9 (que se consideran no patógenos para la población general), pueden inducir lesiones cutáneas preneoplásicas y neoplásicas en pacientes inmunodeprimidos y pueden desempeñar un papel causal en los carcinomas escamocelulares postrasplante (20).
En cuanto al poliomavirus de células de Merkel, este es un virus causalmente relacionado con el desarrollo del carcinoma de células de Merkel (21). Estudios anteriores han informado sistemáticamente que el virus se puede detectar en aproximadamente el 80 y el 60 % de todos los carcinomas de células de Merkel mediante PCR en tiempo real y por inmunohistoquímica (22). Un metaanálisis en 2015 de 23 estudios encontró una prevalencia global del virus del 79 % (IC del 95 %: 72-84 %) en los tumores de células de Merkel frente al 12 % (IC del 95 %: 8-9 %) en las muestras de piel de control (23). Se desconoce el mecanismo por el cual la inmunosupresión interactúa con el virus y la exposición a la radiación UV en la patogenia del carcinoma de células de Merkel, pero se cree que la inmunosupresión puede facilitar la replicación del virus y aumentar la posibilidad de integración del virus en la célula progenitora del carcinoma. Además, la vigilancia inmunitaria reducida puede contribuir a la supervivencia y la proliferación de células atípicas (24).
Otro factor de riesgo importante en la paciente tiene relación con el manejo inmunosupresor a altas dosis, dado que existe una relación dependiente de la dosis entre los inhibidores de calcineurina y las neoplasias malignas secundarias (25). En un ensayo prospectivo se asignaron al azar 231 receptores de aloinjertos renales después de 12 meses de terapia inmunosupresora estándar para recibir dosis de ciclosporina ajustadas para producir concentraciones mínimas en sangre de 100 ng/ml o dosis que produjeron concentraciones mínimas de 200 ng/ml. En un periodo de seguimiento de 66 meses, los pacientes que recibieron el régimen de ciclosporina de dosis baja tuvieron una incidencia significativamente menor de todos los cánceres secundarios (23 % vs. 37 %), particularmente en cánceres de piel (17 % vs. 26 %) (26).
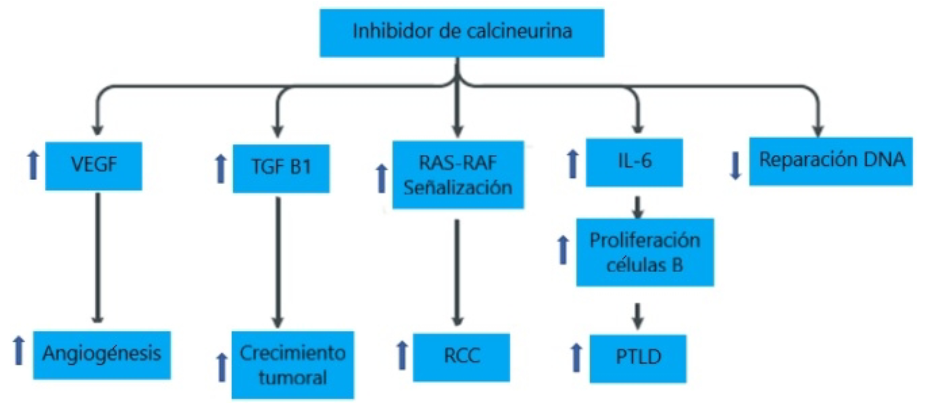
Estudios experimentales han demostrado varios mecanismos para el desarrollo y el crecimiento del cáncer debido a los inhibidores de la calcineurina como el tacrolimus y la ciclosporina. Estos pueden aumentar la producción del factor de crecimiento transformante β1 (TGFβ1) en células tumorales, lo que conduce a un mayor crecimiento tumoral (25). La ciclosporina también puede aumentar la expresión del factor de crecimiento endotelial vascular (VEGF), lo que conduce a un aumento en la angiogénesis para el crecimiento tumoral y se ha informado que aumenta la producción de IL-6 en células B, llevando a la activación y la proliferación de las células B y, por consiguiente aumentando el riesgo de desarrollo del trastorno linfoproliferativo postrasplante (PTLD) (27). Además, la ciclosporina puede afectar directamente la reparación del ADN en receptores de trasplante de riñón, estudios in vitro e in vivo han demostrado la activación de la vía oncogénica RAS-RAF por inhibidores de calcineurina que contribuyen al crecimiento del carcinoma de células renales. Por otra parte, el uso de tacrolimus también aumenta el riesgo de malignidad después del trasplante de riñón y parece aumentar los niveles de TGF-beta al igual que la ciclosporina (figura 4) (2).
Fuente: (2).
Figura 4 Inhibidor calcineurina. Notas aclaratorias: VEGF: factor de crecimiento endotelial vascular; TGF B1: factor de crecimiento transformante β1; RCC: crecimiento de carcinoma en células renales; PTLD: trastorno linfoproliferativo postrasplante
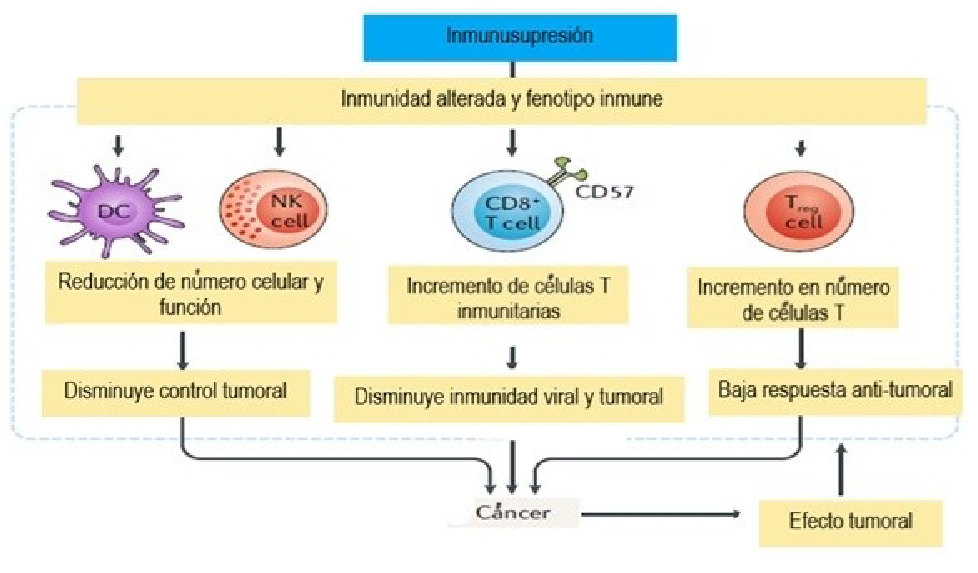
Se ha demostrado que la inmunosupresión a largo plazo genera cambios a nivel celular que pueden favorecer la generación de neoplasias, estos incluyen una reducción del número y la función de las células dendríticas y células natural killer, así como un aumento en las células T reguladoras. Estos cambios en las células inmunitarias pueden estar asociados con deficiencias en la vigilancia de tumores, alteración en la inmunidad contra antígenos virales o tumorales y disminución de la respuesta inmunitaria antitumoral, contribuyendo así al desarrollo del cáncer (figura 5) (2).
En contraparte, se ha evidenciado que la modificación de la terapia inmunosupresora puede traer efectos benéficos en los pacientes postrasplante. La sustitución de ciclosporina por sirolimus en receptores de trasplante de riñón se ha asociado con una regresión completa del sarcoma de Kaposi (28). La ciclosporina fue sustituida por sirolimus en un estudio de 15 pacientes con trasplante de riñón con sarcoma de Kaposi y esto resultó en la desaparición de las lesiones en todos los pacientes a los tres meses, sin observarse episodios de rechazo agudo o disminución de la función renal (29).
Otros ensayos clínicos, comparando terapia inmunosupresora basada en inhibidores de calcineurina vs. inhibidores m-TOR, han demostrado una reducción en la incidencia de cáncer pos trasplante en la población que recibe terapia basada en inhibidores m-TOR en el seguimiento a largo plazo (30). Los inhibidores de m-TOR como el sirolimus y el everolimus inhiben la producción de VEGF y la respuesta de las células endoteliales al VEGF.
En la biopsia de piel se encontró que las lesiones de Kaposi tenían niveles aumentados de VEGF, Flk-1 / KDR y Akt fosforilado y p70S6, los cuales son moléculas reguladas por los m-TOR, esto sugiere que la regresión se debió en gran parte a la inhibición directa del sarcoma por sirolimus más que a la retirada de ciclosporina (29).
Los resultados de un metaanálisis publicado en el 2014, incluyendo varias estrategias de inmunosupresión encontró una reducción del 40 % del riesgo de cáncer postrasplante y de un 56 % de reducción en el riesgo de cáncer de piel no melanoma en pacientes que reciben esquemas basados en inhibidores m-TOR, tanto de novo, como en conversión, lo que se correlaciona con el papel pro-oncogénico de los inhibidores de calcineurina relacionados con el tiempo de exposición y las dosis en el postrasplante renal (31). En el caso de nuestra paciente se decidió la suspensión completa del inhibidor de calcineurina y el micofenolato, y el cambio a terapia basada en inhibidor m-TOR (everolimus), además, debido al riesgo inmunológico del paciente se asoció manejo con belatacept, con lo que se logró, en el seguimiento, una resolución completa de la neoplasia, logrando un estado de inmunosupresión adecuado con estabilidad de la función renal y la negativización de anticuerpos anti HLA a los dos años de seguimiento, sin recurrencia tumoral.
Conclusiones
El sarcoma de Kaposi es una de las neoplasias postrasplante con mayor incidencia comparativamente con la población no trasplantada, donde el papel de la reactivación de la infección viral más el papel de la inmunosupresión son puntos fundamentales en la génesis de la neoplasia. La determinación del estatus serológico IgG para HHV8 podría ser una estrategia de determinación del riesgo en el pretrasplante. La reducción de la inmunosupresión y el cambio a terapias basadas en inhibición de la vía m-TOR son los puntos principales en el manejo, este caso es el primero en reportar una estrategia de manejo basada en inhibidores m-TOR y belatacept con respuesta adecuada.