Introducción
El ácido úrico es el producto final de la degradación de las purinas en los primates, incluido el humano, en este proceso, adenina y guanina son convertidas a inosina y guanosina por la acción de enzimas nucleotidasas y, posteriormente, son transformadas en hipoxantina, que finalmente se transforma en xantina, este último metabolito se convierte en ácido úrico, donde los últimos dos pasos son catalizados por la enzima xantinoxidasa (1).
El ácido úrico también proviene de comidas ricas en glutamato, fructosa, con alto contenido de sodio o glucosa y el exceso en el consumo de alcohol (2).
En las aves y los reptiles, el ácido úrico es convertido, por acción de la uricasa, en un metabolito más soluble: la alantoína. Esta enzima se pierde en el proceso evolutivo, probablemente durante el mioceno, quizá como un mecanismo para evitar el ortostatismo durante la bipedestación y mantener las reservas de grasa, por esa razón los primates, incluido el ser humano, manejan niveles circulantes de ácido úrico superiores a lo de todos los demás mamíferos (1, 2).
El proceso de excreción renal de ácido úrico lleva cuatro pasos: filtrado glomerular, reabsorción, excreción tubular y, posteriormente, una nueva reabsorción, estas últimas tanto en túbulos proximales como distales (3). Así, dos terceras partes del ácido úrico son eliminadas por vía renal y una tercera parte a través de las heces fecales (2).
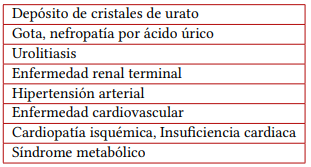
En condiciones normales, el ácido úrico es un agente antioxidante endógeno (de hecho, es el agente con mayor capacidad para recolectar radicales libres de oxígeno) que participa también en la respuesta inmune, promoviendo la activación de linfocitos T y que también favorece la función intelectual en homínidos (4), sin embargo, cuando los niveles séricos de urato se incrementan, participan en el desarrollo de diversas enfermedades, las que se enlistan en la tabla 1 (5, 6).
Desde el siglo XIX, se conoce la asociación entre hiperuricemia y daño renal, con la descripción de una nefritis intersticial con destrucción del glomérulo, los túbulos y las arteriolas en pacientes con gota (7).
Uno de los factores que confunden sobre la participación del daño renal ocasionado por la uricemia, es que la concentración sérica de uratos se modifica de acuerdo con la función renal, lo que dificulta establecer si la hiperuricemia es causa o efecto (8).
La relación entre aumento en los niveles séricos de urato y daño renal agudo está bien establecida, este incremento es un predictor independiente tanto de lesión renal aguda como de nefropatía crónica, como se revisará más adelante (3).
Mecanismos de daño renal por hiperuricemia
Nefropatía crónica
La hiperuricemia puede causar daño renal por diversos mecanismos, enlistados en la tabla 2. El aumento en los niveles séricos de ácido úrico favorece su depósito en los túbulos, generando atracción de neutrófilos, los cuales fagocitan los cristales de urato y finalmente ocurre la lisis del neutrófilo y la liberación del contenido a la matriz renal, amplificando el daño e induciendo el incremento sérico de diversos marcadores de inflamación y fibrosis (3).
También se produce activación del eje renina-angiotensina, así como alteraciones en la hemodinámica renal (3, 7), estos cambios generan proliferación mesangial, disfunción endotelial y apoptosis de células endoteliales y tubulares, además de engrosamiento de la capa media de las arteriolas aferentes (arteriolopatía aferente) (3).
El ácido úrico intracelular tiene efectos prooxidantes, estimula la actividad de la enzima nicotin-adenin dinucleótido fosfato-oxidasa, generando disfunción mitocondrial (7) y todo ello condiciona para hipertensión arterial, disminución del flujo sanguíneo renal, pérdida de la capacidad de autorregulación de las arteriolas, hipertensión intraglomerular, isquemia glomerular y disminución del filtrado glomerular (3, 7).
Daño renal agudo
Un mecanismo de daño renal agudo, ocasionado por el ácido úrico, es el depósito de cristales que puede llevar a la insuficiencia renal aguda (3), como se ve en el síndrome de lisis tumoral, donde la destrucción celular ocasiona la liberación a la circulación de nucleótidos provenientes del ácido desoxirribonucleico, lo que finalmente produce una elevación abrupta del ácido úrico, el cual se deposita en los túbulos renales llevando a inflamación y obstrucción (3, 9).
También la hiperuricemia puede afectar la autorregulación arteriolar, la disfunción endotelial, la activación del sistema renina angiotensina, la vasoconstricción y la reducción del flujo renal y la oliguria (9).
Ácido úrico y enfermedad renal crónica
Como se comentó previamente, los pacientes con gota tienen mayor riesgo de presentar enfermedad renal crónica, por ello, desde hace unos años se ha puesto atención en el papel del ácido úrico como factor de riesgo para el desarrollo de enfermedad renal terminal (10).
En un estudio realizado en el sistema de salud del Reino Unido (10), se encontró que la gota aumenta el riesgo de desarrollar enfermedad renal crónica (RR 2,0, IC 95 % 1,92-2,07), con una incidencia de 8,54 por mil habitantes, contra 4,08 en sujetos sin gota y la asociación fue más fuerte en quienes padecían enfermedad renal terminal (2,13 IC 95 % 1,73-2,61), pero no hubo relación con muertes asociadas a enfermedad renal crónica.
En un estudio poblacional, donde se analizó la asociación entre enfermedad renal crónica con los niveles séricos de ácido úrico, se encontró una relación entre niveles elevados de ácido úrico y riesgo de enfermedad renal terminal de nueva aparición (RR 2,02, IC 95 % 1,24-3,38), al comparar con sujetos con valores bajos de ácido úrico en suero, en forma independiente al índice de masa corporal, la edad, el sexo y la hipertensión arterial (11).
Aunado a lo anterior, la hiperuricemia suele asociarse con hipertensión arterial y con diabetes mellitus, dos entidades que favorecen el deterioro renal y, de forma interesante, la hiperuricemia favorece el desarrollo de ambas patologías (3, 4).
En un estudio que incluyó a 21.475 sujetos seguidos por siete años, los niveles de ácido úrico entre 7 y 8,9 casi duplicaron el riesgo de enfermedad renal (RM 1,74 IC 95 % 1,45-2,09) y cifras por arriba de 9 mg/dl triplicaron dicho riesgo (3,21, IC 95 % 2,29-4,5) (12).
Se ha visto que la presencia de niveles elevados de ácido úrico durante el primer año después de un trasplante renal predice la pérdida del órgano trasplantado (13). Un estudio japonés en sujetos mayores de 40 años, seguidos por cinco años, demostró que presentar valores séricos del metabolito > 5,9 mg/dl es un factor de riesgo importante para desarrollar enfermedad renal crónica y proteinuria (14).
Ácido úrico y enfermedad renal aguda
La hiperuricemia también se relaciona con daño renal agudo, diversas condiciones como la nefropatía por cisplatino, cirugía cardiaca, leucemia aguda, tratamiento con quimioterapia de las neoplasias, quemaduras y exposición a medios de contraste radiológico (9).
Se ha descrito que valores séricos de ácido úrico > 5,5 mg/dl se asocian un aumento de más de cuatro veces al riesgo de desarrollar daño renal postoperatorio (9) y varios reportes muestran la asociación entre niveles séricos de ácido úrico y daño renal agudo en pacientes sometidos a cirugía cardiaca, incluso años después de la cirugía (15).
En el síndrome de lisis tumoral, la liberación de grandes cantidades de ácido desoxirribonucleico y posteriormente purinas a la circulación, ocasiona aumento en los niveles de ácido úrico, lo que se ha asociado con precipitación y obstrucción de los túbulos renales por cristales de este metabolito, inflamación y daño renal agudo (15).
Cada aumento de 1 mg/dl en las cifras de ácido úrico aumentan un 16 % al riesgo de presentar daño renal por material de contraste (14).
Ácido úrico, daño renal y enfermedad cardiovascular
La principal causa de muerte en pacientes con enfermedad renal terminal es la enfermedad cardiovascular y es importante señalar que la hiperuricemia también se asocia a enfermedad cardiovascular en sujetos sin enfermedad renal crónica (9).
Hay estudios que muestran que hay un aumento marginal de ECV en hombres con urato sérico > 7,0 mg/dl, sin asociación con mortalidad y riesgo incrementado de enfermedad CV y muerte en mujeres con urato sérico > 7,0 mg/dl; aunque no hay estudios que evalúen si la hiperuricemia aumenta el riesgo cardiovascular en pacientes con enfermedad renal crónica, la hiperuricemia también se asocia con insuficiencia cardiaca y aumento de riesgo de enfermedad vascular cerebral, incluso después de ajustar con respecto a hipertensión arterial y otros factores de riesgo cardiovascular (16).
Un subanálisis del estudio LIFE reportó que las cifras basales de urato sérico se asociaron significativamente con un aumento de los eventos cardiovasculares (RR 1,024 IC 95 % 1,017- 1,032) en toda la población del estudio, aunque la asociación fue más fuerte en mujeres (17).
Adicionalmente, un estudio reciente encontró que los individuos con gota que experimentaron un evento cardiovascular tuvieron, en forma significativamente más alta, un brote reciente de gota en los días anteriores. Estos hallazgos sugieren que los brotes de gota se asocian con un aumento transitorio de los eventos cardiovasculares después del brote (18). Por su parte, el ácido úrico se asocia a una mayor rigidez arterial en sujetos con síndrome metabólico, lo que contribuye a aumentar el riesgo de complicaciones cardiovasculares (19).
Materiales y métodos
Manejo profiláctico de la hiperuricemia
Si bien ninguna guía de manejo recomienda el uso de fármacos hipouricemiantes en pacientes asintomáticos, sin duda alguna las modificaciones al estilo de vida sí deben usarse en sujetos con niveles aumentados de ácido úrico, sean o no sintomáticos.
Algunas de ellas son dieta y ejercicio, reducción en la ingesta de alcohol, carne, y evitar bebidas azucaradas con fructuosa (5). Vale la pena recordar que la vitamina C es un uricosúrico débil, por lo que pueden emplearse alimentos que la contengan (5).
En algunos casos especiales, el manejo farmacológico de pacientes con hiperuricemia asintomáticos está justificado y se enlistan en la tabla 3 (5).
El uso de inhibidores de la xantinoxidasa en sujetos con cáncer que reciben quimioterapia o radioterapia para prevenir la nefropatía por lisis tumoral está totalmente justificado, aunque estén asintomáticos (5).
Recientemente la Agencia Europea de Medicamentos aprobó el uso de febuxostat en pacientes con hiperuricemia y depósito de cristales, detectado por ultrasonido en articulaciones metatarsofalángicas (20).
Resultados
Manejo hipouricemiante y protección renal
En cuanto al aspecto renal, se justifica el uso de fármacos hipouricemiantes en sujetos con hiperuricemia y deterioro de la función renal (caída del FG > 4 ml/min/1,73m2) en un año (21). Varios grupos también la recomiendan con fines de nefroprotección cuando los niveles séricos de ácido úrico sean > 13 mg/dl en hombres o > 10 mg/dl en mujeres (5).
Por otro lado, varios estudios han mostrado que el uso de inhibidores de la xantinoxidasa (alopurinol o febuxostat) atenúa la disminución de la función renal y la progresión de la enfermedad renal crónica en sujetos con gota (22, 23), sin embargo, no han mostrado un beneficio para pacientes con diabetes mellitus ni con nefropatía por IgA (22).
El uso de inhibidores de la xantinoxidasa (tanto alopurinol como febuxostat) en pacientes hipertensos con hiperuricemia, mostró que ambos fármacos retardan la progresión del daño renal en estos pacientes, un análisis de regresión multivariado expuso una asociación inversa entre los cambios en el filtrado glomerular y los ocurridos con las cifras séricas de urato (24).
Un análisis pos hoc de un estudio que incluyó a 113 pacientes seguidos durante dos años y posteriormente siguió a 107 pacientes por cinco años más, encontró que los pacientes que recibieron 100 mg de alopurinol tuvieron significativamente menos eventos renales comparados con el grupo control (RR 0,32; IC 95 %, 0,15-0,69; P = 0,004) incluso después de ajustar para edad, sexo, función renal basal, nivel de ácido úrico y bloqueadores del sistema renina-angiotensina-aldosterona (25).
Los inhibidores de SGLT2, canagliflozina y empagliflozina, reducen los niveles séricos de ácido úrico, posiblemente por la activación indirecta (a través de glucosuria) del transporte de urato mediado por GLUT9 (26).
En el estudio Controlled Trial of Slowing of Kidney Disease Progresion from the inhibition of Xantine Oxidase (CKD-FIX), el uso de alopurinol de 100 a 300 mg en 185 pacientes con enfermedad renal crónica estadio 3 o 4, no redujo la caída en el filtrado glomerular cuando se comparó con un grupo similar con placebo, en un seguimiento a 104 semanas (27). Por otro lado, el uso de alopurinol a las mismas dosis, en pacientes con enfermedad renal leve a moderada, preservó la función renal en un seguimiento a un año, al compararse con placebo (28). Lo anterior sugiere que el uso de inhibidores de la xantinoxidasa protege al riñón en casos de enfermedad de leve a moderada, pero no en casos de enfermedad renal avanzada, este concepto requiere ser confirmado en estudios posteriores.
Un ensayo aleatorizado controlado con placebo mostró que el inhibidor de SGLT2, empagliflozina, disminuyó la progresión de la enfermedad renal en pacientes con diabetes mellitus tipo 2 y la necesidad de terapia de reemplazo renal, además, el fármaco también redujo eficazmente los niveles séricos de ácido úrico, por lo que los autores postularon una posible contribución de este último efecto sobre los resultados renales (29).
Discusión
Manejo hipouricemiante y cardioprotección
Diversos estudios muestran que el uso de alopurinol mejora el riesgo cardiovascular en enfermos con enfermedad renal crónica; en un seguimiento a 9 meses de 67 pacientes con hiperuricemia tratados con 300 mg de alopurinol o placebo, este mostró mejoría en la función endotelial, el índice de aumentación y la hipertrofia ventricular izquierda en el grupo con alopurinol (30). Además, tres metaanálisis encontraron una reducción del 60 % en eventos cardiovasculares en pacientes con enfermedad renal crónica que recibieron alopurinol comparados con el placebo (9).
En el estudio pos hoc comentado previamente, el uso de alopurinol redujo significativamente la aparición de eventos cardiovasculares (RR 0,43; IC 95 % 0,21-0,88; P = 0,02), ajustado por edad, sexo y función renal basal (25). Por su parte, en pacientes hipertensos con enfermedad renal crónica, el uso de alopurinol disminuyó en un 65 % los eventos cardiovasculares y la mortalidad total en 178 pacientes seguidos durante 18 meses (31).
Recientemente se publicó que, en pacientes con gota, los eventos cardiovasculares mayores (RR 7,40, IC 95 % 5,38-10,17) y la muerte por causa cardiovascular aumentaron significativamente desde el día 2 hasta 6 meses después de la interrupción de febuxostat o alopurinol (32), lo que sugiere que la interrupción de ambos fármacos puede aumentar las complicaciones cardiovasculares, asociado con la hiperuricemia que acompaña a la suspensión de dichos fármacos. El uso de fármacos que disminuyen las cifras de ácido úrico también se acompaña de disminución de las cifras de presión arterial en pacientes hipertensos (2).
Conclusión
El papel de la hiperuricemia como factor de riesgo independiente para la enfermedad renal crónica sigue siendo controversial, pero actualmente contamos con evidencia experimental y epidemiológica, así como con ensayos clínicos para apoyar tal relación y que el tratamiento reductor del ácido úrico puede prevenir la progresión de la enfermedad renal crónica.
Si bien el tratamiento profiláctico de la hiperuricemia asintomática aún está bajo debate, los niveles aumentados de urato se asocian con daño renal, tanto agudo como crónico.
El uso de fármacos inhibidores de la xantinoxidasa parece acompañarse de mejoría en la función renal, la presión arterial y la reducción del riesgo cardiovascular, y su suspensión en enfermos de gota parece incrementar dicho riesgo.
La administración de inhibidores de la xantinoxidasa en pacientes con enfermedad renal crónica establecida parece detener la progresión del daño renal en los casos de enfermedad leva a moderada, pero no en enfermedad avanzada (27, 28). Nosotros recomendamos el uso profiláctico de inhibidores de la xantinoxidasa, además de las situaciones descritas en la tabla 3, en los siguientes casos:
Pacientes con enfermedad renal y riesgo de presentar un evento cardiovascular a 10 años por arriba del 10 % y niveles séricos de ácido úrico > 9 mg/dl, insistiendo en que se trata de opinión de los autores basada en los resultados de los estudios comentados (9,25,29,30).
Pacientes hipertensos con hiperuricemia y riesgo de presentar un evento cardiovascular a 10 años por arriba del 10 % y niveles séricos de ácido úrico > 9 mg/dl o deterioro de la función renal. Esta opinión la basamos en el estudio que mostró que cifras de urato mayores a 9 mg/dl triplican el riesgo de enfermedad renal (12).
Pacientes con hiperuricemia y enfermedad renal crónica de leve a moderada.