1 Introducción
Los alimentos son la base de la nutrición y determinan el estado de salud de los seres humanos. En su procesamiento es necesaria la creación de nuevas industrias que cumplan con los lineamientos legales establecidos por las entidades de control y de la población en términos de calidad, nutrición e inocuidad; por consiguiente, garantizar la elaboración de productos saludables, seguros e inocuos para el consumo de la población se convierte en una prioridad.
De acuerdo a la encuesta de ingresos y gastos EIG 2006-2007, se encontró que las personas en Colombia destinaban 19% al rubro de “alimentos y bebidas no alcohólicas”, que correspondía al tercer renglón de gastos más importante dentro de los hogares promedio colombianos, lo cual es un dato valioso al analizar las dinámicas entorno al consumo de algunos alimentos que conforman este gasto1.
El consumo mundial de jugos de frutas superó los 80 mil millones de litros en 2015, lo que representa el 10 % del volumen actual de bebidas refrescantes, según estudios de la consultora Zenith International. Se prevé que el consumo de jugo a nivel global (África, Medio Oriente, Asia Pacífico, América Latina, Norteamérica y Europa Occidental) va a seguir en aumento a un ritmo de 5%, llegando a 105 mil millones de litros en 20202.
El informe cubre jugos de frutas al 100%, néctares con un 25-99% de contenido de jugo, y bebidas con sabor a fruta con un 5-24 % contenido frutal2.
Las bebidas con sabor a frutas es el segmento más importante al representar alrededor del 50% del consumo de jugos en el año 2015. Norteamérica y Europa occidental tienen el consumo porcentual per cápita de jugo más alto, mientras que Asia Pacífico es el mercado más grande, con el 40% de las ventas mundiales2.
El Ministerio de Salud y Protección Social, define un néctar de fruta como un producto sin fermentar, elaborado con jugo (zumo) o pulpa de frutas concentrados o no, clarificados o no, o la mezcla de estos, adicionado de agua, aditivos permitidos, con o sin adición de azúcares, miel, jarabes, o edulcorantes o una mezcla de estos3. Uno de los principales retos del sector de la industria de alimentos es corresponder con la demanda de la población generando equilibrio entre costo, beneficio y calidad y, finalmente, enfocándolo directamente al uso de los conservantes más adecuado en eficiencia y estabilidad4.
El uso de antimicrobianos como agentes conservantes es una práctica común en la industria de los alimentos. Tradicionalmente, se han utilizado antimicrobianos sintetizados químicamente (que en algunos casos causan daño en la salud de los consumidores (como en el caso de los sulfitos) redundando en un rechazo por parte de los consumidores de productos procesados, por lo cual ha surgido la necesidad de buscar otras opciones. En esta búsqueda se han encontrado nuevos agentes antimicrobianos de origen natural, como sustitutos5.
En la actualidad existen diversos agentes conservantes y/o aditivos permitidos con gran eficiencia en la inhibición de la carga microbiológica contaminante en diferentes etapas del proceso de producción; sin embargo, la tendencia es cada vez consumir productos más frescos y sanos, lo más parecido a su forma original. Esto debido a que se ha asociado el consumo de conservantes químicos como son los benzoatos, nitritos y nitratos, anhídrido sulfuroso (SO2), entre otros con intoxicaciones, cáncer y otras enfermedades degenerativas. Esto genera la necesidad de buscar alternativas de conservación que cubran las mismas propiedades antimicrobianas y compatibilidad con el alimento5.
Una de las alternativas más viables corresponde a los conservantes de origen natural encontrada en el potencial de la naturaleza. La actividad antimicrobiana de hierbas y plantas es generalmente atribuida a los compuestos fenólicos presentes en sus extractos o aceites esenciales6 y se ha observado que la grasa, proteína, concentración de sal, pH y temperatura afectan la actividad antimicrobiana de estos compuestos5.
En la actualidad existen varias formas para aprovechar la actividad antimicrobiana de diferentes compuestos en la materia vegetal7, una de ellas es la obtención de los aceites esenciales cuya actividad de inhibición microbiana se basa en el deterioro de varios sistemas enzimáticos, incluidos los involucrados en la producción de energía y la síntesis de componentes estructurales8. Por otra parte, los compuestos fenólicos y terpénicos afectan la actividad de las enzimas catalizadoras a nivel de la membrana, actuando como desacopladores, los cuales interfieren en la traslocación de protones sobre la membrana y, subsecuentemente, interrumpen la fosforilación del adenosín difosfato8.
Los antimicrobianos naturales más estudiados son los aceites esenciales9 de plantas, hierbas o especias como la pimienta de Jamaica (Pimenta dioica), orégano (Origanum vulgare), tomillo (Thymus vulgaris), clavo de olor (Syzygium aromaticum) y canela (Cinnamomum zeylanicum) y cuyos principales constituyentes son: el eugenol, timol, carvacrol y aldehído cinámico8.
Pastrana et al. (2017) referencian el estudio de las propiedades microbianas de 30 especias y resumen el espectro antibacteriano de cada una. Se encontró que el 80% de ellas inhibía el crecimiento de más del 50% de las bacterias del estudio, de hecho, el clavo y la canela, inhibieron entre el 75 y el 100% de las cepas bacterianas utilizadas en el estudio)10. Por lo anterior, se considera como principales opciones para la aplicación en bebidas tipo néctar de extractos acuosos de canela (Cinnamomum verum).
Al presente, la industria de alimentos utiliza en todo el mundo una gran cantidad de antimicrobianos. Estos difieren según el país, ya que su uso está regulado por las leyes alimentarias de cada nación. La producción de antimicrobianos genera una fuente de ingresos económicos importante a nivel mundial. Tan solo en los Estados Unidos en 1991 se consumieron 37,5 millones de kilogramos de conservantes, cifra que va en aumento desde entonces. Se estima que, a nivel mundial, el consumo de antimicrobianos aumenta 4,1% anualmente, siendo los más utilizados los sorbatos, los propionatos y los benzoatos5.
La actividad antimicrobiana de estos aditivos se debe porque atacan la pared y/o membrana celular, enzimas metabólicas, la síntesis de proteínas y el sistema génico11. Cada uno de estos puntos, son esenciales para el desarrollo celular, por lo tanto, si uno de ellos es atacado o inactivado, la velocidad de crecimiento del microorganismo se afecta5.
Sin embargo, muchos alimentos contienen compuestos naturales con actividad antimicrobiana. En estado natural, estos compuestos pueden desempeñar el papel de prolongadores de la vida útil de los alimentos. Incluso muchos de ellos han sido estudiados por su potencial como antimicrobianos alimentarios directos12. El uso de aditivos alimentarios de origen natural implica el aislamiento, purificación, estabilización e incorporación de dichos compuestos a los alimentos con fines antimicrobianos, sin que ello afecte negativamente a las características sensoriales, nutritivas y a su garantía sanitaria. Esto tiene que lograrse manteniendo los costos de formulación, procesamiento o comercialización. Los sistemas antimicrobianos naturales pueden clasificarse por su origen5:
1. Origen animal, incluye proteínas, enzimas líticas como lisozima, hidrolasas como lipasas y proteasas y polisacáridos como el quitosán.
2. Origen vegetal, incluye compuestos fenólicos provenientes de cortezas, tallos, hojas, flores, ácidos orgánicos presentes en frutos y fitoalexinas producidas en plantas.
3. Origen microbiano, incluye compuestos producidos por microorganismos como las bacteriocinas y antibióticos5.
Algunas otras especias y hierbas exhiben actividad antimicrobiana; entre las usadas en alimentos se encuentran por ejemplo el apio, cilantro, laurel, almendra, albahaca, café, angélica, puerro, rábano picante, hierbabuena, tomillo, etc. Los compuestos presentes en especias y hierbas que tienen actividad antimicrobiana son derivados simples y complejos del fenol, los cuales son volátiles a temperatura ambiente. Las especias son raíces, cortezas, semillas, brotes, hojas o frutos de plantas aromáticas que se añaden a los alimentos como agentes saborizantes. Sin embargo, se sabe desde tiempos antiguos que las especias y sus aceites esenciales tienen diferentes grados de actividad antimicrobiana. El primer reporte del uso de las especias como conservantes se remonta a 1.550 años a.c., cuando los egipcios las empleaban para conservar alimentos y embalsamar muertos 5.
Ciertas especias inhiben el crecimiento de microorganismos. En general son más efectivas frente a organismos Gram-positivos que frente a bacterias Gram-negativas 5:
Canela, clavo y mostaza: gran poder conservante “El aceite esencial de canela está constituido fundamentalmente por 65 - 75% de aldehído cinámico y de 5 - 10% de eugenol”8.
Pimienta negra/roja, jengibre: inhibidores débiles frente a una gran variedad de microorganismos.
Pimienta, laurel, cilantro, comino, orégano, romero, salvia y tomillo: actividad intermedia.
Otros: anís, menta, hinojo, apio, eneldo, cúrcuma.
La función conservadora se debe a los aceites esenciales que poseen, en cuya composición se encuentran compuestos tipo eugenol o aldehído cinámico con poder antimicrobiano, aunque también presentan actividad las oleorresinas de estas especias5.
A pesar de las grandes alternativas que representa el uso de conservantes de origen natural podemos citar algunas desventajas o impactos negativos generados por sus usos: por ejemplo, una alta concentración de sus extractos es necesaria para obtener un efecto de preservación y, por lo tanto, se generan alteraciones en el sabor. Por consiguiente, el uso de extractos vegetales como agentes antimicrobianos está limitada a los alimentos en los cuales el cambio en el sabor es considerado deseado5.
La acción de los antimicrobianos sobre las células de los microorganismos en la conservación de alimentos está basada en una gran variedad de efectos individuales13 dentro de los que se incluyen mecanismos físicos, fisicoquímicos y reacciones bioquímicas de la célula afectada. Algunas veces diversos factores individuales pueden producir un efecto tanto acumulativo como de bloqueo10. Ellos actúan sobre los microorganismos inhibiendo la síntesis de la pared, de la membrana celular, de los ácidos nucleicos y la de las proteínas. Los solutos hidrofílicos de menor tamaño son capaces de pasar la membrana externa a través de los poros proporcionando a las proteínas transmembranales canales hidrófilos, mientras que la membrana externa sirve como barrera de penetración hacia las macromoléculas y compuestos hidrófobos, y es por esta razón que las bacterias Gram-negativas son relativamente resistentes a los antibióticos y a las drogas tóxicas hidrófobas10.
El género Cinnamomum, familia Lauraceae, es nativa de Sri Lanka. Son árboles de hojas perennes y aromáticos en su mayoría. Su sabor es debido a sus aceites esenciales aromáticos, que comprenden entre el 0,5% y 1% de su composición14. Comprende una variedad de especies que están distribuidas en Asia y Australia, de las cuales las más representativas, por sus aceites, son: Cinnamomum zeylanicum, C. cassia y C. camphora15. Cinnamomum zeylanicum (canela) a veces conocido como C. verum, es oriundo de Sri Lanka y su aceite extraído de la corteza y de las hojas tiene diversas aplicaciones; en cocina, en bebidas, en la industria farmacéutica y en perfumería. El aceite esencial de la Canela, tiene entre sus componentes a (E)-cinnamaldehido (68,95%), benzaldehido (9,94%) y (E)-cinnamylacetatoe (7,44%), los cuales demostraron proporcionar propiedades antimicrobianas y anticarcinogénicas, sugiriendo ser empleadas 10 contra infecciones y neoplasias15.
Entre los efectos antimicrobianos de C. verum tenemos el aumento de la permeabilidad y la salida de iones de la membrana. Dicha actividad se da gracias a la acción de componentes como taninos, saponinas, compuestos fenólicos, aceites esenciales y flavonoides. Incluso sus extractos etanólicos muestran gran actividad contra las cepas resistentes, a diferencia de los antibióticos convencionales, cuya aplicación, en condiciones similares, fracasa15.
Los estudios muestran que el aceite esencial de C. verum y sus componentes poseen actividad antimicrobiana, insecticida, acaricida, actividad antitirosinasa, antioxidante y antimutagénica. Otra función del aceite de la canela es la de inducir a la apoptosis. Esto a su vez genera la consecuente necrosis a través de un mecanismo por el cual se interfiere con la función mitocondrial de las células de las levaduras. Incluso, se ha demostrado que la canela, en diversas células cancerosas presenta actividad citotóxica, así como apoptosis. El efecto antimicrobiano dura hasta las 24 horas después de la exposición. Éste resulta mayor sobre levaduras que sobre bacterias; sin embargo, si comparamos sus efectos con los de otros aceites, la canela guarda una mayor actividad antimicrobiana15.
Las sustancias antioxidantes pueden ayudar a proteger el organismo humano o animal contra varios tipos de daños oxidativos, ocasionados por especies reactivas del oxígeno16 (anión superóxido, radical hidroxilo, peróxido de hidrógeno, ozono, oxígeno singlete, entre otras) y del nitrógeno (óxido nítrico, dióxido de nitrógeno, radical peroxinitrito). Los oxidantes y antioxidantes juegan papel importante en la patogenia de un número importante de enfermedades (cáncer, diabetes, artritis, envejecimiento prematuro, Parkinson, aterosclerosis) y lesiones tisulares como las úlceras y la inflamación17.
Con el presente estudio se espera un gran impacto en las áreas de producción industrial de bebidas a base de néctares de frutas, orientado hacia la implementación de estrategias naturales de conservación de alimentos, la reducción de costos de fabricación, la reducción del impacto negativo generado por los conservantes químicos sobre la salud de los consumidores, la reducción en la emisión de agentes contaminantes como resultados de los procesos industriales de elaboración de alimentos, la conservación de los recursos naturales (aire, suelo, agua)18) e incentivar en el sector educativo en la investigación y la creación de nuevas alternativas para la producción de alimentos sanos e inocuos que garanticen los requerimientos nutricionales de los consumidores sin generar efectos secundarios; sin dejar a un lado las políticas normativas y de producción sostenible, en vista del aprovechamiento de las nuevas tecnologías, conocimientos y la gran esencia de los recursos con los que contamos.
2 Materiales y métodos
Fase I - Obtención de los extractos acuosos
Los extractos acuosos fueron obtenidos implementando la metodología propuesta por Sánchez-Barrueto y Luján-Corro (2013)15. Se pesaron 50 gramos de la materia seca deshidratada de canela (astilla de Canela) y se mezclaron con 250 mL de agua destilada estéril del equipo desionizador de agua Milipore. Posteriormente se llevó a calentamiento a 100 ºC, durante 15 minutos (Figura 1). Se dejó enfriar y sedimentar los sólidos presentes en la mezcla durante dos horas y posteriormente se realizó la separación de las fases mediante mecanismos de filtración.

Figura 1 Alistamiento de materiales en cabina de flujo laminar: Materiales utilizados en la obtención de los extractos acuosos de canela (Cinnamomum verum), posterior al proceso de esterilización a 121 °C, 15 PSI, durante 15 minutos.
Inicialmente se realizó la separación de los sólidos de mayor tamaño con el uso de gasas estériles y posteriormente se realizó el proceso de filtración utilizando membranas de celulosa con diámetro de poro de 0,45 mµ, en sistema de vacío. Se recolectó el producto del proceso de filtración en recipientes estériles color ámbar (Figura 2) y se le realizó control microbiológico de microorganismos indicadores de contaminación en el proceso (mesófilos aerobios, mohos y levaduras), evidenciando ausencia de contaminación en los extractos acuosos. Los frascos ámbar fueron almacenados en la nevera de refrigeración a temperatura entre 2 y 4 ºC.

Figura 2 Izquierda: Pesaje materia seca de canela. Derecha: Filtrado de la solución acuosa. Método de preparación para los extractos acuosos de canela (Cinnamomum verum). A la izquierda se observa el pesaje de la materia seca de canela en la balanza de precisión y en la derecha el filtrado final de la solución, a través de una membrana de celulosa con diámetro de poro de 0,45 mµ, para extraer las partículas con diámetro superior a 0,45 mµ.
Fase II - Inclusión de los extractos acuosos en el proceso de producción
Se evaluó el efecto de la presencia de los extractos acuosos de canela (C. verum) en la formulación de néctares de pera, manzana y durazno, en paralelo con tratamientos adicionados con los conservantes de origen químico convencionales (sorbato de potasio) y un tratamiento control al cual no se le adicionó ningún tipo de conservante. Se establecieron para cada tipo de fruta los siguientes tratamientos a los cuales no se les aplicó tratamiento térmico de pasteurización:
Tratamiento 1: Control (néctar sin la adición de sorbato de potasio, sin la adición de extractos acuosos de canela).
Tratamiento 2: Sorbato de potasio (néctar + sorbato de potasio) concentración 0,5 g/Litro de preparación.
Tratamiento 3: Canela (néctar + extracto acuoso de canela) concentración 0,2 g/Litro de preparación.
El proceso de producción fue ejecutado en la planta piloto de FRUVER ubicado en la sub sede Álamos en Bogotá, con el apoyo de los aprendices de los programas Tecnología en Control de calidad de alimentos, Tecnología en Procesamiento de alimentos y los aprendices del semillero de investigación “Alimentos Orgánicos” (Figuras 3 y 4). Los aditivos de diferente naturaleza fueron agregados a cada tratamiento bajo las mismas condiciones de personal, equipos, temperatura y humedad relativa. Los recipientes utilizados para envasar el producto fueron esterilizados en las mismas condiciones (frascos de vidrio borosilicato transparente tapa metálica con cierre hermético, con capacidad de 200 mL).

Figura 3 Alistamiento de materiales en planta de producción de FRUVER: Aprendices del programa Tecnología en Procesamiento de alimentos y los aprendices del semillero de investigación “Alimentos Orgánicos”, en el proceso de alistamiento de los materiales para producción.

Figura 4 Izquierda: Obtención de extractos acuosos de canela. Derecha: Adición de extractos acuosos a tanque mezclador: Proceso de adición de los extractos acuosos a las preparaciones con cada una de las frutas (pera, manzana y durazno).
Concluido el proceso de producción se evaluaron variables microbiológicas según normatividad legal vigente - Resolución 3929 de 2013 (mesófilos aerobios, mohos, levaduras, coliformes totales y Escherichia coli) y variables fisicoquímicas (acidez titulable, pH, grados Brix - sólidos solubles). Las diferentes pruebas fueron ejecutadas (Figura 5) con el apoyo de los aprendices perteneciente al grupo de semillero “Alimentos Orgánicos” en los laboratorios especializados para control de calidad de alimentos Microbiológico y Fisicoquímicos del Centro Nacional de Hotelería, Turismo y Alimentos.

Figura 5 Izquierda: Análisis fisicoquímico en muestras de néctar. Derecha: Análisis microbiológico en muestras de néctar: Aprendices del semillero “Alimentos Orgánicos”, desarrollando pruebas de análisis microbiológico y fisicoquímico a los productos terminados para el estudio de vida útil de los néctares.
Se evaluaron muestras en los días 0, 5, 10, 15, 20, 25 y 30, por triplicado cada tratamiento y a la vez cada prueba de laboratorio por triplicado. Los resultados del proceso fueron analizados de acuerdo con las diferencias presentadas entre cada uno de los tratamientos con el fin de evidenciar el comportamiento de las diferentes variables evaluadas en función del tiempo de vida útil estimando principalmente los requisitos microbiológicos en función de la posible capacidad antimicrobiana ejercida por los extractos acuosos de C. verum (Figura 6).
Fase III - Evaluación in vitro de los extractos acuosos de canela (Cinnamomum verum)
Sobre cinco (5) cepas de importancia en enfermedades transmitidas por alimentos (Enterococcus faecalis, Bacillus cereus, Pseudomonas aeruginosa, Streptococcus bovis y Candida albicans).
Se prepararon extractos acuosos de C. verum con el método propuesto por Sánchez-Barrueto y Luján-Corro (2013). Se pesaron 8, 12, 16, 20 y 24 gramos de la materia seca deshidratada de canela (astilla de canela) y se mezclaron en cinco (5) recipientes diferentes de vidrio borosilicato con 100 mL (Figura 7) de agua destilada estéril, posteriormente, se llevó a calentamiento a 100 ºC, durante 15 minutos. Se dejó enfriar y sedimentar los sólidos presentes en la mezcla durante 2 horas y se realizó la separación de las fases mediante mecanismos de filtración.

Figura 7 Preparación de los extractos acuosos de canela: Preparación de los extractos acuosos de canela (Cinnamomum verum) en concentraciones de 8, 12, 16, 20 y 24 gramos por 100 mL.
Se realizó la separación de los sólidos de mayor tamaño con el uso de gasas estériles y se efectúo el proceso de filtración utilizando membranas de celulosa con diámetro de poro de 0,45 mµ en sistema de cierre al vacío. Se recolectó el producto del proceso de filtración en recipientes estériles de vidrio y se realizó control de microorganismos indicadores de contaminación (mesófilos aerobios, mohos y levaduras) (Figura 7) evidenciando ausencia de contaminación en los extractos acuosos.
Se preparó una suspensión bacteriana para cada una de las cepas a evaluar, aplicando la metodología de escala de McFarland. En tubos con agua destilada estéril, con la ayuda de un asa de punta redonda se adicionó biomasa obtenida a partir de cajas de Petri con cultivos puros incubados en agar nutritivo incubados a 35 +/- 1 °C durante 18 a 24 horas. Posteriormente, se ajustó la turbidez del tubo hasta lograr la absorbancia requerida adicionando agua destilada estéril o biomasa del cultivo, obteniendo valores de absorbancia entre 0,148 y 0,162 con longitud de onda de 620 nm, en los cuales se asume que se presenta una concentración celular de 150.000.000 células/mL, según la escala de McFarland (Figura 8). Se confirmó la concentración celular para cada una de las suspensiones preparadas obteniendo rangos de concentración entre 6.300.000 y 400.000.000 células/mL.

Figura 8 Preparación de las suspensiones microbianas: Aprendices de semillero de investigación “Alimentos Orgánicos” e Instructor en la preparación de las suspensiones microbianas con base en la metodología escala de McFarland.
Posteriormente, se realizaron diluciones seriadas utilizando frascos de vidrio transparente boca ancha con 99 mL y 9 mL de agua destilada estéril a partir de las suspensiones iniciales para cada una de las cepas de trabajo, hasta lograr estandarizar suspensiones celulares de 150, 1.500 y 15.000 células/mL. De acuerdo con la Tabla 1, se obtuvieron diferentes valores de absorbancia para cada una de las suspensiones celulares con las cepas de referencia.
Tabla 1 Estandarización de la concentración celular
| Cepa Microbiana ATCC | Longitud de onda (ƛ) | Absorbancia | Concentración celular (Células/mL) |
|---|---|---|---|
| Bacillus cereus | 620 nm | 0,153 | 52.450.000 |
| Pseudomonas aeruginosa | 620 nm | 0,148 | 6.300.000 |
| Enterococcus faecalis | 620 nm | 0,162 | 399.500.000 |
| Streptococcus bovis | 620 nm | 0,152 | 250.700.000 |
| Candida albicans | 620 nm | 0,148 | 160.000.000 |
Concentraciones celulares de las cepas microbianas (Células/mL), en función de la absorbancia detectada por el equipo espectrofotómetro de luz UV vis a 620 nm de longitud de onda.
Se verificó la concentración celular de cada una de las preparaciones celulares con las cepas de referencia, realizando diluciones con base 10 adicionando 1 mL de la suspensión madre a un frasco con 99 mL de agua destilada estéril y de esta manera sucesivamente hasta encontrar el rango adecuado de lectura, los cuales fueron analizados por duplicado para dos diluciones consecutivas (Figura 8). De cada una de las diluciones se inoculó 1 mL en profundidad aplicando el método recuento de colonias, se llevó a incubación a 35 +/- 1 °C, durante 18 a 24 horas. Se realizó el conteo celular luego de trascurrido el periodo de incubación.
Luego de estandarizadas las suspensiones se procedió a la aplicación de los diferentes tratamientos: En 5 mL de caldo infusión cerebro corazón (BHI) se mezcló 1 mL de la suspensión celular con concentración conocida con 1 mL del extracto acuoso en cada una de las cinco concentraciones de (C. verum) (8 g/100 mL, 12 g/100 mL, 16 g/100 mL, 20 g/100 mL y 24 g/100 mL). Posteriormente se incuba a 35 +/- 1 °C, durante 18 a 24 horas, para comprobar finalmente la viabilidad de las células luego de la exposición a los extractos acuosos en un medio líquido nutritivo. Se realizó el conteo de las células viables utilizando la técnica de recuento de colonias en placa, inoculando en profundidad 1 mL de la mezcla de caldo nutritivo llevado previamente a incubación. Se llevó a incubación en aerobiosis a 35 +/- 1 °C, durante 18 a 24 horas, finalmente se realizó el conteo de las colonias y se estableció el porcentaje de remoción microbiana con respecto al conteo inicial en cada uno de los tratamientos.
Las mismas suspensiones microbianas con concentración conocida fueron aplicadas en las superficies de placas con agar PCA (Plate Count Agar), y posteriormente se ubicaron cinco discos de celulosa impregnados con cada una de las soluciones acuosos con C. verum) se llevó a incubación durante 24 +/- 2 horas y se tomó nota del halo de inhibición aclarado alrededor de los discos.
Nota: Se realizaron pruebas de identificación morfológica, agrupación y reacción a la tinción de Gram en las cepas de referencia utilizadas, evidenciando concordancia con respecto a las características esperadas. En la tabla 2 se resumen los resultados en la verificación de las propiedades microscópicas.
Tabla 2 Características morfológicas de las cepas de referencia
| Cepa de referencia | Tinción de Gram | Morfología | Agrupación |
|---|---|---|---|
| Enterococcus faecalis | (+) | Cocos | En cadenas |
| Bacillus cereus | (+) | Bacilos cortos | En pares |
| Pseudomonas aeruginosa | (-) | Bacilos | En Pares |
| Streptococcus bovis | Gram (+) | Cocos | En cadenas |
| Candida albicans | No aplica | Ovaladas | En racimos |
Resultados de la verificación microscópica luego de realizar el proceso de tinción de Gram, observando en el microscopio óptico a 100 X de aumento.
3 Resultados y discusión
Fase I - Obtención de los extractos acuosos
Se logró obtener extractos acuosos a partir de la materia seca de canela (C. verum), en una concentración de 0,2 g/L, lo cual se pudo incluir en la formulación del producto para los néctares de manzana, pera y durazno en la etapa previa al envasado. Se evidenció ausencia de microorganismos indicadores (mesófilos aerobios, mohos y levaduras) en las pruebas de control de calidad microbiológicos. Se presentó dificultad en la preparación de los extractos debido a que inicialmente la materia seca fue sometida a molienda, lo cual generó partículas finas que no quedaban retenidas en el filtrado primario, dificultando el paso de la solución a través de la membrana con diámetro de poro de 0,45 mµ, por lo cual se realizó el ensayo con materia seca en astilla. Finalmente, los extractos presentaron características de turbiedad de acuerdo con las concentraciones preparadas las cuales fueron de 0,2 g/L, para la aplicación en el proceso de planta y de 8g/100 mL, 12g/100 mL, 16g/100 mL, 20g/100 mL y 24g/100 mL para la evaluación de acción antimicrobiana en condiciones de laboratorio. Es importante tener en cuenta que, a pesar del proceso de filtrado en dos etapas, el producto final de los extractos acuosos de C. verum, cambiaban sus características de textura, densidad y apariencia luego de almacenados durante dos o tres días, principalmente presentándose dos fases en la solución lo que es una alteración en el producto, es preciso mencionar que las pruebas microbiológicas para los extractos acuosos después del tercer día, almacenados entre 2° y 6 °C, arrojan resultados conformes los parámetros indicadores de microorganismos mesófilos aerobios, mohos y levaduras. Por lo anterior es importante evaluar la estabilidad y las características fisicoquímicas de los extractos acuosos en función del tiempo y de acuerdo con los objetivos de este estudio considerar la preparación inmediatamente antes de la adición a los tratamientos con la finalidad de favorecer una mayor estabilidad de los compuestos activos.
Fase II - Inclusión de los extractos acuosos en el proceso de producción
El proceso de inclusión de los extractos de C. verum en los tratamientos designados para los néctares de pera, durazno y manzana significó un reto muy complejo debido a que la variable concentración podía afectar significativamente el sabor de los néctares, por lo anterior se adicionó un volumen de 10 mL de extracto acuoso de canela en concentración de 0,2 gramos por cada litro de preparación. Al realizar las pruebas de laboratorio se evidencia un efecto positivo en la conservación de néctares de manzana por la adición de extractos acuosos de canela en las características microbiológicas, hasta el día 27 de producción, sin la aplicación de tratamiento térmico (pasteurización) y almacenadas en un rango de temperatura entre 16° y 25 °C. Con respecto al tiempo de conservación se analiza que las variables temperatura de almacenamiento y la ausencia del tratamiento térmico, facilitan evidenciar el efecto de los extractos en un periodo de tiempo más reducido, por lo cual se considera una buena alternativa evaluar la acción de conservación por parte de los extractos en función de la temperatura de almacenamiento.
Se evidenció un efecto positivo en la conservación de los néctares de manzana y pera adicionados con extractos acuosos de canela en una concentración de 0,2 g/L, con respecto a los tratamientos control entre los días 20 y 30 post de producción. Para el caso de los néctares de durazno, no se evidenció un efecto significativo entre con respecto a los tratamientos control, para las muestras adicionadas con extractos acuosos de canela.
También fue posible verificar un comportamiento positivo en las muestras para los tratamientos adicionados con extractos acuosos de canela, con respecto al tratamiento con Sorbato de Potasio en la variable fisicoquímica pH, la cual presenta un comportamiento similar al tratamiento control (sin adición de conservantes), considerándose como un aporte importante en virtud de que el pH se constituye un factor sensible e influyente en el crecimiento microbiano y por ende se puede aprovechar en conjunto con las características del producto a trabajar como un factor de apoyo a la inhibición microbiana en las bebidas tipo néctares.
La variable pH fue afectada de manera significativa por la adición de extractos acuosos de canela, con referencia a los tratamientos con conservantes químicos convencionales (sorbato de potasio). Las variables mesófilas aerobios, mohos y levaduras, como indicadores de inocuidad fueron las más afectadas por la ausencia de conservantes en los tratamientos control.
Por otra parte, los parámetros seleccionados de carácter químico, después de comparar los efectos en las tres frutas, permiten observar que los grados Brix presentan un comportamiento muy inestable y por ende son los menos confiables, seguidos por el índice de acidez cuya variabilidad es menor, pero con presencia de datos por fuera del comportamiento medio esperado; Por último, el pH es la variable química que mejor se comportó en los análisis comparativos de las tres frutas.
Se identificaron las posibilidades de la inclusión de la canela como agente conservante, así como también considerando los aportes nutricionales que podría generar en diferentes alimentos de tipo bebidas y su incorporación en la gastronomía.
Fase III - Evaluación in vitro de los extractos acuosos de canela (Cinnamomum verum)
Al evaluar cinco cepas microbianas diferentes (Streptococcus bovis, Enterococcus faecalis, Pseudomonas aeruginosa, Candida albicans y Bacillus cereus) un rango de 150 a 15.000 células/mL, se pudo evidenciar que los tratamientos aplicados para los extractos acuosos en cada una de las cepas de trabajo, presentaron un efecto de inhibición en las concentraciones más elevadas (20 g/100 mL y 24 g/100 mL) (Figura 9), para todas las poblaciones evaluadas, mostrando un efecto marcado en su acción sobre las cepas Gram (+) positivas (S. bovis, E. faecalis y B. cereus) y C. albicans.
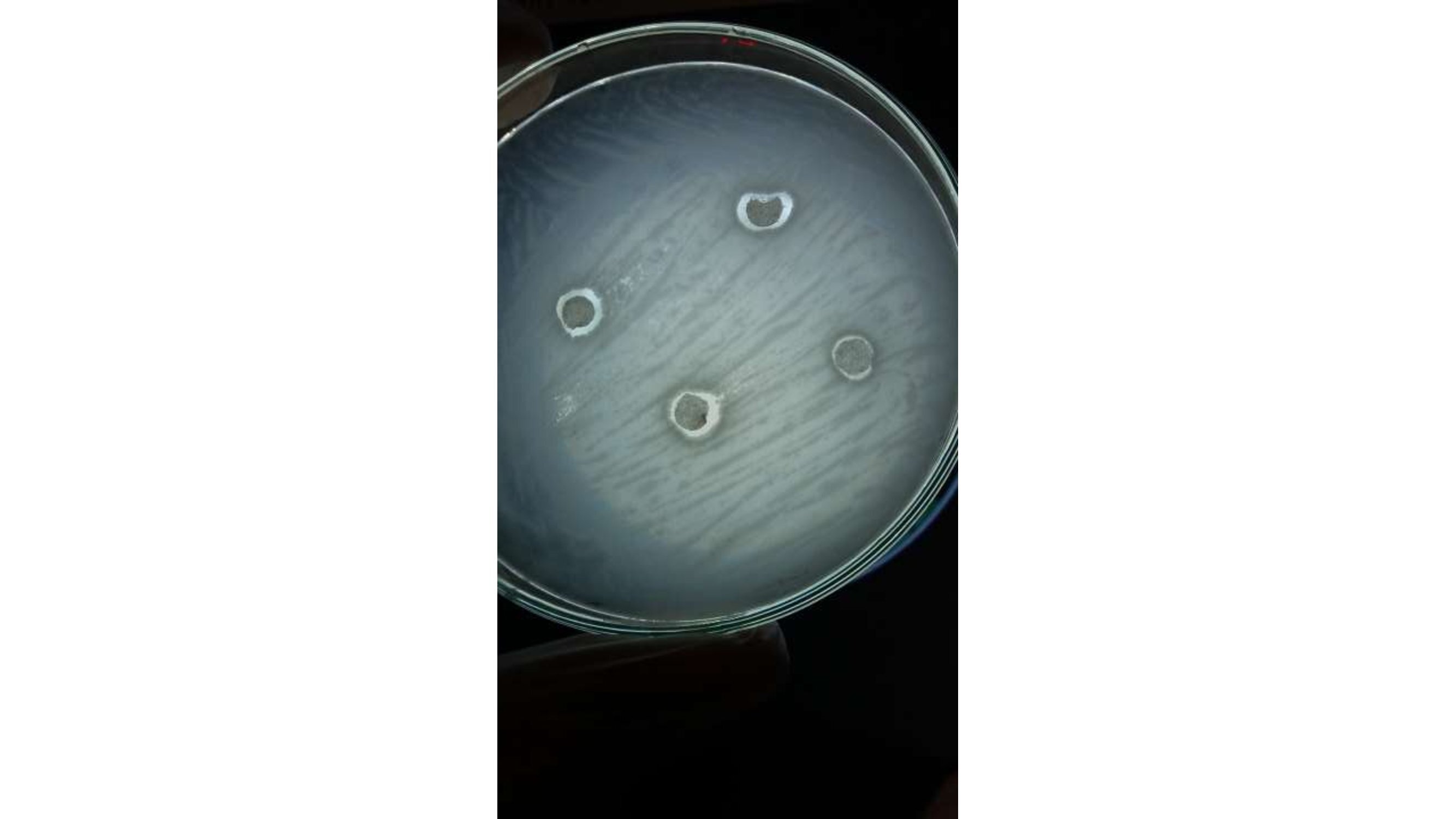
Figura 9 Halo de inhibición para Bacillus cereus: Halo de inhibición para la cepa de referencia ATCC Bacillus cereus, al aplicar discos impregnados con extractos acuosos de canela (Cinnamomum verum) en una concentración de 24 g/100 mL.
En el transcurso de este estudio se pudo evidenciar que las concentraciones más bajas de los extractos acuosos de canela no presentaron efecto de inhibición microbiana en ninguna de las poblaciones evaluadas (Tabla 3), a pesar de que la concentración empleada a nivel de planta fue de 2 gramos por cada 100 mL de preparación; lo que se puede explicar al considerar la concentración celular de los tratamientos empleados y el rango de trabajo; lo que finalmente nos conduce a pensar que el efecto antimicrobiano de los agentes activos de la canela son influenciados directamente por la densidad de la población celular del sustrato en el que se pretenda emplear y el tiempo de exposición en las condiciones específicas de almacenamiento. Para el caso de los tratamientos evaluados en el proceso de producción y el estudio de vida útil, se contempló un tiempo prolongado de almacenamiento lo que probablemente pudo favorecer el comportamiento y la acción germicida de los extractos acuosos de canela sobre la carga presente en los productos, permitiendo evaluar la estabilidad de los agentes activos en la canela.
Tabla 3 Resultados halos de inhibición sobre cepas de referencia
| Enterococcus faecalis | |||||
|---|---|---|---|---|---|
| Disco/Concentración del extracto (gramos/100 mL). | Halo de inhibición microbiana (mm) | ||||
| 6 g/100 mL | 12 g/100 mL | 16 g/100 mL | 20 g/100 mL | 24 g/100 mL | |
| Disco 1 | 0,0 | 0,0 | 0,0 | 0,2 | 1,2 |
| Disco 2 | 0,0 | 0,0 | 0,0 | 0,0 | 2,5 |
| Disco 3 | 0,0 | 0,0 | 0,0 | 0,0 | 1,5 |
| Disco 4 | 0,0 | 0,0 | 0,0 | 0,0 | 1,5 |
| Disco 5 | 0,0 | 0,0 | 0,0 | 0,0 | 1,5 |
| Bacillus cereus | |||||
| Disco/Concentración del extracto (gramos/100 mL). | Halo de inhibición microbiana (mm) | ||||
| 6 g/100 mL | 12 g/100 mL | 16 g/100 mL | 20 g/100 mL | 24 g/100 mL | |
| Disco 1 | 0,1 | 0,1 | 0,3 | 1,5 | 2,2 |
| Disco 2 | 0,0 | 0,2 | 0,3 | 1,2 | 1,5 |
| Disco 3 | 0,0 | 0,2 | 0,3 | 1,2 | 2,0 |
| Disco 4 | 0,0 | 0,0 | 0,0 | 1,5 | 2,0 |
| Disco 5 | 0,0 | 0,0 | 0,0 | 1,5 | 2,0 |
| Pseudomonas aeruginosa | |||||
| Disco/Concentración del extracto (gramos/mL). | Halo de inhibición microbiana (mm) | ||||
| 6 g/mL | 12 g/mL | 16 g/mL | 20 g/mL | 24 g/mL | |
| Disco 1 | 0,1 | 0,2 | 0,3 | 0,4 | 0,7 |
| Disco 2 | 0,1 | 0,2 | 0,3 | 0,3 | 0,5 |
| Disco 3 | 0,1 | 0,2 | 0,2 | 0,3 | 0,5 |
| Disco 4 | 0,0 | 0,0 | 0,2 | 0,3 | 0,4 |
| Disco 5 | 0,0 | 0,0 | 0,3 | 0,3 | 0,5 |
| Streptococcus bovis | |||||
| Disco/Concentración del extracto (gramos/mL). | Halo de inhibición microbiana (mm) | ||||
| 6 g/mL | 12 g/mL | 16 g/mL | 20 g/mL | 24 g/mL | |
| Disco 1 | 0,2 | 0,3 | 0,7 | 1,7 | 2 |
| Disco 2 | 0,2 | 0,2 | 0,4 | 2,0 | 2,5 |
| Disco 3 | 0,2 | 0,3 | 0,2 | 2,5 | 2,5 |
| Disco 4 | 0,3 | 0,2 | 0,3 | 1,0 | 2,5 |
| Disco 5 | 0,2 | 0,2 | 0,2 | 1,5 | 2,5 |
| Candida albicans | |||||
| Disco/Concentración del extracto (gramos/mL). | Halo de inhibición microbiana (mm) | ||||
| 6 g/mL | 12 g/mL | 16 g/mL | 20 g/mL | 24 g/mL | |
| Disco 1 | 0,1 | 0,1 | 0,7 | 1,0 | 2,0 |
| Disco 2 | 0,0 | 0,1 | 0,8 | 1,3 | 2,1 |
| Disco 3 | 0,0 | 0,1 | 0,5 | 1,2 | 1,8 |
| Disco 4 | 0,0 | 0,1 | 0,6 | 1,4 | 2,0 |
| Disco 5 | 0,1 | 0,1 | 0,5 | 1,2 | 1,5 |
Resultados de la evaluación del espectro de inhibición microbiana, al someter las suspensiones microbianas de las cepas (Streptococcus bovis, Enterococcus faecalis, Pseudomonas aeruginosa, Bacillus cereus y Candida albicans) a diferentes concentraciones de extractos acuosos de canela.
Por otra parte se evidenció que los extractos acuosos de canela presentan efecto de reducción en la población microbiana de cuatro (4) cepas patógenas de importancia en alimentos (S. bovis, E. faecalis, P. aeruginosa y B. cereus), en concentraciones dentro del rango entre 1,5x103 y 1,5x105 células/mL. En la Tabla 4, se plasman los resultados el ensayo de evaluación de la reducción celular de las cepas de trabajo, encontrando en el estudio que los extractos acuosos de canela en las concentraciones de 8 g/100 ml, 12 g/100 ml, 16 g/100 ml, 20 g/100 ml y 24 g/100 ml ejercieron reducción de la población celular en las cepas Gram (+) positivas (S. bovis, E. faecalis, P. aeruginosa y B. cereus), para las cepas Gram (-) negativas (P. aeruginosa) solo se presentó reducción a partir de la concentración de 8 g/100 mL (Tabla 4). Se encontró un 100 % de remoción microbiana solo para las cepas E. faecalis y P. aeruginosa a partir de las concentraciones de 12 g/100 mL y 20 g/100 mL, respectivamente. Para las cepas de S. bovis y B. cereus se presentó una reducción de la concentración celular del 92,18% y 97,331%, respectivamente por lo cual podemos afirmar que los extractos acuosos de canela presentan una alta efectividad en inhibición del crecimiento para las cuatro cepas, resaltando una condición determinante que cumple el tiempo de exposición de los microorganismos en condiciones óptimas de crecimiento. Por los resultados también podemos mencionar que las cepas Gram (+) positivas son más susceptibles al efecto de los agentes activos presentes en los extractos acuosos de canela.
Tabla 4 Porcentaje de remoción microbiana
| Concentración de Canela (g/100 mL) | Bacillus cereus | Pseudomonas aeruginosa | Streptococcus bovis | Enterococcus faecalis |
|---|---|---|---|---|
| 8 | 87,989% | 0,000% | 86,874% | 34,471% |
| 12 | 87,989% | 66,667% | 89,946% | 100,000% |
| 16 | 91,992% | 77,778% | 90,505% | 100,000% |
| 20 | 95,996% | 100,000% | 91,063% | 100,000% |
| 24 | 97,331% | 100,000% | 92,180% | 100,000% |
Teniendo en cuenta los recuentos obtenidos en la estandarización de la concentración celular de las suspensiones preparadas se establece el porcentaje de eliminación microbiana en función del recuento final obtenido con relación inicial de las preparaciones, luego de aplicar los extractos acuosos de canela en diferentes concentraciones.
4 Conclusiones y recomendaciones
Se evidencia un efecto positivo en la conservación de néctares de manzana y pera por la adición de extractos acuosos de canela en las características microbiológicas, hasta el día 27 de producción, sin la aplicación de tratamiento térmico de pasteurización.
La variable pH es afectada de manera significativa por la adición de extractos acuosos de canela, con referencia a los tratamientos con conservantes químicos convencionales.
Las variables mesófilos aerobios, mohos y levaduras, como indicadores de inocuidad son las más afectadas por la ausencia de conservantes en los tratamientos control.
Los extractos acuosos de canela presentan un efecto de inhibición microbiana significativo, generando mayor efecto sobre las cepas microbianas Gram (+) positivas.
Todas las cepas de trabajo fueron afectadas por la exposición al efecto de los extractos acuosos de canela generando mejores resultados con respecto al rango de inhibición de crecimiento celular en las concentraciones más elevadas de canela.
El tiempo de exposición es una variable muy importante relacionada con la eficiencia de los extractos acuosos de canela frente a la eliminación de la carga microbiana, se recomienda evaluar la estabilidad de los agentes activos de los extractos acuosos de canela y su interacción con los componentes de los sustratos en los que se pretende aplicar.
Se recomienda caracterizar las propiedades de la variedad de canela empleada en el proceso de evaluación en miras a la implementación de extractos aceitosos en otros procesos de producción como cárnicos, panadería y repostería.
Evaluar la capacidad de inhibición microbiana de los extractos aceitosos de sustratos como clavo, laurel, orégano, tomillo, anís estrellado, ajo y pimentón; en condiciones de laboratorio frente a cepas de importancia en control de calidad de alimentos e implementar su uso en los procesos de producción de alimentos derivados cárnicos.
















