Introducción
El control sanitario en los sistemas productivos piscícolas de tilapia continúa siendo un reto en Colombia, principalmente para los pequeños productores, los cuales ingresan a la piscicultura por iniciativa propia con la finalidad de autoconsumo o como alternativa para mejorar sus ingresos económicos (Merino et al., 2013; FAO, 2020). A nivel nacional, el departamento de Antioquia ocupa el cuarto lugar en producción acuícola, representado por un número importante de pequeños productores localizados en zonas de montaña (Montoya-López et al., 2019) como el municipio de San Carlos, ubicado en el oriente antioqueño. Este cuenta con cerca de 150 productores medianos y pequeños que producen tilapia y cachama con un área total en espejo de agua de 51.526 m. y una producción anual estimada en 200 toneladas (pnud & Red Ormet, 2015).
Los productores piscícolas, algunas veces por desconocimiento, suelen implementar de manera deficiente las medidas sanitarias establecidas en las “Buenas Prácticas de Producción Acuícola” (BPPA) que detallan los estándares de calidad e inocuidad para garantizar la salud del consumidor final (Villanueva et al., 2007). La afectación de la calidad y la inocuidad del producto pueden verse afectados por la aparición de brotes a causa de altas densidades de siembra, manejo deficiente del cultivo, condiciones desfavorables de la calidad del agua y una mala nutrición, lo que genera estrés e inmunosupresión, por lo tanto, hay una mayor susceptibilidad a infecciones e infestaciones de microorganismos primarios u oportunistas que se encuentran en las fuentes hídricas (El-Sayed, 2006; Briones-Pérez et al., 2017; González, 2019).
Con alto impacto económico sobre la producción piscícola, se encuentran los parásitos protozoarios tricodínidos y monogéneos (Zago et al., 2014; Lim et al., 2016; Grano-Maldonado et al., 2018). Los primeros suelen encontrarse en piel y branquias, los peces afectados por estos protozoos suelen mostrar episodios de agitación y letargia, lo que genera un incremento en la producción de moco, manchas blanco-azuladas y úlceras en la piel, aletas desgastadas, desprendimiento de escamas y episodios de distrés respiratorio (Prats et al., 2011; Maciel et al., 2018). Los monogéneos suelen infestar epidermis, branquias y aletas, lo que causa trastornos inflamatorios, lesiones e hiperplasia del epitelio, fusión y atrofia lamelar y reducción de la capacidad respiratoria del hospedador (Aguirre-Fey et al., 2015; Hidalgo et al., 2017; Grano- Maldonado et al., 2018). Se ha evidenciado que la presencia masiva de ectoparásitos puede aumentar la susceptibilidad de la tilapia a coinfecciones por bacterias, lo que incrementa la mortalidad de la tilapia de manera significativa (Abdel-Latif et al., 2020; Nguyen et al., 2020; Wanja et al., 2020).
Entre las bacterias más comunes a nivel mundial, se encuentran Streptococcus iniae S. agalactiae y Edwardsiella tarda, las cuales generan una condición patológica asociada a signos clínicos como áreas hemorrágicas, presencia de ulceraciones y necrosis (El-Sayed, 2006; Laith et al., 2017; Ortega et al., 2018; Buján et al., 2018). A nivel nacional, se han registrado datos de prevalencia de Streptococcus spp. del 4% y de Edwardsiella sp. del 6% (Iregui et al., 2004). Particularmente, S. iniae y E. tarda manifiestan signos en edades finales de la producción, con la consecuente pérdida económica por las inversiones sustanciales en la alimentación y el cuidado de los peces (Jiménez et al., 2007; Ortega et al., 2018; Buján et al., 2018) y S. agactiae se ha relacionado con enfermedades en otros huéspedes como pollos, perros, camellos, caballos, gatos, ranas, ratones y monos, comprometiendo la seguridad alimentaria y la salud pública al tratarse de una zoonosis (Jiménez et al., 2007; Laith et al., 2017).
Otra de las bacterias de importancia económica y productiva en la fase de poscosecha y transformación es Escherichia coli, siendo la especie más abundante del grupo de bacterias coliformes fecales (Gorlach-Lira et al., 2013; Ribeiro et al., 2016). Las cepas patógenas suelen producir brotes diarreicos severos en humanos y animales endotérmicos, y en los peces infecta distintos órganos como el tegumento, el tejido muscular, las branquias y el hígado (Gorlach-Lira et al., 2013; Ribeiro et al., 2016; Steckert et al., 2019).
Dentro del contexto de los pequeños productores, los brotes de enfermedades afectan significativamente la economía familiar, lo que genera que los productores se desmotiven y no vean la piscicultura como una fuente alternativa de ingreso económico para su núcleo familiar. Es así que, al identificar de manera oportuna los agentes patógenos de los centros productivos, se puede definir el tratamiento oportuno y preciso y las medidas preventivas. Por lo tanto, esta investigación buscó identificar el estado sanitario de pequeños centros de producción de tilapia en el municipio de San Carlos, Antioquia, rastreando los principales agentes patógenos de las producciones, su relación con los factores físicos y químicos del agua y la importancia de implementar las buenas prácticas de producción acuícola para mitigar la presencia de estos microorganismos patógenos.
Materiales y métodos
El proyecto fue aprobado por el comité institucional para el cuidado de animales (CICUA) de la Universidad CES, a través del acta 34 del 2019 (código del proyecto: 190). Estudio descriptivo transversal realizado in situ en 14 centros productivos en el municipio de San Carlos, Antioquía, entre los 730 y 1335 m s.n.m. De cada centro productivo, se tomaron 10 tilapias de forma aleatoria para un total de 140 individuos.
Recolección y procesamiento de las muestras de tilapia
A cada uno de los peces se les realizó biometría, midiendo su longitud estándar en centímetros, desde la cabeza hasta la parte final de la aleta caudal y se obtuvo el peso en gramos de cada uno de ellos. También se realizaron encuestas a los productores para determinar la fase productiva y las raciones de alimento suministradas. Posteriormente, se realizó necropsia y registro de los hallazgos macroscópicos externos e internos a través del montaje en fresco de branquias, aletas, raspado de piel, riñón, bazo, hígado y tejido muscular, para lo cual se utilizó un microscopio óptico. Luego, se tomaron los órganos blanco de interés: cerebro, corazón, bazo, hígado, tejido muscular y riñón, los cuales fueron almacenados en etanol al 96 % para realizar la extracción del material genético en el laboratorio de biología molecular.
Luego de obtener la información necesaria y extraer los órganos, tres de estos especímenes evaluados fueron conservados en refrigeración hasta ser llevados al laboratorio del Instituto Colombiano de Medicina Tropical (ICMT), donde se les realizó un hisopado sobre el tejido muscular y fueron incubados en agua peptonada para, posteriormente, ser replicados en agar Cromocult® con el propósito de identificar la presencia o ausencia de Escherichia coli (Schets et al., 2002).
Extracción y detección de agentes bacterianos
En el proceso de extracción se utilizó el protocolo para bacterias Gram (+), se empleó el kit de ADN comercial: DNeasy Blood and Tissue Kit (Qiagen®) con una variación de protocolo que consistió en dejar secar por 24 horas la columna DNeasy Mini Spin para eliminar el exceso de etanol presente en la muestra a causa del almacenamiento. Luego se realizó la cuantificación del ADN empleando el equipo Nanodrop 2000 (Thermo Scientific®) para verificar la cantidad de adn extraído y se realizó la detección de S. agalactiae, S. iniae . Edwardsiella tarda por medio de una reacción en cadena de la polimerasa (PCR), para lo cual se utiliza el kit ExcelTaq™ 5X PCR Master Dye Mix (Smobio®) a partir del ADN obtenido en la extracción. Los oligonucleótidos utilizados fueron diseñados a partir del software Express v 3.0 y estandarizados previamente. Para la detección de S. agalactiae, los primers fueron: forward (5´ AGGAAACCTGCCATTTGCG 3´) y reverse (5´ CAATCTATTTCTAGATCGTGG 3´), sintetizados a partir del gen 16S rRNA (n.° de acceso CP051848.1 en Genbank). Para la detección de E. tarda, los primers fueron: forward (5´ CGCGCATAGTATCCTCAACA 3´) y reverse (5´ CGAACAGTGCTTAGCCCATT 3´), sintetizados a partir del gen Eha (n.° de acceso AF295331.1 en Genbank). Finalmente, para S. iniae los primers fueron: forward (5´ GTTTGAAAGCTGAAGGGGTA 3´) y reverse (5´ CTTTTGGTGATAGGGCTTGT 3´), sintetizados a partir del gen lctO (n.° de acceso CP010783.1 en Genbank).
La amplificación se llevó a cabo en un termociclador de 96 pocillos Veriti™ de Applied Biosystems™, bajo las siguientes condiciones: 12,5 µl de PCR Master Dye Mix 2x (Smobio), 0,4 µM (S. agalctiae) y 0,3 µM (E. tarda . S. iniae) de cada primer, 2µl de adn (1-150 ng) y 9,7 µl de agua molecular para un volumen total de 25 µl con condiciones de amplificación de 94 °C en una primera desnaturalización y 36 ciclos de 30 segundos de desnaturalización a 94 °C, 30 segundos de hidratación a 57 °C para S. agalactiae, 58 °C para S. iniae y 59 °C para E. tarda y 30 segundos de extensión a 72 °C, con una extensión final de un minuto a 72 °C. Finalmente, 10 µl de cada producto de PCR fueron sometidos a electroforesis horizontal en geles de agarosa al 2% durante 60 minutos a 100V en TBE (Tris-Borate EDTA) a 1x y visualizado con el tinte de carga FluoroDye bajo luz ultravioleta en un transiluminador en un Doc MP imaging system (Bio rad Chemi®). Adicionalmente, se contó con controles positivos de ADN extraído a partir de Cepas ATCC (American Type Culture Collection) para cada agente de interés. Las cepas de referencia utilizadas fueron: S. agalactiae ATCC® 51487, S. iniae atcc® 29177 y E. tarda ATCC® 1594, las cuales sirvieron para la estandarización previa de especificidad y sensibilidad, detectándose una sensibilidad de 10. copias de ADN.
Recolección de muestras de agua
Se tomaron 50 ml de muestras de agua y se almacenaron a 4 °C para ser transportadas al ICMT y evaluar las UFC/ml de Escherichia coli y coliformes totales bajo la metodología del Standard Methods 9221, indicado para evaluar el recuento (APHA et al., 1998), bajo la técnica de filtración por membrana y posterior siembra en el medio de crecimiento. Durante el muestreo, se midió la temperatura (°C), el pH, el oxígeno disuelto (ppm), la conductividad (µS/cm), la salinidad (psu), el porcentaje de oxígeno disuelto y los sólidos totales disueltos (ppm) del agua del estanque de donde provenían los animales, utilizando un medidor multiparamétrico Hanna® 98194.
Análisis estadísticos
Se realizaron análisis estadísticos y descriptivos de cada una de las variables del estudio. Se realizó una prueba de Kolmogórov-Smirnov para determinar la normalidad, pero ninguna de las variables incluidas tuvo una distribución normal, por lo tanto, se realizó una prueba U de Mann- Whitney, una prueba de correlación de Spearman y una prueba ji cuadrado para determinar la asociación estadísticamente significativa. Los datos fueron procesados en el programa estadístico SPSS 21.0 (licencia de la Universidad CES), con un nivel de confianza del 95% y asumiendo que p < 0,05, indica diferencias significativas.
Resultados y discusión
El peso promedio de los 140 peces muestreados fue de 282 g (± 147,1), con una longitud estándar de 18,8 cm (± 2,50), donde 98,6% de los peces estaban en la fase de preengorde, mientras que el 1,4 % estaba en engorde. Todos los peces incluidos en el estudio tuvieron una alimentación con concentrado del 24% y 25% de proteína. Las características fisicoquímicas y las microbiológicas del agua se describen en la tabla 1.
Tabla 1. Promedio de las características fisicoquímicas y microbiológicas del agua de los centros productivos en las muestras de San Carlos, 2019
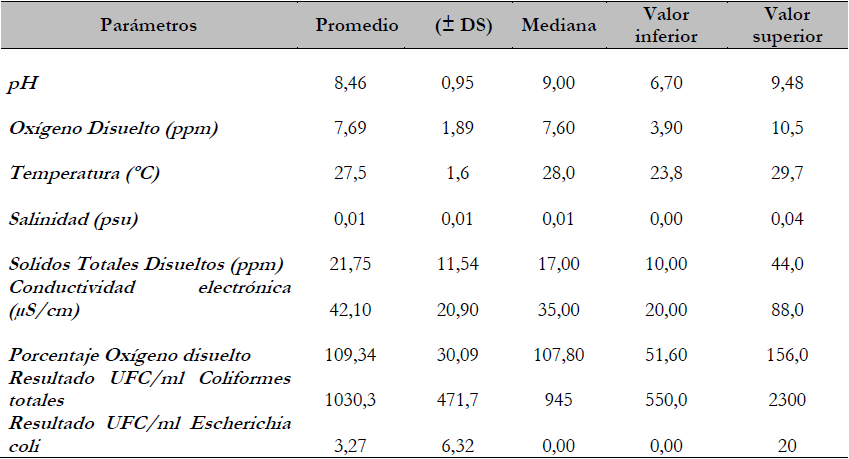
Fuente: Elaboración propia
El promedio de los parámetros fisicoquímicos del agua estuvo entre los límites deseables y aceptables para el cultivo de tilapia (El-Sayed, 2006; Wanja et al., 2020), sin embargo, en algunos centros productivos se registró una concentración de oxígeno disuelto por debajo de 5 mg/l y pH por encima de 8,5 (estos valores se encuentran por fuera de los rangos óptimos recomendados). Se ha documentado que la exposición por periodos largos a valores de pH no tolerables por la tilapia puede provocar cambios de comportamiento, daños de células epiteliales branquiales, reducción de la eficiencia en la excreción de nitrógeno y aumento de su mortalidad (Briones-Pérez et al., 2017; Ojwala et al., 2018). Además, el pH elevado aumenta significativamente la toxicidad del amoniaco, lo que genera irritación branquial, reducción de la capacidad de transporte de oxígeno y aumento de la susceptibilidad de los peces a eventos de hipoxia (El-Sayed, 2006). Por otro lado, la baja concentración de oxígeno disuelto por periodos cortos afecta el metabolismo de los peces, disminuye su consumo de alimento e impacta su crecimiento (El-Sayed, 2006; Wanja et al., 2020) y asociado al estrés en los individuos, aumenta la susceptibilidad a enfermedades y muerte (Ojwala et al., 2018; Briones-Pérez et al., 2017).
Los hallazgos macroscópicos de órganos evidenciaron anormalidades, principalmente en ojos, riñón posterior e hígado, con más del 30% de los peces afectados, como se presenta en la figura 1. A nivel de los ojos, se observó opacidad corneal unilateral y bilateral, Laith et al. (2017) manifiestan que las lesiones oculares, generalmente, se observan en la mayoría de las enfermedades bacterianas sistémicas y los órganos internos afectados como riñón e hígado presentan agrandamiento, hemorragia, inflamación y ascitis; sin embargo, las manifestaciones clínicas causadas por cualquier patógeno ocurren por diversos factores, entre ellos, la edad del organismo, el tipo de huésped y el estadio de la enfermedad, por lo cual, en muchos casos no se logra correlacionar los daños internos y los externos (Abdel-Latif et al., 2020).
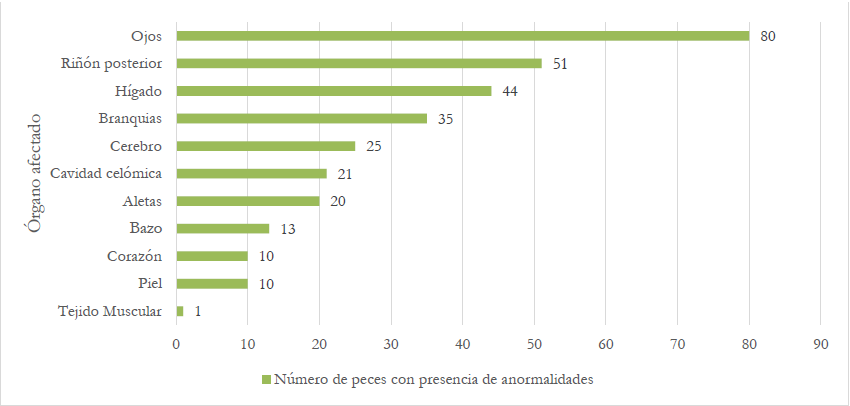
Fuente: Elaboración propia
Figura 1. Descripción de la presencia de anormalidades por órganos en las muestras de San Carlos 2019
Se tuvieron en cuenta parámetros como: método de extracción y concentración del ADN, prueba de especificidad, ensayos con diversas temperaturas de hibridación y programas de amplificación que aseguraran las condiciones apropiadas para la amplificación de los genes seleccionados (Kralik & Ricchi, 2017), sin embargo, en los resultados obtenidos no se encontraron individuos positivos para ninguno de los tres agentes bacterianos de interés que permitieran relacionar los signos clínicos de los órganos con la presencia de agentes bacterianos como S. agalactiae, S. iniae . E. tarda. Estos resultados negativos pueden deberse a que la carga bacteriana en el pull de órganos es nula o estaba en una baja concentración, la cual no pudo detectarse a través de la PCR convencional.
Entre los resultados se evidenció la presencia de microorganismos externos en piel y branquias (figura 2). Los microorganismos con mayor presencia fueron los monogéneos con un 53,9% (n= 76) y tricodínidos con el 29,1 % (n = 41). Además, fueron identificados protozoarios del género Epystylis en el 7,8 % de los peces (n = 11). Varios autores manifiestan que las altas densidades de siembra y las inadecuadas condiciones nutricionales y fisicoquímicas del agua favorecen la proliferación y la infestación de ectoparásitos tricodínidos y monogéneos (Prats et al., 2011; Zago et al., 2014; Suliman & Al-Harbi, 2016; Hidalgo et al., 2017). Autores como Valladão et al. (2016) y Paredes-Trujillo et al. (2021) manifiestan que, aunque los productores no suelen percibir la infestación por ectoparásitos como peligrosa, estos son responsables de graves repercusiones económicas en la acuicultura, ya que afectan el crecimiento, la condición corporal y son la puerta de entrada de infecciones bacterianas (Hidalgo et al., 2017; Dang et al., 2019; Burbano-Gallardo et al., 2021).
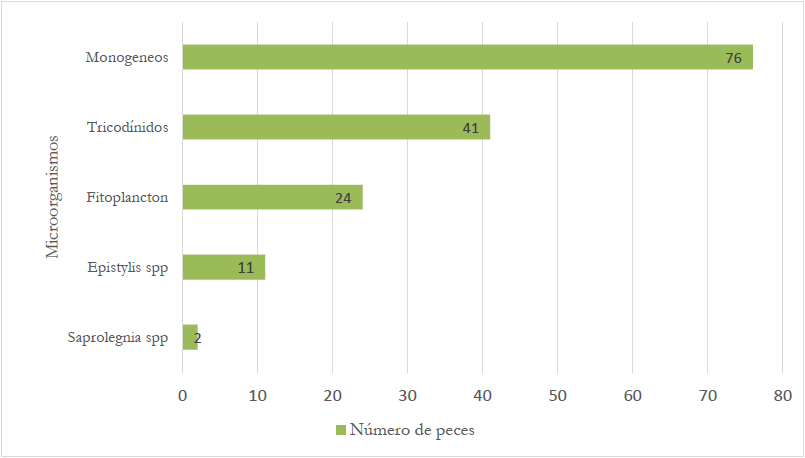
Fuente: Elaboración propia
Figura 2 Número de peces con presencia de microorganismos externos en las muestras de San Carlos 2019
Los peces con peso y longitud mayor presentaron una alta frecuencia de monogéneos (p = 0,017 y p = 0,046, respectivamente), como se observa en la figura 3. Esto puede estar asociado a una mayor exposición en el tiempo y a una mayor probabilidad de contacto con el parásito. Zago et al. (2014) hacen referencia a que los huéspedes de mayor crecimiento, aparentemente, proporcionan una mayor área disponible para la recepción de nutrientes, favoreciendo el crecimiento y el desarrollo de los parásitos. Aunque este estudio no evaluó la carga parasitaria, Paredes-Trujillo et al. (2021) y Grano-Maldonado et al. (2018) afirman que la cantidad de parásitos puede influir sobre la condición corporal, ya que genera efectos deletéreos sobre los individuos infestados.
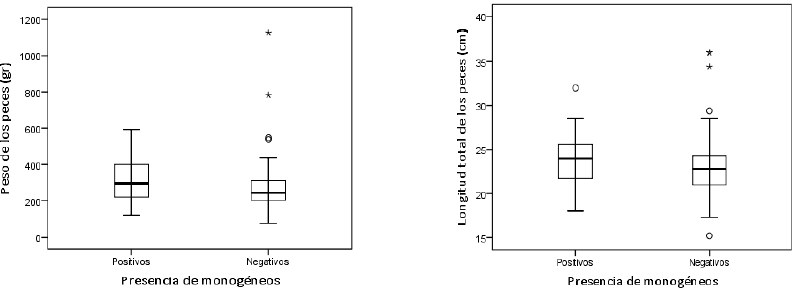
Fuente: Elaboración propia
Figura 3. Descripción de parámetros zootécnicos de acuerdo con la presencia de monogéneos en las muestras de San Carlos, 2019
No se encontró una relación estadísticamente significativa entre la presencia de monogéneos y las características fisicoquímicas y microbiológicas del agua (p > 0,05), sin embargo, no se realizó seguimiento de las características del agua durante el ciclo de producción que permitiera identificar un posible impacto de las condiciones del agua a través del tiempo y frente a la proliferación de estos microorganismos. Diversos autores afirman que la presencia de monogéneos está relacionada con la calidad del agua y su manejo (Hidalgo et al., 2017; Abdel- Latif et al., 2020), lo que favorece principalmente las aguas lénticas, con bajo oxígeno disuelto, altas cantidades de amonio, nitritos y nitratos, alta salinidad y materia orgánica (Aguirre-Fey et al., 2015; Noga, 2010). Lim et al. (2016) e Hidalgo et al. (2017) relacionan la baja calidad del agua de los estanques con el aumento del estrés en los peces, lo cual suprime su sistema inmunológico y favorece la presencia de ectoparásitos.
Se encontró que la presencia de lesiones en branquias fue mayor en los peces con presencia de monogéneos (RP: 1,56, IC95% 1,17-2,06, p = 0,006). Estos parásitos suelen provocar epizootias severas y ser detectados en branquias, los cuales se asocian a lesiones como atrofia lamelar, fusión lamelar, hiperplasia del epitelio e hipertrofia del epitelio laminar, y conducen a problemas respiratorios (Suliman & Al-Harbi, 2016; Grano-Maldonado et al., 2018; Abdel-Latif et al., 2020; Paredes-Trujillo et al., 2020).
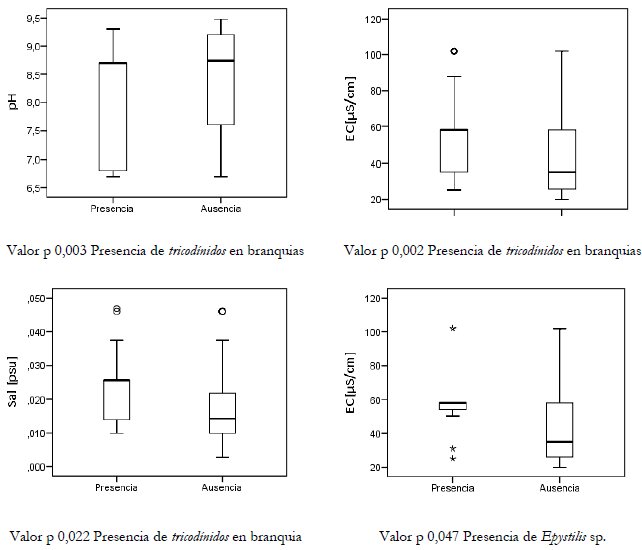
La presencia de tricodínidos se relacionó con la presencia de lesiones en bazo (RP: 2,01, IC95% 1,13-3,59, p = 0,041) y se evidenció una diferencia estadísticamente significativa (p = 0,05) entre la presencia de tricodínidos y las variables fisicoquímicas del agua: pH, conductividad eléctrica y concentración de sal (figura 4). En los peces, los tricodínidos parasitan principalmente la piel, las aletas y las branquias y con menor frecuencia se puede encontrar en ojos, boca, tracto gastrointestinal, tracto urinario y gónadas (Dang et al., 2019; Maciel et al., 2018), aunque se han descrito especies endozoicas que puede afectar órganos internos tales como riñón, hígado y bazo (Dang et al., 2019). La presencia de lesiones en el bazo puede estar relacionada con otro agente etiológico que afecta la salud del animal, favoreciendo la presencia de tricodínidos en los individuos estudiados o viceversa. Maciel et al. (2018) relacionan la presencia de este microorganismo con temperaturas altas, concentración baja de oxígeno disuelto y alta concentraciones de fitoplancton, lo cual genera condiciones favorables para el mantenimiento del parásito en la superficie del anfitrión. Por su parte, Prieto et al. (2008) mencionan que el pH tiene una fuerte relación con la presencia de fitoplancton, ya que, en el proceso de la generación del dióxido de carbono, el pH aumenta. Por otro lado, la conductividad se puede relacionar con la mineralización del agua (sólidos disueltos) (Fuentes et al., 2015) y, teniendo presente que la alta concentración de materia orgánica favorece la presencia de estos ciliados (Noga, 2010), se puede relacionar una alta concentración de materia orgánica con una alta conductividad y cantidad de fitoplancton (Valladão et al., 2016; Maciel et al., 2018).
Con respecto a la presencia del género de Epystylis, se encontró relación con lesiones en el cerebro (RP: 8,05, IC95% 2,54-25,41, p = 0,001) y anormalidades en el corazón (RP: 7,43, IC95% 2,61-21,16, p = 0,004), además de una relación estadísticamente significativa con la conductividad eléctrica (p = 0,047), como se observa en las figuras 4.
Este protozoo a menudo se considera un organismo comensal en los sistemas productivos y en condiciones ambientales adversas suele causar daño al tegumento y las branquias de los peces, asociándose con una disminución en la eficiencia de conversión de alimento y generando una mayor susceptibilidad a otros agentes infecciosos.
Las lesiones a nivel de branquias suelen ser focales, lo que permite que los peces sobrevivan y la mortalidad ocurre cuando se evidencian casos de infestación grave con lesiones branquiales extensas (El-Sayed, 2006; Valladão et al., 2015; Pala et al., 2018). Las condiciones desfavorables para los cultivos de tilapia, como el exceso de materia orgánica, la alta densidad poblacional y los bajos niveles de oxígeno disuelto, inducen una respuesta de estrés en los peces, predisponiéndolos a la infestación de estos protozoos (Valladão et al., 2015; Pala et al., 2018).
Autores como Prieto et al. (2008) afirman que las anormalidades cardiacas representadas en su mayoría por infiltraciones grasas pueden ser atribuidas al régimen alimentario de los centros productivos, lo que sugiere un manejo inadecuado en la cantidad de alimento suministrado que podría conllevar al aumento de la cantidad de materia orgánica en los estanques, favoreciendo potencialmente la presencia de microorganismos.
Fuente: Elaboración propia
Figuras 4. Descripción de las variables fisicoquímicas del agua asociadas con la presencia de tricodínidos en branquias y Epystylis sp. en piel, en las muestras de San Carlos, 2019
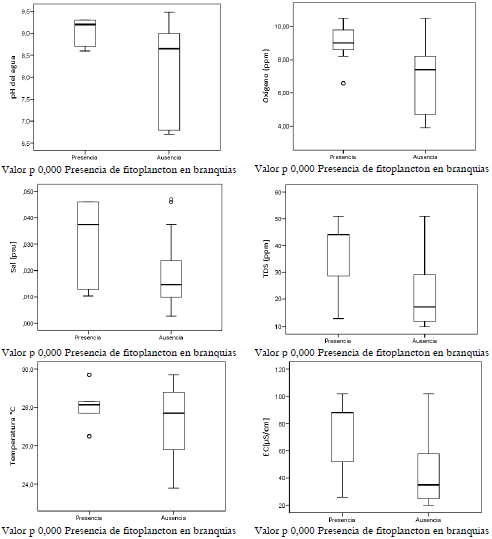
Se identificó un 17% (24 peces) con presencia de fitoplancton en branquias y una relación estadísticamente significativa entre la presencia de fitoplancton con valores altos de pH y una mayor concentración de oxígeno (figuras 5). Prieto et al. (2008) mencionan que el proceso de fotosíntesis aumenta la concentración de oxígeno, por lo que al remover el dióxido de carbono del agua aumenta su pH. En condiciones donde no se controla el exceso de fitoplancton, se suele promover un incremento de la cantidad y tipo de microalgas nocivas como las cianobacterias, las cuales pueden llegar a causar irritaciones en las branquias y toxicidad a los peces, lo que provoca problemas de hipoxia o anoxia (Prieto et al., 2008). Adicionalmente, el exceso de fitoplancton puede causar déficit de oxígeno durante las noches y las madrugadas, generándose competencia del oxígeno disuelto entre los peces y la respiración del fitoplancton, lo cual genera estrés, alteraciones respiratorias y afecta el apetito de los peces, disminuyendo su crecimiento, por lo que también favorece la presencia de enfermedades y problemas de mal sabor en el producto final (Fuentes et al., 2015; González, 2019).
Fuente: Elaboración propia
Figura 5. Descripción de las variables fisicoquímicas del agua asociadas con la presencia de fitoplancton en branquias, en las muestras de San Carlos, 2019
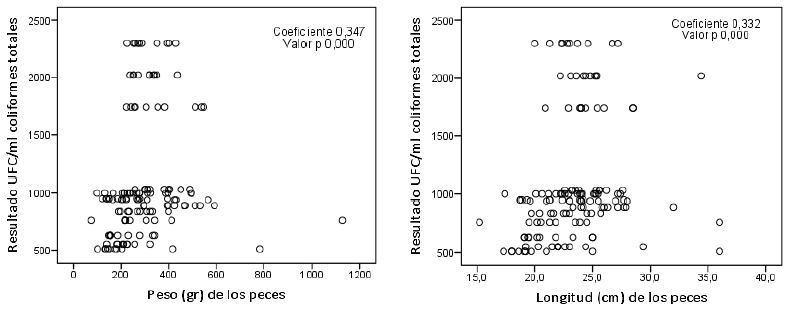
Con respecto a las unidades formadoras de colonia (UFC) de Escherichia coli en agua, se encontró una correlación estadísticamente significativa con los niveles de oxígeno, temperatura y concentración de sales (p = 0,002). A mayor temperatura se incrementa el número de UFC de E. coli (coeficiente de 0,325). A mayor cantidad de oxígeno y de concentración de sales disminuye la cantidad de UFC (coeficientes de -0,255 y -0,274, respectivamente) (figuras 6). Debido a la baja magnitud de los coeficientes, se debe considerar analizar más variables que puedan influenciar la cantidad de UFC, las cuales pueden ser particulares para cada uno de los sistemas productivos.
Fuente: Elaboración propia
Figura 6. Descripción de correlación entre la presencia de coliformes totales y parámetros zootécnicos de los peces, en las muestras de San Carlos, 2019
La cantidad de UFC de coliformes totales encontradas en el agua tienen una correlación altamente significativa con el oxígeno y la temperatura (p = 0,003); a mayor cantidad de oxígeno y temperatura, aumenta la cantidad de UFC (coeficientes de 0,326 y 0,253, respectivamente). La densidad bacteriana detectada en el agua superó los estándares fijados de (1000 UFC/ml) por la Comisión Internacional de Especificaciones Microbiológicas en Alimentos (Icmsf) (Ordoñez & Diaz, 1986) para la producción de peces, sin embargo, no se detectó en tejido muscular e intestino de las tilapias la presencia de E. coli. Según Steckert et al. (2019), este microorganismo no es parte de la microbiota intestinal natural del pez, pero según la densidad bacteriana presente en el agua, puede llegar a colonizar el tejido muscular de los peces, lo cual dependerá de las características de la especie y el estado inmunológico (Fuentes et al., 2015; Ribeiro et al., 2016; Burbano-Gallardo et al., 2021). Por lo tanto, es importante implementar estrategias que favorezcan la disminución de estos, tales como la implementación de buenas prácticas de limpieza y desinfección de los estanques entre las siembras para evitar la acumulación de las cargas bacterianas entre los diferentes lotes, como eliminación de la materia orgánica de los fondos de los estanques a través de la construcción idónea de drenajes, uso de cal y secado del estanque previo a nuevas siembras, evitar la descomposición del concentrado por sobrealimentación, el cual favorece el aumento de la materia orgánica y, finalmente, evitar el exceso de fitoplancton que puede descomponerse.
La evaluación general del estado sanitario en los centros de producción permite generar información de reconocimiento base para la toma de decisiones en torno a las medidas preventivas primarias que deben implementarse en la producción piscícola. Particularmente, la presencia de parásitos suelen ser buenos indicadores de la calidad del agua, ya que comúnmente se encuentran en aguas contaminadas con exceso de materia orgánica, baja cantidad de oxígeno, valores extremos de pH, temperatura con grandes variaciones y suministro de alimento de manera inadecuada. Estos organismos suelen generar lesiones y aumentar el estrés en los animales, convirtiéndose en la puerta de entrada de otras enfermedades, esto se ve representado en los malos indicadores de calidad y las pérdidas productivas de los sistemas. Los pequeños productores son un eslabón importante dentro de la cadena acuícola en el sector agropecuario y abordar el estatus sanitario de pequeños y medianos piscicultores suministra información que permite mejorar la sanidad, la inocuidad de los productos y la competitividad del sector.
Conclusiones
El estado sanitario de los sistemas productivos incluidos en el estudio evidenció la ausencia de Streptococcus agalactiae, S. iniae, y Edwardsiella tarda en el filete de pescado a través de pruebas moleculares, pero se evidenció la presencia de monogéneos, tricodínidos y Epystylis en animales de mayor tamaño con presencia de lesiones en branquias. Por otro lado, los parámetros fisicoquímicos del agua como pH alcalinos, alta conductividad y concentración de sal, se relacionaron con la presencia de tricodínidos, mientras que altos niveles de oxígeno, temperatura y concentración de sales, favorecieron la presencia de Escherichia coli en el agua. La información generada puede utilizarse para plantear acciones zootécnicas y sanitarias para mejorar el estatus sanitario de los sistemas productivos de tilapia en San Carlos, Antioquia.
Contribución de los autores
Lina Correa Agudelo: registro de información en campo, construcción de base de datos, análisis de información y elaboración de manuscrito; Janeth Pérez García: elaboración de proyecto para acceso a recursos económicos, diseño de metodologías, análisis de información y elaboración de manuscrito; Alejandro Ramírez Guerra: registro de información en campo, identificación de especímenes parasitarias y elaboración de manuscrito y Francisco José Arango Vacares: supervisión de actividades, construcción de base de datos y elaboración de manuscrito.
Implicaciones éticas
El presente artículo cuenta con el aval del Comité Institucional para el Cuidado de Animales (CICUA) de la Universidad CES, a través del acta 34 del 2019 (Código del proyecto 190) y también se obtuvo el consentimiento de los colaboradores para usar la información suministrada en la documentación del proceso presentado en el artículo.















