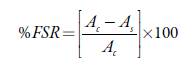INTRODUCCIÓN
Una de las principales áreas de interés en la química medicinal moderna se centra en la búsqueda y desarrollo de compuestos con selectividad sintética, asequibles económicamente y con potentes propiedades farmacológicas, que les permitan competir de forma eficaz contra agentes microbianos multirresistentes causantes de múltiples enfermedades infecciosas [1]. Una estrategia emergente dentro de la química medicinal para el desarrollo de nuevos fármacos es la combinación de dos diferentes farmacóforos en una sola molécula, estrategia conocida como hibridación molecular [1, 2]. Estas moléculas son una poderosa herramienta en química medicinal ya que le permiten tener al nuevo fármaco diferentes funciones biológicas y una actividad dual [3], proporcionando terapias combinadas en un solo agente multifuncional haciéndolo más eficiente en tratamientos convencionales [4]. Esta área de investigación se encuentra en expansión a nivel global y ha aportado de manera significativa al diseño y desarrollo de nuevos agentes terapéuticos.
En este sentido, los compuestos heterocíclicos juegan un rol importante en diversos procesos biológicos ya que hacen parte estructural de las células vivas, ADN y ARN, otorgándoles un amplio espectro de actividades farmacológicas con variadas aplicaciones terapéuticas. Dentro de las moléculas líderes para el diseño de potenciales agentes bioactivos se encuentran los compuestos con núcleos heteroaromáticos de benzimidazol u oxadiazol, los cuales son conocidos por tener actividad antioxidante, antibacteriana, antifúngica, anticancerígena, analgésica y antiinflamatoria [5, 6]. Esta actividad está relacionada con la capacidad de ser sustitutos bioisotéricos de grupos funcionales éster y amida, facilitando su interacción con enzimas y receptores en los sistemas biológicos [7].
Los compuestos heterocíclicos benzimidazol y oxadiazol son de gran importancia en el campo de la química inorgánica medicinal ya que pueden coordinarse a centros metálicos a través de los heteroátomos que poseen en su estructura, formando complejos cinéticamente inertes y termodinámicamente estables, aumentando la biodisponibilidad y selectividad de los mismos. Investigaciones recientes, han demostrado que la actividad biológica aumenta cuando ligandos con andamios orgánicos heterocíclicos se coordinan con centros metálicos, encontrando un efecto potenciador de sus propiedades farmacológicas, lo cual es de gran interés para la química medicinal [8].
Continuando con nuestros esfuerzos para desarrollar nuevos compuestos con actividad biológica [9], en este trabajo reportamos la síntesis de nuevos complejos metálicos derivados de híbridos heteroaromáticos. A continuación, se presenta una detallada caracterización de todos los compuestos, además de discutir los posibles mecanismos de acción antioxidante y antimicrobiana.
METODOLOGÍA
Los reactivos y solventes empleados para la síntesis de los compuestos obtenidos fueron adquiridos de las casas comerciales Sigma-Aldrich, Merck y Alfa Aesar® en grado analítico. Se utilizó sílica gel 60 F254 con espesor de 0,25 mm para monitorear las reacciones. Los espectros de RMN-1H, 13C y bidimensionales (HSQC, HMBC y COSY) fueron obtenidos con un espectrómetro de 400 MHz Bruker Ultra Shield, utilizando como solvente deuterado el DMSO-d 6.
Los espectros de infrarrojo fueron tomados en el espectrofotómetro SHIMADZU IR Affinity1 (pastilla de KBr) y Thermo scientific Nicolet TM 6700 (ATR). El estudio de la composición porcentual de los productos se realizó utilizando el analizador elemental Thermo Flash EA 1112 Series y el porcentaje de metal se determinó mediante titulación complexométrica con EDTA. Los espectros de masas se realizaron en el espectrómetro de masas SHIMADZU-GCMS-QP2010 usando ionización por impacto electrónico (IE) a 70 eV. Los puntos de fusión de los compuestos se determinaron en un fusiómetro Stuart* SMP10. El análisis térmico se realizó en el equipo TGA 550 TA Instruments bajo atmósfera de nitrógeno. La conductividad de todos los complejos lantánidos se realizó en el equipo OrionTM 131S. El estudio electroquímico fue registrado por voltamogramas en un bipotenciostato modelo 700B de CH Instruments.
Síntesis de los compuestos químicos
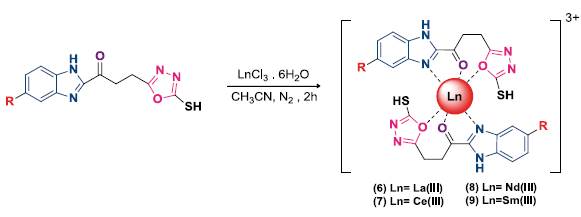
Las figuras 1 y 2 presentan la ruta sintética empleada para la obtención del ligando híbrido heteroaromático y sus complejos metálicos, respectivamente. Para la obtención del ligando orgánico 5 se utilizó una ruta sintética de 3 etapas, donde los compuestos intermedios fueron aislados y completamente caracterizados.
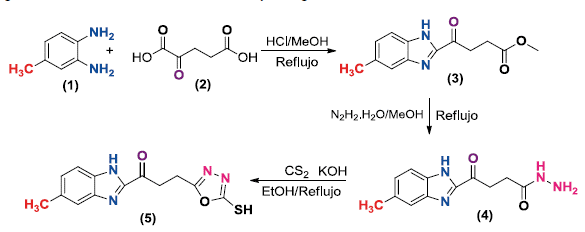
Figura 1 Ruta sintética empleada para obtener el ligando híbrido heteroaromático (benzimidazol/ oxadiazol).
Síntesis de metil4-(5-metil-lH-benzo[d]imidazol-2-il)-4-oxobutanoato (3)
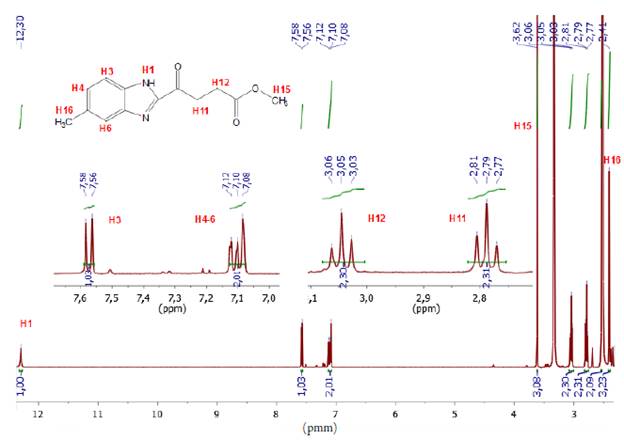
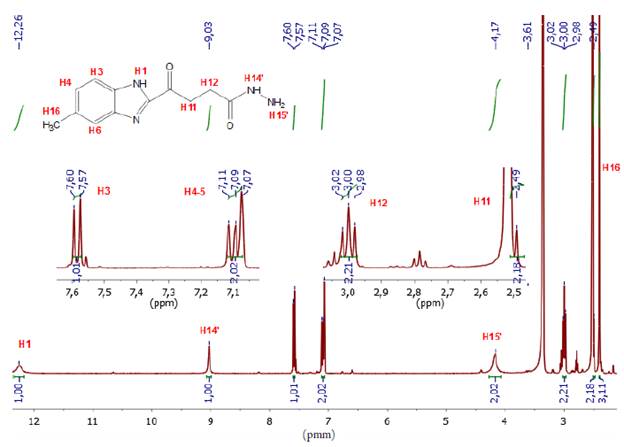
El éster metílico se obtuvo a partir de una modificación de la metodología planteada por Husain [10]. A una solución metanólica (10 mL) de la respectiva 0-fenilendiamina (1) (0,093 mol-L-1, 0,93 mmol) y ácido 2-cetoglutárico (0,093 mol-L-1, 0,93 mmol) se adicionaron 5 mL de una solución ácida de HCl 5 mol-L-1. La mezcla resultante se mantuvo a reflujo a 70 °C por 48 horas. El sólido obtenido fue filtrado, aislado y lavado 3 veces con agua fría con el objetivo de eliminar residuos polares presentes en el mismo. Sólido blanco. (Rendimiento 207 mg, 90%). Punto de fusión (204 -207 °C). C13H14N2O3 (PM 246 g-mol-1). IR cm-1 (ATR, KBr) 3100 (N-H), 1734 (C=O), 1676 (C=N), 1587 (C=C). RMN 1H [400 MHz, DMSO-d6 δ ppm]; 2,41 (3H, s, H-4), 2,79 (2H, t, J = 8 Hz, H-11), 3,05 (2H, t, J = 8 Hz, H-12), 3,62 (3H, s, H-15), 7,10 (2H, m, J = 8 Hz, H-4 y H-6), 7,58 (1H, d, J = 8 Hz, H-3), 12,30 (1H, s, H-1). EM m/z (%): 246 (M+, 100), 231 (M+-C12H12N2O3); 187 (M+ -C11H11N2O); 159 (M+ -C9H7N2O).
Síntesis de 4-(5-metil-1H-benzo[d]imidazol-2-il)-4-oxobutanohidrazida (4)
La hidrazida 4 se sintetizó a partir de la metodología planteada por Husain [10]. A una solución metanólica (10 mL) del éster 3 (0,093 mol-L-1, 0,93 mmol) se adicionó hidrazina monohidratada (1 mol-L-1, 10 mmol) para llevar a reflujo convencional a 65 °C por un periodo de 10 horas. Finalmente, el sólido obtenido fue filtrado, aislado y lavado 3 veces con metanol frío para eliminar el exceso de hidrazina. Sólido blanco. Rendimiento (207 mg, 90%). Punto de fusión (270 - 272 °C). C12H14N4O2 (PM 246 g-mol-1). IR cm-1 (ATR, KBr) 3270 (C-H), 1700 (C=O), 1680 (C=N), 1530 (C=C). RMN 1H [400 MHz, DMSO-d 6 δ ppm]; 2,40 (s, 3H, H-16), 2,49 (s, 2H H-11), 3,00 (t, J=8 Hz, 2H, H-12), 4,18 (s, 3H, H-15), 7,10 (m, J=8 Hz, 2H, H-4 y H-6), 7,57 (d, J=12 Hz, 1H, H-3), 9,30 (s, 1H, H-14), 12,30 (s, 1H, H-1). EM m/z (%): 246 (M+, 100), 231 (M+ -C11H12N4O2); 187 (M+-C11HnN2O); 159 (M+-C9H7N2O).
Síntesis del ligando 3-(5-mercapto-1,3,4-oxadiazol-2-il)-1-(5-metil-1H-benzo[d]imidazol-2-il)propanona (5)
El ligando 5 fue obtenido mediante la metodología propuesta por Husain [10]. A una solución etanólica (10 mL) de la respectiva hidrazida 4 (0,1 mol-L-1, 1 mmol) se adicionaron 500 µL de una solución 2 mol-L-1 de KOH (0,1 mol-L-1, 1 mmol) con agitación y calentamiento constante a 50 °C, hasta completa disolución. Posteriormente, a esta mezcla se agregó CS2 en exceso (0,82 mol-L-1, 8,2 mmol) y se mantuvo a reflujo convencional por 20 horas. Terminado el tiempo de reacción, se ajustó el pH=2 y se adicionaron 20 mL de H2O, precipitando el compuesto oxadiazólico.
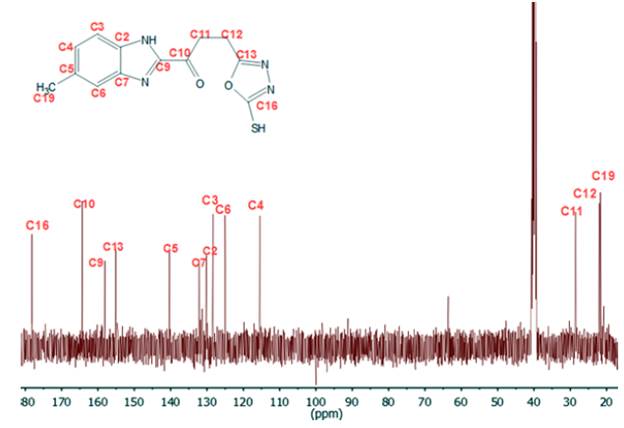
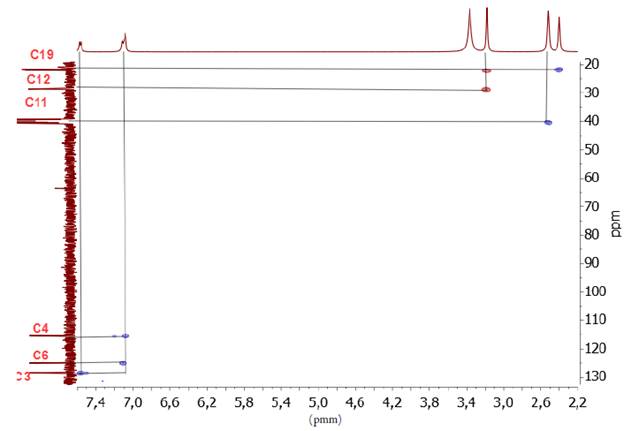
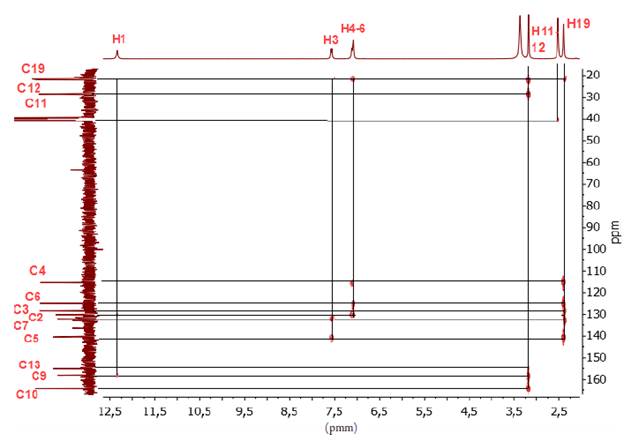
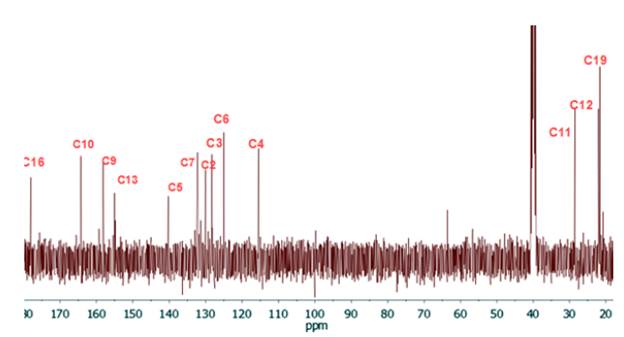
El sólido obtenido fue aislado y lavado varias veces con una solución fría agua/metanol (2:1). Sólido amarillo oscuro. Rendimiento (231 mg, 80%). Punto de fusión (260-262 °C). C13H12N4O2S (PM 288 g-mol-1). Análisis elemental C 50,7 (cal 54,15), N 18,11 (cal 19,43), H 4,5 (cal 4,2), S 10,5 (cal 11,2). IR cm-1 (ATR, KBr), 3630 (S-H), 1640 (c=O), 1545 (C=N). RMN 1H [400 MHz, DMSO-d 6 δ ppm]; 2,40 (s, 3H, H-19), 3,18 (s, 4H, H-11 y H-12), 7,09 (m, 7=4 Hz, 12 Hz, 2H, H-4 y H-6), 7,59 (d, 7=8 Hz, 1H, H-3), 12,34 (s, 1H, H-1), 14,19 (s, 1H, H-18). RMN 13C [400 MHz, DMSO- d 6 δ ppm]; 21,68 (C19), 22,06 (C12), 28,52 (C11), 115,42 (C4), 125,02 (C6), 128,36 (C3), 130,11 (C2), 132,15 (C7), 140,37 (C5), 155,10 (C13), 158,14 (C9), 164,35 (C10), 178,17 (C16). EM m/z (%): 287 (M+, 100), 271 (M+ - C12H9N4O2S); 256 (M+ - C13H11N4O2); 239 (M+ - C13H11N4O.3); 213 (M+ - C12H11N3O).
Síntesis de nuevos complejos metálicos derivados del ligando híbrido
Se sintetizaron cuatro complejos lantánidos a partir de los cloruros de La(III), Ce(III), Nd(III), Sm(III) y el ligando híbrido heteroaromático (5). Se adicionó el cloruro de lantánido correspondiente (0,125 mol-L-1, 0,5 mmol) a una solución de acetonitrilo (4 mL) del ligando 5 (0,25 mol-L-1, 1 mmol), la mezcla se sometió a reflujo (80 °C) por 2 horas bajo atmósfera de nitrógeno. Posteriormente, se filtró el precipitado y se lavó con una mezcla de metanol/agua en una proporción 1:1. Todos los complejos lantánidos fueron recristalizados en etanol.
Complejo de lantano (6)
Sólido beige. Rendimiento (345 mg, 77%). Punto de fusión (263-265 °C). C26H24Cl3La-N8O4S2 (PM 825,91 g- mol-1). Análisis elemental C 36,6 (cal 37,9), N 14,7 (cal 13,6), H 2,3 (cal 2,9), S 7,9 (cal 7,8). La 18,5 (cal 16,9). IR cm-1 (ATR, KBr), 2761 (s-H), 1665 (C=O), 1620 (C=N), 453 (La-O). RMN 1H [400 MHz, DMSO- d 6 δ ppm]; 2,39 (s, 3H, H-19), 3,17 (s, 4H, H-11 y H-12), 7,09 (d, 7=4 Hz, 8 Hz, 1H, H-4), 7,15 (s, 1H, H-6), 7,55 (d,y=8 Hz, 1H, H-3), 12,46 (s, 1H, H-1), 14,35 (s, 1H, H-18). RMN 13C [400 MHz, DMSO- d 6 δ ppm]; 21,69 (C19), 22,05 (C12), 28,54 (C11), 115,50 (C4), 124,99 (C6), 128,32 (C3), 130,11 (C2), 132,21 (C7), 140,32 (C5), 155,06 (C13), 158,15 (C9), 164,28 (C10), 178,08 (C16). Λ (DMSO, 28 °C) (Ω-1-cm2-mol-1): 210. TGA pérdida de masa 0,42% (87-91 °C, 1 paso, calc. 0,2 H2O = 0,42%), 14,43% (99313 °C, 1 paso, calc. 2xSH = 14,63%), 18,66% (313-550 °C, 1 paso, calc. Formación de La2O2CO3 = 22,64%).
Complejo de cerio (7)
Sólido beige. Rendimiento (345 mg, 76%). Punto de fusión (265-268 °C). C26H26Ce-CL3N8O5S2 (PM 841,12 g-mol-1). Análisis elemental C 36,2 (cal 37,9), N 15,9 (cal 13,6), H 4,4 (cal 2,9), S 7,0 (cal 7,8), Ce 18,9 (cal 16,7). IR cm-1 (ATR, KBr), 3515 (S-H), 1648 (C=O), 1547 (C=N), 452 (Ce-O). A (DMSO, 28 °C) (Ω-1-cm2-mol-1): 208. TGA pérdida de masa 2,1% (25-82 °C, 1 paso, calc. 1,0 H2O = 2,1%), 15,22% (97-295 °C, 1 paso, calc. 2xSH = 14,23%), 19,92% (295-550 °C, 1 paso, calc. formación de Ce2O2CO3 = 21,12%).
Complejo de neodimio (8)
Sólido café. Rendimiento (340 mg, 75%). Punto de fusión (263-265 °C). C28H31Cl-3N9NdO6S2 (PM 830,85 g-mol-1). Análisis elemental C 36,7 (cal 37,7), N 14,2 (cal 13,5), H 3,7 (cal 2,9), S 7,8 (cal 7,7) Nd 17,8 (cal 17,44). IR cm-1 (ATR, KBr), 3583 (S-H), 1653 (C=O), 1551 (C=N), 437 (Nd-O). Λ (DMSO, 28 °C) (Ω-1-cm2-mol-1): 205. TGA pérdida de masa 15,08% (150-287 °C, 1 paso, calc. 2XSH = 14,96%), 29,07% (300-500 °C, 1 paso, calc. formación de Nd2O2CO3 = 27,34%).
Complejo de samario (9)
Sólido amarillo oscuro. Rendimiento (320 mg, 70%). Punto de fusión (267-269 °C). C28H33Cl3N9SmO7S2 (PM 910,37 g-mol-1). Análisis elemental C 36,9 (cal 36,9), N 14,5 (cal 13,8), H 3,8 (cal 3,4), S 7,8 (cal 7,04) Sm 19,2 (cal 16,5). IR cm-1 (ATR, KBr), 3574 (S-H), 1653 (C=O), 1549 (C=N), 457 (Sm-O). Λ (DMSO, 28 °C) (Ω-1-cm2-mol-1): 210. TGA pérdida de masa 2,35% (39-83 °C, 1 paso, calc. 0,5 CH3CN = 2,39%), 10,33% (242-296 °C, 1 paso, calc. 2xSH = 9,55%), 32,65% (315,90-497,08 °C, 1 paso, calc. formación de Sm2O2CO3 = 30,10%).
Estudio de la actividad antioxidante
Siguiendo la metodología planteada de Sdiri [11] se evaluó la actividad antioxidante expresada como porcentaje de captación de radicales libres (%FRS, por sus siglas en inglés free radical scavenging) de los compuestos sintetizados empleando el método del radical libre 2,2-difenil-1-picrilhidracilo (DPPH-), frente a los estándares antioxidantes de vitamina C y quercetina. Este procedimiento se realizó en placa de 96 pocillos, donde el ligando y los complejos sintetizados se adicionaron desde la columna 1 a la columna 11 en un rango de concentraciones entre 512 µg- mL-1 y 0,5 µ- mL-1, y en la columna 12 se adicionó el blanco DPPH- metanol. Finalmente, después de 1 hora se realizó la lectura de las placas con el programa M965 y los resultados se desarrollaron en el programa GraphPad Prism 7. El experimento se realizó por triplicado y el valor promedio fue calculado. Los resultados se expresaron en porcentaje de la actividad de captación del radical libre DDPH- empleando la siguiente ecuación:
Donde Ac es la absorbancia del control y As la absorbancia de los compuestos. La concentración de las muestras que inhiben el 50% de radicales DPPH- expresados en %FRS50 fue calculada mediante una regresión no lineal y reportada en µg-mL-1.
Estudio electroquímico
Estudios de voltametría cíclica (VC) y voltametría de onda cuadrada (SWV) fueron llevados a cabo para complementar los resultados obtenidos mediante la captación del radical libre DPPH-. Para esto, se realizaron medidas de corriente en función del potencial, a una velocidad de barrido de 0,1 V-s-1. Se empleó como solvente DMF seco, hexafluorofosfato de tetrabutilamonio (NBu4PF6) como electrolito soporte, una barra de carbono vítreo como electrodo de trabajo, un cable de platino como electrodo auxiliar y un alambre de plata como electrodo de pseudoreferencia. Los compuestos evaluados se trabajaron a una concentración de 1x10-3 mol-L-1 y los valores fueron calibrados respecto a la pareja de ferroceno/ferricinio (Fc/Fc+) como estándar interno.
Actividad antibacteriana: determinación de la concentración mínima inhibitoria
Empleando el método recomendado por el CLSI (ClinicalLaboratory Standards Institute) [12] se determinó la concentración mínima inhibitoria (CMI) expresada en µg-mL-1, en 5 cepas bacterianas Gram negativas (E. coli ATCC 25922, K. pneumoniae ATCC1705, K. pneumoniae ATCC 2146 y cepas clínicas S. dysenteriae y Salmonella y dos cepas bacterianas Gram positivas (B. subtilis ATCC 6633 y S. aureus ATCC 6538), suministradas por la unidad de microbiología del complejo de salud pública Aníbal Patiño Rodríguez de la ciudad de Santiago de Cali.
Las cepas bacterianas se replicaron en un cultivo de agar chocolate en condiciones aerobias, a 37 °C durante 24 horas. Posteriormente, se preparó el inóculo para lo cual se aislaron las colonias de bacterias de la respectiva cepa de trabajo y se suspendieron en caldo Mueller-Hinton hasta obtener una disolución con una turbidez equivalente a 0,5 McFarland para posteriormente preparar la solución madre de la bacteria a una concentración aproximada de 1x108 unidades formadoras de colonias (UFC) por mililitro.
Posteriormente, se tomó una alícuota de la solución madre y se disolvió en caldo Mueller-Hinton, obteniendo de esta manera la solución de trabajo para cada microorganismo patógeno. Se depositaron por triplicado los compuestos en placas de 96 pocillos. En la columna 1 se depositó el control positivo (caldo Mueller-Hinton y solución bacteriana), en la columna 12 el control negativo caldo Mueller-Hinton) y en los pocillos restantes se depositaron los compuestos antibacterianos en un rango de concentración entre 1,95 µg-mL-1 y 1000 µg-mL-1. Finalmente, cada una de las placas se incubó a 37 °C por un periodo de 24 horas en condiciones aerobias para así obtener los resultados de la CMI.
RESULTADOS Y DISCUSIÓN
Síntesis y caracterización
La síntesis del compuesto 3 se realizó a través de dos reacciones. En primer lugar se formó el anillo benzimidazólico en medio ácido para favorecer la sustitución nucleofílica de la o-fenilendiamina sobre el carbono carbonílico del ácido α-cetoglutarico [13], para posteriormente mediante una reacción de esterificación de Fisher obtener 3 con un rendimiento del 90%. Se realizó la amidación del éster metílico 3 utilizando un exceso (1:10) de hidrazina monohidratada, para obtener mediante una sustitución nucleofílica el sólido blanco cristalino correspondiente a la hidrazida 4. Finalmente, el ligando híbrido heteroaromático (benzimidazol/oxadiazol) 5 se obtuvo con un rendimiento del 80%, a partir de la reacción en medio etanólico de 4 con un exceso de sulfuro de carbono, como un sólido cristalino amarillo [14].
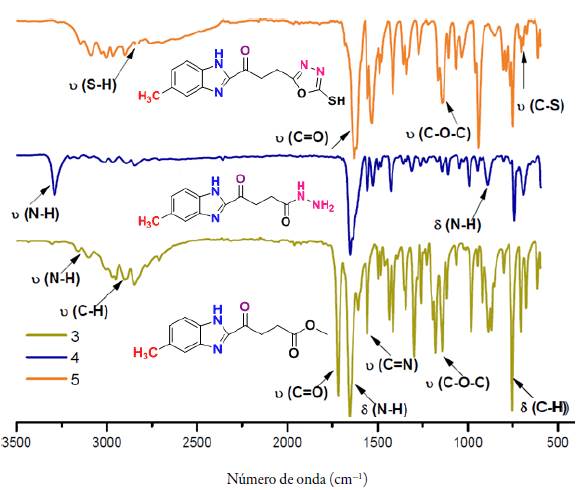
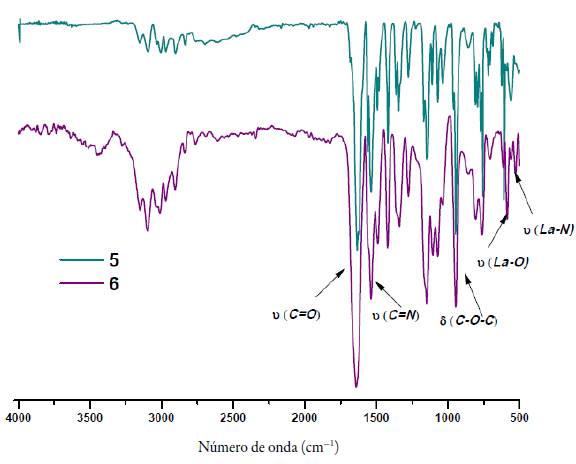
Los compuestos orgánicos 3-5 fueron aislados y caracterizados mediante punto de fusión, análisis elemental, espectroscopias IR, RMN-1H y 13C (mono y bidimensional, ver anexos), y espectrometría de masas. En la figura 3 se muestran, como ejemplo comparativo, los espectros FT-IR de 3-5 con las bandas principales asignadas a los grupos funcionales de estos compuestos. La formación del anillo benzimidazólico se evidenció por la presencia de las bandas de vibración de tensión (N-H) y del grupo carbonilo v(C=0) a 3100 cm-1 y 1734 cm-1, respectivamente. Además, para el compuesto 3 fueron asignadas las bandas de vibración de tensión simétrica y asimétrica (C-O-C), propias del éster metílico. En el espectro infrarrojo del compuesto 4 se observaron las bandas de vibración de tensión (3270 cm-1) y de deformación fuera del plano (891 cm-1), que evidenciaron la formación de un nuevo enlace (N-H). Además de conservar la banda correspondiente a la vibración de tensión v(C=O) a 1700 cm-1.
Finalmente, en el espectro de FT-IR del compuesto 5 se observó la banda de vibración de tensión del enlace v(S-H) a 3630 cm-1, que demuestra la formación en estado sólido del tautómero tiol [15]. Se confirmó la formación del anillo 1,3,4-oxadiazólico, por la presencia de nuevas bandas de vibración de tensión simétrica y asimétrica v(C-O-C) características del grupo éter a 941 cm-1 y 965 cm-1. Además, se observó un corrimiento batocrómico en la banda de vibración de tensión del grupo carbonilo v(C=O) a 1640 cm-1, posiblemente a consecuencia del efecto resonante proporcionado por el anillo benzimidazólico.
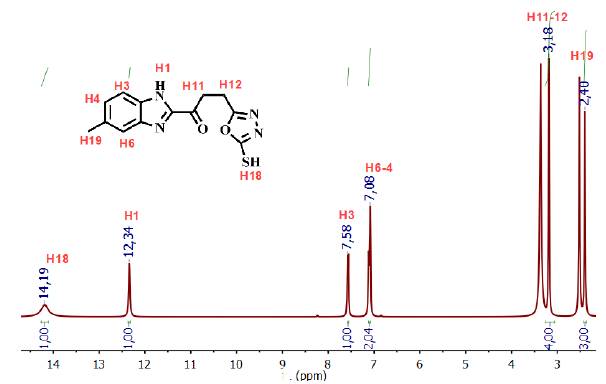
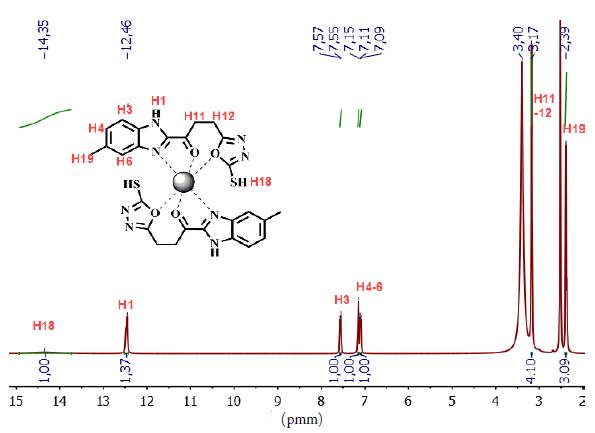
En el análisis del espectro de RMN-1H del compuesto 5 (ver figura 4), se asignó un singlete a campo alto (δ 2,40 ppm) correspondiente a los tres protones del grupo metilo unido al anillo aromático, un multiplete a δ 7,09 ppm que integra para los protones H-4 y H-6, un doblete a δ 7,59 ppm asignado al protón H-3, y a campo más bajo (δ 12,34 ppm y δ 14,19 ppm) se observaron dos singletes asignados a los protones del anillo imidazólico H-1 y del anillo oxadizólico H-18. El protón H-18 se encuentra a campo más bajo debido al efecto resonante que ejerce el grupo tiol, en el anillo heterocíclico 1,3,4-oxadiazol. También se observa un falso singlete a 3,18 ppm el cual corresponde al solapamiento de los tripletes asignados para los protones H-11 y H-12, este hecho ocurre debido a la similitud que poseen los protones en sus ambientes magnéticos.
La caracterización de los complejos lantánidos se realizó mediante análisis elemental (C, N, H y S), contenido de metal por complexometría, espectroscopia IR, RMN-1H y 13C, análisis termogravimétrico y medición de conductividad molar. Los resultados del análisis elemental y complexometría sugieren una relación 2:1 (ligando: metal). Mientras que los valores de conductividad molar en DMF a 25°C (entre 200 Ω-1-cm2-mol-1 y 210 Ω -1-cm2-mol-1) evidencian la naturaleza electrolítica para todos los complejos [16].
En la figura 5 se presentan los espectros FT-IR comparativos de los compuestos 5 y 6. Para el complejo metálico 6 se observaron corrimientos químicos de las bandas principales indicando el posible modo de coordinación entre el ligando y el ion lantánido. Los desplazamientos hipsocrómico de 1640 cm-1 a 1665 cm-1, y de 1545 cm-1 a 1620 cm-1 de las bandas correspondientes a las vibraciones de tensión de los grupos carbonilo v(C=O) y amino v(C=N), respectivamente; el corrimiento batocrómico de la banda de vibración de tensión del enlace v(C-S), además de la presencia de las bandas a 585 cm-1 v(La-N) y 464 cm1 v(La-O) [17], muestra que el ligando híbrido 5 actúa como agente quelante tridentado a través del grupo car-bonilo y los heteroátomos de nitrógeno y oxígeno de los anillos de benzimidazol y oxadiazol, respectivamente.
En el espectro de RMN-1H del complejo 6 se observaron los desplazamientos a campo bajo (δ 14,35 ppm y δ 12,46 ppm) de los protones H-18 y H-1, correspondientes a los anillos 1,3,4- oxadiazol y benzimidazólico, respectivamente (ver figura 6) [17, 18]. Se observa que el multiplete asignado para los protones H-6 y H-4 en el ligando libre, se resuelve como un doblete y un singlete, en donde el protón H-6 sufre mayor desapantallamiento apareciendo a campo más bajo (δ 7,15 ppm), como consecuencia del enlace entre el anillo benzimidazólico y el ion lantánido. También, comparando los datos de RMN-13C del ligando 5 y del complejo 6, se observa que el carbono C-7, C9 y C2 presentes en el anillo benzimidazólico se desplazan a campo más bajo, debido al efecto inductivo que el centro metálico genera al coordinarse a través de este grupo.
El análisis espectroscópico evidencia el efecto sobre el desplazamiento químico, que ocurre cuando se coordina el centro metálico al ligando orgánico derivado de anillos heteroaromáticos. El corrimiento hacia campo bajo de las señales asignadas a los protones y átomos de carbono cercanos a los grupos carbonilo, amino y oxadiazol confirma que el ligando híbrido coordina de forma tridentada a los iones metálicos.
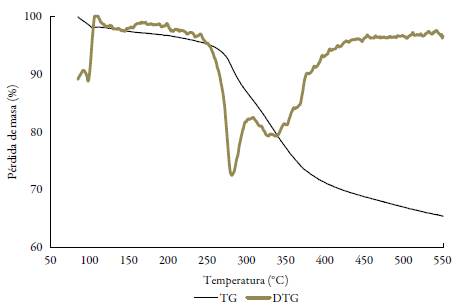
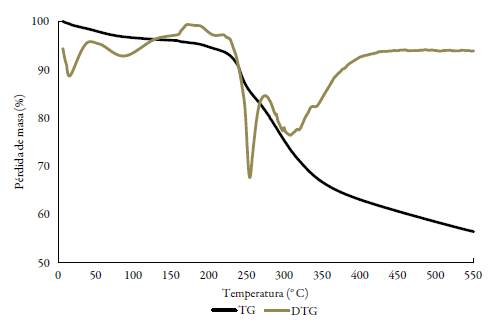
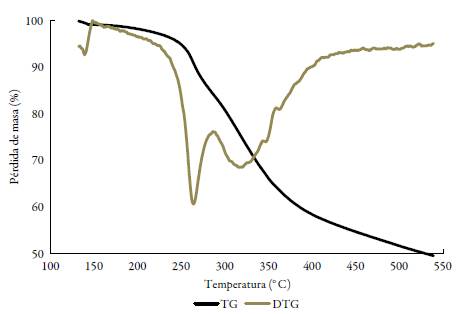
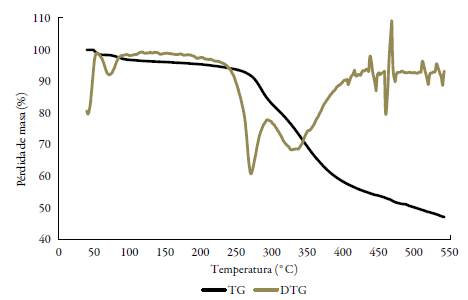
La caracterización de los complejos lantánidos se complementó con estudios de termo-gravimetría que permitieron identificar el grado de hidratación, así como la formación de carbonatos óxidos del metal correspondiente, lo cual es común encontrar como productos de descomposición térmica para este tipo de iones metálicos con ligandos orgánicos [19, 21]. El estudio termogravimétrico sugiere que sólo los complejos de lantano y cerio presentan aguas de hidratación, en una relación de 0,2 y 1,0 respectivamente, y en todos los casos se observa una pérdida de masa hasta cerca de 300 °C en un solo paso que corresponde en masa a los dos grupos -SH presentes en cada molécula de complejo (un grupo de cada ligando), resultado acorde a los compuestos propuestos del tipo [LnL2]Cl3. Se puede observar, además, que sólo para el caso del complejo de samario, se da una primera pérdida de masa del 2,35%, que correspondió a 0,5 de una molécula de acetonitrilo proveniente del solvente en el que se realizaron las reacciones de síntesis (ver anexos).
Evaluación farmacológica
Debido a su amplio rango de actividades biológicas, los compuestos derivados de los núcleos benzimidazol u oxadiazol han generado un especial interés en la química medicinal, ya que estudios recientes muestran la selección de este tipo de estructuras como farmacóforos para el desarrollo de nuevos agentes bioactivos con potencial capacidad antioxidante y antibacteriana, lo cual muestra prometedores resultados en el diseño racional de nuevos fármacos.
Actividad antioxidante
Las especies reactivas de oxígeno (ROS) son especies químicas altamente inestables que tienen en su estructura uno o más electrones desapareados, lo que los hace potenciales generadores de otros radicales libres a través de reacciones en cadena. En condiciones óptimas, los organismos vivos mantienen como mecanismo de defensa un equilibrio homeostático entre las ROS y los antioxidantes endógenos, aunque un desbalance entre ellos puede generar estrés oxidativo causando daño a componentes celulares importantes como las proteínas, los ácidos nucleicos, los lípidos, el ADN y los carbohidratos. Estas especies radicalarias están asociadas en procesos fisiopatológicos de enfermedades crónicas y degenerativas como cáncer, diabetes, artritis reumatoide, cataratas, enfermedades cardiovasculares y neurodegenerativas, entre otras. De ahí la importancia de considerar el estrés oxidativo como diana terapéutica para el desarrollo de agentes terapéuticos antioxidantes con el potencial de inhibir procesos radicalarios nocivos para la salud.
La actividad antioxidante de los compuestos sintetizados se realizó mediante el ensayo in vitro de captación del radical libre DPPH-, el cual es un radical estable que reacciona con moléculas que puedan donar protones o hidrógenos radicalarios generando una disminución en la intensidad del color púrpura y la absorbancia de la solución [22].
En la figura 7 se muestran los porcentajes de captación de radicales libres (% FRS) de los compuestos evaluados en función de la concentración. También se observa de manera general que tanto el ligando como los complejos lantánidos presentan altos porcentajes de inhibición del radical DPPH a bajas concentraciones, encontrándose valores muy similares a los estándares antioxidantes utilizados como referencia. Este resultado puede ser consecuencia principalmente a dos factores: (i) según la teoría HSAB (hard andsoft acids and bases), los iones lantánidos son considerados ácidos duros de Lewis y por tanto tienden a formar enlaces fuertes con bases duras de Lewis como los átomos de oxígeno y nitrógeno (presentes en los anillos benzimidazólico y oxadiazólico).
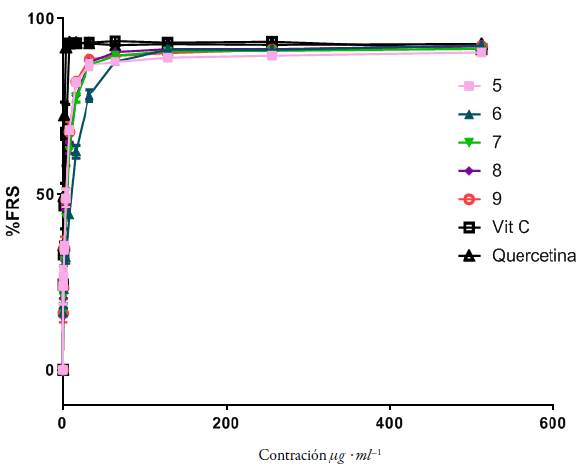
Figura 7 Porcentaje de captación de radicales libres para los compuestos evaluados. Los valores son el promedio de tres réplicas.
Considero que esto no debería estar en un nuevo párrafo, debería continuar con la idea anterior como un punto seguido, pues se está dando una información que consta de "dos factores": (i) y (ii) con el ligando genera la polarización y la ionización del enlace del grupo -SH (ver figura 8) [23], generando especies radicalarias estables, a través del mecanismo de reacción HAT (hydrogen atom transfer). Los resultados mostraron que los complejos metálicos tienen un mayor porcentaje de captación de radicales libres (%FRS) en relación al ligando libre, lo que muestra el efecto sinérgico al formarse los complejos de coordinación; y (ii) que los compuestos sintetizados puedan estabilizar la carga generada, una vez han donado sus protones, mediante la deslocalización de la misma en los anillos heterocíclicos 1,3,4-oxadiazol y el benzimidazol, presentes en la estructura de los compuestos [24].
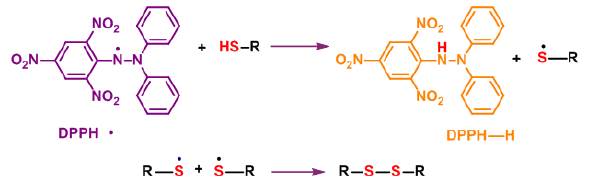
Figura 8 Reacción del mecanismo de eliminación de radicales libres DPPH- mediante el grupo tiol (-SH).
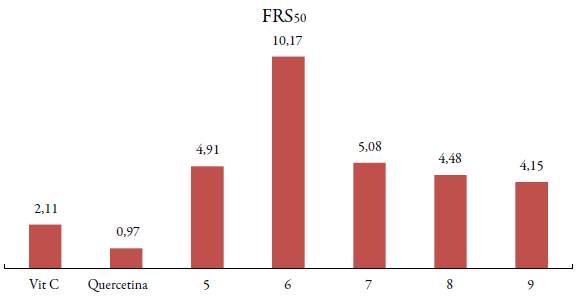
Igualmente, se observó el efecto que tiene el radio iónico sobre la actividad de captación de radicales libres en los compuestos evaluados, se encontró en el compuesto 9 que a concentraciones más bajas se obtienen mayores porcentajes de inhibición en relación con los otros complejos metálicos. Esto se debe fundamentalmente a que los cationes de samario al tener el radio iónico de menor tamaño (1,079 Å) poseen mayor poder polarizante sobre el enlace -SH, lo que favorece su capacidad antioxidante [25]. Este efecto también se vio reflejado en los valores de %FRS50 encontrados para las muestras evaluadas, obteniendo el menor valor %FRS50 expresado en unidades µg-mL-1 para el complejo 9 (ver figura 9).
Estudios electroquímicos
Con el fin de complementar los resultados de actividad antioxidante proporcionados por el método de reducción del radical DPPH-, y considerando que los compuestos antioxidantes presentan bajos potenciales de oxidación, se realizó el estudio electroquímico de los compuestos sintetizados mediante voltametría cíclica y voltametría de onda cuadrada (ver figura 10).
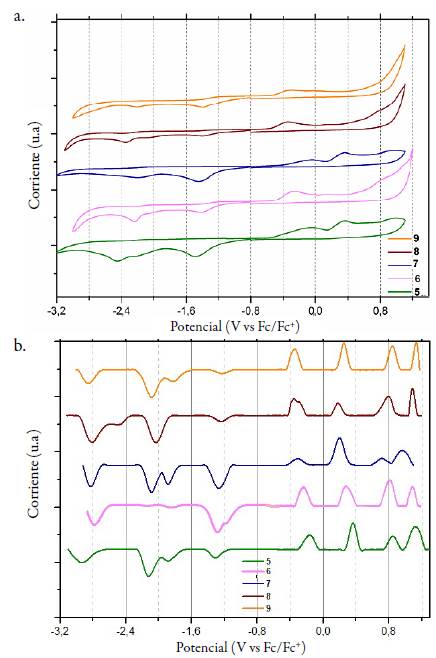
Figura 10 Estudio electroquímico del ligando 5 y sus complejos lantánidos: voltametría cíclica (a) y voltametría de onda cuadrada (b).
La voltametría cíclica (CV) es una técnica electroquímica frecuentemente utilizada (a menudo junto con el ensayo DPPH) para la determinación de compuestos con propiedades antioxidantes. Este procedimiento consiste en un escaneo del potencial desde un valor inicial hasta un valor final vs la corriente. El potencial al que se registra un aumento de la corriente corresponde a la oxidación (o reducción) de una especie en solución. Por lo tanto, el potencial de oxidación medido por voltametría cíclica se puede tomar como una medida de la facilidad del proceso de oxidación [26]. Específicamente, los bajos potenciales de oxidación están asociados a una mayor facilidad de electrodonación por parte de aquellos compuestos considerados potencialmente antioxidantes [27, 28]. Este mismo resultado se obtiene mediante voltametría de onda cuadrada, sin embargo, posee un menor límite de detección comparada con la voltametría cíclica, por tanto es posible observar con una mayor sensibilidad el proceso redox [29].
De manera general, se observa que el ligando 5 y sus complejos lantánidos presentan cuatro picos de oxidación bajos y cuatro picos de reducción altos, por lo tanto, se consideran compuestos altamente antioxidantes ya que presenta potenciales catódicos por debajo de 0,5 V. Todos los voltamogramas cíclicos de los compuestos sintetizados evidenciaron irreversibilidad, además de presentar un comportamiento electroquímico similar (ver figura 10, izquierda), lo que indica que el proceso redox está centrado en el ligando, por lo tanto, se considera que el ion metálico favorece la actividad antioxidante del ligando al disminuir su potencial de oxidación.
En la figura 10 (izquierda y derecha) se observa que los complejos lantánidos presentan bajos potenciales de oxidación y altos potenciales de reducción respecto al ligando libre, lo que evidencia el efecto sinérgico metal-ligando. Al igual que los resultados obtenidos mediante el ensayo de captación del radical libre DPPH-, en la figura 10 (derecha) se observa que el complejo de samario 9, presentó potencial de oxidación bajo y alto potencial de reducción comparado con los demás complejos lantánidos, indicando que el tamaño del ion metálico favorece la electrodonación. Estos resultados sugieren que el posible mecanismo mediante el cual ocurre la reacción de reducción del través de la donación de un átomo de hidrógeno o un electrón [30].
Estudio de la actividad antibacteriana
La resistencia a los medicamentos antimicrobianos es uno de los mayores desafíos para la química medicinal moderna, ya que existe una creciente necesidad de desarrollar nuevos agentes antimicrobianos con menor toxicidad y actividad farmacológica más potente. Los compuestos derivados del benzimidazol u oxadiazol son una clase importante de compuestos heterocíclicos con un amplio espectro de actividades biológicas, y son farmacóforos comúnmente utilizados en el diseño racional de fármacos, debido a su facilidad para interactuar con diversos biopolímeros que se encuentran en los sistemas vivos.
Se determinaron, mediante ensayos in vitro, las concentraciones mínimas inhibitorias (CMI, en µg- mL1) del compuesto orgánico empleado como ligando y sus respectivos complejos lantánidos. Se utilizó el método de microdilución recomendado por el CLSI (Clinical Laboratory Standards Institute), sobre 5 cepas bacterianas Gram negativas (E. coli ATCC25922, K. pneumoniae ATCC 1705, K. pneumoniae ATCC 2146 y cepas clínicas S. dysenteriae y Salmonella sp) y 2 cepas bacterianas Gram positivas (B. subtilis ATCC 6633 y S. aureus ATCC 6538). En la tabla 1 se presentan los resultados obtenidos de CMI para los compuestos evaluados.
Tabla 1 Concentración mínima inhibitoria (expresada en µg. mL-1) del ligando 5 y sus respectivos complejos lantánidos 6-9.
| Compuesto | Gram negativas | Gram positivas | |||||
|---|---|---|---|---|---|---|---|
| E. coli ATCC 25922 | K. pneumoniae ATCC 1705 | K. pneumoniae ATCC 2146 | S. dysenteriae | Salmonella sp | B. subtilis ATCC 6633 | S. aureus ATCC 6538 | |
| 5 | >1000 | >1000 | >1000 | 1000 | >1000 | >1000 | >1000 |
| 6 | 800 | >1000 | >1000 | 800 | 800 | >1000 | >1000 |
| 7 | 800 | >1000 | >1000 | 800 | 800 | >1000 | >1000 |
| 8 | 800 | >1000 | >1000 | 800 | 800 | >1000 | >1000 |
| 9 | >800 | >1000 | >1000 | 800 | 800 | >1000 | >1000 |
Los compuestos sintetizados fueron activos principalmente en 3 cepas bacterianas Gram negativas. El ligando (5) inhibió el crecimiento de la cepa S. dysenteriae, a una concentración de 1000 µg-mL-1 y todos los complejos lantánidos presentaron actividad frente a las cepas de S. dysenteriae, Salmonella sp y E. coli ATCC 25922 a una concentración de 800 µg-mL-1, con excepción del complejo de samario (9) frente a E. coli. De acuerdo con los resultados, se observa que el efecto del tamaño del ion metálico no es significativo en la inhibición del crecimiento de las cepas bacterianas, sin embargo, es posible considerar un efecto sinérgico entre el ligando y el respectivo catión lantánido, al observar que todos los complejos lantánidos presentaron una menor concentración mínima inhibitoria en las cepas S. dysenteriae y Salmonella, con respecto al ligando libre. Este comportamiento se explica debido al efecto Overtone [31] y la teoría de quelación de Tweedy [32], la cual plantea que en un complejo de coordinación disminuye la polaridad del ion metálico y aumenta la lipofilicidad del complejo, facilitando así, su paso a través de la membrana lipídica de los microorganismos patógenos y una posible inhibición de catálisis enzimática o de la síntesis de ADN.
Es importante resaltar que el anillo benzimidazólico presente en los compuestos puede ejercer un efecto antibacteriano debido a su similitud estructural con la purina, la cual desempeña una labor importante en la biosíntesis de los ácidos nucleicos y proteínas en la pared celular bacteriana. Por tanto, se considera que el benzimidazol es un inhibidor competitivo y pueden reemplazar la purina, bloqueando la biosíntesis de ácido nucleicos, matando o inhibiendo el crecimiento bacteriano [33].
También, se debe considerar que la actividad antibacteriana del anillo benzimidazólico se debe a la inhibición de enzimas que participan en la división celular como la ADN girasa, la inhibición enzimática ocurre mediante la formación de enlaces de hidrógeno del grupo amino NH del anillo y los carboxilatos de los aminoácidos (ASP) de la proteína. De esta manera, a pesar de la coordinación del centro metálico al ligando mediante el heteroátomo del anillo benzimidazol, el compuesto no pierde la capacidad de interactuar con la ADN girasa [34], por lo que es posible considerar que la actividad antibacteriana del ligando y los complejos, se encuentre relacionada con la inhibición de la actividad enzimática durante la síntesis y replicación del ADN.