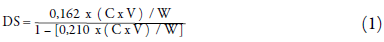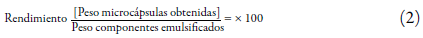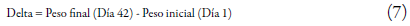INTRODUCCIÓN
La industria avícola es un sector de gran importancia en el país y en el mundo, gracias al cual disponemos de alimentos que son incluidos con alta frecuencia y proporción en nuestra nutrición, como la carne y los huevos de pollo. Desde 1950, la industria avícola ha utilizado aditivos promotores de crecimiento (APC), principalmente antibióticos, en la alimentación de pollos de engorde con el fin de incrementar la productividad y competitividad, dado que estos productos mejoran el estatus fisiológico y nutricional del ave [1-2]. Sin embargo, los países altamente regulados han prohibido o restringido su uso procurando reducir los riesgos de resistencia a los antibióticos [3, 4], la Organización Mundial de la Salud (OMS) apoyó esta posición [5], por lo que es necesario la buscar alternativas a los APC.
El aceite esencial de tomillo, proveniente de la especie Thymus vulgaris, es conocido por sus propiedades antimicrobianas [6]., antifúngicas [7], antioxidantes, antiinflamatorias, entre otras; ha sido estudiado y propuesto como una interesante opción de APC para aves de corral [8]. No obstante, por su alta volatilidad, estas propiedades no pueden ser aprovechadas en todo su potencial si el estado del aceite esencial es natural [9]. La microencapsulación surge como una posibilidad de protección de dicho aceite ya que, a su vez, permite modular su liberación para ejercer el efecto deseado.
La microencapsulación es el proceso con el cual se rodea un componente o mezcla de componentes, que podría ser un ingrediente activo, con una pared (generalmente conformada por polímeros) y se obtienen partículas de aproximadamente 3 μm hasta 800 μm [10]. Se pueden microencapsular diferentes materiales biológicamente activos como enzimas, microorganismos, fármacos e ingredientes naturales, para protegerlos contra condiciones medioambientales, controlar su liberación, entre otros [11, 12]. Existen diferentes técnicas para microencapsular y, en algunos casos, nanoencapsular un activo, que se agrupan en métodos físicos, químicos y fisicoquímicos. Entre los físicos se destaca el secado por aspersión; la polimerización interfacial e inclusión molecular son ejemplo de los químicos; y la coacervación, la formación de liposomas y la gelificación iónica, de los fisicoquímicos [13].
El secado por aspersión, técnica empleada en este estudio, es un proceso en el que la fase líquida (emulsión, suspensión o solución) se ve forzada a formar gotas mediante un atomizador o una boquilla de pulverización. El equipo funciona utilizando una corriente de gas a presión a determinada temperatura, que arrastra por vacío la fase líquida a través de la boquilla de apertura fina (generalmente 1,5 mm), la cual integra también el gas comprimido expulsando el líquido en forma de gotitas, que son secadas instantáneamente en una cámara (cilindro) que se encuentra sobre los 100 °C. Posteriormente, las microcápsulas formadas son llevadas por el flujo del sistema hacia un ciclón en el cual se separan del aire y caen hacia un recipiente recolector [14].
El secado por aspersión elimina rápidamente el agua por vaporización de emulsiones de aceite en agua (O/W) que permite una alta retención de compuestos volátiles [15] y protege los compuestos microencapsulados contra la reacción con el ambiente [16]. En comparación con otros métodos, el secado por aspersión proporciona una eficiencia de encapsulación relativamente alta. La mayor eficiencia de encapsulación que se alcanza con el secado por aspersión se encuentra entre 96 y 100 %, valores superiores en comparación con otros métodos [17].
Se pueden emplear polímeros de origen natural como material de pared de las micro-partículas [18]. Algunos de los empleados son gomas, maltodextrina, carboximetilcelulosa, almidón, gelatina, quitosano, entre otros [17, 19]. Los materiales seleccionados deben ser de grado alimenticio, pues los pollos de engorde están destinados al consumo humano. Por lo tanto, se seleccionó como material de pared el almidón de ñame modificado con anhídrido octenil succínico (aprobado en el Codex Alimentarius), el cual se propuso en combinación con maltodextrina y goma arábiga, también empleados para este tipo de productos.
Las exigencias del mercado y de las regulaciones fomentan la investigación de alternativas a los productos existentes y de uso tradicional por los productores. En el caso de los antibióticos que han sido ampliamente utilizados como promotores de crecimiento en producción avícola, hoy se reconoce el potencial riesgo de esta práctica para la salud humana, como agravante se pronostica el crecimiento de la producción y consumo de la carne avícola a nivel mundial en los próximos años. Según informe de la FAO, la producción de carne de ave estuvo en 115,19 millones de toneladas en 2016 y se espera que llegue a 131,25 en 2025 [20]. Lo anterior denota la importancia de disponer de alternativas que apoyen la producción de aves de corral que no representen riesgos de salud pública. Por esta razón, partiendo de los estudios que se han realizado acerca del efecto de los aceites esenciales como promotores de crecimiento [8, 21-23], componentes que están respaldados como seguros por la Agencia de Drogas y Alimentos de Estados Unidos (FDA) y, además, tienen gran aceptación por la población en general debido a su origen natural y familiaridad en el uso tradicional, por ello, se buscó llegar a un producto que pudiera ser empleado por los productores avícolas.
El objetivo de este estudio fue desarrollar un microencapsulado que incluya al aceite esencial de tomillo como ingrediente natural activo, mediante la técnica de secado por aspersión utilizando como material de recubrimiento una mezcla de biopolímeros, con el propósito de disminuir la volatilización de sus componentes y controlar la liberación del activo, para su empleo como promotor de crecimiento en la producción de pollos de engorde.
MATERIALES Y MÉTODOS
Materiales
Obtención de los microencapsulados
Aceite esencial de tomillo (Green Andina, Lote: ATMGAC 1804-37, FV: 27/04/2019, Colombia). Goma arábiga en polvo (grado farmacéutico, Ciacomeq S.A.S., Lote: PT16-2017, Colombia). Maltodextrina (grado farmacéutico, Ciacomeq S.A.S., Lote: M1628201, Colombia). Almidón de ñame modificado (lipofilizado con octenil suc-cínico). Reactivo OSA (grado alimenticio, Sigma-Aldrich®, EU, Lote: MKBJ5610V). Agua destilada.
Reactivos y demás material requerido para el estudio
Acetato de etilo (grado HPLC, PanReact AppliChem, Lote: 0000833239, Alemania). Alcohol etílico 96% (grado farmacéutico, Ciacomeq S.A.S., Colombia). Hipoclorito, HCl, AgNO3 0,1 N, polisorbato 40, acetato de sodio, tubos de membrana de acetato de celulosa con tamaño de poro de 12KDa (Sigma). Agua filtrada calidad HPLC (Milli-Q®, Millipore), búfer de acetato de sodio.
Ensayo en producción de pollos
Pollos de la raza Ross 308 AP, cascarilla de arroz, pienso sin promotor de crecimiento, alimento comercial con promotor de crecimiento, agua potable.
Equipos
Ultraturrax T18, IKA, Alemania. Estufa universal, UN 55, Memmert GmbH + Co. KG, Alemania. DV-E Viscometer, Modelo RVDVE, Brookfield Engineering, EU. Mini Spray Dryer Buchi B-290, con Inert Loop B-295 integrado, Suiza. Generador de nitrógeno, Proton on Site Nitrogen N341M. Ultrasonido, Cole-Parmer®, 90 Watts, 47 kHz ± 6%, EU. Ultracentrifuga, Megafuge 16 Thermo®, EU. Espectrofotómetro Shimadzu IRPres-tige-21/ATR, Japón. Cromatógrafo de gases Thermo®, TRACE 1300 Mainframe MS, conectado a un ISQ QD espectrofotómetro de masas simple cuadropolo y a un auto-muestreador AL1310 (Thermo Fischer), Massachusetts, EU, en modo de inyección líquida. Masterizer® 3000, Malvern Panalytical, UK. Microscopio electrónico de barrido Fei Quanta 200. Potenciómetro Hanna HI 2221, EU. Cámara climatizada Memmert® HPP750, Alemania. UV-Vis 1800, Shimadzu, Japón. Balanza analítica Ohaus® serie Pioneer PA214, EU. Plancha de agitación multipunto IKA® modelo RO 10 PS1 Werke, Alemania, báscula, nevera, termómetro, Soxhlet.
Obtención del microencapsulado
La obtención de las micropartículas se llevó a cabo mediante el proceso de secado por aspersión, que se describirá más adelante. Para ello fue necesario proveer una emulsión (que fue lo que se atomizó en el equipo) cuya fase oleosa se compone del aceite esencial a encapsular (aceite de tomillo) y la fase acuosa formada por una dispersión del polímero (o mezcla de polímeros) que constituyó la matriz de recubrimiento. Los polímeros evaluados fueron la maltodextrina (M), la goma acacia (GA) y el almidón de ñame succinatado (AÑS). A continuación, se presentan las fases previas requeridas para llegar a la obtención del aceite de tomillo microencapsulado.
Obtención, modificación y caracterización del almidón de ñame
El almidón de ñame (Dioscorea rotundata, var. espino) en su estado nativo se extrajo de tubérculos adquiridos en la plaza de mercado del municipio de Sabanalarga, departamento del Atlántico, Colombia, (10° 37 latitud norte y 74° 55 longitud oeste), a 41 km de la ciudad de Barranquilla vía Cordialidad. Se partió con 10 kg de material vegetal fresco, entero, con adecuado aspecto y madurez apto para consumo humano. Para la obtención del almidón nativo se siguió el método convencional de rallado y precipitación [24], se dejó en remojo durante 12 horas con solución de hipoclorito de sodio, posteriormente, fue licuado y el jugo obtenido se filtró empleando una tela con el propósito de retirar las fibras de celulosa. El filtrado se decantó y el sedimento se lavó con agua destilada varias veces; se filtró al vacío verificando la ausencia de cloruros con solución de AgNO3 0,1 N. El almidón obtenido se dejó secar a 50 °C durante 24 h, luego se empacó en bolsas plásticas herméticas para su posterior hidrólisis y lipofilización (succinatación), lo que se realizó por triplicado, esto dió lugar a tres lotes diferentes del almidón modificado.
La hidrólisis se llevó a cabo siguiendo la metodología propuesta por Zambrano y Marúa con ciertas modificaciones [25, 26]. Se preparó una dispersión de 250 g del almidón nativo de ñame en 625 mL de agua destilada con agitación constante. Seguidamente se adicionó ácido clorhídrico en cantidad suficiente para obtener una concentración del 3% continuando la agitación por 24 h. Con el fin de neutralizar el sistema, se adicionó NaOH al 10% según la relación estequiométrica durante la agitación; se decantó, se lavó, se filtró al vacío y se dejó secar a 50 °C por 24 h. Finalmente, el almidón hidrolizado seco se almacenó en bolsas plásticas de sellado hermético.
La lipofilización del almidón se llevó a cabo con anhídrido octenil succínico (OSA) según el método de Chi con modificaciones [27]. Se pesaron 239 g del almidón hidrolizado y se suspendió en 597,5 mL de agua destilada con agitación magnética constante. Se ajustó el pH hasta 8,5 durante media hora empleando solución de NaOH al 3. Se adicionaron 60 g de OSA disuelto en etanol. Se mantuvo el pH entre 8,5 y 9,0 con la misma solución de NaOH al 3% durante las 2 h de la reacción. Posteriormente, el pH de la solución se ajustó con HCl al valor de 7. Al sedimento obtenido se le hicieron lavados con agua destilada, se filtró al vacío y se secó en horno a 45 °C durante 24 h. Posteriormente, el almidón modificado se sometió a lavados con 300 mL de etanol al 96% en un equipo Soxhlet, haciendo 10 recirculaciones con el propósito de garantizar la remoción total del anhídrido octenil succínico libre. Finalmente, el almidón modificado se secó a 45 °C durante 48 h.
Determinación del grado de sustitución (GS)
Se determinó mediante titulación ácido-base, a los tres lotes de almidón modificado. Indica el número promedio de grupos hidroxilos sustituidos por mol de anhidroglucosa (AG) [28]. Se dispersaron 2 g de almidón lipofilizado en 40 mL de agua destilada. Se sometió a calentamiento hasta ebullición y se dejó enfriar a temperatura ambiente. Se adicionaron tres gotas de fenolftaleína al 1 % como indicador y se tituló con NaOH 0,01 N hasta coloración rosa leve. El GS se calculó mediante la ecuación 1:
Dónde:
C= normalidad de la solución de NaOH utilizado durante la titulación.
V = volumen (mL) consumido de la solución de NaOH.
W = peso (g) de la muestra analizada.
162 es el peso molecular de la unidad de glucosa.
210 es el peso molecular del OSA.
Caracterización por espectroscopía infrarroja
El AÑ y el AÑS se caracterizaron mediante espectroscopia infrarroja (infrarrojo, Shimadzu IRPrestige-21), en un rango de longitud de onda entre 4000 y 500 cm-1, las mediciones fueron realizadas con el aditamento ATR, siguiendo la metodología descrita por la USP 42 [29].
Caracterización del aceite esencial de tomillo
La composición del aceite esencial de tomillo se analizó mediante la técnica instrumental de cromatografía de gases acoplada a detector de masas con impacto electrónico (GC-MS/EI), siguiendo la metodología de Fernandes et al. [30] con algunas modificaciones. Todos los análisis fueron llevados a cabo en un equipo Thermo Scientific™ Trace™ 1300, conectado a un ISQ QD espectrofotómetro de masas simple cuadropolo y a un auto-muestreador AL1310 (Thermo Fischer, Massachusetts, EE.UU.) en modo de inyección líquida, bajo las siguientes condiciones: como muestra se tomaron 20 [iL de aceite esencial que se disolvieron en 480 μL de acetato de etilo. De esta solución se inyectaron 2 μL en modo split 20:1 a una temperatura de 220 °C. Se empleó una columna capilar de polydimethylsiloxane, 5 % phenyl, 30 m x 0,25 mm ID con un espesor fase estacionaria de 0,25 μL de Thermo (Massachusetts, EE.UU.), empleando helio como gas de arrastre (≥ 99,99% de pureza). El horno fue trabajado con gradiente de temperatura iniciando a 40 °C por un minuto, con una rampa de 4 °C por minuto hasta 180 °C, seguido de un incremento de 30 °C por minuto hasta alcanzar los 250 °C para un tiempo total de corrida de 38,3 min. El espectrofotómetro de masas fue trabajado en rango de escaneo de m/z 50-600 u.m.a. en modo de impacto electrónico y una energía de ionización de 70 eV. La temperatura de la línea de transferencia fue de 280 °C y la de la fuente de ionización de 230 °C.
La evaluación de los datos fue llevada a cabo mediante el software Chromeleon® 7-Chromatography versión 7.2.2.6394. La identificación de los componentes del aceite esencial se determinó por comparación entre los espectros de masas obtenidos de las muestras y los reportados en la librería NIST-2007 del programa.
Preparación de las emulsiones
Mediante ensayos preliminares se determinaron las condiciones de emulsificación para formar una emulsión con estabilidad aceptable y apropiada para llevar a cabo el proceso de microencapsulación. Esto comprendía la selección del agente o mezcla de agentes que conformarían la matriz biopolimérica GA, M o AÑS, la relación de las fases oleosa y acuosa, la velocidad y el tiempo de homogenización. A partir de las composiciones de las matrices definidas se evaluaron distintas relaciones de fases oleosa/acuosa tales como 1:4, 1:5 y 1:6. La velocidad de homogenización se probó entre 10 000-15 000 rpm y el tiempo entre 15 y 30 min. Los biopolímeros se dispersaron previamente en agua durante 12 h, a fin de asegurar su dispersión o hinchamiento, con contenidos totales de sólidos del 20 %. Para la matriz GA/M se definió una proporción 50:50 de cada dispersión y para la matriz GA/M/AÑS se definieron proporciones equivalentes de cada material (1/3: 1/3: 1/3).
Se prepararon las emulsiones de aceite esencial de tomillo con la matriz de recubrimiento seleccionada mediante un proceso convencional en caliente para emulsiones Pickering. Se siguió la técnica propuesta por Song et al. y Chevalier and Bolzinger [31, 32], que consiste en iniciar con la suspensión del sólido que cumplirá el papel de estabilizante de la emulsión en la fase acuosa, por lo cual se dispersó el almidón succinatado en agua, permitiendo su hidratación durante 12 h a 50 °C. Una vez disperso, el aceite esencial de tomillo se fue adicionando a la dispersión anterior, homogenizando con el equipo de dispersión Ultraturrax T18, IKA, bajo las condiciones establecidas en los ensayos preliminares.
Caracterización de las emulsiones
Para el éxito de la microencapsulación fue necesario asegurar una estabilidad idónea de las emulsiones, por lo cual se evaluó la viscosidad y apariencia. La viscosidad de la emulsión debía estar en un rango entre 100-300 cp para ser bombeable por el equipo de secado por atomización. Este parámetro se midió por triplicado a 100 g de la emulsión, utilizando un viscosímetro Brookfield modelo RVDV-E a 50 rpm, empleando la aguja 2 y a 18 ± 2 °C. Asimismo, se observó el aspecto visual de la emulsión a temperatura ambiente y de refrigeración en un lapso de 7 días, considerando la presencia o ausencia de separación de fases.
Elaboración de las micropartículas
La obtención de las micropartículas se llevó a cabo mediante el proceso de secado por atomización en un equipo Mini Spray Dryer Buchi B-290, con Inert Loop B-295 integrado, equipado con un generador de nitrógeno (Proton on Site Nitrogen N341M) que provee una atmosfera inerte durante el secado, para reducir la oxidación del aceite esencial, siguiendo la metodología de Kusonwiriyawong [33]. La emulsión fue bombeada peristálticamente en el equipo y pasó a través de una boquilla (1,5 mm de diámetro interno), donde se atomizó en forma de finas gotas. Las condiciones de trabajo fueron: temperatura de inyección: 137-138 °C, flujo de nitrógeno: 414 L/h, tasa de aspiración de aproximadamente: 32 m3/h y velocidad de alimentación de aproximadamente: 3 mL/min.
Las condiciones de obtención y composición de los microencapsulados se definieron mediante un diseño estadístico experimental (DEE) fraccionado 25, cuyas variables de ensayo fueron: tipo de matriz polimérica, temperatura de inyección, flujo de nitrógeno, flujo de alimentación y flujo de aspiración; mientras que las variables respuesta fueron: rendimiento, eficiencia de encapsulación, tamaño de partícula e índice de dispersión. Se realizaron ensayos previos con el propósito de encontrar las condiciones de partida para el DEE, evidenciando, por ejemplo, que la temperatura de inyección no podía estar por debajo de 138 °C ya que no permitía el secado total del solvente. Finalmente, se establecieron las condiciones del DEE como se describe en las tablas 1 y 2.
Tabla 1 Variables de ensayo y niveles del diseño estadístico experimental.
| Variable de ensayo a evaluar | Nivel bajo (-) | Nivel alto (+) |
|---|---|---|
| A: matriz polimérica | GA/M | GA/M/AÑS |
| B: flujo de nitrógeno | 414 l/h | 601 l/h |
| C: flujo de aspiración | 32 m3/h | 38 m3/h |
| D: flujo de alimentación | 3 ml/min | 6 ml/min |
| E: temperatura de inyección | 138 °C | 142 °c |
GA: goma arábiga, M: maltodextrina y AÑS: almidón de ñame succinatado.
Tabla 2 Experimentos del diseño estadístico experimental fraccionado 25.
| Factores experimento | Matriz polimérica (A) | Flujo de nitrógeno (B) | Flujo aspiración (C) | Flujo alimentación (D) | Temperatura inyección (E) |
|---|---|---|---|---|---|
| 1 | - | - | - | + | + |
| 2 | - | - | + | - | + |
| 3 | - | + | - | + | - |
| 4 | - | + | + | - | - |
| 5 | + | - | - | - | + |
| 6 | + | - | + | + | + |
| 7 | + | + | - | - | - |
| 8 | + | + | + | + | - |
(-) Nivel bajo; (+) nivel alto
Caracterización de las microcápsulas: variables respuesta del DEE
Los microencapsulados se caracterizaron mediante pruebas que permitieron evaluar las propiedades de mayor interés para el objetivo propuesto. Se evaluaron el rendimiento del proceso, la eficiencia de encapsulación, el tamaño de partícula y el índice de polidispersidad.
Rendimiento del proceso
Se calculó el rendimiento del proceso llevado a cabo por secado por aspersión de acuerdo con la ecuación 2:
Donde el peso de los componentes emulsificados corresponde a la masa de los biopolímeros y el aceite esencial adicionado en la emulsión sin tener en cuenta la masa de agua utilizada para preparar la dispersión de sólidos [30].
Eficiencia de encapsulación
Para determinar la eficiencia de la encapsulación se realizó una extracción por ultrasonido (Ultrasonido, Cole-Parmer®) a muestras de 1 g de microencapsulados, exactamente pesadas, durante una hora en 5,0 mL de acetato de etilo, luego se centrifugaron por 10 minutos a 8000 rpm (Ultracentrifuga, Megafuge 16 Thermo®), posteriormente, se filtraron y completaron a volumen en balones aforados de 5,0 mL. Para su análisis, se preparó una dilución tomando 40 μL del filtrado y llevándolo a 1,0 mL en acetato de etilo; esta muestra se analizó mediante GC-MS/EI, según la metodología reportada previamente en la identificación del aceite esencial de tomillo.
Se realizó una semicuantificación siguiendo el método de estándar externo de único punto y normalización de áreas [34], preparando dilución del aceite esencial puro como estándar de acuerdo con el procedimiento descrito anteriormente. La eficiencia de la encapsulación (EE por sus siglas en inglés, Encapsulation Efficiency) se calculó de acuerdo con la ecuación 3, mientras que la eficiencia de carga (LC por sus siglas en inglés, Loading Capacity) con la ecuación 4 [35].
Contenido de aceite superficial
Para la determinación del aceite superficial se tomaron muestras exactamente pesadas de 500 mg de microcápsulas, las cuales se lavaron 5 veces con 1 mL de acetato de etilo, se filtraron y recuperaron para llevar a volumen de 5,0 mL [30]. Para su análisis, se preparó una dilución tomando 40 μL del filtrado y llevándolo a 1,0 mL en acetato de etilo; esta muestra se analizó mediante cromatografía de gases acoplada a detector de masas, de igual forma que lo reportado previamente.
Tamaño de partícula e índice de dispersión
Parala determinación del tamaño de partícula de las microcápsulas obtenidas se empleó un equipo de dispersión de rayo láser Masterizer® 3000, Malvern Panalytical, equipado con una unidad de dispersión de muestra húmeda, con un índice de refracción de 1,0 y precisión de ±1%, empleando agua como medio de transporte a 20 °C.
Las micropartículas se suspendieron en agua y se sometieron a la dispersión de luz empleando un láser de helio-neón a 633 nm y un ángulo de 173° utilizando una celda de alta concentración ZEN 1010. Se realizaron tres mediciones por muestra, en el mismo tiempo, con el fin de evitar el hinchamiento de los polímeros.
El índice de dispersión (Span) que indica la distribución del tamaño de las micropartículas y se calculó mediante la ecuación 5:
Donde:
Dv90= tamaño de partícula que poseen el 90% de las partículas.
Dv10= tamaño de partícula que poseen el 10% de las partículas.
Dv50= el tamaño del 50% de las partículas.
Análisis estadístico realizado a las variables cuantitativas derivadas del DEE
Se realizó un análisis de efectos principales y su significancia estadística (p>0,05) a partir de los resultados de las variables respuesta evaluadas, con el fin de encontrar la influencia de las variables de ensayo. De esta manera se definieron las condiciones de operación para la obtención del microencapsulado.
Evaluaciones realizadas a la formulación elaborada bajo las condiciones seleccionadas
A la formulación obtenida bajo las condiciones establecidas se le realizó una caracterización organoléptica y morfológica, un estudio de estabilidad, su comportamiento de liberación y se llevó a cabo su evaluación como posible promotor de crecimiento en un estudio de campo empleando pollos de engorde.
Caracterización organoléptica
Para definir las características organolépticas de las microcápsulas se determinaron los parámetros: color y aspecto mediante determinación visual, por observación directa de las muestras y se evaluó el olor.
Morfología
Se identificó la morfología mediante microscopía electrónica de barrido en un equipo Fei Quanta 200. Las superficies de las microcápsulas fueron recubiertas con oro a un grosor de aproximadamente 20 nm utilizando un sistema combinado de recubrimiento por sputter y por evaporación de carbón, Quorum Technologies Q150R ES.
Estudio de estabilidad
Se evaluaron 3 lotes del microencapsulado elaborados bajo las condiciones definidas, incluidos en viales de vidrio inerte con cierre hermético, que fueron colocados en una cabina de estabilidad (Cámara climatizada Memmert® HPP750) a temperatura de 30 °C y 75 % de humedad relativa. Se realizaron muestreos en los siguientes tiempos: 0 h, 24 h, 72 h, 7 días y 20 días. Cada muestra fue procesada según la metodología descrita para el ensayo de eficiencia de encapsulación y se analizó mediante cromatografía de gases acoplada a detector de masas (Thermo®, Trace 1300 Mainframe MS), siguiendo lo planteado para la identificación del aceite esencial de tomillo, mediante semi-cuantificación por el método de estándar externo de único punto y normalización de áreas.
Evaluación del comportamiento de liberación
Se emplearon dos métodos, uno basado en la pérdida de peso en función del tiempo a una temperatura específica y el otro fue un ensayo empleando un medio de disolución, en el que se cuantificó el aceite de tomillo liberado en función del tiempo.
Evaluación basada en la pérdida de peso
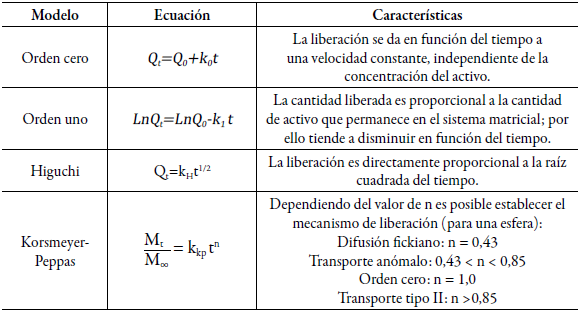
Se siguió una metodología similar a la realizada en un trabajo previo [36]. Se pesaron aproximadamente 2,5 g de los microencapsulados por triplicado, los cuales se llevaron a una temperatura de 37 °C durante 3 h (Estufa universal, UN 55, Memmert GmbH + Co. KG), muestreando a los tiempos 0, 20, 40, 60, 90, 120 y 180 minutos. Se determinó el peso a cada tiempo evaluado y se calculó la diferencia del peso encontrado respecto al tiempo cero. Este valor corresponde a lo liberado de aceite de tomillo. Con los resultados se determinó la cinética de liberación, considerando el mejor ajuste al modelo, empleando las ecuaciones que se presentan en la tabla 3.
Evaluación basada en la cuantificación del aceite esencial de tomillo en un medio de disolución
Se dispersaron 3,2 g de las micropartículas en 3 mL en un medio que contenía buffer de acetato de sodio a pH 5,0 y polisorbato 40 al 0,03 %. Esta dispersión se introdujo en una bolsa de diálisis (membrana de acetato de celulosa con tamaño de poro de 12 kDa (Sigma)) que se sumergió en un vaso de precipitados que contenía 100 mL del medio de liberación, manteniendo la temperatura a 37 °C. El muestreo se hizo durante 3 h, tomando alícuotas de 5 mL en el medio receptor a los mismos tiempos evaluados en el ensayo anterior: 0, 20, 40, 60, 90, 120 y 180 minutos. Las condiciones establecidas buscaron simular las condiciones digestivas del pollo [37, 38]. Para la cuantificación del aceite esencial de tomillo se realizó una curva de calibración, siguiendo una metodología analítica por UV a 274,2 nm (UV-Vis 1800, Shimadzu) y en ella se interpolaron los resultados obtenidos. Como blanco se emplearon las microcápsulas vacías, a las que se les aplicó el mismo procedimiento empleado para las microcápsulas con el aceite de tomillo. Se evaluó el modelo cinético a que mejor se ajustaban los datos, de manera similar a lo explicado previamente y considerando las ecuaciones de la tabla 3. El montaje del ensayo se muestra en la figura 1.
Evaluación del desempeño del microencapsulado de aceite esencial de tomillo en la producción de pollos de engorde
El estudio se realizó siguiendo una metodología similar a la reportada por [39-41], en el municipio de Fusagasugá, Cundinamarca, vereda Usatama, el cual cuenta con las siguientes características agroclimatológicas: ubicado entre los 1550 a los 3050 m s.n.m, temperatura promedio 20 °C y humedad relativa media: 85 %. Se evaluaron un número total de 45 pollos de la raza Ross 308 AP, empleando un diseño experimental aleatorizado, distribuidos en tres tratamientos que consistían en 5 repeticiones con 3 aves por repetición, para un total de 15 pollos por tratamiento. El tratamiento 1 correspondió al grupo control (dieta basal), a los pollos se les dio el pienso sin incluir ningún promotor de crecimiento; el tratamiento 2, correspondió al pienso al que se le adicionaron 32 mg del microencapsulado que contenía el aceite de tomillo, considerando estudios recomendados por la literatura científica [42, 43] y el porcentaje de encapsulación encontrado para el producto desarrollado; y el tratamiento 3 era el alimento comercial que contenía el promotor de crecimiento (control positivo). Los pollos (machos) de un día de edad se criaron hasta los 42 días y fueron alimentados con una dieta de iniciación (del día 1 al 21) y una de crecimiento (del día 22 al 42). Todas las aves se mantuvieron en condiciones similares de manejo durante todo el período experimental. Se proporcionó alimento y agua para consumo ad libitum. Durante los 42 días del estudio se determinó el peso y la ingesta de cada uno de los individuos. A partir de esta información se determinaron la ganancia de peso (GDP), el consumo de alimento acumulado (CAA) y la conversión alimenticia (CA). La mortalidad se registró diariamente para corregir los datos de conversión alimenticia.
La GDP se obtuvo por la diferencia entre los pesos iniciales y pesos finales. El CAA se calculó semanalmente a partir del peso del alimento sobrante de los comederos de cada tratamiento. Al peso del alimento inicial suministrado se le restó el peso final del alimento restante en comederos y a partir de eso se calculó el promedio acumulado semanal.
La CA se calculó mediante la ecuación 6 al cierre de cada semana.
Los resultados de la distribución de peso del pollo fueron graficados en función del tiempo, incluyendo todas las réplicas para observar la variabilidad entre tratamientos. Basado en los resultados se estableció un análisis estadístico para los datos de la GDP correspondientes al último tiempo de estudio de los 3 tratamientos, aplicando la ecuación 7:
Con estos resultados, se estableció la significancia del modelo, se realizó un Anova de una vía con una significancia del 5 %, previamente, se demostró la normalidad y homocedasticidad del modelo mediante las pruebas de Shapiro y Breush-Pagan, respectivamente.
Obtención y caracterización de los almidones de ñame nativo y lipofilizado
El rendimiento del proceso de extracción del almidón de ñame nativo fue de aproximadamente 20 %, siguiendo la metodología descrita. El material obtenido fue de color blanco grisáceo, libre de material extraño, olor y textura parecida a la del almidón de maíz y mantuvo estas características organolépticas luego de su modificación como se muestra en la figura 2.
Determinación del grado de sustitución (GS) en el almidón lipofilizado
Se realizó esta prueba para verificar la reacción de sustitución por parte del anhídrido octenil succínico. Los resultados se presentan en la tabla 4, cuyos valores están conforme a lo encontrado en estudios previos [25].
Análisis por espectroscopia infrarroja (IR)
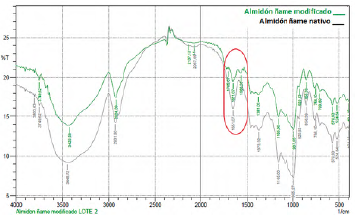
La modificación del almidón de ñame se confirmó mediante IR, comparando las diferencias entre los espectros del almidón nativo con el modificado, corroborando las interacciones entre el grupo OH de la glucosa y el grupo carboxilo del anhídrido tal como se presenta en la figura 3.
En el espectro infrarrojo se observa la señal característica del almidón modificado, que corresponde a la vibración del grupo carbonilo (C=O) en la región de 1705,07 cm-1 perteneciente al carboxilo de la cabeza que queda libre del anhídrido succínico y que estaría ausente en el almidón nativo [44-47], así como la vibración del grupo (O-C=O) en la región de 1566,20 cm-1, resultado similar a lo encontrado por Matiz [25].
Caracterización del aceite esencial de tomillo
Para efectos de control de calidad (y para la posterior cuantificación del aceite retenido en las microcápsulas) se realizó el análisis de cromatografía GC-MS/EI al aceite esencial de tomillo, que permitió identificar 24 componentes. El perfil de composición se presenta en la tabla 5, en el que se identifica como componente principal al d-limoneno, por lo cual fue seleccionado como marcador analítico. La figura 4 muestra el cromatograma correspondiente.
Tabla 5 Perfil de composición del aceite esencial de tomillo obtenido mediante cromatografía de gases con detector de masas.
| #pico | Nombre compuesto | Proporción (%) |
| 1 | Tricicleno | 0,10 |
| 2 | α-pineno | 1,99 |
| 3 | Canfeno | 0,48 |
| 4 | Sabineno | 0,52 |
| 5 | Pineno | 0,19 |
| 6 | β-pineno | 1,71 |
| 7 | 3-careno | 0,07 |
| 8 | p-cimeno | 15,30 |
| 9 | D-limoneno | 45,65 |
| 10 | p-mentha-1,4(8)-diene | 0,15 |
| 11 | β-linalool | 2,51 |
| 12 | exo-Fenchol | 0,07 |
| 13 | Trans-p-mentha-2,8-dienol | 0,07 |
| 14 | Canfor | 0,57 |
| 15 | iso-β-terpineol | 2,80 |
| 16 | Isoborneol | 1,56 |
| 17 | Endo-borneol | 3,01 |
| 18 | 2-isopropenyl-5-methylhex-4-enal | 0,02 |
| 19 | Terpinen-4-ol | 0,15 |
| 20 | α-terpineol | 3,20 |
| 21 | ү- terpineol | 0,96 |
| 22 | Timol | 18,27 |
| 23 | Cariofileno | 0,39 |
| 24 | Eremofileno | 0,07 |
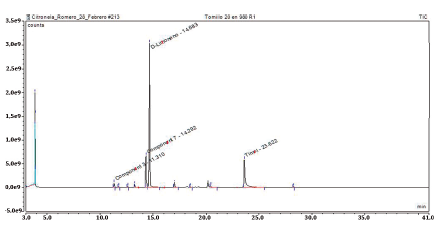
Figura 4 Cromatograma obtenido mediante GC/MS con impacto electrónico del análisis del aceite esencial de tomillo (20 μL/980 μL).
De acuerdo con estos resultados, la composición química identificada corresponde a un quimiotipo de Thymus Vulgaris, que hasta la fecha no ha sido reportado, al cual nombraremos quimiotipo D-limoneno, ya que es el monoterpeno dominante en este aceite esencial. Los diferentes quimiotipos de aceite esencial de tomillo se presentan dependiendo del suelo, del clima, de la época y tiempo de recolección, entre otros aspectos que inciden en la existencia de estos polimorfismos químicos [48]. Los quimiotipos más comunes que se han identificado previamente corresponden a geraniol, a-terpineol, tuyanol-4, linalol, carvacrol, timol, 1,8-cineol [49-51], borneol, hidrato de sabineno y ciclocitral/verbenol [52].
Condiciones de preparación y caracterización de las emulsiones
Las condiciones de emulsificación determinadas se describen en la tabla 6. Los dos tipos de matriz definidos, GA/M y GA/M/AÑS, permitieron la emulsificación del aceite. La relación de fases oleosa/acuosa que emulsificó fue 1:6. La velocidad de homogenización adecuada fue de 13 000 rpm y el tiempo entre 15 y 20 min. La viscosidad de ambas emulsiones se encontraba muy por debajo del límite máximo permitido (300 Cp) para la alimentación en el equipo de secado por aspersión.
Tabla 6 Resultados de los ensayos que permitieron definir las condiciones de emulsificación.
| Relación AET:matriz | Matriz de recubrimiento | Velocidad de homogenización (rpm) | Tiempo de homogenización (min) | Viscosidad (Cp) | Resultado |
|---|---|---|---|---|---|
| 1:4 | GA:M (50:50) | 15 000 | 30 | No medido | Separación de fases. No emulsificó. |
| 1:5 | GA:M (50:50) | 15 000 | 20 | No medido | Separación de fases. No emulsificó. |
| 1:6 | GA:M (50:50) | 13 000 | 20 | 200 | Una sola fase. Emulsificó |
| 1:6 | GA:M:AÑS (1/3:1/3:1/3) | 13 000 | 15 | 112,5 | Una sola fase. Emulsificó |
GA: goma arábiga, M : maltodextrina, AÑS : almidón de ñame succinatado, AET: aceite esencial tomillo.
El aspecto visual observado de los sistemas en los que se obtuvo una emulsión fue adecuado, sin evidenciar separación de fases durante 24 h ni gotículas de aceite sin emulsificar. No obstante, al cabo de 7 días sí se evidenció la separación de fases durante el almacenamiento, a temperatura ambiente y de refrigeración, esto fue más evidente en la medida que transcurría más tiempo (resultados no mostrados). Cabe anotar que con la agitación mecánica se logró dispersar nuevamente las fases separadas. La elevada concentración de los biopolímeros lograda en los sistemas que emulsificaron con relación al aceite esencial de tomillo (relación 1:6) es una ventaja importante porque es uno de los factores que contribuyen a tener eficiencias de encapsulación más altas, debido a al mayor número de interacciones intermoleculares que se presentan entre los biopolímeros y el aceite esencial, de acuerdo con lo reportado por otros autores [53].
Microencapsulación y caracterización
De acuerdo con lo planteado en la metodología, aplicando el DEE 25, se obtuvieron los resultados de las variables respuesta que se presentan en la tabla 7.
Tabla 7 Resultados de las variables respuesta asociadas al diseño estadístico experimental.
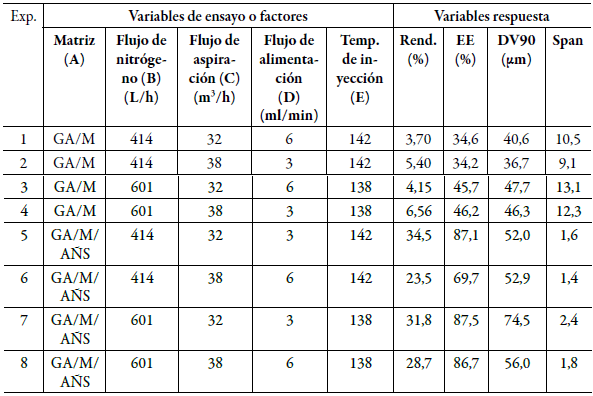
GA: goma arábiga, M: maltodextrina, AÑS: almidón de ñame succinatado, TEMP: temperatura, REND: rendimiento, EE: eficiencia de encapsulación, DV90: tamaño de partícula, Span: índice de dispersión.
El análisis estadístico realizado demostró que la variable de ensayo que tiene una influencia estadística significativa con un p<0,05, es el tipo de matriz polimérica. Las demás variables de ensayo no tienen una influencia estadísticamente significativa en las variables respuesta, como se muestra en la figura 5.
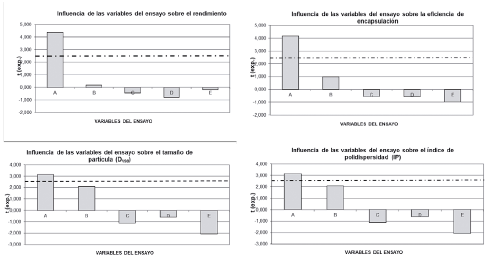
Figura 5 Diagramas de Pareto en los que se relaciona las variables del ensayo sobre cada una de las cuatro variables respuesta. A: matriz polimérica; B: flujo de nitrógeno; C: flujo de aspiración; D: flujo de alimentación y E: temperatura de inyección.
De esta manera, considerando el efecto deseado para cada variable respuesta, de acuerdo con el tipo de producto a desarrollar (tabla 8) y su significancia estadística (figura 5), se eligieron las condiciones señaladas por el DEE para la variable de ensayo A. Las demás no presentaron un efecto estadísticamente significativo, el nivel elegido dependió del efecto deseado. Así, la variable A quedó definida en su nivel superior que corresponde a la matriz GA/M/AÑS. La variable B cuando está en su nivel superior favorece el aumento del rendimiento (se busca que sea el más alto posible), la eficiencia de encapsulación (el interés es que sea alta) y el tamaño de partícula (que sea lo más grande posible). Las variables C y D, si están en un nivel inferior, favorecen el aumento de las variables-respuesta mencionadas. En cuanto a la variable E, se eligió en su valor inferior considerando que favorece el efecto deseado para tres de las cuatro variables respuesta. Este mismo criterio, de favorecer el mayor número de variables respuesta de acuerdo con el efecto deseado se consideró para el resto de las variables del ensayo.
Tabla 8 Resumen de la significancia estadística de cada variable de ensayo y del efecto deseado para cada variable respuesta.
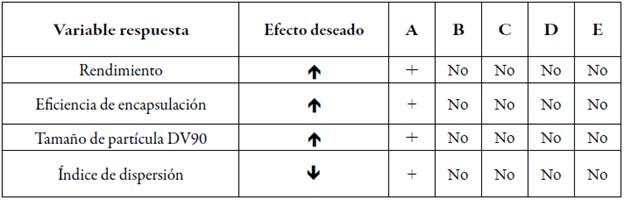
 : aumento de la variable;
: aumento de la variable; 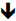 : disminución de la variable; No: la variable de ensayo no tiene efecto estadísticamente significativo sobre la variable respuesta; +: la variable de ensayo tiene efecto estadísticamente significativo sobre la variable respuesta.
: disminución de la variable; No: la variable de ensayo no tiene efecto estadísticamente significativo sobre la variable respuesta; +: la variable de ensayo tiene efecto estadísticamente significativo sobre la variable respuesta.
A partir del análisis estadístico se establecieron como condiciones de la formulación y del proceso las siguientes: matriz del microencapsulado G/M/AÑS (nivel +), flujo de nitrógeno 601 L/h (nivel +), flujo de aspiración 32 m3/h (nivel -), flujo de alimentación 3 mL/min (nivel -) y temperatura de inyección 138 °C (nivel -) que coincidieron con las del experimento 7 del DEE.
Los resultados correspondientes a las propiedades evaluadas para la formulación 7 muestran un rendimiento adecuado, una alta eficiencia de encapsulación, un tamaño de partícula grande y un índice de dispersión no tan alto. De acuerdo con lo discutido previamente, este comportamiento era el deseado. La alta eficiencia de encapsulación lograda (87,5%), refleja una muy buena interacción de los biopolímeros, dentro de los que se destaca al AÑS, que al incorporar una larga cadena hidrocarbonada en su estructura lo hace más lipofílico, haciendo posible que el aceite quede incluido en la micropartícula en una mayor proporción, al tener una naturaleza química similar entre ellos [54]. Porcentajes menores de encapsulación, señalados entre paréntesis, se encontraron con otro tipo de aceites y para diferentes condiciones de emulsificación y secado por aspersión, empleando como material de pared: a la GA-M (79 %) [15], GA-M (45,45 %) [18], valor que mejoraba si en vez de GA se incluía un almidón modificado lipofilizado (60,22 %) [18], GA (36,34 %) [30] y GA-M (75,5 %) [55]. Estos resultados son variados y dependen de la composición del tipo de aceite que se quiera encapsular, algunos resultados pueden ser parecidos [15] y [55] y otros muy diferentes [18], a pesar de emplear los mismos materiales de pared. De manera similar a la tendencia encontrada en el presente estudio, la inclusión de un almidón modificado lipofilizado mejora el porcentaje de encapsulación, lo que confirma la importancia de las interacciones intermoleculares entre el aceite a encapsular y él o los biopolímero(s) que haga(n) parte del material de la microcápsula.
Evaluaciones realizadas a la formulación elaborada bajo las condiciones seleccionadas
A continuación, se presentan los ensayos realizados a las micropartículas obtenidas bajo las condiciones definidas previamente, de acuerdo con lo planteado en la metodología.
Caracterización organoléptica y morfología
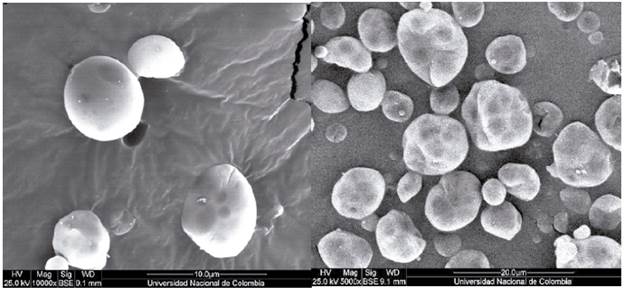
Los microencapsulados elaborados bajo las condiciones seleccionadas fueron de color blanco, textura de polvo suelto y olor característico a aceite de tomillo. En la figura 6 se pueden observar las imágenes tomadas mediante microscopía electrónica de barrido, en la que se define una morfología ovoide tendiente a esférica, como es lo esperado para la obtención de micropartículas por secado por aspersión [54]. Se evidencia la presencia de aceite en su interior.
Estudio de estabilidad
En la figura 7 se presentan los resultados de la variación de la concentración de D-limoneno. en los sistemas microparticulados en función del tiempo para los tres lotes evaluados.
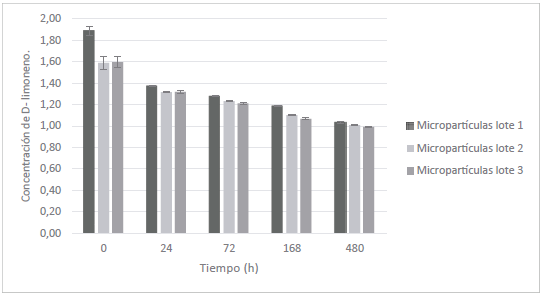
Figura 7 Resultados de la variación de la concentración de D-limoneno incluido en las micropartí-culas, en función del tiempo.
De acuerdo con los resultados del estudio, se estableció que el máximo porcentaje en el que se disminuyó la concentración fue de 45,1 %, que corresponde a lo ocurrido en el día 20 con el lote 3. Para los lotes 1 y 2, estos valores fueron de 36,5 % y 37,7 %, respectivamente. Los resultados mostraron que en los cromatogramas se mantiene la señal de los componentes principales del aceite esencial de tomillo y aparecen algunas otras señales posiblemente relacionadas con productos de degradación (en muy bajas proporciones), que no fueron identificadas (resultados no mostrados). La disminución en la concentración podría atribuirse a la degradación de los compuestos presentes en el aceite, aunque se presume que esto ocurrió en baja proporción de acuerdo con lo descrito anteriormente, mientras una gran parte del aceite esencial de tomillo posiblemente se volatilizó.
En la literatura científica se evidencian comportamientos similares con compuestos volátiles microencapsulados, que al incluirlos dentro de un sistema reservorio, hace que las paredes sólidas que se forman debida a los biopolímeros aumenten su estabilidad, regulando la liberación del aceite esencial y por lo tanto reduciendo la evaporación [55].
Evaluación del comportamiento de liberación
De acuerdo con lo planteado en la metodología se realizaron dos tipos de ensayos: uno basado en la pérdida de peso y el otro mediante cuantificación del aceite de tomillo empleando un medio de disolución.
Evaluación basada en la pérdida de peso
Este ensayo es una manera sencilla y de algún modo preliminar de mostrar que la liberación del aceite de tomillo se va dando paulatinamente en función del tiempo. Como se observa en la gráfica de la figura 8, se alcanza un máximo de pérdida de peso, que corresponde al aceite de tomillo volatilizado, de alrededor de 25 % en un lapso de 3 h, lo que indicaría que la pared de la microcápsula sí está ejerciendo una protección a la volatilización o en otras palabras sí se está dando una modulación de la liberación. Desde lo planteado existen dos miradas para analizar lo sucedido: una desde la óptica de la estabilidad física y la protección que está brindando el sistema al aceite de tomillo incluido en él, disminuyendo su velocidad de volatilización a pesar de que el microencapsulado se está sometiendo a 37 °C de temperatura (simulando una temperatura fisiológica) y sin envase alguno; y la otra mirada es desde su comportamiento de liberación, que como se mencionó se está presentando un control de este parámetro, que se refleja en la pérdida del 25 %; si no hubiera una modulación de la liberación se podría estar evidenciando un 100 % de pérdida de peso en un lapso de 30 min.
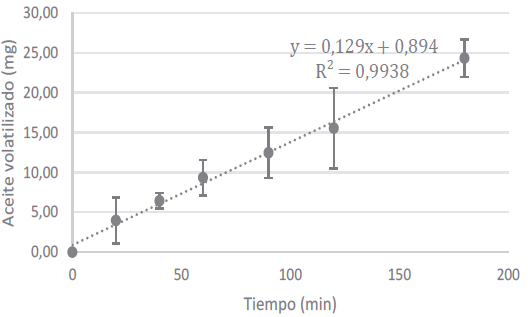
Figura 8 Comportamiento de la pérdida de peso de los sistemas (aceite volatilizado) en función del tiempo.
Los datos presentan un ajuste lineal, reflejando una cinética de orden cero con un R2 de 0,9938 y una constante de velocidad de liberación de 0,129 mg/min. No se evaluaron los modelos de Higuchi y Korsmeyer-Peppas, debido al bajo porcentaje liberado. Estos parámetros son propios del sistema desarrollado y demuestran que la liberación se está dando independientemente de la cantidad de aceite esencial que vaya quedando dentro de la micropartícula, en otras palabras, que el control en la pérdida que se está dando depende de la barrera propia del sistema reservorio.
Evaluación basada en la cuantificación del aceite de tomillo en un medio de disolución
El comportamiento de la liberación del aceite de tomillo a partir del sistema microparticulado se muestra en la figura 9. A diferencia del estudio por pérdida de peso, en este caso las partículas entran en contacto con un medio de disolución, simulando las condiciones fisiológicas del ave, por lo que se alcanza cerca del 100% de aceite de tomillo liberado durante el tiempo de estudio.
Figura 9 Comportamiento de la liberación del aceite de tomillo a partir de las micropartículas en función del tiempo.
En la tabla 9 se muestran los parámetros derivados de evaluar el ajuste a los modelos cinéticos señalados en la metodología. Para cada modelo cinético se presenta su coeficiente de determinación y la constante de velocidad de liberación correspondiente. Los mejores ajustes se dan con los modelos de Higuchi y Korsmeyer-Peppas. Esto implica que la difusión es uno de los mecanismos importantes que gobiernan el proceso de liberación. El valor del exponente n del modelo de Korsmeyer-Peppas, revela que la liberación se está dando de manera anómala, es decir, una combinación de difusión e hinchamiento [56]
Tabla 9 Parámetros calculados para el sistema microparticulado que contiene el aceite de tomillo, para cada modelo de liberación evaluado.
| Modelo | Orden cero | Orden 1 | Higuchi | Korsmeyer-Peppas | |||||
|---|---|---|---|---|---|---|---|---|---|
| Parámetro | R2 | Ko | R2 | K | R2 | kH | R2 | n | |
| Micropartículas | 0,981 | 0,636 | 0,900 | 0,012 | 0,993 | 9,964 | 0,991 | 0,036 | 0,678 |
Estos resultados muestran una modulación en la liberación durante las 3 h del estudio, lo que lleva a sugerir que el producto podría comportarse adecuadamente in vivo.
Evaluación del desempeño del microencapsulado de aceite de tomillo en la producción de pollos de engorde
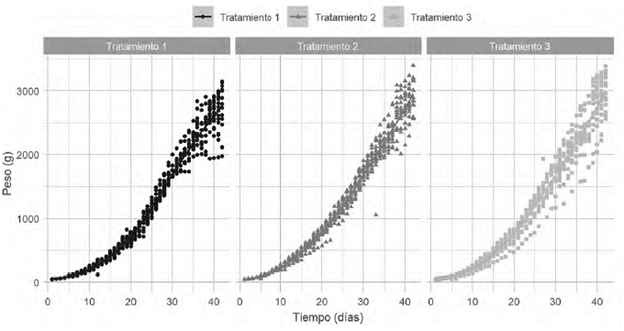
La distribución de peso en función del tiempo, de todos los resultados experimentales se presentan en la figura 10, en la que se observa que los tres tratamientos tienen una distribución de datos similar, destacándose una mayor variabilidad en los datos del tratamiento 3. Se observa que el crecimiento de los pollos a lo largo de tiempo se ajusta a un modelo exponencial y existe una mayor variabilidad en los pesos de los últimos días.
Para evidenciar si estas diferencias son estadísticamente significativas se realizó un análisis de varianza (Anova) de la GDP al tiempo 42, de acuerdo con lo planteado en la metodología. Se encuentra que los tratamientos 2 y 3 son estadísticamente diferentes con el tratamiento 1, mientras los tratamientos 2 y 3 son similares estadísticamente entre ellos. Al existir una diferencia con el tratamiento 1, que es el grupo al que no se le administró promotor de crecimiento, se demuestra que tanto el producto en estudio (tratamiento 2) como el producto comercial (tratamiento 3) influyen en el aumento de peso del pollo, por lo que se estaría evidenciando la actividad del microencapsulado con aceite de tomillo como promotor de crecimiento. Adicionalmente, en las tablas 10 y 11 se presentan los resultados de la CA y del CAA.
Tabla 10 Resultados de conversión alimenticia.
| Semana 1 | Semana 2 | Semana 3 | Semana 4 | Semana 5 | Semana 6 | |
|---|---|---|---|---|---|---|
| T1 | 0,78 | 0,87 | 1,08 | 1,13 | 1,45 | 1,49 |
| T2 | 0,88 | 1,04 | 1,10 | 1,16 | 1,44 | 1,52 |
| T3 | 0,86 | 1,28 | 1,21 | 1,37 | 1,44 | 1,42 |
Tabla 11 Resultados de consumo de alimento acumulado
| CA | T1 | T2 | T3 |
| Semana 1 | 1490 | 1230 | 3445 |
| Semana 2 | 4632 | 5959 | 7225 |
| Semana 3 | 5773 | 14 432 | 14 784 |
| Semana 4 | 24 476 | 17 353 | 20 611 |
| Semana 5 | 29 145 | 15 648 | 18 498 |
| Semana 6 | 27 497 | 17 737 | 25 801 |
| Consumo total | 93 013 | 72 359 | 90 364 |
| Consumo por pollo (g) | 6201 | 4824 | 6024 |
| Consumo por pollo (kg) | 6,20 | 4,82 | 6,02 |
Como era de esperarse para la CA este valor tiende a aumentar en función del tiempo, y se presenta un comportamiento diferente de la semana 2 a la 4 para el tratamiento 2, tiempo durante el cual la CA es mayor en comparación con los otros dos tratamientos. Respecto al CAA, los resultados muestran un menor valor para el tratamiento 2, es decir hubo un menor consumo de alimento, sin embargo, en la figura 10 se evidenció que el comportamiento del peso a lo largo del tiempo fue similar a los tratamientos 1 y 3. Estos resultados sugieren que los pollos del tratamiento 2 presentan un mayor aprovechamiento de los nutrientes. Se ha reportado que el tomillo tiene beneficios en la producción de aves de corral [57-59]lo cual es de esperarse dado la actividad antimicrobiana de este que hace que se disminuyan la pérdida de nutrientes por la presencia de microorganismos, modificando la flora intestinal como lo han reportado algunos autores [42].
CONCLUSIONES
El desarrollo de este estudio permitió definir una formulación para la obtención de micropartículas que incluyeron al aceite de tomillo como ingrediente natural activo, adecuada para el consumo en producción de pollos de engorde, demostrando su comportamiento como promotor de crecimiento estadísticamente similar al presentado por el producto comercial.
Esta formulación se diseñó partiendo de biopolímeros aptos para el consumo por parte de los pollos, que fueran capaces de emulsificar al aceite para su posterior atomización, logrando así obtener micropartículas por la técnica de secado por aspersión bajo condiciones previamente definidas de acuerdo con el DEE propuesto. Se evidenció la protección física que le proporcionó la cubierta polimérica para disminuir la volatilización del aceite de tomillo y el control de la liberación conferido al sistema, que permitió que el producto pudiera ejercer su acción como promotor de crecimiento, bajo las condiciones estudiadas.