Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Entomología
Print version ISSN 0120-0488
Rev. Colomb. Entomol. vol.38 no.1 Bogotá Jan./June 2012
Efecto de Cryptolaemus montrouzieri (Coleoptera: Coccinellidae) en la actividad parasitoide de Anagyrus kamali (Hymenoptera: Encyrtidae) sobre Maconellicoccus hirsutus (Hemiptera: Pseudococcidae)
Effect of Cryptolaemus montrouzieri (Coleoptera: Coccinellidae) in the parasitoid activity of Anagyrus kamali (Hymenoptera: Encyrtidae) on Maconellicoccus hirsutus (Hemiptera: Pseudococcidae)
SALVADOR HERNÁNDEZ-MORENO1, HÉCTOR GONZÁLEZ-HERNÁNDEZ2, J. REFUGIO LOMELI-FLORES1, ESTEBAN RODRÍGUEZ LEYVA1 y AGUSTÍN ROBLES BERMÚDEZ3
1 Postgrado en Fitosanidad-Entomología y Acarología, Colegio de Postgraduados, km 36.5 carretera México-Texcoco, Montecillo, Texcoco, Estado de México, C.P. 56230, México. radamantiz69@yahoo.com.mx, jrlomelif@colpos.mx, esteban@colpos.mx.
2 Postgrado en Fitosanidad-Entomología y Acarología, Colegio de Postgraduados, km 36.5 carretera México-Texcoco, Montecillo, Texcoco, Estado de México, C.P. 56230, México. hgzzhdz@colpos.mx. Autor para correspondencia.
3 Universidad Autónoma de Nayarit, Unidad Académica de Agricultura, Xalisco, Nayarit km. 9 Carr. Tepic-Compostela, Nayarit. CP 63190. nitsugarobles@hotmail.com.
Recibido: 21-oct-2011 - Aceptado: 25-may-2011
Resumen: En varios países se ha introducido Anagyrus kamali y Cryptolaemus montrouzieri para el control de la cochinilla rosada del hibisco (CRH) Maconellicoccus hirsutus, pero no se han establecido las interacciones entre estos enemigos naturales. En el presente trabajo se evaluó en condiciones de laboratorio la interacción de C. montrouzieri (larvas de cuarto estadio y hembras adultas) en la actividad parasitoide de A. kamali sobre la CRH. Para determinar la interacción entre el depredador y el parasitoide se realizaron pruebas de liberación individual y simultánea de ambas especies en pruebas de elección y no elección, utilizando como alimento ninfas de tercer estadio de CRH no parasitadas y parasitadas por A. kamali. Las ninfas parasitadas tenían diferentes periodos de maduración del parasitoide (huevo, larva joven, larva madura, pupa joven y pupa madura). Los resultados mostraron que la presencia de C. montrouzieri redujo la actividad parasitoide de A. kamali a un 2,2 y 5%. En las pruebas de elección C. montrouzieri no discriminó entre CRH sanas y parasitadas de menos de 5 días. En las pruebas de no elección, los adultos y larvas de C. montrouzieri disminuyeron su actividad depredadora sobre CRH parasitadas de más de 6 días, posiblemente debido al endurecimiento de las momias de CRH. Los resultados del presente trabajo apoyan la hipótesis de que en la interacción de C. montrouzieri y A. kamali existe un efecto de interferencia en presencia de un recurso limitado, ya que la presencia del depredador disminuyó la actividad parasitoide de A. kamali en el control de CRH.
Palabras clave: Control biológico. Enemigos naturales. Competencia.
Abstract: In several countries, Anagyrus kamali and Cryptolaemus montrouzieri have been introduced for the biological control of the pink hibiscus mealybug (PHM) Maconellicoccus hirsutus, but there is not a formal study to assess the interaction between those natural enemies. In the present study we evaluated, under laboratory conditions, the interaction of C. montrouzieri (forth-instar larvae and adult female) in A. kamali parasitoid activity on PHM. Individual and simultaneous liberations of both species, using choice and no-choice tests, were made in order to determine the interaction between the predator and the parasitoid. Third PHM nymphs parasitized by A. kamali at different parasitoid maturation periods (egg, young larvae, mature larvae, young pupae and mature pupae) were used as hosts. The results showed that C. montrouzieri reduced the parasitoid activity of A. kamali to 2.2 and 5%. In the choice test, C. montrouzieri did not discriminate against wealthy PHM and parasitoized under five days. In the no-choice tests, C. montrouzieri adults and larvae reduced their predatory activity when parasitized PHM had more than six days of having been parasitized, possibly due to the hardening of PHM mummies. The results of the present study support the hypothesis that in the interaction between C. montrouzieri and A. kamali there is an antagonistic effect since the presence of the predator reduced the parasitic activity of A. kamali in the PHM control.
Key words: Biological control. Natural enemies. Competition.
Introducción
La cochinilla rosada del hibisco (CRH), Maconellicoccus hirsutus (Green, 1908) (Hemiptera: Pseudococcidae), es una plaga nativa del sureste asiático y de distribución cosmopolita. La incidencia de esta plaga genera impacto económico no sólo por los daños directos en las plantas, sino por su importancia cuarentenaria, que limita las exportaciones y la movilización comercial de los productos agrícolas (Miller 1999; Kairo et al. 2000; Meyerdirk et al. 2003; Zhang et al. 2004). La CRH se detectó por primera vez en México en 1999 en Mexicali, Baja California (Roltsch et al. 2000) y en febrero de 2004 en Bahía de Banderas, Nayarit (NAPPO 2004). Conociendo la importancia de esta plaga, el gobierno de México puso en marcha el plan nacional de emergencia para su control en el 2004. Este plan incluyó entre otros, un programa de control biológico clásico basado en la introducción de dos enemigos naturales exóticos: el parasitoide Anagyrus kamali Moursi, 1948 y el coccinélido Cryptolaemus montrouzieri Mulsant, 1853 (González Gaona et al. 2008; Santiago-Islas et al. 2008). Estos enemigos naturales han resultado exitosos en el control de esta plaga en varios países del mundo (Dominica, Grenada, Jamaica, St. Kitts y Nevis, St. Thomas, St. Vincent y Granadinas, Sta. Lucia, Trinidad y Tobago, US Islas Vírgenes, Puerto Rico y California EE.UU., Bahía de Banderas, México), en algunos casos con la introducción de un solo enemigo natural o usando ambos (Sagarra y Peterkin 1999; Kairo et al. 2000; Michaud y Evans 2000; Sermeño y Navarro 2000; Roltsch et al. 2006; García-Valente et al. 2009).
Anagyrus kamali es un endoparasitoide solitario koino-bionte, arrenotoco y específico de la CRH. Su ciclo de vida dura entre 24 y 32 días en condiciones de laboratorio a 27°C, y fotoperiodo de 8:16 L:O. En ambientes tropicales tiene un promedio de vida de 15 días. Es capaz de parasitar 60 CRH con mortalidad adicional del 30% cuando el parasitoide se alimenta de hemolinfa del huésped (Sermeño y Navarro 2000; Meyerdirk et al. 2003), además, este parasitoide puede llegar a poner hasta tres huevos en ninfas de tercer estadio de la CRH (Sagarra y Vincent 1999). El coccinélido C. montrouzieri, es un depredador generalista que se desarrolla en 17 a 22 días en condiciones de laboratorio a 28°C. El periodo larvario incluye cuatro estadios y tarda entre 12 y 15 días, tiempo durante el cual las larvas consumen entre 250 a 268 ninfas. Cada individuo adulto consume de 750 a 800 ninfas de CRH y la hembra pone entre 400 y 500 huevos durante sus 50 días de vida (Bartlett 1978; Goolsby et al. 2002; Meyerdirk et al. 2003; Valencia-Luna et al. 2007). Esta misma preferencia del adulto de C. montrouzieri de consumir ninfas de piojos harinosos se ha observado cuando ataca a Planococcus citri (Risso, 1813) (Rosas-García et al. 2009).
A pesar de que A. kamali y C. montrouzieri se han introducido al mismo tiempo en varios países para el control de CRH, no se han realizado estudios específicos de la posible interferencia o interacción en su actividad contra la CRH. Meyerdik et al. (2003) señalan que si ambos enemigos naturales se liberan al mismo tiempo hay un efecto negativo en el establecimiento del parasitoide, sin embargo no realizaron estudios formales para probarlo. Esta información sugiere que el depredador pudiera depredar sobre ninfas parasitadas tal como fue observado por Chong y Oetting (2007) con este mismo coccinélido y el parasitoide Leptomastix dactylopii (Howard, 1885) (Hymenoptera: Encyrtidae).
Considerando que para que un programa de control biológico, donde se contemple la liberación de más de una especie resulte exitoso, es necesario conocer las relaciones que existan entre los agentes que se introducen, los objetivos de este trabajo fueron estudiar las interacciones que pudieran existir entre el depredador C. montrouzieri y el parasitoide A.kamali cuando son utilizados en conjunto en el control de la CRH.
Materiales y Métodos
Los individuos de CRH y el parasitoide A. kamali, se obtuvieron del laboratorio de la Campaña contra la CRH ubicado en el Municipio de Bahía de Banderas, Nayarit, perteneciente al Servicio Nacional de Sanidad, Inocuidad y Calidad Agroalimentaria (SENASICA), Secretaría de Agricultura, Ganadería, Desarrollo Rural, Pesca y Alimentación (SAGARPA) de México, en el cual los parasitoides se reproducen sobre CRH criada sobre el sustrato de calabaza japonesa Cucurbita moschata Duchesne ex Poir., 1786 variedad Chirimen. Los larvas y adultos de C. montrouzieri fueron proporcionadas por la empresa "Organismos Benéficos para la Agricultura, S. A. de C. V" ubicada en Autlán, Jalisco.
Los experimentos se realizaron en "arenas" de observación, las cuales estaban construidas de recipientes de plástico translúcido de 16 cm de diámetro y 17 cm de altura, éste se cerraba con una tapa que tenía un orificio al centro de 14 cm cubierto por organza para facilitar ventilación. En todos los experimentos se utilizaron hembras adultas de A. kamali de 4 a 5 días de edad ya copuladas. En el caso de C. montrouzieri, se emplearon hembras adultas de 5 días de edad y larvas de cuarto estadio. El depredador se sometió a 24 h de ayuno antes de ser utilizado en los ensayos.
Pruebas de liberación individual y liberación simultánea
Para determinar si existía interferencia entre el depredador y el parasitoide se realizaron pruebas de liberación individual y liberación simultánea de parasitoides y/o depredador. Cada unidad experimental consistió en una arena de observación donde se colocaba un trozo de 9 x 6 cm de calabaza, que servía como sustrato y alimento para la CRH. Cada trozo de calabaza incluía tres hendiduras naturales en la superficie las cuales proporcionaba refugio para la CRH. Esta variedad de calabaza es el hospedero idóneo para el estudio, por el tiempo de vida de postcosecha y por presentar una superficie rugosa de la cascara o exocarpio que favorecen el establecimiento y permanencia de la CRH . Una vez colocado el hospedero en la arena se introdujeron 40 hembras de tercer estadio de CRH, se utilizó este estadio de desarrollo ya que en observaciones preliminares se detectó que es el estadio preferido por el depredador.
El estudio de liberación individual consistió en colocar a los agentes de control biológico por separado en cada arena de observación. Se establecieron tres tratamientos: (a) dos hembras de A. kamali, (b) una larva de C. montrouzieri y (c) un adulto de C. montrouzieri. Para cada tratamiento se realizaron 15 repeticiones.
Para el estudio de liberación simultánea se colocaron los agentes de control biológico juntos y en diferentes combinaciones en cada arena. Los tratamientos consistieron en: (a) dos hembras de A. kamali y un adulto de C. montrouzieri; (b) dos hembras de A. kamali y una larva de C. montrouzieri; y (c) dos hembras de A. kamali en combinación de una larva y un adulto de C. montrouzieri. Para cada tratamiento se realizaron 15 repeticiones.
A las 24 h de ser establecidas las arenas se retiraron los enemigos naturales, que en el caso de las pruebas de liberación simultánea o liberación de solo depredador se realizó un conteo del número de CRH no depredadas con el fin de obtener el porcentaje de depredación. En el caso de tratamientos con parasitoides, el material de CRH se mantuvo en cámaras de cría (27 ± 1°C, 60 ± 5% HR y fotoperiodo de 14:10 L: O) durante 15 días con el fin de observar la posible emergencia del parasitoide y calcular el porcentaje de parasitismo. Los datos de cada experimento se analizaron mediante ANOVA y prueba de comparación de medias (Tukey a = 0.05) para determinar si había o no interferencia del depredador en la actividad parasítica de A. kamali.
Depredación de C. montrouzieri sobre CRH no parasitadas y parasitadas por A. kamali en pruebas de elección y no elección. A. kamali es un endoparasitoide del que es difícil reconocer su estado de desarrollo; por esta razón, en este trabajo se consideró al tiempo en días como un indicador de los diferentes estados de desarrollo como lo sugiere Chong y Oetting (2007). Observaciones preliminares en condiciones controladas (27 ± 1°C, 60 ± 5% HR y fotoperiodo de 14:10 L: O), permitieron determinar que A. kamali al parasitar ninfas de CRH de tercer estadio, se encuentra en estado de huevo los primeros 2 días, en estado de larva joven a los 4 días, larva madura a los 6 días, pupa a los 8 días y que entre 14 y 17 días emergen. Se consideró entonces a los estados de huevo, larva joven, larva madura, pupa joven y pupa madura (5 días antes de emergencia de A. kamali).
Pruebas de no elección. Para esta prueba se utilizaron recipientes de plástico de 60 ml de capacidad con un disco de calabaza de 3 cm de diámetro con 1 cm de espesor y una hembra o larva de C. montrouzieri. Cada unidad experimental contenía 40 ninfas de CRH previamente parasitadas con algún periodo de maduración, huevo [2 días después de parasitación (ddp)], larva joven (4 ddp), larva madura (6 ddp), pupa joven (8 ddp) y pupa madura (10 ddp). Se realizaron 15 repeticiones por cada tratamiento incluyendo el testigo.
Los depredadores se retiraron a las 24 h y se determinó el número de CRH consumidas o destruidas. El número de presas consumidas de cada tratamiento se analizó por ANOVA y cuando fue necesario se aplicó una prueba de comparación de medias (Tukey α = 0.05).
Pruebas de elección. La unidad experimental en pruebas de elección fue semejante a la descrita anteriormente pero con la variante de que cada unidad estaba formada por 20 ninfas de CRH parasitadas con algún estado de desarrollo de A. kamali y 20 ninfas de CRH de tercer estadio no parasitadas (NP). Estas pruebas se realizaron con su testigo con 40 CRH no parasitadas en las mismas condiciones que los tratamientos ya descritos. Se realizaron 15 repeticiones por cada tratamiento incluyendo el testigo.
A las 24 h se realizaron observaciones para determinar el número de CRH sanas y parasitadas consumidas. El número de presas consumidas por cada tratamiento se analizó por ANOVA y prueba de comparación de medias (Tukey α= 0.05).
Resultados
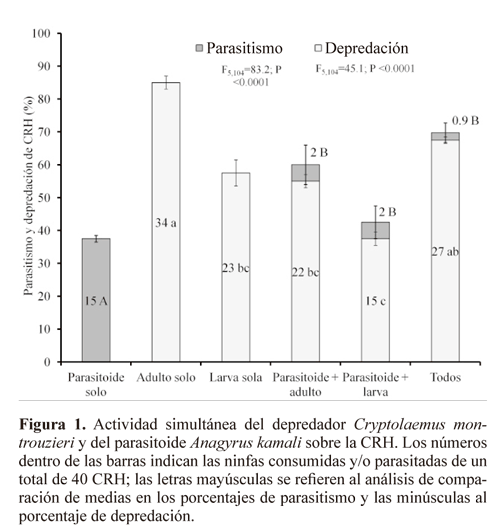
En la liberación individual, donde se permitió la acción del depredador adulto en ausencia de parasitoides, arrojaron los mayores niveles de mortalidad de CRH (85%), mientras en la liberación de los parasitoides cuando se aislaron de los depredadores ocasionaron un 37,5% de mortalidad (Fig. 1). En los experimentos donde se realizó liberación simultánea de ambos enemigos naturales se observaron diferencias altamente significativas tanto en los niveles de parasitismo (F5,104 = 83.2; P < 0.0001) como en los de depredación (F5,104 = 45.1; P < 0.0001). La presencia del depredador, tanto de larvas como de adultos, disminuyó la actividad parasítica de A. kamali a tan solo el 5%, y cuando ambos estados de desarrollo del depredador estuvieron presentes, el parasitismo fue únicamente de 2,2%.
La presencia del parasitoide también tuvo un impacto negativo en la actividad de C. montrouzieri, ya que la depredación de los adultos disminuyó en un 30% cuando A. kamali estuvo presente. No se detectó una diferencia significativa en la actividad depredadora de la larva de C. montrouzieri en presencia de A. kamali. La liberación simultánea de los agentes de control no ocasionó una mortalidad total de CRH significativamente mayor a la obtenida en los tratamientos de depredación por parte del adulto de C. montrouzieri actuando de manera aislada (Fig. 1).
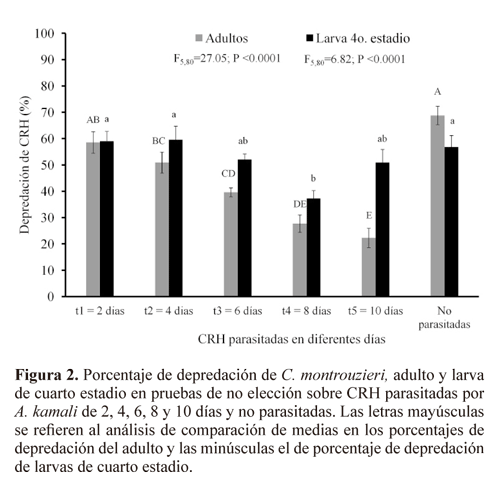
En las pruebas de no elección de C. montrouzieri se observó una diferencia significativa en la depredación tanto en adulto (F5,80 = 27.05; P < 0.0001) como en larva (F5,80 = 6.82; P < 0.0001), con los máximos niveles de depredación en el tratamiento de 2 días, el cual no fue diferente a CRH no parasitadas, mientras que los mínimos valores se observaron en los tratamientos con CRH de 8 días de haber sido parasitadas. En estas pruebas, los adultos de C. montrouzieri no mostraron diferencia al alimentarse de ninfas recién parasitadas (Fig. 2). Conforme aumentó el desarrollo del parasitoide el adulto de C. montrouzieri, disminuyó sus niveles de depredación hasta en un 25% sobre las CRH que presentaban la pupa del parasitoide. Las larvas de C. montrouzieri fueron menos hábiles en discriminar CRH parasitadas que los adultos. Se observó una diferencias significativa en la depredación de larvas sobre CRH no parasitadas (60%) en comparación con CRH parasitada en el octavo día (37% depredación) (Fig. 2).
La larva de C. montrouzieri presentó una marcada diferencia de consumo de CRH de 8 y 10 días de haber sido parasitadas, en comparación con en el consumo del adulto. La larva del depredador tuvo un mayor número de presas depredadas en todos los tratamientos de CRH parasitadas. Sin embargo, para ambos estados de desarrollo de C. montrouzieri, la actividad como depredador disminuyó conforme maduraba el parasitoide dentro de CRH (Fig. 2).
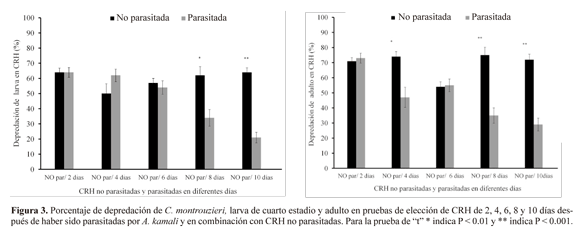
En las pruebas de elección, al ofrecer a los depredadores simultáneamente CRH parasitadas y no parasitadas, se observó que el depredador, en ambos estados de desarrollo, no logró reconocer entre CRH no parasitadas y aquellas con los primeros días de desarrollo del parasitoide, es decir no existe alguna discriminación por parte del depredador hacia sus presas a los 2 y 6 días de haber sido parasitadas (Fig. 3). La larva de C. montrouzieri mostró no tener alguna preferencia por CRH no parasitadas (64%) y parasitadas de 2 días (64%) (P = 0.95) en comparación con CRh parasitadas de 10 días (21%) (P = 0.0001), se observó que en el décimo día existe una marcada preferencia del depredador hacia CRH no parasitadas, y del mismo modo sucedió un comportamiento similar con el depredador adulto, ya que en los 8 días y 10 días de CRH parasitadas el consumo disminuyó considerablemente (Fig. 3).
Discusión
Los resultados del presente trabajo apoyan la hipótesis de que en la interacción de C. montrouzieri con A. kamali existe una competencia por el recurso entre estos dos agentes de control biológico por su presa/huésped, la CRH. El parasitoide no logró obtener el mismo porcentaje de parasitismo sobre CRH estando solo (37,5%), que cuando se encuentra en interacción con el depredador. Anagyrus kamali disminuyó su nivel de parasitismo a un 5% al estar en conjunto con adultos de C. montrouzieri y menos de 3% en presencia de las larvas.
Por medio de este estudio en la interacción de C. montrouzieri y A. kamali en el control de CRH, se logró sustentar que existe un efecto antagónico o de interferencia, ya que la presencia del depredador disminuye la actividad parasítica de A. kamali y a su vez el parasitoide tuvo un impacto negativo en la actividad de C. montrouzieri, la depredación disminuyó cuando A. kamali estuvo presente; por lo tanto una sincronización en la liberación de la actividad de estos agentes de control biológico es importante, ya que de esto dependerá del buen funcionamiento de estos agentes para suprimir la densidad de CRH en campo. Los resultados soportan la hipótesis de Meyerdirk et al. (2003), quiénes sugieren que si se introducen al mismo tiempo C. montrouzieri y A. kamali se puede retrasar el establecimiento del parasitoide. Chong y Oetting (2007) presentan observaciones similares, ya que mencionan que tanto el adulto como la larva de C. montrouzieri se alimentaron de P. citri en los primeros 7 días de haber sido parasitadas por Leptomastix dactylopii Howard, 1885, sin hacer alguna discriminación por su presa, por lo tanto no sólo C. montrouzieri se alimentaba de P. citri parasitadas, también estaba interfiriendo con la eficacia del forrajeo del parasitoide.
El adulto de C. montrouzieri es capaz de discriminar a CRH parasitadas maduras, ya que CRH con 6 días de parasitismo en adelante no tuvo la misma aceptación por este depredador. Esto se observó más claramente con momias endurecidas (por parasitismo) de CRH en el octavo día. Sengonca y Yanuwiadi (1994) observaron que C. montrouzieri discrimina hacia su presa P. citri parasitadas a partir del sexto día por L. dactylopii. Esta discriminación por el depredador podría deberse a que en este periodo el parasitoide ha empezado a pupar y el reconocimiento del depredador es fuertemente relacionado con la morfología de su presa (Dixon 2000), ya que algunos cambios en las características químicas y físicos de presas ya parasitadas impiden a un depredador reconocerla o aceptarla.
La larva de C. montrouzieri mostró ser más voraz y tener una menor capacidad de discriminación por CRH parasitadas con respecto al depredador adulto. Al respecto Mustu et al. (2008) observaron que la larva de C. montrouzieri fue más voraz que los adultos al ser alimentados tanto de presas parasitadas y no parasitadas de las especies Planococcus ficus (Signoret, 1875) y P. citri y que esto podría deberse a que la larva tiene limitado su rango de búsqueda y desplazamiento, mientras que el adulto tiene un mayor rango de búsqueda y desplazamiento teniendo más posibilidad de seleccionar sus presas. Al tener esta desventaja la larva debe consumir el mayor número de presas a su alcance y tener menor discriminación por una presa parasitada. Cabe mencionar que conformé madura el parasitoide, la CRH disminuye aún más su movilidad lo que la hace más vulnerables a ser capturada (New 1991).
En los primeros 5 días del parasitismo en CRH, C. montrouzieri no logra reconocer o hacer alguna diferencia por su presa al tener CRH parasitadas y CRH no parasitadas. Esto pudiera deberse a que el parasitoide no ha hecho cambios apreciables en la morfología o textura del huésped, por lo tanto el adulto y larva del depredador consumieron el mismo número de presas sin tener preferencia por CRH parasitadas o no parasitadas. Lo anterior puede influir en el establecimiento y la actividad parasítica de A. kamali. Por el contrario, García-Valente (2008) pudo observar que en Bahía de Banderas, Nayarit, en plantaciones de teca Tectona grandis Linn. f., 1781, el depredador C. montrouzieri fue capaz de suprimir las poblaciones de CRH en cerca de dos meses después de su liberación y posteriormente abandonó el habitat, y que esas bajas densidades de CRH fueron posteriormente atacadas y mantenidas reguladas por el parasitoide A. kamali que se liberó en áreas cercanas a esas plantaciones, por lo que el depredador pudo no haber afectado el establecimiento de A. kamali en esa región.
Por lo anterior, el mejor conocimiento de la interacción del depredador C. montrouzieri sobre A. kamali como agente de control biológico es importante para la toma de decisiones y liberación de estos agente en el control de la CRH.
Conclusiones
Existe una competencia por el recurso de CRH entre los dos enemigos naturales evaluados, la combinación de ambos no necesariamente supone un efecto sinérgico, ya que existe una fuerte interacción negativa de C. montrouzieri sobre A. kamali. El depredador fue capaz de devorar a las CRH parasitadas, influyendo en la supervivencia de A. kamali y en su actividad como agente de control biológico. La compatibilidad en el control de CRH por A. kamali al agregar C. montrouzieri dependerá de la sincronización en liberación y conocimiento que se tenga en la interacción de estos agentes de control biológico. Es necesario e importante divulgar la preferencia de C. montrouzieri por su presa y el comportamiento que tiene este depredador en la ocurrencia de la interacción de gremio entre el depredador y el parasitoide. La elaboración de estudios en campo o invernadero de estos agentes de control biológico influenciados por factores ambientales será necesaria para el manejo óptimo de estos agentes.
Agradecimientos
Al Consejo Nacional de Ciencia y Tecnología (CONACYT): Proyecto Nayarit 2007/CO4/81795, Tecnología Para el Control Biológico de la Cochinilla Rosada del Hibisco (Macone-llicoccus hirsutus Green) en Nayarit y al Colegio de Postgra-duados por el financiamiento para el desarrollo del presente estudio y beca de postgrado al primer autor. Al Laboratorio Regional de Reproducción de Agentes de Control Biológico del Programa CRH, DGSV, SENASICA, SAGARPA, Valle de Banderas, Nayarit, así como a Organismos Benéficos para la Agricultura, S.A. de C.V. por proporcionar el material biológico del depredador.
Literatura citada
BARTLETT, B. R. 1978. Pseudococcidae. pp. 137-170. In: Clausen, C. P. (Ed.). Introduced Parasites and Predators of Arthropod Pest and Weeds: A World Review. Agriculture Handbook No. 480. USDA. Washington D. C. [ Links ]
CHONG, J. H.; OETTING, R. 2007. Intraguild predation and interference by the mealybug predator Cryptolaemus montrouzieri on the parasitoid Leptomastix dactylopii. Biocontrol Science and Technology 17 (9): 933-944. [ Links ]
DIXON A., F. G. 2000. Insect Predator-Prey Dynamics. Ladybird Beetles and Biological Control. Cambridge University Press. 268 p. [ Links ]
GARCÍA-VALENTE, F. 2008. Control Biológico de la Cochinilla Rosada del Hibisco Maconlellicoccus hirsutus Green en México. Tesis de Doctorado en Ciencias. Colegio de Postgraduados, Montecillo, Texcoco, México. [ Links ]
GARCÍA-VALENTE, F.; ORTEGA-ARENAS, L. D.; GONZÁLEZ-HERNÁNDEZ, H.; VILLANUEVA-JIMÉNEZ, J. A.; LÓPEZ-COLLADO, J.; GONZÁLEZ-HERNÁNDEZ, A.; ARRE-DONDO-BERNAL, H. C. 2009. Parasitismo natural e inducido de Anagyrus kamali sobre la cochinilla rosada en brotes de teca, en Bahía de Banderas, Nayarit. Agrociencia 43 (7): 729-738. [ Links ]
GONZÁLEZ GAONA. E.; SÁNCHEZ, M. G.; QUEZADA, G. E. 2008. Determinación, monitoreo y control de la cochinilla rosada del hibisco Maconellicoccus hirsutus (Green). Libro Técnico Núm, 5. INIFAP-CIRNOC-Campo Experimental Pabellón, Pabellón de Arteaga, Aguascalientes. México. 133 p. [ Links ]
GOOLSBY, A. J., KIRK, A. A.; MEYERDIRK, D. E. 2002. Seasonal phenology and natural enemies of Maconellicoccus hirsutus (Hemiptera: Pseudococcidae) in Australia. Florida Entomologist 85 (3): 494-498. [ Links ]
KAIRO, M. T. K.; POLLARD, G. V.; PETERKING, D. D.; LÓPEZ, V. F. 2000. Biological control of the hibiscus mealybug, Maconellicoccus hirsutus Green (Hemiptera: Pseudococcidae) in the Caribbean. Integrated Pest Management Reviews 5 (4):241-254. [ Links ]
MEYERDIRK, D. E.; WAKENTIN, R.; ATTRAVIAN, B.; GERSA-BECK, E.; FRANCIS, A.; ADAMS, M.; FRANCIS, G. 2003. Manual del Proyecto para el Control Biológico de la Cochinilla Rosada del Hibisco. IICA. USDA, APHIS, PPQ. 2a.Edición. San José, Costa Rica. 214 p. [ Links ]
MICHAUD, J. P.; EVANS, G. A. 2000. Current status of pink hibiscus mealybug in Puerto Rico, including a key to parasitoid species. Florida Entomologist 83 (1): 97-101. [ Links ]
MILLER, D. M. 1999. Identification of the pink hibiscus mealybug, Maconellicoccus hirsutus (Green) (Hemiptera: Sternorrhyncha: Pseudococcidae). Insecta mundi 13 (3-4): 189-204. [ Links ]
MUSTU, M.; KILINCER, N.; ÜLGENTÜRK, S.; KAYDAN, M. B. 2008. Feeding behavior of Cryptolaemus montrouzieri on mealy bugs parasitized by Anagyrus pseudococci. Phytoparasitica 36(4): 360-367. [ Links ]
NAPPO. 2004. Detección de la cochinilla rosada del hibisco (Maconellicoccus hirsutus Green), en el municipio de Bahía de Banderas, Nayarit, México. Noticias sobre brotes de plagas del Sistema de Alerta Fitosanitaria de NAPPO, 8 de marzo de 2004. Disponible en: http://www.pestalert.org/ViewArchNewsStory.cfm?nid=297[Fecha revisión: 05 mayo 2011] [ Links ].
NEW, T. R. 1991. Insects as Predators. New South Wales University Press in association with the Australian Institute of Biology. 178 p. [ Links ]
ROLTSCH, W. J.; MEYERDIRK, D. E.; WARKETING, R. 2000. Pink hibiscus mealybug biological control in Imperial Valley. pp. 14-18. In: Woods, D. M. (Ed.). Biological Control Program. California Department of Food and Agriculture, Plant Health and Pest Prevention Services, Sacramento, California. California. [ Links ]
ROLTSCH, W. J.; MEYERDIRK, D. E.; WARKENTIN, R.; ANDRESS, E. R.; CARRERA, K. 2006. Classical biological control of the pink hibiscus mealybug, Maconellicoccus hirsutus (Green) in southern California. Biological Control 37 (2): 155-166. [ Links ]
ROSAS-GARCÍA, N. M.; DURÁN-MARTÍNEZ, E. P.; LUNA-SANITLLANA, E. J.; VILLEGAS-MENDOZA, J. M. 2009.Potencial de depredación de Cryptolaemus montrouzieri Mulsant hacia Planococcus citri Risso. Southwestern Entomologist 34 (2): 179-188. [ Links ]
SAGARRA, L. A.; PETERKIN, D. D. 1999. Invasion of the Caribbean by the hibiscus mealybug, Maconellicoccus hirsutus Green (Homoptera: Pseudococcidae). Phytoprotection 80 (2): 103-113. [ Links ]
SAGARRA, L. A.; VINCENT, C. 1999. Influence of host stage on oviposition, development, sex ratio, and survival of Anagyrus kamali Moursi (Hymenoptera: Encyrtidae), a parasitoid of the hibiscus mealybug, Maconellicoccus hirsutus Green (Homoptera: Pseudococcidae). Biological Control 15 (1): 51-56. [ Links ]
SANTIAGO-ISLAS, T.; ZAMORA-CRUZ, A.; FUENTES-TEMBLADOR, E. A.; VALENCIA-LUNA, L.; ARREDONDO-BERNAL, H. C. 2008. Cochinilla rosada del hibiscus, Maconellicoccus hirsutus (Hempitera: Pseudococcidae). pp. 177-190. En: Arredondo-Bernal, H. C.; Rodríguez del Bosque, L. A. (Eds.). Casos de Control Biológico en México. Editorial Mundi Prensa. México. D.F. 423 p. [ Links ]
SENGONCA, C.; YANUWIADI, B. 1994. Frassverhalten des sch-mierlausra ubers Cryptolaemus montrouzieri Mulsant beidurch Leptomastix dactylopii Howard parasitierten Placococcus citri (Risso). Mitteilungen der DeutchenGesellschaft fur Allgemeine und Angewandte Entomologie 9: 121-124. [ Links ]
SERMEÑO, J. M.; NAVARRO, J. A. 2000. Manual Técnico: Identificación de Insectos de la Superfamilia Coccoidea, con Especial Énfasis en Cochinilla Rosada del Hibisco Maconellicoccus hirsutus (Green). OIRSA. Universidad del Salvador. San Salvador.73 p. [ Links ]
VALENCIA-LUNA, L.; SANTIAGO-ISLAS, T.; ZAMORA, A.;ARREDONDO-BERNAL, H. C. 2007. Control biológico de la cochinilla rosada del hibiscus Maconellicoccus hirsutus (Hemiptera: Pseudococcidae). pp. 250-266. En: Rodríguez-del-Bosque, L. A.; Arredondo-Bernal, H. C. (Eds.). Teoría y Aplicación del Control Biológico. Sociedad Mexicana de Control Biológico, México. 303 p. [ Links ]
ZHANG, A.; AMALIN, D.; SHIRALI, S.; SERRANO, M. S.; FRANQUI, R. A.; OLIVER, J. E.; KLUN, J. A.; ALDRICH, J. R.; MEYERDIRK, D. E.; LAPOINTE, S. L. 2004. Sex pheromone of the pink hibiscus mealybug, Maconellicoccus hirsutus, contains an unusual cyclobutanoid monoterpene. Proceedings of the National Academy of Sciences of the United States of America 101: 9601-9606. [ Links ]