Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Entomología
Print version ISSN 0120-0488
Rev. Colomb. Entomol. vol.38 no.1 Bogotá Jan./June 2012
Nota científica
Susceptibilidad de Plutella xylostella a Heterorhabditis sp. SL0708 (Rhabditida: Heterorhabditidae)
Susceptibility of Plutella xylostella to Heterorhabditis sp. SL0708 (Rhabditida: Heterorhabditidae)
ADRIANA SÁENZ A.1
1 M. Sc. Profesor Asistente. Unidad de Ecología y Sistemática UNESIS Departamento de Biología Pontificia Universidad Javeriana. Cra 7a No 43-82 Ed 54 (Jesús Emilio Ramírez), Of. 200. adriana.saenz@javeriana.edu.co.
Recibido: 2-nov-2010 - Aceptado: 27-sep-2011
Resumen: Plutella xylostella (Lepidoptera: Plutellidae) conocida como polilla dorso de diamante (DDM) es una de las plagas más importantes en cultivos de crucíferas en Colombia. La estrategia de control más utilizada ha sido el uso de insecticidas de síntesis química como piretroides, carbamatos, organofosforados y reguladores de crecimiento. Como una alternativa de control, se evalúa la susceptibilidad del tercer instar de DDM al nemátodo entomopatógeno Heterorhabditis sp. SL0708 en condiciones de laboratorio. Se probaron cinco dosis de juveniles infectivos (JI) (0, 100, 300, 600, 1200 JI/ml/5 larvas) y se evaluó cada 24 horas la sintomatología, mortalidad y recuperación de JI. Las larvas afectadas por Heterorhabditis sp. SL0708 presentaron cambios de coloración de verde a marrón claro, se mostraron poco móviles y con cuerpo flácido. Algunas larvas alcanzaron a mudar a pupa y se observó el desarrollo de adultos de primera generación. El porcentaje promedio de mortalidad fue de 95,6%, con un tiempo de mortalidad entre las 48 y 72 horas. La dosis que mostró diferencias significativas fue 100 JI. De las larvas infectadas por tratamiento se recuperó en promedio diariamente 2.743 JI en cinco días. Las larvas de P. xylostella fueron susceptibles a los JI de Heterorhabditis sp. SL0708, indicando que se debe continuar evaluando su capacidad patogénica en invernadero y campo.
Palabras clave: Nemátodo entomopatógeno. Polilla dorso de diamante. Juvenil infectivo. Control biológico.
Abstract: Plutella xylostella (Lepidoptera: Plutellidae) known as the diamondback moth (DBM) is the more important pestof cruciferous crops in Colombia. The most common control strategy has been the use of chemically synthesized insecticides such as pyrethroids, carbamates, organophosphates and growth regulators. As an alternative control, we evaluated the susceptibility of third instar DDM to Heterorhabditis sp. SL0708 under laboratory conditions. We tested five doses of infective juveniles IJ (0, 100, 300, 600.1200 IJ/ml/5 larvae) and every 24 hours we assessed symptoms of mortality and recovery IJ. Larvae affected by Heterorhabditis sp. SL0708 showed color changes from green to brown, little mobility and a flabby body. Some larvae reached the pupa instar and even reached first generation adults. The average mortality rate was 95.6%, with a time of death betWeen 48 and 72 hours. There were significant differences at a dose of 100 IJ. Around 2,743 IJ were recovered per larvae daily average along 5 days. The larvae of P. xylostella were susceptible to Heterorhabditis sp.SL0708 IJ, indicating that its pathogenicity should be evaluated in greenhouse and field conditions.
Key words: Entomopathogenic nematode. Diamondback moth.Infective juvenile. Biological control.
Introducción
En Colombia el cultivo de brásicas o crucíferas constituye un renglón productivo para la economía campesina y de medianos productores. En el año 2009 se sembraron 4.937 ha principalmente en brócoli (Brassica oleracea L. var. italica), repollo (Brassica oleracea L. var. capitata), y coliflor (Brassica oleracea L. var. botrytis) (Anónimo 2009).
Dentro del complejo de plagas que atacan las crucíferas se destacan especies de lepidópteros como Copitarsia sp., Spodoptera sp. y Peridroma sp. (Lepidoptera: Noctuidae), moluscos como Deroceras reticulatum (Müller, 1774) y Vaginulus sp. (Pulmonata: Veronicellidae), el áfido Myzus persicae (Sulzer, 1776) (Hemiptera: Aphididae) y Lyriomiza spp. (Diptera: Agromyzidae). Sin embargo, la principal plaga de cultivos de crucíferas en el mundo es la polilla dorso de diamante, Plutella xylostella (Linnaeus, 1758) (Lepidoptera: Plutellidae). Sus poblaciones pueden alcanzar frecuentemente el 75% del total de insectos en un cultivo y causan pérdidas de hasta el 90% en la producción (Shelton et al. 2000). Las pérdidas causadas varían con las características ambientales de la localidad, el período de crecimiento del cultivo, la extensión de las plantaciones y la frecuencia de aplicación de insecticidas (Idris 1995; Shelton etal. 2000; Nyasani et al. 2008a).
La estrategia de control más utilizada para la polilla dorso de diamante, ha sido usar insecticidas químicos de síntesis como piretroides, carbamatos, organofosforados y reguladores de crecimiento (Shelton et al. 2000; Nyasani et al. 2008a). Sin embargo, P. xylostella ha desarrollado resistencia a todos los insecticidas usados para su manejo (Leibiee y Savage 1992; Idris 1995; Shelton et al. 2000; Liu et al. 2003; Nyasani et al. 2008b). Los problemas de resistencia de las plagas se han reducido con la introducción de nuevas moléculas o principios activos, no obstante, lejos de resolver la situación, ésta se ha tornado cada vez más compleja, por fenómenos como resistencia cruzada a diferentes grupos de insecticidas (Tabashnik et al. 1994; Idris 1995; Zhao et al. 2001). Para el manejo integrado de P. xylostella se enfatiza en la reducción de aplicaciones e integrar diferentes métodos de control, como los nemátodos entomopatógenos (Nyasani et al.2008a)
Los nemátodos entomopatógenos de las familias Heterorhabditidae y Steinernematidae pueden ser una alternativa a los insecticidas químicos (Cherry et al. 2004; Nyasani et al. 2008a; Nyasani et al. 2008b) ya que han sido reportados causando infección a la polilla dorso de diamante (Baur et al. 1998); sin embargo, son necesarias evaluaciones en laboratorio y campo antes de ser incluidos en programas de manejo integrado de plagas (Sarfraz et al. 2005; Nyasani et al. 2008a).
Heterorhabditis sp SL0708 es un nemátodo aislado de Alcalá-Valle del Cauca, que ha mostrado ser un agente importante para el control biológico de plagas. Tiene un complejo ciclo de vida, la primera generación es hermafrodita y la segunda generación es amfimíctica y hermafrodita, que ocurren dentro del hospedero parasitado muchas veces y superponiéndose (Sáenz y López 2011). Una característica particular es que guarda una relación mutualista con un simbionte bacteriano del género Photorhabdus (Enterobacteriaceae) el que aloja a lo largo de su intestino. Esta relación le da una ventaja competitiva pues mata a su hospedero entre las primeras 24 a 48 horas después de infección (Sáenz y López 2011).
Teniendo en cuenta la importancia del cultivo de las brásicas en Colombia y la problemática del control de la polilla dorso de diamante, se presenta una alternativa de control con nemátodos entomopatógenos. En Colombia se han registrado especies de nemátodos entomopatógenos que requieren estudios específicos para ser implementados en programas de manejo de plagas; es así como se evaluó la susceptibilidad de larvas de tercer instar de P. xylostella a juveniles infectivos (JI) de Heterorhabditis sp.SL0708, con el fin de establecer el tiempo y porcentaje de mortalidad, síntomas y recuperación de JI por la polilla dorso de diamante.
Materiales y Métodos
Condiciones experimentales y obtención del material
biológico. Los ensayos se desarrollaron en el laboratorio de control biológico de la Pontificia Universidad Javeriana a 25°C, 12 horas de luz y 12 horas de oscuridad. Los JI de Heterorhabditis sp. SL0708 de una semana de cosechados, se criaron en larvas de último instar de Galleria mellonella (Linnaeus, 1756) siguiendo las recomendaciones de Kaya y Stock (1997). Las larvas de tercer instar de P. xylostella fueron obtenidas de la cría existente en el Centro de Investigaciones y Asesorías Agroindustriales (CIAA) de la Universidad Jorge Tadeo Lozano.
Infectividad y recuperación de Heterorhabditis sp. SL0708. Para establecer el porcentaje y tiempo de mortalidad, se expusieron larvas de tercer instar de P. xylostella a 0, 100, 300, 600, 1200 JI/ml/5 larvas en cajas de Petri que contenían papel filtro húmedo, 5 gr de hoja de brócoli. Se evaluaron cada 24 horas por seis días, registrando los síntomas. Las larvas muertas de cada unidad experimental se incubaron individualmente a 25°C por cinco días y posteriormente se montaron en trampas White para la recuperación de los JI, siguiendo las recomendaciones de Sáenz y López (2011). El ensayo se organizó bajo un diseño completamente al azar con cinco tratamientos y cinco repeticiones. Se realizó un análisis de varianza y cuando se presentaron diferencias significativas, la separación de medias se realizó con la prueba de Tukey al 0.05% (SAS Institute 2002).
Resultados y Discusión
Las larvas de tercer instar de P. xylostella presentaron 95,6% (90-95,6%) de mortalidad entre las 48 y 72 horas (Tabla 1).
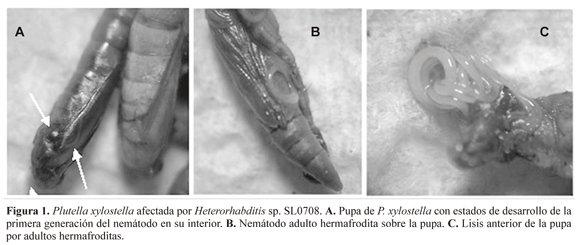
Sin embargo, un 5% de las larvas murieron entre las 96 y 120 horas. Las larvas afectadas por Heterorhabditis sp. SL0708, presentaron cambios de coloración de verde a marrón claro, lo cual no corresponde a la coloración típica exhibida por los hospederos afectados por JI de la familia Heterorhabditidae, esto posiblemente se atribuye a la coloración del insecto, concentración de células bacterianas de Photorhabdus sp. en cada JI que ingreso a la larva, concentración de Photorhabdus sp. en la hemolinfa del insecto y refracción de luz en la cutícula de las larvas de P. xylostella (Akhurst y Dunphy 1993; Burnell y Stock 2000). Otros síntomas presentados fueron poca movilidad antes de morir y cuerpo flácido. Además, 15 larvas alcanzaron a mudar a pupa, en las cuales se observó el desarrollo de adultos hermafroditas en el interior (Fig. 1A), sin embargo por el tamaño de la pupa algunos adultos de Heterorhabditis sp. SL0708 se localizaron sobre esta (Fig. 1B) o se presentó lisis en la parte anterior (Fig. 1C). Esto es similar a lo reportado por Baur et al. (1998) y Nyasani et al. (2008a).
Se presentaron diferencias significativas entre las dosis (F = 735; df = 4; P = 0,0001) y de acuerdo con la prueba de Tukey el tratamiento de 100JI mostró diferencias significativas frente a las demás, por registrar un porcentaje de mortalidad de 90% en 98 horas (Tabla 1). En dosis evaluadas por Ratansinghe y Hauge (1995) y Nyasani et al. (2008a, b) se presentan porcentajes de mortalidad similares con H. indica (Poinar, Karunakar & David, 1992) y H. taysearae (Shamseldean, El-Sooud, Abd-Elgawad & Saleh, 1996), en 20, 27, 31.61 y 72 horas.
Los JI de las larvas de tercer instar de P. xylostella se recuperan nueve días después de la infección y no se presentan diferencias significativas entre larvas y pupas muertas de cada dosis (F = 9.568; df = 4; P > 0.05). En promedio diariamente se recuperaron 2.743 JI en cinco días, con una producción total de 19.201 JI/larva, lo cual sugiere que solo se desarrolla una generación del nemátodo; estos resultados de producción de JI se atribuye a la poca disponibilidad de alimento para que pueda soportar otra generación (Kaya y Stock 1997) y a la lisis que presentaron algunas larvas del hospedero al desarrollarse el ciclo de vida de Heterorhabditis sp. SL0708, la lisis se presentó especialmente en larvas que alcanzaron a formar pupa; resultados similares son establecidos por Ratansinghe y Hauge (1995).
La susceptibilidad de las larvas de tercer instar de P. xylostella a juveniles infectivos del nemátodo entomopatógeno nativo Heterorhabditis sp., SL0708, constituye la base de información para orientar diferentes estudios relacionados con el conocimiento sobre su potencial reproductivo y uso para el control de esta plaga bajo condiciones de invernadero y campo, elementos básicos necesarios para el uso exitoso de nemátodos entomopatógenos en programas de manejo integrado en las zonas productoras del país.
Literatura citada
AKHURST, R. J.; DUNPHY, G. B. 1993. Tripartite interactions between symbiotically associated entomopathogenic bacteria, nematodes, and their insect hosts. pp. 1-23. In: Beckage, N. E.; Thompson, S. N.; Frederici, B. A. (Eds.). Parasites and pathogens of insects. Volume 2: Pathogens. Academic Press. San Diego. [ Links ]
ANÓNIMO. 2009. MINISTERIO DE AGRICULTURA Y DESARROLLO RURAL. Secretaría de Agricultura Departamental. Oficina de información y estadística. pp 25. [ Links ]
BAUR, M.E.; KAYA, H.K.; TABASHNIK, B.; CHILCURTT, C.F. 1998. Suppression of diamondback moth (Lepidoptera: Plutellidae) with an entomopathogenic nematode (Rhabditida: Steinernematidae) and Bacillus thuringiensis Berliner. Journal of Economic Entomology 91: 1089-1095. [ Links ]
BURNELL, A. M.; STOCK, S. P. 2000. Heterorhabditis, Steinernema and their bacterial symbionts lethal pathogens of insects. Nematology 2 (1): 31-42. [ Links ]
CHERRY, A.J.; MERCADIER, G.; MEIKLE, W.; CASTELO-BRANCO, M.; SCHROER, S. 2004. The role of entomopathogens in DBM biological control. pp. 51-70. In: Kirk, A. A; Bordat, D. (Eds.). Improving biocontrol of Plutella xylostella proceedings of the international symposium, Montpellier, France, 21-24 October 2004. CIRAD. [ Links ]
IDRIS, A. B. 1995. Ecology and behavior of Diadegma insulare (Cresson), a biological control agent of diamondback moth, Plutella xylostella (L.). Ph. D. Dissertation, Michigan State University, East Lansing, MI. pp 24. [ Links ]
KAYA, H. K.; STOCK, S. P. 1997. Techniques of insect nematology. Capitulo VI. pp. 1-409. In: Manual of techniques in insect pathology. Lawrence Lacey (Eds.). Biological Techniques Series. Academic Press, San Diego (Estados Unidos). [ Links ]
LEIBIEE, G. L.; SAVAGE, K. E. 1992. Evaluation of selected insecticides for control of diamondback moth and cabbage looper in cabbage in Central Florida with observations on insecticide resistance in the diamondback moth. Florida Entomologist 75 (4): 585-591. [ Links ]
LUI, T. X.; HUTCHISON, W. D.; CHEN, W., BURKNESS. E. C. 2003. Comparative susceptibilities of diamondback moth (Lepidoptera: Plutellidae) and cabbage looper (Lepidoptera: Noctuidae) from Minnesota and South Texas to Cyhalothrin and In-doxicarb. Journal of Economic Entomology 94 (4): 1230-1236. [ Links ]
NYASANI, J. O.; KIMENJU, F. M.; OLUBAYO, S. I.; SHIBAIRO, A.; WILSON, M. 2008a. Laboratory and field investigations using indigenous entomopathogenic nematodes for biological control of Plutella xylostella in Kenya. International Journal of pest management 54 (4): 355-361. [ Links ]
NYASANI, J.O.; KIMENJU, F.M.; OLUBAYO, S.I.; SHIBAIRO, A.; MUTUA, G.K. 2008b. Ocurrence of entomopathogenic nematodes and their potential in the management of diamondback moth in Kale. Asian Journal of Plant Sciences 7 (3): 314-318. [ Links ]
RATANSINGHE, G.; HAUGE, N.G.M. 1995. The susceptibility of diamond back moth Plutella xylostella (Lepidoptera: Yponomeutidae) to entomopathogenic nematodes. Afro Asian Journal Nematology 5: 20-23. [ Links ]
SÁENZ, A.; LÓPEZ. J.C. 2011.Ciclo de vida y patogenicidad del aislamiento nativo Heterorhabditis sp. SL0708 (Rhabditida: Heterorhabitidae). Revista Colombiana de Entomología 37 (1): 43-47. [ Links ]
SAS (Statistical Analytical Institute). 2002. Versión 2002. SAS Institute Inc. Cary, N.C. [ Links ]
SARFRAZ, M.; ANDREW, B.; DOSDALL, L. 2005. Biological control of the diamondback moth, Plutella xylostella: A review. Biocontrol Science and Technology 15 (8): 763-789. [ Links ]
SHELTON, A. M.; SANCES, F. V.; HAWLEY, J.; TANG, J. D.; BOUNE, M.; JUNGERS, D.; COLLINS, H. L.; FARIAS, J. 2000. Assessment of insecticide resistance after the outbreak of diamondback moth (Lepidoptera: Plutellidae) in California in 1997. Journal of Economic Entomology 93: 931-936. [ Links ]
TABASHNIK, B. E.; FINSON, N.; GROETERS, F. R.; MOAR, W.J.; JOHNSON, M. W.; LOU,.K.; ADANG, M. J. 1994. Reversal of resistance to Bacillus thuringiensis in Plutella xylostella. Agricultural Science 91: 4120-4124. [ Links ]
ZHAO, J.: Li, Y.; COLLINS, H. L.; CAO, J.; EARLE, E. D.; SHELTON, A. M. 2001. Different cross-resistance patterns in the diamondback moth (Lepidoptera: Plutellidae) resistant to Bacillus thuringiensis Toxin CrylC. Journal of Economic Entomology 94 (6): 1547-1552. [ Links ]