Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Revista Colombiana de Entomología
versión impresa ISSN 0120-0488
Rev. Colomb. Entomol. vol.38 no.2 Bogotá jul./dic. 2012
Diversidad de termitas (Isoptera: Termitidae, Rhinotermitidae)
en plantaciones de caucho en Puerto López (Meta, Colombia)
Diversity of termites (Isoptera: Termitidae, Rhinotermitidae) in rubber-tree plantations in Puerto López (Meta, Colombia)
Olga Patricia PINZÓN1,2, Ana María Hernández1,3 y Leonardo Andrés Malagón1,4
1 Laboratorio de sanidad forestal. Facultad del Medio Ambiente y Recursos Naturales. Universidad Distrital Francisco José de Caldas. Cra. 7 No. 40-53. Bogotá, D.C., Colombia.
2 Ph. D. Profesora Titular, opatriciap@udistrital.edu.co, autor para correspondencia.
3 Estudiante Ingeniería Forestal. Asistente de investigación, anamforestal@gmail.com.
4 Estudiante Ingeniería Forestal. Asistente de investigación, landresmalagon@hotmail.com
Recibido: 27-dic-2011 - Aceptado: 18-oct-2012
Resumen: Se estimaron la diversidad y la abundancia relativa de termitas en asociación con plantaciones de caucho (Hevea brasiliensis) de diferentes edades en un núcleo forestal de la altillanura bien drenada de los Llanos Orientales (Puerto López, Meta). Se muestrearon tres edades de plantación en dos épocas climáticas: lluviosa de 2009 (mayo, julio) y seca de 2010 (febrero, marzo), utilizando el método de transecto con modificaciones. Se encontraron 10 especies pertenecientes a las familias Termitidae (Apicotermitinae, Termitinae, Nasutitermitinae, Syntermitinae) y Rhinotermitidae (Heterotermitinae). La diversidad de termitas en plantaciones de caucho mayores a dos años fue predominantemente xilófaga y humívora siendo Anoplotermes spp., Heterotermes convexinotatus y Grigiotermes sp. las especies con mayor frecuencia. La diversidad y abundancia de termitas xilófagas en asociación con el cultivo del caucho fue favorecida por la disponibilidad de recursos en las plantaciones de mayor desarrollo pero en ningún caso se observó actividad dañina sobre el cultivo. Los resultados sugieren un papel importante de H. convexinotatus en el reciclaje de residuos de madera, especialmente, en los rodales de mayor edad.
Palabras clave: Heterotermes. Cebos de madera. Llanos Orientales.
Abstract: The diversity and relative abundance of termites in association with rubber-tree (Hevea brasiliensis) plantations was estimated for different aged stands in well-drained plateau in the Llanos Orientales (Puerto López, Meta). Three plantation ages were surveyed in two climate seasons: rainy in 2009 (May, June) and dry in 2010 (February, March), using the transect method with modifications. Ten species were found belonging to the families Termitidae (Apicotermitinae, Termitinae, Nasutitermitinae, Syntermitinae) and Rhinotermitidae (Heterotermitinae). Termite diversity in rubber plantations older than two years was predominately xylophagous and saprophagous, with Anoplotermes spp., Heterotermes convexinotatus and Grigiotermes sp. being the most common species. The diversity and abundance of xylophagous termites in association with rubber trees was favored by the availability of resources in the more well developed plantations, but in no case was any damaging activity observed in the crop. The results suggest an important role for H. convexinotatus in the recycling of wood residues, especially in the older tree plantations.
Key words: Heterotermes. Wood baits. Llanos Orientales.
Introducción
Las termitas son organismos esenciales en la dinámica de los ecosistemas tropicales por su participación como detritívoros de materia orgánica, su capacidad para mantener y modificar positivamente las características fisicoquímicas del suelo y por su contribución en las redes tróficas entre otras (Holt y Lepage 2000; Lavelle et al. 2006). Estos organismos, junto con las lombrices son dominantes en la macrofauna edáfica de sabanas tropicales como El Cerrado brasileño (Constantino 2005) y los Llanos Orientales colombianos en donde tienen influencia en las características físicas y actividad química de los suelos (Galvis 1978; Jiménez et al. 2006, 2008). Asimismo, sus poblaciones son sensibles a la intensificación del uso del suelo para actividades agricolas, forestales y pecuarias (Decaëns 2001).
Las termitas son también importantes desde el punto de vista económico. En cultivos agrícolas y forestales algunas especies ocasionan pérdidas siendo catalogadas como plagas (Schabel et al. 1999; Nair 2001; Constantino 2002a; Nair 2007; Wagner et al. 2008). Infortunadamente, como se desconoce el rol de las especies presentes en un determinado ecosistema, frecuentemente, se asocia su presencia con pérdidas económicas y, entonces, se puede sobreestimar su verdadero impacto nocivo (Gutiérrez et al. 2004; Calderon y Constantino 2007).
Las termitas se registran como una de las plagas de importancia en las plantaciones de caucho (Hevea brasiliensis (Willd. ex A. Juss.) Müll. Arg. (Euphorbiaceae)) nativas o introducidas (Nair 2001). En lugares donde el caucho ha sido introducido y establecido en monocultivos, se registran la infestación y pérdidas económicas por varias especies de Rhinotermitidae: Coptotermes curvignathus Holmgren, 1913, C. elisae (Desneux, 1905), C. gestroi (Wasmann, 1896), Neotermes sp. y Termitidae: Odontotermes obesus (Rambur, 1842), Ancistrotermes guinensis (Silvestri, 1912), Macrotermes bellicosus (Smeathman, 1781) (Nair 2001; Nair 2007). Otro aspecto menos estudiado ha sido el efecto nocivo en la termitofauna del suelo, cuando bosques o vegetación natural nativa han sido reemplazados por monocultivos de caucho (Jones et al. 2003).
En Colombia, en donde el caucho es nativo y se planta en monocultivos, los trabajos han tenido enfoque más de tipo económico y se relacionan a la especie Heterotermes tenuis (Burmeister, 1839) con la mortalidad de plántulas recién trasplantadas (Sterling et al. 2011) y al género Coptotermes con el ataque del duramen de árboles maduros (Garzón y Eslava 2000). En Colombia, el cultivo de caucho natural reviste importancia económica teniendo en cuenta las áreas de plantación actual y potencial en los departamentos de Caquetá, Santander, Antioquia y particularmente en la altillanura del departamento del Meta (DANE 2009) en donde se están estableciendo plantaciones en áreas previamente ocupadas por pasturas naturales e introducidas. Considerando la importancia de las termitas en la actividad biológica de los suelos de los Llanos Orientales, así como el hecho de que algunas especies xilófagas pueden constituir una amenaza para el cultivo del caucho, el presente trabajo se desarrolló para caracterizar las composición de especies, grupos funcionales y posible efecto dañino de las especies de termitas que se desarrollan en núcleos productivos de caucho en la altillanura colombiana.
Materiales y Métodos
El estudio se llevó a cabo durante 2009 y el primer semestre de 2010 en un núcleo forestal de aproximadamente 3000 has de plantación de caucho natural, localizado en la franja de altillanura bien drenada de los Llanos Orientales en el municipio de Puerto López (Meta), coordenadas: 04°15’56.7’’N; 72°35’18,5’’O; a 184 m de altitud, perteneciente a la zona de vida bosque húmedo tropical (Espinel 1963). La zona presenta un régimen de precipitación anual unimodal que alcanza su máximo entre abril y julio, en tanto que los mínimos corresponden a diciembre, enero y febrero. En promedio, la precipitación anual es de 2800 mm. La temperatura media anual oscila entre los 26 y 27 °C siendo enero, febrero y marzo los meses que presentan los valores más altos y junio y julio los más bajos; la humedad relativa promedio es de 75%. Los suelos del municipio hacen parte de la altillanura plana ligeramente ondulada, que comprende una faja que limita al norte con el río Meta y al sur con la altillanura ondulada y fuertemente disectada, siguiendo la carretera central Puerto López- Puerto Gaitán. Los suelos corresponden a oxisoles del tipo Tropeptic haplortox que se localizan en las partes planas y ligeramente onduladas de la altillanura (IGAC 1978).
La fauna de termitas se estudió en 2, 3 y 3 rodales de 2, 13 y 17 años de edad, respectivamente. Se realizó un transecto por rodal, siguiendo la orientación de las líneas de plantación. Las características y ubicación de los rodales se indican en la tabla 1.
Con el fin de estimar la diversidad y abundancia de especies de termitas en cada rodal de plantación, se utilizó el método estandarizado de transecto (Jones et al. 2005), con ligeras modificaciones. Se demarcaron transectos de 100 m x 2 m, siguiendo las líneas de plantación y cada transecto se dividió en 10 secciones (10 x 2 m). En cada sección se examinó, registró y documentó la presencia de termitas y termiteros en los estratos arbóreo, epigeo y subterráneo (Jones et al. 2005). Las modificaciones al método del transecto consistieron en la revisión de un menor número de secciones por transecto (se revisaron 5 de las 10 subparcelas en forma alternada), y se estandarizó el número de piezas de madera examinadas por sección, utilizando 60 piezas de madera (correspondientes a ramas y ramitas caídas naturalmente de los árboles de la plantación). A cada pieza de madera visiblemente atacada por termitas, se le determinó el diámetro con ayuda de un calibrador y el grado de descomposición utilizando la siguiente escala: Incipiente: descomposición apenas perceptible, la pieza de madera no se rompe al aplicarle fuerza manual; moderada: textura ligeramente blanda y débil, presencia de manchas cafés o blancas correspondientes a hongos descomponedores, se rompe con presión física moderada y severa: textura muy blanda y débil, presencia de hongos abundante, cavidades o galerías longitudinales, se rompe con facilidad. Posteriormente, en laboratorio, se determinó el contenido de humedad de las piezas de maderas sanas e infestadas.
Así mismo, se examinó la diversidad de termitas en el horizonte A del suelo (hasta 20 cm de profundidad) en un área de 1m x 1m, es decir en un volumen de 0,20 m3 por sección examinada. Sin incluir el examen de cada muestra de suelo, la revisión de cada sección tomó un tiempo de 30 minutos a un grupo de dos personas.
Teniendo en cuenta que las especies de termitas más comúnmente registradas como dañinas en cultivos de caucho natural, son de hábitos subterráneos, es decir que no tienen nidos superficiales o aparentes, entonces en el muestreo además se utilizaron cebos consistentes en piezas de cartón corrugado (15 cm de altura y 8 cm de ancho, enterrados a 20 cm de la superficie del suelo) (Junqueira y Berti-Filho 2000; Junqueira et al. 2006) y estacas de madera blanda (Pinus sp.) de 3 cm x 3 cm x 50 cm (enterradas a tres cuartos de su altura total) expuestos por un periodo de 4 a 6 semanas (Costa 1997) cuyo conteo inició al momento de la evaluación de cada transecto. Se enterraron una estaca y un pedazo de cartón en cada sección en los transectos, es decir se evaluaron 160 estacas y 160 cebos de cartón. Al término del tiempo señalado se retiró cada cebo, se recolectaron los individuos allí encontrados y se registró el consumo en cada uno de los cebos.
Los grupos tróficos fueron clasificados de acuerdo con la utilización de los recursos, por relación con el sustrato de forrajeo, y /o según lo descrito en la literatura (Eggleton et al. 1995; Eggleton et al. 1997; Constantino y Schlemmermeyer 2000) en humívoros (que se alimentan de suelo); intermedios (que se alimentan en la interfase suelo/madera) que se colectan debajo de troncos caídos, en avanzado estado de descomposición; xilófagos (colectados forrajeando en piezas de madera), y consumidores de hojarasca (los que se alimentan de hojarasca). Con el objeto de establecer la posible relación entre las características de los suelos de las plantaciones y la diversidad de termitas, se describieron en campo las características físicas del suelo mediante la descripción del perfil hasta 1,20 m de profundidad con énfasis en la textura y apariencia del horizonte A y para las características químicas se analizó el contenido de nitrógeno y carbono orgánico en el laboratorio de suelos de la Facultad de Agronomía de la Universidad Nacional de Colombia, sede Bogotá. Así mismo se determinó el contenido de humedad del suelo en cada periodo de muestreo.
Todas las muestras de termitas se recolectaron en etanol al 90% y se trasladaron al laboratorio de Sanidad Forestal de la Universidad Distrital Francisco José de Caldas. Las muestras se determinaron al nivel de género utilizando claves apropiadas para la región neotropical (Constantino 2002b). Las determinaciones a especie de los géneros Heterotermes, Microcerotermes, Nasutitermes, Rotunditermes y Syntermes fueron realizadas por el Dr. Reginaldo Constantino (Universidad de Brasilia). Todas las muestras se encuentran en la colección entomología forestal de la Universidad Distrital Francisco José de Caldas.
Se realizaron muestreos en dos periodos climáticos contrastantes así: en mayo y julio de 2009 y febrero y marzo de 2010 correspondientes a las épocas lluviosa y seca, respectivamente. Mediante el método del transecto se obtuvo la composición y la abundancia relativa de termitas en las plantaciones al contabilizar la presencia de una especie solamente una vez por sección es decir que si una especie estuvo presente en todas las secciones de un transecto tiene un valor de abundancia relativa de cinco (Jones et al. 2003) en cada periodo climático o 10 en total. El número de encuentros de cada especie se utilizó como indicador de la abundancia relativa de cada especie de termitas dentro del transecto y entre transectos, pero no como medida de la abundancia o biomasa ya que solo se colectaron muestras representativas de lo que se consideró una colonia.
Con el objeto de caracterizar las comunidades de termitas, se calcularon los índices de riqueza específica (número de especies encontradas por cada sitio de muestreo) y de diversidad alfa de Shannon y Wienner (H’) (Magurran 2007), usando los datos de riqueza específica y abundancia relativa. Teniendo en cuenta que no fue posible tener el mismo número de transectos en las tres edades de plantación, los índices se calcularon en promedio por transecto por edad. Así mismo, con el objeto de determinar si el esfuerzo de muestreo representaba apropiadamente la cantidad de especies que se esperaba encontrar en el área de estudio, se obtuvieron curvas de acumulación de especies utilizando el programa Estimates 8.2 (Colwell 2009). Además se compararon la riqueza y abundancia relativa de termitas y el porcentaje de infestación de los cebos utilizando análisis de varianza ANOVA y se calculó la correlación entre las variables: riqueza específica acumulada de todos los microhábitats y por microhábitat (árboles, madera muerta, suelo) como variable independiente versus área basal, altura del dosel, pH, contenido de humedad, contenido de carbono orgánico, nitrógeno, densidad aparente y densidad real del suelo como variables dependientes utilizando la prueba paramétrica de correlación de Pearson. Los datos fueron transformados utilizando √X + 0,5 (Junqueira et al. 2009). La edad no se incluyó como variable en este análisis de correlación debido a que estaba intrínsecamente incluida en el área basal y la altura total de los árboles. Para el análisis estadístico de los datos se utilizó el programa SPSS versión 17 para Windows.
Resultados
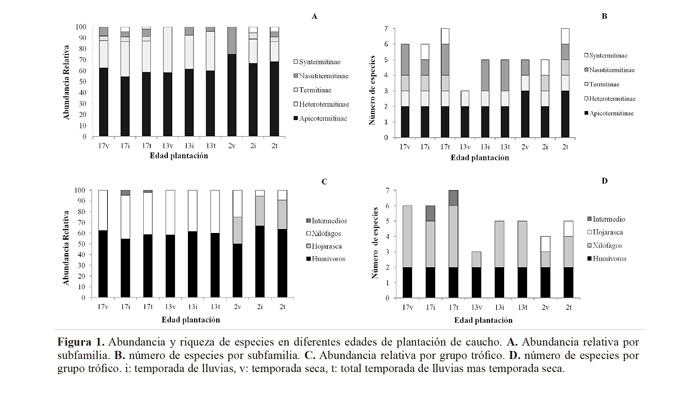
Composición de especies. Se encontraron diez especies la mayoría (90%) Termitidae (subfamilias Apicotermitinae, Nasutitermitinae y Syntermitinae) y Rhinotermitidae (Tabla 2, Figura 1). Las especies Ruptitermes sp. y Rotunditermes cf. bragantinus solamente se registraron en rodales de plantación de dos años de edad y Armitermes sp. únicamente en la plantación de 17 años. Anoplotermes spp., Grigiotermes sp. y Heterotermes convexinotatus (Snyder, 1924d) se encontraron en todas las edades de plantación.
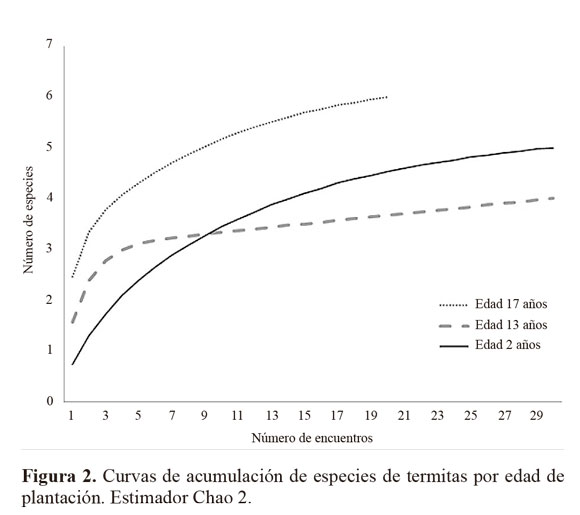
La riqueza absoluta de especies (S), fluctuó entre 3 y 7 entre los diferentes rodales en las tres edades de plantación, pero dada la variación entre las diferentes edades y transectos, la diferencia no se consideró significativa entre edades de plantación. Sin embargo, los índices de diversidad alfa y beta (índice de Jaccard: 0,4 entre plantaciones de 17 y dos años; 0,6 entre plantaciones de 13 y dos años de edad y 0,7 entre plantaciones de 17 y 13 años) reflejan un gradiente de aumento o disminución entre edades de plantación, en donde los valores extremos ocurren para las más desarrolladas y más jóvenes y los valores intermedios para la plantación de 13 años.
Tomando en consideración el sustrato especifico de forrajeo, se recolectaron siete especies forrajeando en galerías sobre el fuste de los árboles, cinco en secciones de madera en contacto con el suelo y cinco en la capa superficial del suelo, con ligeras variaciones entre edades de plantación. En los muestreos se recolectaron 86,7 y 80% de las especies estimadas (Fig. 2). El 80% de las especies de termitas encontradas presentó actividad en las dos épocas climáticas muestreadas, con una ligera disminución en la temporada seca (Fig. 1). Las especies Armitermes sp. y Syntermes cf. molestus solamente se encontraron forrajeando durante la temporada de lluvias mientras que las especies Ruptitermes sp. y Rotunditermes cf. bragantinus solo se encontraron durante la temporada seca. Así mismo, durante la temporada lluviosa el número de especies fue 43% y 20% mayor respectivamente en el fuste de arboles y en piezas de madera en contacto con el suelo.
Abundancia relativa de especies. La abundancia relativa general fue significativamente menor (70%) en las plantaciones de 2 años en comparación con las plantaciones de 17 años (F = 11,44; gl = 2; P = 0,023). Las diferencias en abundancia relativa se acentuaron durante el periodo seco (F = 37,5; gl = 2; P = 0,001) cuando la abundancia en la plantación de 2 años fue 86 y 91% menor a la de las edades de 13 y 17 años. Así mismo, se redujo en aprox. 84% en comparación con el periodo de lluvias de la misma edad. En particular fueron menos frecuentes las especies de la subfamilias Apicotermitinae (F = 6,654; gl = 2; P = 0,015) y Heterotermitinae (F = 14,138; gl = 2; P = 0,01) que corresponden, respectivamente, a especies humívoras y xilófagas (Fig. 1).
Anoplotermes sp., H. convexinotatus y Grigiotermes sp. en ese orden fueron las especies más frecuentemente colectadas, con ligeras variaciones entre edades de plantación, siendo encontradas en 34, 30 y 26%, respectivamente, del total de encuentros en las 80 secciones muestreadas. Estas especiesse encontraronen todas las edades del cultivo y en la mayoría de los sustratos muestreados (excepto cebos de madera y cartón).
Heterotermes convexinotatus fue la especie más abundantemente encontrada forrajeando en fuste de árboles (50%) y en trozos de madera en contacto con el suelo (54%), como también fue la única en los cebos. La infestación de los cebos de madera fue 17% mayor que las secciones de cartón (F = 5,17; gl = 1; P = 0,0393). Así mismo, en promedio la mayor infestación en estacas (47%, F = 6,23; gl = 2; P = 0,044) se observó en los rodales de 17 años de edad. Cabe destacar que durante el periodo seco se observó una mayor infestación en las estacas en la edad más joven de plantación y en la plantación más desarrollada, mientras que en el cartón fue notablemente menos forrajeado en ese periodo.
La infestación de las ramas en contacto con el suelo ocurrió principalmente cuando la madera se encontraba en un nivel de descomposición moderado el cual fue más abundante en plantaciones de 17 años (70% de las piezas evaluadas). Por tratarse de un monocultivo, las piezas de madera en contacto con el suelo correspondieron en su totalidad a ramas y ramillas de arboles de caucho (1,5 y 4 m) que caen de las ramas del árbol, se acumulan entre las líneas de la plantación y se encontraban en diferentes grados de descomposición al momento de realizar los muestreos. De un total de 1500 piezas de madera analizadas, en un 35% se encontraron signos de ataque por H. convexinotatus; las piezas de madera tenían un contenido de humedad mayor a 25% y la mayoría a su vez estaba colonizada por hongos de micelio café oscuro. En el horizonte orgánico de suelo la especie más abundante fue Anoplotermes spp. (31%), seguida por Grigiotermes sp. (20,8%) y H. convexinotatus (11,6%).
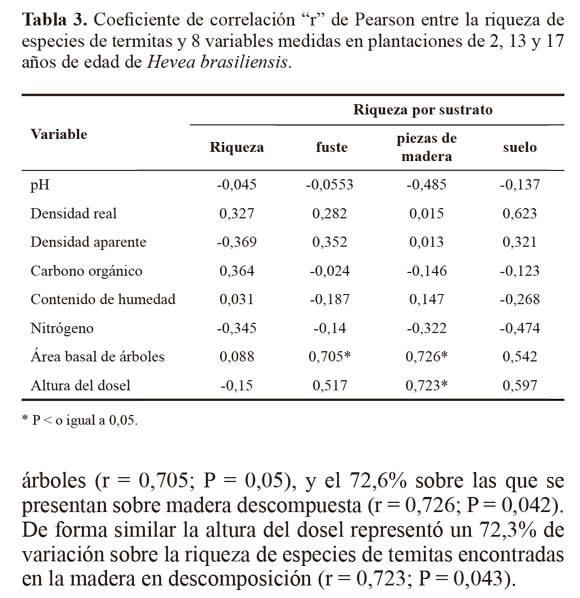
Aun cuando los suelos de la plantaciones se diferenciaron visualmente por la ocurrencia o ausencia de acumulacion superficial de plintita (llamado localmente formación de Serrania) y los análisis revelaron ligeras variaciones en textura del horizonte A, contenido de carbono orgánico y variaciones hasta de 20% en el CH, este conjunto de variables no fueron suficientes para explicar la composición de la termitofauna en los diferentes rodales que, al parecer, estuvo mas relacionada con caracteristicas de los rodales maduros ya que se observó (Tabla 3) que el área basal de la vegetación representó un 70,5% de variación en las termitas que se encuentran en árboles (r = 0,705; P = 0,05), y el 72,6% sobre las que se presentan sobre madera descompuesta (r = 0,726; P = 0,042). De forma similar la altura del dosel representó un 72,3% de variación sobre la riqueza de especies de temitas encontradas en la madera en descomposición (r = 0,723; P = 0,043).
Discusión
La termitofauna de las plantaciones de caucho estuvo compuesta por un mayor número de especies xilófagas (52.4 % en promedio en las tres edades), con ligeras variaciones entre las edades de plantación y régimen de lluvias (Fig. 1). Por su parte la frecuencia de encuentros de las especies xilófagas y humívoras más abundantes fue significativamente menor durante la época seca en las plantaciones más jóvenes.
Se destaca el predominio de dos especies humívoras (Anoplotermes spp. y Grigiotermes sp.) y una xilófaga (H. convexinotatus), las cuales fueron encontradas en todas las edades, transectos muestreados y épocas climáticas, aunque considerablemente reducidas en plantaciones jóvenes y época seca. Teniendo en cuenta que el sustrato de alimentación de las primeras es el suelo, estas dos especies no necesariamente dependen de una estructura de vegetación compleja y su distribución puede ser más amplia (Negret y Redfort 1982).
Por su parte, Heterotermes convexinotatus predominó en las plantaciones de caucho de 13 y 17 años tanto en la época húmeda como en la seca, principalmente en las piezas de madera en contacto con el suelo y en los cebos. Las especies de este género explotan diversas fuentes alimenticias que incluyen cultivos agrícolas, eucalipto, cultivos de caucho jóvenes (Almeida et al. 1998; Moino-Jr. et al. 2002; Sterling et al. 2011) y madera en descomposición (Eggleton 1996; Junqueira y Berti-Filho 2000). Se ha observado cómo en plantaciones forestales maduras se favorece el desarrollo de Rhinotermitidae, en especial H. convexinotatus, al proveer de recursos alimenticios abundantes así como de condiciones favorables para forrajeo ya que cuando el dosel se cierra, se presentan fluctuaciones menos severas de temperatura y humedad relativa en la capa superficial del suelo debido a la menor exposición solar directa. También se ha identificado que bosques con alta concentración de hojarasca y acumulación de piezas de madera en el suelo favorecen la densidad de algunas especies xilófagas (Gonçalves et al. 2005; Polatto y Alves-Junior 2009).
Contrario a lo observado en otros estudios (Junqueira et al. 2004) los cebos de cartón fueron menos efectivos que las estacas de madera para detectar la presencia de termitas subterráneas del género Heterotermes, aunque se debe anotar que las piezas de cartón no fueron enrolladas al momento de ser enterradas y es posible que este factor haya incidido en la efectividad.
La disminución en la frecuencia de encuentros de macroinvertebrados del suelo, especialmente de las termitas subterráneas, durante los periodos secos se ha relacionado con el hecho de que estos organismos migran a horizontes profundos del suelo, debido a que la baja humedad relativa, altas temperaturas y disminución en el contenido de humedad de la capa superficial y de la madera depositada sobre el suelo durante la época seca limitan fuertemente el forrajeo en la superficie y por ende la frecuencia de encuentros en los muestreos (Nobre et al. 2009). Las condiciones de temperatura y humedad del suelo (en este estudio el contenido de humedad disminuyó aproximadamente 20% en dos de los tres rodales jóvenes evaluados) son más limitantes en las plantaciones jóvenes ya que la densidad, altura y tamaño de las ramas es insuficiente para proteger el suelo y ello se refleja en una disminución más drástica del forrajeo durante el periodo seco en comparación con plantaciones desarrolladas. Así mismo, en plantaciones desarrolladas se presenta una ligera disminución en frecuencia de forrajeo superficial de H. convexinotatus durante la época seca, que puede deberse a que las piezas de madera que se encuentran protegiendo el suelo son delgadas y su diámetro no les permite almacenar humedad por mucho tiempo. Esto ha sido observado en plantaciones forestales homogéneas de eucalipto, en H. tenuis donde el forrajeo en las piezas de madera de diámetros pequeños encontradas en el suelo en las épocas de verano disminuye sustancialmente en comparación con piezas de madera de diámetros mayores (Junqueira y Berti-Filho 2000; Nobre et al. 2009).
Por su parte, las piezas de madera con signos de descomposición (en términos de resistencia física y presencia de hongos xilófagos) fueron encontradas con mayor frecuencia de forrajeo por H. convexinotatus, corroborando resultados de termitofauna en monocultivos (Nobre et al. 2009), y estudios que sugieren que la actividad de algunas especies de Rhinotermitidae puede ser facilitada o precedida de la colonización de microorganismos (Cornelius et al. 2002), la cual a su vez es más activa en periodos húmedos. La presencia de microorganismos descomponedores de madera en este estudio fue corroborada por la presencia de pudrición seca (blanca o parda), sin embargo las relaciones específicas de estos microorganismos y H. convexinotatus debe ser estudiada con mayor detalle.
Las plantaciones de mayor desarrollo favorecieron una mayor diversidad y densidad de termitas en el fuste y ramas de árboles, coincidiendo con estudios en los cuales la abundancia de termiteros aéreos se relaciona con el desarrollo de los árboles; particularmente el diámetro y altura, así como la ramificación se correlaciona positivamente con mayores densidades de Termitidae (Decaëns 2001; Davies et al. 2003; Gillison et al. 2003; Jones et al. 2003; Gonçalves-Peralta et al. 2004; Gonçalves et al. 2005).
El ataque por termitas ha sido registrado como una amenaza para el cultivo del caucho, sin embargo las especies encontradas en asociación con plantaciones a partir de los dos años en la llanura bien drenada de los Llanos Orientales y particularmente la actividad de forrajeo de H. convexinotatus no fue directamente vinculada a lesiones que permitan determinarla como especie plaga para el cultivo. Al parecer, la abundancia de H. convexinotatus tiene relación con la disponibilidad de recursos alimenticios en la plantación, de tal manera que esta especie parece estar contribuyendo a la descomposición de los tocones sobrantes del injerto en la plantación de dos años y las ramas y ramitas en las plantaciones más desarrolladas. Así mismo, es importante anotar que en estas plantaciones no se detectaron especies de Coptotermes consideradas como plagas de forestales incluyendo el caucho natural en Colombia (Garzón y Eslava 2000; Madrigal 2003). En conclusión, el cultivo de caucho establecido en sitios previamente ocupados por pasturas o sabanas en condiciones de la altillanura bien drenada, presentó una termitofauna relativamente simplificada con predominio de humívoros y xilófagos, los cuales son favorecidos por la disponibilidad de alimento y de microclima en las plantaciones de mayor edad. No se encontraron especies de termitas causantes de daño en estas plantaciones.
Agradecimientos
Al doctor Reginaldo Constantino por asesoría en la determinación taxonómica, los ingenieros Pedro Garzón y Raúl Nizo, Sergio Zambrano, Yudy Ortiz, Víctor Rivero y Marina Farján. Este estudio fue financiado con recursos del Centro de Investigación y Desarrollo Científico CIDCUD de la Universidad Distrital Francisco José de Caldas y apoyado logísticamente por la empresa MAVALLE S.A. Así mismo, los autores agradecen los comentarios y contribuciones de los revisores anónimos a las versiones anteriores de este manuscrito.
Literatura citada
ALMEIDA, J. M.; ALVES, S. B.; MOINO JR., A.; LOPES, E. R. 1998. Controle do cupim subterrâneo Heterotermes tenuis (Hagen) com iscas Termitrap impregnadas com inseticidas e associadas ao fungo entomopatogênico Beauveria bassiana (Bals.) Vuill. Anais da Sociedade Entomológica do Brasil 27: 639 - 644. [ Links ]
CALDERON, R. A.; CONSTANTINO, R. 2007. A survey of the termite fauna (Isoptera) of an Eucalypt plantation in Central Brazil. Neotropical Entomology 36: 391-395. [ Links ]
COLWELL, R. K. 2009. EstimateS: Statistical estimation of species richness and shared species from samples. Version 8. [ Links ]
CONSTANTINO, R. 2002a. The pest termites of South America: taxonomy, distribution and status. Journal of Applied Entomology 126: 355-365. [ Links ]
CONSTANTINO, R. 2002b. An illustrated key to Neotropical termite genera (Insecta: Isoptera) based primarily on soldiers. Zootaxa 67: 1-40. [ Links ]
CONSTANTINO, R. 2005. Padrões de diversidade e endemismo de térmitas no bioma Cerrado. pp. 319-333. En: Scariot, A.; J., S.; Felfili, J. (Eds.). Cerrado: ecologia, biodiversidade e conservação. Brasília: Ministério do Meio Ambiente. 439 p. [ Links ]
CONSTANTINO, R.; SCHLEMMERMEYER, T. 2000. Cupins (Insecta: Isoptera). pp. 129-151. En: Alho, C. J. R. (Eds.). Fauna silvestre da região do rio Manso. Ediciones IBAMA. Brasilia, Brazil. [ Links ]
CORNELIUS, M. L.; DAIGLE, D. J.; CONNICK, W. J., JR.; PARKER, A.; WUNCH, K. 2002. Responses of Coptotermes formosanus and Reticulitermes flavipes (Isoptera: Rhinotermitidae) to three types of wood rot fungi cultured on different substrates. Journal of Economic Entomology 95: 121-128. [ Links ]
COSTA, A. M. 1997. Metodos para coleta e estudo das populacoes de cupins subterraneos. Naturalia 22: 199-206. [ Links ]
DANE. 2009. Metodología del Censo de Unidades Productoras de Plantaciones de Caucho - UPPC, en Once Municipios de Antioquia y Tres Municipios de Córdoba 2009. Bogotá, D. E. 48 p. [ Links ]
DAVIES, R. G.; EGGLETON, P.; JONES, D. T.; GATHORNE-HARDY, F. J.; HERNÁNDEZ, L. M. 2003. Evolution of termite functional diversity: analysis and synthesis of local ecological and regional influences on local species richness. Journal of Biogeography 30: 847-877. [ Links ]
DECAËNS, T., JIMÉNEZ, J., RANGEL, A., CEPEDA, A., MORENO, A., LAVELLE, P. 2001. La macrofauna del suelo en la sabana bien drenada de los Llanos Orientales. pp. 111 - 137. En: Rippstein, G.; Escobar, G.; Motta, F. (Eds.). Agroecología y biodiversidad de las sabanas en los Llanos Orientales de Colombia. Cali, Colombia: CIAT. [ Links ]
EGGLETON, P.; BIGNELL, D. E.; SANDS, W. A.; WAITE, B.; WOOD, T. G.; LAWTON, J. H. 1995. The species richness of termites (Isoptera) under differing levels of forest disturbance in the Mbalmayo Forest Reserve, Southern Cameroon Journal of Tropical Ecology 11: 85-89. [ Links ]
EGGLETON, P., BIGNELL, D., SANDS, W., MAWDSLEY, N., LAWTON, J., WOOD, T., BIGNELL, N. 1996. The diversity, abundance and biomass of termites under differing levels on disturbance in the Mbalmayo forest reserve, Southern Cameroon. Philosophical Transactions: Biological Sciences 351: 51-68. [ Links ]
EGGLETON, P.; HOMATHEVI, R.; JEEVA, D.; JONES, D. T.; DAVIES, R. G.; MARYATI, M. 1997. The species richness and composition of termites (Isoptera) in primary and regenerating lowland dipterocarp forest in Sabah, East Malaysia. Ecotropica 3: 119-128. [ Links ]
ESPINEL, S. 1963. Zonas de vida o formaciones vegetales de Colombia. Memoria explicativa sobre mapa ecológico. IGAC.Bogotá. 201 p. [ Links ]
GALVIS, C., CHAMORRO, C., CORTÉS, A. 1978. Actividad de las termitas en algunos suelos de la Orinoquia Colombiana. Revista Colombiana de Entomologia 4: 51-60. [ Links ]
GARZÓN, F.; ESLAVA, H. 2000. Principales enfermedades y plagas en el cultivo de caucho Hevea brasiliensis (Willd. ex A. Juss) Muel. Arg. con enfasis en la Amazonía Colombiana, Colombia, SINCHI. 63 p. [ Links ]
GILLISON, A. N.; JONES, D. T.; SUSILO, F.-X.; BIGNELL, D. E. 2003. Vegetation indicates diversity of soil macroinvertebrates: a case study with termites along a land-use intensification gradient in lowland Sumatra. Organisms Diversity & Evolution 3: 111-126. [ Links ]
GONÇALVES-PERALTA, R. C.; BARSANULFO-MENEZES, E.; CARVALHO, A. G.; AGUIAR-MENEZES, E. D. L. 2004. Wood consumption rates of forest species by subterranean termites (Isoptera) under field conditions. Revista Árvore 28: 283-289. [ Links ]
GONÇALVES, T.; DE SOUZA, O.; REIS JR., R.; PONTES RIBEIRO, S. 2005. Effect of tree size and growth form on the presence and activity of arboreal termites (Insecta: Isoptera) in the Atlantic Rain Forest. Sociobiology 46: 1-12. [ Links ]
GUTIÉRREZ, A.; URIBE, S.; QUIROZ, J. 2004. Termitas asociadas a plantaciones de Eucalyptus spp. en una reforestadora en Magdalena, Colombia. Manejo Integrado de Plagas y Agroecología 72 54-59. [ Links ]
HOLT, J.; LEPAGE, M. 2000. Termites and soil properties. pp. 389-407. En: Abe, T.; Bignell, D.; Higashi, M. (Eds.). Termites: evolution, sociality, symbioses, ecology. Kluwer Academic Publishers. [ Links ]
IGAC. 1978. Estudio general de suelos de los municipios de Cabuyero, Fuente de Oro, Puerto López, San Carlos de Guaroa y la inspección de Barranca de Upia: departamento del Meta. Bogotá. 451 p. [ Links ]
JIMÉNEZ, J.; DECAENS, T.; LAVELLE, P. 2006. Nutrient spatial variability in biogenic structures of Nasutitermes (Termitinae; Isoptera) in a gallery forest of the Colombian 'Llanos'. Soil Biology and Biochemistry 38: 1132-1138. [ Links ]
JIMÉNEZ, J.; DECAENS, T.; LAVELLE, P. 2008. C and N concentrations in biogenic structures of a soil-feeding termite and a fungus-growing ant in the Colombian savannas. Applied Soil Ecology 40: 120-128. [ Links ]
JONES, D. T.; SUSILO, F. X.; BIGNELL, D. E.; HARDIWINOTO, S.; GILLISON, A. N.; EGGLETON, P. 2003. Termite assemblage collapse along a land-use intensification gradient in lowland central Sumatra, Indonesia. Journal of Applied Ecology 40: 380-391. [ Links ]
JONES, D. T.; VERKERT, R. H.; EGGLETON, P. 2005. Methods for sampling termites. pp. 221-253. En: Leather, S. (Ed.). Insect sampling in forest ecosystems. Victoria, Australia: Blackwell. 320 p. [ Links ]
JUNQUEIRA, L.; BERTI-FILHO, E. 2000. Termite (Insecta: Isoptera) in plantings of Eucalyptus spp. in Anhembi, state of Sao Paulo, Brazil. Acta Biologica Leopoldensia 22: 205-211. [ Links ]
JUNQUEIRA, L. K.; DIEHL, E.; FLORENCIO, D. F.; FILHO, E. B. 2004. Seasonal species richness of termite in an Eucalyptus plantation in Anhembi, state of Sao Paulo, Brazil. Acta Biologica Leopoldensia 26: 241-248. [ Links ]
JUNQUEIRA, L. K.; BERTI FILHO, E.; FLORENCIO, D. F.; DIEHL, E. 2006. Efficiency of subterranean baits for termite sampling in Eucalyptus forests. Bioikos 20: 3-7. [ Links ]
JUNQUEIRA, L. K.; DIEHL, E.; BERTI, E. 2009. Termite (Isoptera) diversity in Eucalyptus-growth areas and in forest fragments. Sociobiology 53: 805-828. [ Links ]
LAVELLE, P.; DECAENS, T.; AUBERT, M.; BAROT, S.; BLOUIN, M.; BUREAU, F.; MARGERIE, P.; MORA, P.; ROSSI, J. 2006. Soil invertebrates and ecosystem services. European Journal of Soil Biology 42: S3-S15. [ Links ]
MADRIGAL, A. 2003. Insectos Forestales de Colombia, Biología, Hábitos, Ecología y Manejo, Medellin, Universidad Nacional de Colombia, Facultad de Ciencias. 609 p. [ Links ]
MAGURRAN, A. 2007. Measuring biological diversity, Oxford, R.U., Blackwell Publishing. 256 p. [ Links ]
MOINO-JR., A.; BATISTA ALVES, S.; BIAGGIONI LOPES, R.; OLIVEIRA, P. M.; NEVES, J.; PEREIRA, R. M.; APARECIDA, V. 2002. External development of the entomopathogenic fungi Beauveria bassiana and Metarhizium anisopliae in the subterranean termite Heterotermes tenuis. Scientia Agricola 59: 267-273. [ Links ]
NAIR, K. 2001. Pest outbreaks in tropical forest plantations. Is there a greater risk for exotic tree species?, Jakarta, CIFOR. 82 p. [ Links ]
NAIR, K. 2007. Tropical Forest Insect pest Ecology, Impact and Management, Cambridge University Press. 404 p. [ Links ]
NEGRET, H.; REDFORT, K. 1982. The Biology of nine termites species (Isoptera: Termitidae) from the Cerrado of central Brazil. Psyche 89: 81-106. [ Links ]
NOBRE, T.; NUNES, L.; BIGNELL, D. E. 2009. Survey of subterranean termites (Isoptera: Rhinotermitidae) in a managed silvicultural plantation in Portugal, using a line-intersection method (LIS). Bulletin of Entomological Research 99: 11-21. [ Links ]
POLATTO, L.; ALVES-JUNIOR, V. 2009. Distribuição e densidade de Nasutitermes sp. (Isoptera: Termitidae) em Mata Ribeirinha do Rio Miranda, Pantanal Sul-Matogrossense, Brasil. EntomoBrasilis 2: 27-30. [ Links ]
SCHABEL, H.; HILJE, L.; NAIR, K.; VARMA, R. 1999. Economic entomology in tropical forest plantations: an update. Journal of Tropical Forest Science 11: 303-315. [ Links ]
STERLING, A.; GOMEZ, C. A.; CAMPO, A. A. 2011. Patogenicidad de Metarhizium anisopliae (Deuteromycota: Hyphomycetes) sobre Heterotermes tenuis (Isoptera: Rhinotermitidae) en Hevea brasiliensis. Revista Colombiana de Entomologia 37: 36-42. [ Links ]
WAGNER, M.; COBBINAH, J.; BOSU, P. 2008. Forest Entomology in West Tropical Africa: Forest insects of Ghana.Países Bajos, Springer. 244 p. [ Links ]