Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Química
Print version ISSN 0120-2804
Rev.Colomb.Quim. vol.45 no.2 Bogotá May/Aug. 2016
https://doi.org/10.15446/rev.colomb.quim.v45n2.60370
Doi: http://dx.doi.org/10.15446/rev.colomb.quim.v45n2.60370
Determinación del contenido extra e intracelular de algunas enzimas líticas relacionadas con pared celular en raíces de clavel (Dianthus caryophyllus L.)
Determination of extra and intracellular lytic enzymes related with carnation (Dianthuscaryophyllus L.) root cell wall
Determinação do conteúdo extra e intracelular de algumas enzimas líticas relacionadas com a parede celular em raízes de cravo (Dianthus caryophyllus L.)
Edilene Ramírez1, Sixta T. Martínez1,*
1 Laboratorio Estudio de actividades metabólicas vegetales-Facultad de Ciencias, Universidad Nacional de Colombia, Bogotá D.C, Colombia.
Autor para correspondencia: stmartinezp@unal.edu.co
Article citation:
Ramírez, E.; Martínez, S. T. Determinación del contenido extra e intracelular de algunas enzimas líticas relacionadas con pared celular en raíces de clavel (Dianthus caryophyllus L.). Rev. Colomb. Quim. 2016, 45 (2), 5-11.DOI: http://dx.doi.org/10.15446/rev.colomb.quim.v45n2.60370.
Recibido: 12 de Mayo de 2016. Aceptado: 7 de Junio de 2016.
Resumen
En el presente trabajo se verificó la presencia de algunas enzimas relacionadas con la pared celular vegetal (poligalacturonasa, pectato liasa, proteasa y xilanasa) en raíces de clavel (Dianthus caryophyllus L.). Así mismo, se determinaron los niveles de actividad de las mismas. Estos niveles se analizaron en diferentes espacios celulares: en el fluido intercelular que hace parte del apoplasto, en el simplasto y en el tejido total de las raíces de clavel (apoplasto y simplasto).
Para extraer el fluido intercelular, se ensayaron dos metodologías. Para obtener el contenido intracelular (simplasto) y el extracto total (apoplasto y simplasto) en raíces de clavel se ensayaron tres metodologías que utilizaban como solución i) extractante buffer fosfato, ii) buffer fosfato con PVPP y iii) lavados con acetona a las raíces de clavel, antes de la extracción con buffer fosfatos. Los resultados mostraron el efecto de las diferentes soluciones en las actividades enzimáticas y en el contenido de proteína. Se propuso una de estas metodologías para extraer las cuatro enzimas en un único paso y realizar análisis comparativo de actividad enzimática.
Palabras clave: Fluido intercelular, extracto intracelular, actividad enzimática, poligalacturonasa, pectato liasa, proteasa, xilanasa.
Abstract
The presence of some enzymes related to cell wall (polygalacturonase, the pectate lyase, protease and xylanase) in carnation (Dianthus caryophyllus L.) roots as well as the activity levels were determined. These levels were analyzed in different cellular places: the intercellular fluid that is part of the apoplast, the symplast, and the total level (apoplast and symplast) in carnation roots.
Two methods were tested to extract the intercellular fluid. To obtain the intracellular content (symplast) and total extract (apoplast+symplast), three methods were tested, using as extracting solution i) phosphate buffer, ii) phosphate buffer + PVPP, iii) before the extraction with phosphate buffer, the carnation roots were washed with acetone. The results showed the effect of different extracting solutions in the enzymatic activities and in the protein content. A new only one step method is proposed to extract the four enzymes and make the comparative analysis of enzymatic activity.
Keywords: Intercellular fluid, intracellular extract, enzymatic activity, polygalacturonase, pectate lyase, protease, xylanase.
Resumo
No presente trabalho foi evidenciada a presença de algumas enzimas relacionadas com a parede celular vegetal: poligalacturonasa, pectato liasa, proteasa e xilanasa e se determinaram seus níveis de atividade, em raízes de cravo (Dianthus caryophyllus L.). Os níveis se analisaram em diferentes espaços celulares: no fluido intercelular que faz parte do apoplasto, no simplasto e no tecido total das raízes de cravo (apoplasto e simplasto). Foram avaliadas duas metodologias para extrair o fluido intercelular.
Para obter o conteúdo intracelular (simplasto) e o extrato total (apoplasto e simplasto) se avaliaram três metodologias que utilizavam como solução extratora i) buffer fosfato, ii) buffer fosfato com PVPP e iii) lavados com acetona às raízes de cravo, antes da extração com buffer fosfato. Os resultados mostraram o efeito das diferentes soluciones nas atividades enzimáticas e no conteúdo de proteína. Se propõem uma de estas metodologias para extrair as quatro enzimas num único passo e realizar a analise comparativa da atividade enzimática.
Palavras-Chave: Fluido intercelular, extrato intracelular, atividade enzimática, poligalacturonasa, pectato liasa, proteasa, xilanasa.
Introducción
Las células de las plantas constan de dos compartimentos separados por una membrana plasmática continua, uno intracelular, conocido como simplasto, y otro extracelular, conocido como apoplasto, compuesto por las paredes celulares, los espacios intercelulares, el fluido intracelular (IFW por sus siglas en inglés), las células muertas vacías de los tubos del xilema y el agua contenida en el mismo (1).
La pared celular de las plantas (PC) determina el tamaño y la forma de las células. Así mismo, constituye el primer obstáculo que los patógenos deben superar para acceder a ésta (2). Es una estructura altamente compleja, compuesta por polisacáridos que comprenden celulosa, hemicelulosa, pectina, proteínas y lignina, entre otras (3). De igual modo, la PC que rodea el protoplasto no es una estructura estática, sino que se remodela y reorganiza durante el crecimiento y desarrollo de la célula. También, la PC se desarticula durante los procesos terminales como absición de órganos y maduración de frutos; es fuente de nutrientes y una barrera que limita el acceso de patógenos al contenido celular (4).
Así, con el fin de tener acceso a la planta, los patógenos secretan numerosas enzimas que degradan la pared celular, y que, en algunos casos, llegan a ser factores de virulencia (2, 4). En el IFW los patógenos secretan sustancias para colonizar al huésped y se dan los procesos de defensa por parte de las plantas (1, 5). Por tanto, ha sido estudiado para conocer las proteínas presentes, relacionadas y secretadas por la planta y el patógeno en el inicio de una interacción planta-patógeno (5, 6).
Específicamente para el clavel (Dianthus caryophyllus L.), algunos estudios señalan que los hongos producen una serie de enzimas depolimerizantes que degradan la pectina presente en la PC, como consecuencia taponan los vasos del xilema y reducen el flujo vascular originando stress hídrico y en algunos casos pudrición de la planta (7). Micoorganismos como los Fusarium oxysporum f.sp. dianthi, secretan proteasa, xilanasa, poligalacturonasa y pectato liasa en el IFW a tiempos de infección tempranos (8). La secreción de estas enzimas líticas puede inducir una respuesta de defensa por la liberación de oligogalacturónidos de la PC de la planta (3, 9, 13).
De este modo, las enzimas líticas permiten al patógeno la penetración y expansión dentro de los tejidos vegetales y el uso de la PC como fuente de carbono. A su vez, estas enzimas son utilizadas por la planta para remodelación de la PC, entre otras funciones (4). Se han desarrollado algunas revisiones (14, 15) y se encuentra que la matriz de la PC de las plantas posee más de 20 actividades glicosil hidrolasas (GH), las cuales incluyen glicosidasas y glicanasas que hidrolizan la mayoría de enlaces glicosídicos de los polisacáridos presentes en esta.
En la clasificación por familias reportada por Frankováy Fry (14), aparece en la familia GH10 la pi-4 xilanasa, en la GH28 la endopoligalacturonasa y en la PL1 la pectato liasa. De manera general, y sin especificar un tejido en particular, estas enzimas son asociadas con expansión celular, diferenciación, maduración y reparación de pared (16). Las proteasas, por ejemplo, son reguladores clave de una variedad de procesos biológicos, se expresan en tiempos y espacios específicos y se acumulan según su función en diferentes compartimientos subcelulares (17).
Puesto que las enzimas líticas asociadas a la PC son comunes a ambos organismos (planta y hongo), pero de funciones tanto bioquímica como fisiológicamente distintas para cada una, resultan de interés en estudios de interacción huésped-patógeno (4).
Estas se han estudiado utilizando aproximaciones bioquímicas y de genética molecular. La aproximación bioquímica consiste en la extracción y posterior purificación de las enzimas de la pared celular, lo cual permite, entre otros, realizar estudios de actividad (15).
Por tanto, en el presente trabajo se siguió la aproximación bioquímica y se determinó la actividad de las enzimas proteasa (PRT), xilanasa (XL), pectato liasa (PL) y poligalacturonasa (PG) en el IFW, en el simplasto del residuo vegetal de raíces de clavel (Dianthus caryophyllus L.), luego de extraer el fluido intercelular, y en el tejido total (IFW + simplasto). Para este propósito se ensayaron varias metodologías que permitieron la extracción de las cuatro enzimas en los diferentes espacios celulares seleccionados.
Materiales y métodos
Material Vegetal
Se emplearon raíces de esquejes de clavel (Dianthus caryophyllus L.) de tres semanas de enraizamiento. La variedad usada fue Moonlight. El material fue donado por la empresa floricultora QFC-SAS ubicada en Gachancipá.
Extracción de fluido intercelular (IFW)
Para la extracción del fluido de lavado intercelular, fueron evaluadas dos metodologías reportadas por Olivieri et al. (18) y Van Pelt-Heerschap (19).
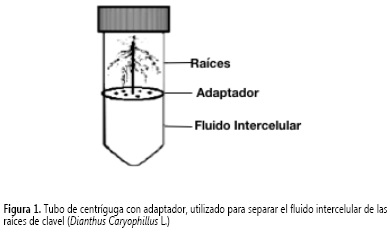
Para desarrollar el procedimiento descrito por Van Pelt-Heerschap (19), denominado fluido intercelular sin vacío (IFW-SV), se utilizaron 2,5 g de raíces de clavel, se lavaron con agua destilada y se cortaron en piezas de 0,5 a 1 cm; el tejido se lavó con 5 mL de buffer tris-HCl 50 mM pH 7,5; se secó y se centrifugó durante 20 min a 2000 x g en una centrífuga (Hettich, modelo Universal 320R) empleando un tubo con un adaptador (Figura 1) que fue diseñado para permitir separar el IFW de las raíces.
En el procedimiento reportado por Olivieri et al. (18), denominado fluido intercelular con vacío (IFW-CV), se empleó la misma cantidad de material vegetal, se lavó y se cortó como se describió anteriormente. El tejido se sumergió en 5 mL de buffer Tris-HCl 50 mM, pH 7,5; NaCl 0,6 M y 2-mercaptoetanol 0,1% (v/v), se sometió a vacío durante tres periodos de 10 s, separados por intervalos de 30 s y se secó sobre papel filtro. La muestra se colocó en un tubo con adaptador (Figura 1) que permitió separar el IFW de las raíces, por centrifugación (Centrífuga Hettich, modelo Universal 320R) durante 20 min a 3000 x g. El fluido obtenido (1 mL) se almacenó a -20 °C.
Se realizaron cuatro réplicas para cada uno de los métodos ensayados. El contenido de proteína se cuantificó usando el método de Bradford y la linealización reportada por Zor y Selinger (20).
Una vez seleccionada la metodología para la extracción del fluido intercelular, se aplicó para obtener el extracto con el que se determinaron las diferentes actividades enzimáticas. Para lo anterior, se aumentaron a cinco las réplicas biológicas, se eliminaron los compuestos de bajo peso molecular mediante microdiálisis (Membrana SigmaD-9277. lOKd) a 4 °C, usando buffer fosfatos 10 mM pH 6,5; realizando tres cambios cada 2 h.
Obtención de extracto intracelular (EIn)
Para la obtención del material soluble presente en el espacio intracelular (simplasto), se extrajo el IFW y en el tejido sobrante se ensayaron tres metodologías: un tratamiento que utilizó como solución extractante buffer fosfato 100 mM pH 6,5 (EIn) (21), un segundo tratamiento que usó polivinilpolipirrolidona (EIn-PVPP) (23) y finalmente uno en donde se empleó un tratamiento previo con polvos de acetona (EIn-AC) (22).
Obtención del extracto intracelular usando buffer fosfato (EIn)
Se pesaron las raíces (2,5 g), se trituraron con nitrógeno líquido y se resuspendieron en buffer fosfatos 100 mM pH 6,5 en relación 1:2 (p/ v); se mantuvieron en agitación sobre hielo por 1 h. Finalizado el tiempo, la mezcla se centrifugó a 11000 x g por 30 min (Centrífuga Hettich, modelo Universal 320R) (21).
Obtención del extracto intracelular usando buffer fosfato más polivinilpolipirrolidona (EIn-PVPP)
Se trituraron las raíces (2,5 g) con nitrógeno líquido y se resuspendieron en buffer fosfatos 100 mM pH 6,5 con polivinilpolipirrolidona (PVPP) al 1% (p/v), y NaCl 1 M en relación 1:2 (p/v), un compuesto utilizado para eliminar polifenoles y evitar así la unión de estos con las proteínas, (24) ; se mantuvieron en agitación sobre hielo por 1 h. Finalmente la mezcla se centrifugó a 11000 x g por 30 min (Centrífuga Hettich, modelo Universal 320R)(23).
Obtención del extracto intracelular utilizando tratamiento previo con polvos de acetona (EIn-AC)
Se trituraron las raíces (2,5 g) con nitrógeno líquido, el material vegetal se lavó tres veces con acetona a -20 °C por 1 min en una relación 1:2 (p/v); se resuspendió en buffer fosfatos 100 mM pH 6,5 manteniendo la misma relación de los lavados con acetona y se agitó sobre hielo por una hora. Finalmente la mezcla se centrifugó a 11000 x g por 30 min (Centrífuga Hettich, modelo Universal 320R) (22).
Una vez obtenidos los extractos con cada una de las metodologías anteriores, se eliminaron los compuestos de bajo peso molecular, mediante microdiálisis (Membrana Sigma D-9277, 10Kd) a 4 °C, usando buffer fosfatos 10 mM pH 6,5 y realizando tres cambios cada dos horas. Las muestras obtenidas se congelaron a -20 °C y se utilizaron para determinar las actividades enzimáticas y cuantificar proteína por el método de Bradford y la linealización reportada (20). Los resultados de cada tratamiento son producto de cinco réplicas biológicas.
Obtención de extractos crudos (EC)
Para obtener los extractos crudos o totales, con todo el contenido celular (IFW + simplasto), se emplearon las tres metodologías utilizadas en el paso anterior. Para obtener el extracto crudo, se utilizó todo el tejido vegetal sin extraer previamente el fluido intercelular.
Determinación de actividad α-manosidasa en el fluido de lavado intercelular (IFW) y en el extracto intracelular (EIn)
La integridad del material intracelular (5) se determinó midiendo la actividad de la enzima α-manosidasa descrita por Boller (24). Como sustrato se utilizó p-nitrofenol-α-manopiranósido 5mM, disuelto en buffer acetato 0,01M pH 4,0. Se tomaron 100 μL, se incubaron con 20 μL de los extractos de IFW y EIn durante 2 h a 37 °C. La reacción se detuvo con 1,1 mL de Na2CO3 0,2 M y se midió la absorbancia a 420 nm. Una unidad de actividad equivale a un nmol de p-nitrofenol liberado por min. La unidad de actividad se definió como un incremento con respecto al blanco de 0,01 unidades de absorbancia a 420 nm por minuto por mL de mezcla de reacción en las condiciones del ensayo. Cada ensayo se realizó por triplicado.
Determinación de actividad proteasa (PRT)
Se empleó la técnica descrita por Hübner (25), ensayo basado en la determinación de aminoácidos aromáticos de los péptidos liberados en la hidrólisis de la caseína. Se tomaron 100 μL de extracto y 400 μL de caseína al 0,1 % (p/v) disuelta en buffer Tris-HCl 0,01 M pH 8. La mezcla se incubó a 50 °C por 30 min, y la reacción se detuvo con 1 mL de ácido tricloroacético (ATA) al 10% (v/v). Se centrifugó por 5 min a 10000 x g, a temperatura ambiente. Se midió la absorbancia del sobrenadante a 280 nm. El blanco enzima-sustrato, se preparó adicionando al extracto enzimático que contenía el sustrato 1 mL de ATA al 10% (p/v) y se realizó el mismo tratamiento. El ensayo se realizó por quintuplicado. La unidad de actividad se definió como la cantidad de enzima que cataliza la formación de un nanomol de tirosina por segundo (nKat) en las condiciones de la reacción. La cuantificación se realizó usando una curva de calibración, elaborada con L-tirosina como patrón en concentraciones de 0 a 180 μg/mL.
Determinación de actividad pectato liasa (PL)
La determinación de actividad se realizó usando el método reportado en Parra (26). Se tomaron 100 μL del extracto en el que estaba presente la enzima, se le agregaron 700 μL de ácido poligalacturónico (APG) 0,1% (p/v), preparado en buffer tris-HCl 0,1 M pH 8,5 con CaCl2 0,5 mM; la mezcla se incubó a 37 °C por 1 h. La reacción se detuvo con 1 mL de ácido clorhídrico 1 M. Finalizado el ensayo se determinó la actividad midiendo el incremento en la absorbancia a 232 nm (ε % 4600 L/molcm), producido por la liberación de urónidos insaturados. La unidad de actividad fue definida como la cantidad de enzima que cataliza la formación de un nmol de urónidos insaturados liberados por segundo (nKat) en las condiciones de la reacción. Los ensayos fueron realizados cinco veces.
Determinación de actividad poligalacturonasa (PG)
Para la cuantificación de los azúcares reductores obtenidos como productos de hidrólisis de la enzima PG sobre el sustrato ácido poligalacturónico (APG), se empleó el método de Nelson-Somogyi (27, 28). La cuantificación de los azúcares liberados se realizó por medio de una curva de calibración, usando como patrón glucosa en el rango de 0-30 μg/mL (26, 27). La medida de actividad de la enzima se realizó usando la siguiente mezcla de reacción: 100 μL de extracto enzimático, 250 μL de APG 0,3% (p/v) en ácido acético-acetato de sodio 0,1 M pH 5,0; la mezcla de reacción fue incubada a 30 °C por 1 h (26). La unidad de actividad PG fue definida como nmoles de azúcares reductores generados por segundo/mL (nKat/mL). Los ensayos fueron realizados cinco veces.
Determinación de actividad xilanasa (XL)
La cuantificación de los azúcares reductores obtenidos como productos de hidrólisis de la enzima xilanasa sobre el sustrato xilano de madera de abedul, se realizó con el método de Nelson-Somogyi (27, 28). Para la cuantificación se realizó una curva de calibración, usando como patrón xilosa en el rango de 0 - 500 μg/mL (27- 29). Para la medida de actividad de la enzima xilanasa se tomaron 100 μL de extracto enzimático y 250 μL de xilano de madera de abedul 0,5% (p/v) en buffer Borato/HCl 100 mM pH 9,0; dicha mezcla fue incubada a 45 °C por 20 min. La unidad de actividad XL fue definida como nmoles de azúcares reductores generados/mL (nKat/mL). Los ensayos fueron realizados cinco veces.
Estadística
El análisis estadístico de los resultados se llevó a cabo mediante un análisis de varianza (ANOVA) empleando un procedimiento de diferencia mínima significativa (LSD) de Fisher con ayuda de la herramienta Statgraphics Centurion.
Resultados y discusión
Selección de la metodología para la extracción del fluido intercelular
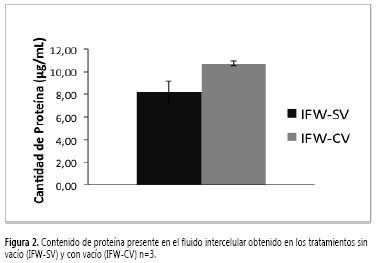
Para la extracción del fluido de lavado intercelular (IFW) en raíces de clavel se ensayaron las metodologías propuestas por Van Pelt-Heerschap (19) y Olivieri et al. (18). La eficiencia de estas se determinó midiendo la cantidad de proteína extraída. Los resultados (Figura 2) indican que con el tratamiento en el cual se aplica vacío (18) se incrementa la cantidad de proteína extraída. Este método utiliza un buffer que contiene NaCl y β-mercaptoetanol, el cual se infiltra en el tejido al aplicar vacío y así aumenta la extracción de proteína. El efecto del NaCl es de tipo iónico ya que las cargas del compuesto disociado interactúan con los aminoácidos cargados de las proteínas. Esto puede facilitar el proceso de extracción (30) que, acompañado del tratamiento con vacío, favorece la liberación de las proteínas del apoplasto, para luego, al ser centrifugadas, obtener un extracto rico en proteínas (30). El resultado anterior permite afirmar que el tratamiento reportado por Olivieri et al. (18), para la extracción del fluido intercelular a partir de tubérculos de papa es el más adecuado para extraer una mayor cantidad de proteínas.
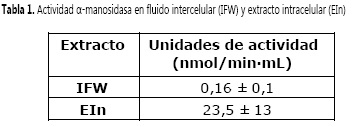
Seleccionado el método de extracción, se verificó la integridad del material intracelular para determinar que no se hubiera presentado lisis celular; se usó como marcador la enzima α-manosidasa, ubicada en la vacuola. Los resultados (Tabla 1) presentan la mayor actividad de la enzima en el extracto intracelular (EIn), la obtenida en el IFW representa el 0,68% de actividad, valor comparable al obtenido por Olivieri et al. (18), quienes reportan actividad α-manosidasa en el IFW de 0,45% respecto al extracto intracelular. Estos resultados demuestran que en el proceso de extracción del fluido intercelular es mínima la ruptura intracelular, que la metodología se realizó de manera adecuada y fue útil para el análisis deseado.
Selección de la metodología para la extracción del contenido intracelular en raíces de clavel
El contenido enzimático celular, se puede evaluar en el tejido total de la raíz (IFW+simplasto) denominado también extracto crudo (EC), o separando primero el IFW y en el tejido sobrante realizar extracción del contenido intracelular (simplasto) (EIn), para así obtener diferentes extractos: el crudo (EC) y el intracelular (EIn) en los cuales se determina el contenido de proteína y la actividad enzimática de las enzimas seleccionadas.
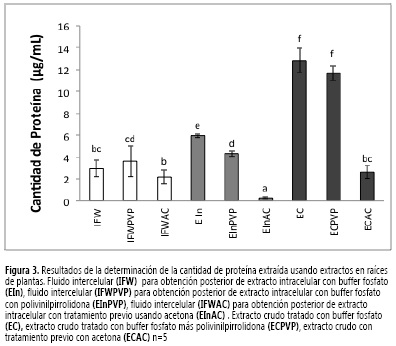
En la Figura 3 se observa que con los tres procedimientos de extracción ensayados es posible obtener cantidades diferenciales de proteína a partir de las raíces. Luego de extraer el IFW, los tratamientos de extracción presentaron un comportamiento similar en el tejido total (EC) y en el tejido sobrante (EIn), La mayor cantidad de proteína se extrajo con los procedimientos que utilizaron buffer fosfatos y buffer fosfatos + PVPP, mientras que con el método que utilizó lavados previos con acetona a las raíces (EIn-AC y EC-AC) se extrajo la menor cantidad.
El tratamiento con acetona contribuyó a la pérdida de un alto contenido de proteína, probablemente por efecto de desnaturalización. El PVPP tampoco presentó el efecto descrito en la literatura (22, 23). Los resultados presentaron coherencia en cuanto al contenido de proteína, ya que su valor en el EC es aproximadamente la suma del presente en el contenido intercelular y en el extracto intracelular.
La menor cantidad de proteína, estadísticamente significativa, se presenta en el IFW como se esperaba, ya que se aplicó en todos la metodología previamente seleccionada para su obtención. Los valores de proteína presentes en el IFW obtenidos de raíces de clavel (Dianthus caryophyllus L.) se aproximan a los reportados en el IFW obtenido en papa de 2 μg/mL (18).
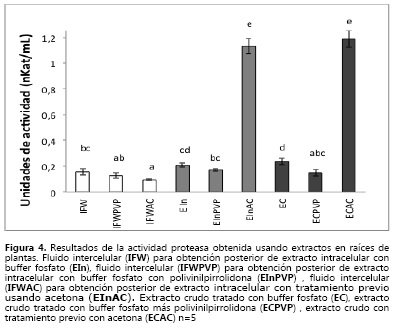
La Figura 4 corresponde a la actividad proteasa (PRT) determinada en los diferentes extractos obtenidos de las raíces de clavel. Se observó actividad tanto en los extractos intracelulares (EIn) que corresponden al simplasto, como en los extractos extracelulares (IFW) correspondientes al apoplasto. En el fluido de lavado intercelular (IFW, IFW-PVPP e IFW-AC), se presentaron diferencias significativas, aunque no entre todos los tratamientos. Cuando se comparan los tres tratamientos de extracción evaluados en el material vegetal sobrante (EIn), luego de extraer el fluido de lavado intercelular, y en el tejido total de las raíces (EC), se observó que la actividad más alta corresponde al extracto obtenido con un tratamiento previo de lavados con acetona (EIn-AC). Este hecho se atribuye a que el tratamiento con acetona puede estabilizar la enzima o permite obtener un extracto más puro de esta, debido a la reducción de agua y de pigmentos de la planta (31-33).
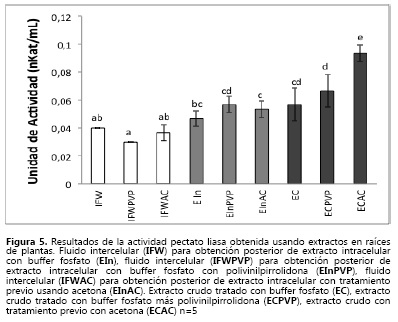
Se encontraron valores similares (Figura 5) en la actividad pectato liasa (PL) en los diferentes extractos, a excepción del extracto crudo tratado previamente con polvos de acetona (EC-AC), en donde la actividad fue estadisticamente mayor, debido a la extracción del contenido total de la célula y a una posible estabilización de la enzima con este tratamiento (32, 33), hecho que no se presenta al realizar el mismo tratamiento al material residual luego de extraer el IFW. De las enzimas analizadas, esta es la única que presenta aumento de actividad por la adición de PVPP al buffer de extracción, aunque, si se compara con el método que usa solamente el buffer, no se presentan grandes diferencias.
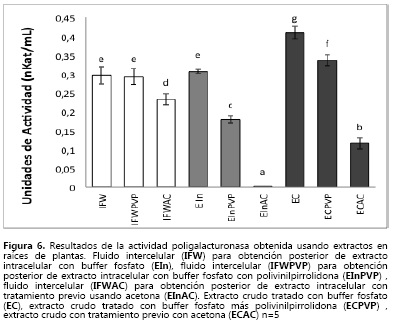
La actividad poligalacturonasa (PG) (Figura 6) se observó en todos los extractos trabajados (IFW, EIn y EC) De acuerdo a lo esperado, la actividad en el IFW no presentó mayores diferencias, sus valores son similares a los obtenidos en el extracto intracelular (EIn) y en el extracto total (EC) En la extracción de la enzima PG intracelular (EIn y EC) el tratamiento que mejor funcionó fue el que utilizó buffer fosfatos, mientras que la actividad más baja se presentó en los extractos que fueron tratados previamente con acetona (EIn-C y EC- C) Esto podría indicar que con dicho tratamiento no se estabiliza la enzima ni se extrae, más bien podría desnaturalizarla Los mayores valores de actividad para la enzima se obtuvieron en el EC obtenido con buffer fosfatos, cuando se le adicionó PVPP.
El uso de acetona y PVPP en el extracto crudo y en el extracto intracelular disminuye la actividad de la enzima (PG) Esto indica que estos tratamientos, comúnmente empleados para eliminar compuestos fenólicos interferentes, no son efectivos pues afectan la estabilidad del extracto y, por lo tanto, la cantidad de enzima.
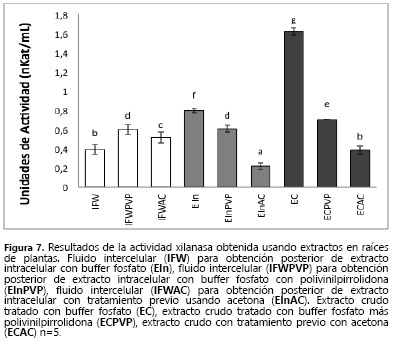
Para la enzima xilanasa (XL) (Figura 7) se presentó un comportamiento similar de los extrantantes al observado en el caso de la PG (Figura 6), es decir, los mayores niveles de actividad se presentaron cuando se realizó la extracción con buffer fosfato y los menores cuando se utilizó acetona. Lo que indica que estos tratamientos para eliminar compuestos fenólicos interferentes afectan la estabilidad (23, 33), y por lo tanto la cantidad de enzima o presentan interferencias en el método de detección. La mayor actividad encontrada para la enzima de estudio en el extracto crudo tratado con buffer fosfatos (EC) concuerda aproximadamente, con la suma de las actividades entre el fluido intercelular (IFW) y el extracto intracelular tratado con buffer fosfatos (EIn). Para las muestras tratadas con PVPP y acetona no se observa esta concordancia, lo que indica pérdidas en la extracción a partir del tejido total. Los métodos de extracción empleados para cada tejido presentaron diferencias estadísticas, comportamiento que no había sido observado en las demás enzimas donde la extracción con buffer fosfatos y buffer fosfatos + PVPP presentaron niveles semejantes.
Los resultados anteriores indican que el tratamiento previo con acetona a las raíces de clavel, si bien favorece la extracción de PRT, en otros casos genera una notable disminución de la actividad. El PVPP disminuye la actividad de las enzimas PG y XL y, en menor grado, para las enzimas PRT y PL si se compara con el tratamiento que usa únicamente buffer fosfato. Sin embargo, esta disminución es menor que cuando se utiliza acetona.
Estos resultados son un aporte para la selección de una metodología de extracción para una enzima específica, a partir de raíces de clavel. Sin embargo, si el interés estádirigido al estudio de las cuatro enzimas simultáneamente, se recomienda el uso del buffer fosfatos como extractante, pues permite la obtención de varias enzimas en un único paso y, así, un análisis comparativo de actividad enzimática.
Es importante destacar que en este estudio se reportan por primera vez los niveles de actividad para las enzimas líticas PRT, PL, PG y XL en raíces clavel, tanto en el apoplasto como en el simplasto.
En el IFW se encuentran diferentes niveles de actividad para las enzimas estudiadas, los mayores son para PG, XL y PRT y el más bajo lo presenta la enzima PL. Estas enzimas están también intracelularmente presentes con niveles que varían de acuerdo al método de extracción. Estos niveles de actividad pueden tener variación cuando un patógeno ingresa a la planta y utiliza estas mismas enzimas en el proceso de colonización (8).
Conclusiones
Con los resultados presentados en el artículo, se determinaron los efectos de diferentes soluciones extractantes en la actividad de las enzimas PG, PL, XL ,PRT, presentes en el simplasto de raíces de clavel. Se aconsejó una metodología sencilla y poco contaminante que permite la extracción de las cuatro enzimas estudiadas en un único paso y así determinar comparativamente niveles de actividad. Se seleccionó una metodología para extraer el IFW en el mismo tejido, con mínima contaminación del contenido intracelular. Se determinaron los niveles de las cuatro enzimas en el apoplasto, en el simplasto y en el extracto total de raíces de clavel.
Agradecimientos
Las autoras agradecen a la Universidad Nacional de Colombia, Facultad de Ciencias, y a la División de Investigación quien apoyó el desarrollo del trabajo, a través del proyecto aprobado con código HERMES 20692.
Referencias
1. Regalado, A.P; Ricardo, P.P. Study of the intercellular fluid of healthy lupinus albus organs. Plant Physiol. 1996, 110, 227-232. [ Links ]
2. Lagaert, S.; Belién, T.; Volckaert, G,. Plant cell walls: Protecting the barrier from degradation by microbial enzymes. Semin. Cell Dev. Biol. 2009, 20 (9),1064-1073. DOI: http://dx.doi.org/10.1016/j.semcdb.2009.05.008. [ Links ]
3. Vorwerk S.; Somerville S.; Somerville C. The role of plant cell wall polysaccharide composition in disease resistence. Trends Plant Sci. 2004, 9 (4), 203-209. DOI: http://dx.doi.org/10.1016/j.tplants.2004.02.005. [ Links ]
4. Cantu. D.; Vicente. A.R.; Greve. L.C; Dewey. F.M.; Bennett. A.B.; Labavitch. J.M.; Powell. A.LT. The intersection between cell wall disassembly, ripening, and fruit susceptibility to Botrytis cinerea Proc. Natl. Acad. Sci. U.S.A. 2008, 105 (3), 859-864. DOI: http://dx.doi.org/10.1073/pnas.0709813105. [ Links ]
5. Mendoza-Rodríguez, M.; Sánchez, R.A.; Leiva, M.M.; Acosta, S.A.; Rojas, L.; Jiménez, E.; Portal, O. Extraccion de proteínas a partir del fluido intercelular en hojas de banano, cultivar 'Grande naine' (Musa AAA). Biotecnol. Veg. 2006, 6 (1), 59-62. [ Links ]
6. Delaunois, B.; Jeandet, P.; Clément, C.; Baillieul, F.; Dorey, S.; Cordelier S Uncovering plant-pathogen crosstalk through apoplastic proteomic studies Front Plant Sci 2014, 5, 18 DOI: http://dx.doi.org/10.3389/fpls.2014.00249. [ Links ]
7. Reignault, Ph; Valette-Collet, O; Boceara, M The importance of fungal pectinolytic enzymes in plant invasion, host adaptability and symptom type. Eur. J. Pathol. 2008, 720,1-11. DOI: http://dx.doi.org/10.1007/sl0658-007-9184-y. [ Links ]
8. Ramírez. V. E. Evaluación de los niveles de actividad y transcripcionales in vivo de algunas enzimas hidrolíticas secretadas por Fusarium oxysporum f.sp. dianthi en su interacción con el clavel Dianthus caryophyllus L. Tesis de Maestría, Universidad Nacional de Colombia, Facultad de Ciencias, Departamento de Química. 2014. [ Links ]
9. Collmer, A.; Keen, N.T. The role of pectic enzymes in plant pathogenesis. Annu. Rev. Phytopathol. 1986, 24, 383-409. DOI: http://dx.doi.org/10.1146/annurev.py.24.090186.002123. [ Links ]
10. Walton, ID. Deconstructing the Cell Wall'. Plant Physiol. 1994, 104 (4), 1113-1118. DOI: http://dx.doi.org/doi:10.1104/pp.104.4.1113. [ Links ]
11. De Lorenzo, G.; Castoria, R.; Bellincampi, D.; Cervone, F. Fungal invasion enzymes and their inhibition. In The mycota V Plant relationships; Carroll C., Tudzynski R. Eds.; Springer Berlin Heidelberg, 1997; 61-83. DOI: http:// dx.doi.org/10.1007/978-3-662-10370-8_5. [ Links ]
12. Vorwerk, S.; Somerville, S.; Somerville, C. The role of plant cell wall polysaccharide composition in disease resistance. Trends Plant Sci. 2004, 9 (4). 203-209. DOI: http://dx.doi.org/10.1016/j.tplants.2004.02.005. [ Links ]
13. Silipo, A.; Erbs, G.; Shinya, T.; Dow, J.M.; Parrilli, M.; Lanzetta, R. et al. Glycoconjugates as elicitors or suppressors of plant innate immunity. Glycobiology 2010, 20, 406-419. DOI: http://dx.doi.org/10.1093/glycob/cwp201. [ Links ]
14. Franková, L.; Fry, S.C. Biochemistry and physiological roles of enzymes that 'cut and paste' plant cell-wall polysaccharides. J. Exp. Bot. 2013, 64, 3519-3550. DOI: http://dx.doi.org/10.1093/jxb/ert201. [ Links ]
15. Minic, Z.; Jouanin, L. Plant glycoside hydrolases involved in cell wall polysaccharide degradation. Plant Physiol Bioch. 2006, 44 (7-9), 435-449. DOI: http://dx.doi.org/10.1016/j.plaphy.2006.08.001. [ Links ]
16. Oviedo, H.I. Los oligogalacturonidos de origen péctico y su accion en las plantas. Tema de cienc. y tecnol. 2009, 39 (13), 31-40. [ Links ]
17. Hoorn, R.A. Plant proteases: from phenotypes to molecular mechanisms. Annual Rev Plant Pathol. 2008, 59, 191-223. DOI: http://dx.doi.org/10.1146/annurev.arplant.59.032607.092835. [ Links ]
18. Olivieri, F; Godoy, A V; Escande, A; Casalongué, A C; Analysis of intercellular washing fluids of potato tubers and detection of increased proteolytic activity upon fungal infection. Physiol Plant. 1998, 104 (2), 232-238. DOI: http://dx.doi.org/10.1034/j.1399-3054.1998.1040211.x. [ Links ]
19. Van Pelt-Heerschap, H.; Smit-Bakker, O. Analysis ofdefense-related proteins in stem tissue of carnation inoculated with a virulent and avirulent race of Fusarium oxysporum f.sp. dianthi. Eur. J. Plant Pathol. 1999, 105, 681-691. DOI:http://dx.doi.org/10.1023/A:1008767830202. [ Links ]
20. Zor. T.; Selinger. Z. Linearization of the bradford protein assay increases its sensitivity: theoretical and experimental studies. Anal Biochem. 1996, 236 (2), 302-308. DOI: http://dx.doi.org/10.1006/abio.1996.0171. [ Links ]
21. Ardila, H.; Higuera, B.L. Induccion diferencial de polifenoloxidasa y β-1.3- glucanasa en clavel (Dianthus caryophyllus) durante la infeccion por Fusarium oxysporum f. sp. dianthi raza 2. Acta Biol. Colomb. 2005, 10 (2), 61-74. [ Links ]
22. Ardila, H; Baquero B; Martínez S. Induccion de la actividad de la enzima fenilalanina amonio liasa en clavel (Dianthus caryophyllus L) por elicitores del hongo Fusarium oxysporum f. sp. Dianthi raza 2. Rev Colomb. Quim. 2007, 36 (2), 151-167. [ Links ]
23. Cuervo, D C; Martínez, S T; Ardila, H D; Higuera, B L. Inducción diferencial de la enzima peroxidasa y su relación con lignificación en los mecanismos de defensa del clavel (Dianthus caryophyllus L.) durante su interacción con Fusarium oxysporum f. sp. Dianthi. Rev. Colomb. Quim. 2009, 38 (3) 379-393. [ Links ]
24. Boller, T.; Kende, H. Hydrolytic enzymes in the central vacuole of plant cells. Plant Physiol. 1979, 63, 1123-1132. DOI: http://dx.doi.org/10.1104/pp.63.6.1123. [ Links ]
25. Hübner, U.; Bock, U.; Schügerl, K. Production of alkaline serine protease subtilisin Carlsberg by Bacillus licheniformis on complex medium in a stirred tank reactor. Appl icrobiol Biotechnol. 1993, 40 (2), 182-188. [ Links ]
26. Parra L. F. Estudio de enzimas que participan en la infección Fusarium-Clavel. Purificación y caracterización parcial de poligalacturonasa (EC 3 2 1 15) y pectato liasa Bibliografía 153 (EC. 4.2.2.2.).Tesis de grado, Universidad Nacional de Colombia. Facultad de Ciencias, Departamento de Química, 2001. pp 26-28. [ Links ]
27. Nelson, N. A photometric adaptation of the somogyi method for the determination of glucose. J Biol Chem. 1944, 153, 375-380. [ Links ]
28.Somogyi, M. Notes on sugar determination. J. Biol. Chem. 1952, 195, 19-23. [ Links ]
29. Tagawa, K.; Kaji, A. Polygalacturonase from Corticium rolfsii. Methods Enzymol. 1988, 161, 361-366. DOI: http://dx.doi.org/10.1016/0076-687988)61041-X. [ Links ]
30. Terry, M.E; Bonner. B.B. An examination of centrifugation as a method of extracting an extracellular solution from peas, and its use for the study of indoleacetic acid-induced growth. Plant Physiol. 1980, 66, 321-325. DOI: http://dx.doi.org/10.1104/pp.66.2.321. [ Links ]
31. Adulyatham, P.; Owusu-Apenten, R. Stabilization and partial purification of a protease from ginger rhizome (Zingiber offinale Roscoe). J. Food Sci. 2005, 70, C231-C234. DOI: http://dx.doi.org 10.1111 j.1365-2621.2005.tb07130.x. [ Links ]
32. Takemori, S.; Furuya, E.; Suzuki, H.; Katagiri, M. Stabilization of enzyme activity by an organic solvent. Nature 1967, 215, 417-419. DOI: http://dx.doi.org/10.1038/215417a0. [ Links ]
33. Fishman, A.; Levy, I.; Cogan, U.; Shoseyov, O. Stabilization of horseradish peroxidase in aqueous-organic media by immobilization onto cellulose using a cellulose-binding-domain. J Mol Catal. B: Enzym. 2002, 18. 121-131. [ Links ]