Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Acta Agronómica
Print version ISSN 0120-2812
Acta Agron. vol.61 no.4 Palmira Oct./Dec. 2012
1Docente investigador, Departamento de Ingeniería Agronómica y Desarrollo Rural, Facultad de Ciencias Agrícolas. Líder Grupo de Investigaciones en Agricultura Sostenible. 2Docente Investigador, Departamento de Biología, Facultad de Ciencias Básicas. Grupo de Investigaciones en Agricultura Sostenible. 3Docente investigador, Departamento de Ingeniería Agronómica y Desarrollo Rural, Facultad de Ciencias Agrícolas. Grupo de Investigaciones en Agricultura Sostenible. Universidad de Córdoba, Carrera 6 No.76-103, Código Postal 354, Montería, Córdoba, Colombia. *Autor para correspondencia: jbarrera11@gmail.com; †luisoviedo59@hotmail.com; ‡lahortaliza@yahoo.com
En el trabajo se evalúo el efecto de la aplicación de tres géneros nativos de micorrizas vesículo arbusculares sobre el crecimiento de plantas de plátano Hartón (Musa AAB Simmonds) en etapa de vivero. Las cepas se obtuvieron de la colección del Laboratorio de Fitopatología de la Universidad de Córdoba, las cuales fueron aisladas de cultivos de plátano en los municipios de Lorica, Los Córdobas y San Bernardo del Viento. Se utilizó el diseño experimental completamente al azar, con seis tratamientos (T): Glomus sp. (T1), Acaullospora sp. (T2), Scutellospora sp. (T3), una combinación de los géneros Glomus, Acaullospora y Scutellospora (T4), un tratamiento químico de fosfato diamónico, DAP (T5) y un control absoluto (T6), con diez repeticiones por tratamiento. Los resultados mostraron que con la combinación de géneros de micorrizas (T4) se obtuvo un mayor número de esporas y un porcentaje más alto de infección, seguido de los tratamientos T1, T3 y T2. Además, con esta combinación se encontraron diferencias significativas en diámetro del pseudotallo, relación de área foliar:peso fresco y seco de raíz, en comparación con los demás tratamientos. El área foliar y la longitud de raíz fueron más altos en el tratamiento T5.
Palabra clave: Acaullospora sp., agricultura sostenible, Glomus sp., inóculo, Scutellospora sp.
The objective was to evaluate the effect of three vesicular arbuscular Mycorrhizal native genera application on growth of Hartón plantain plants in nursery stage. The strains were obtained at Universidad de Córdoba from the Plant Pathology Laboratory collection, which were isolated from plantain crops in Lorica, Los Córdobas and San Bernardo del Viento. A completely randomized experimental design with six treatments (T) was used: Glomus sp. (T1), Acaullospora sp. (T2), Scutellospora sp. (T3), a genera combination of Glomus, Acaullospora and Scutellospora (T4), a chemical treatment (diammonium phosphate, DAP, T5) and absolute control (T6), with ten replicates per treatment. Results showed that more spores obtained and larger infection percentage with the combination of mycorrhizae genera (T4), followed by T1, T3 and T2 treatments. Besides the above, with the combination of mycorrhizal genera, they were obtained significant difference compared with other treatments in regard to pseudostem diameter, leaf area ratio:fresh and dry weight of root. Regarding to leaf area and root length, T5 treatment showed the higher measurements.
Key words: Acaullospora sp., Glomus sp., inoculum, Scutellospora sp., sustainable agriculture.
Las micorrizas pueden ser consideradas como organismos formados por la raíz de una planta y el micelio de un hongo. Absorben nutrientes y agua y se extienden en el suelo proporcionando estos elementos a las plantas, a la vez que las protegen de algunas enfermedades. Las micorrizas vesículo-arbusculares (MVA) constituyen el tipo más común de asociación micorrícica que son capaces de establecer simbiosis mutualísticas con las raíces de la mayoría de especies de interés agrícola, formando parte del microcosmos biológico que reside en el suelo (Sánchez, 2007). En la interacción planta-microorganismo del suelo se consideran tres tipos de relación: patogenicidad, neutralidad y simbiosis. Los hongos formadores de micorrizas arbusculares (MA) y las rizobacterias o bacterias promotoras del crecimiento vegetal (PGPR o PGPB) pertenecen a este último grupo, ya que contribuyen positivamente al favorecer la nutrición y crecimiento de las plantas, al tiempo que pueden funcionar como agentes de control biológico eficaces frente a patógenos (Jaizme y Rodríguez, 2004). La infección de la micorriza produce cambios físicos, bioquímicos y fisiológicos en las raíces colonizadas que conducen a un mejor estado general de la planta y contribuyen a aliviar las situaciones de estrés vegetal de carácter abiótico por ejemplo metales pesados y salinidad, entre otros y bióticos como compensación de daños, activación de mecanismos de defensa, y cambios microbianos en la rizófora (Barea et al., 1997). Estos efectos tienen un significado adicional en suelos tropicales, semiáridos y marginales, donde estos hongos son el principal recurso, tanto para la conservación de los ecosistemas como para la producción (Janos, 1987).
En la naturaleza, los hongos micorrícicos son parte integral de las plantas de cultivos, entre ellas el plátano, asegurando su crecimiento en distintas condiciones y ambientes. Las micorrizas inciden en el cultivo para su óptimo crecimiento en suelos con determinados niveles de fertilidad. Los efectos de estos microorganismos tienen consecuencias sobre el desarrollo y la nutrición y, además, pueden incrementar la resistencia natural de las plantas en situaciones de desequilibrios bióticos o abióticos (Domínguez et al., 2004). En el cultivo de banano se ha demostrado la alta eficiencia de las micorrizas en condiciones controladas y se emplean en la mayoría de materiales micropropagados (Rizzardi, 1990; Declerck et al., 1994, 1995; Jaizme y Azcón, 1995; Yano-Melo et al., 1999).
Alvear et al. (2006) consideran que las aplicaciones de pesticidas inciden negativamente en la actividad biológica de los suelos. En el departamento de Córdoba, Colombia, la aplicación no controlada de fertilizantes y otros agroquímicos ha ocasionado reducción en la fertilidad de los suelos, efectos negativos en la estabilidad estructural, y la microbiota, lo que afecta la producción de plantas de interés agrícola. No obstante esta problemática en este departamento son pocos los estudios enfocados en multiplicar y aplicar hongos micorrícicos nativos en cultivos de plátano; aunque existen estudios orientados específicamente a estimar la diversidad de micorrizas arbusculares (Corcho y Urrea, 2006) y en la relación poblacional de micorrizas asociadas con este cultivo, sus efectos en las propiedades fisicoquímicas del suelo (Novoa et al., 2006) y en la relación micorrizas arbusculares y nematodos presentes en la rizósfera del cultivo (González y Paternina, 2008). El objetivo de la presente investigación fue evaluar los efectos de la inoculación de diferentes géneros de micorrizas nativas y la aplicación de un fertilizante químico sobre algunas variables morfo-fisiológicas de la planta de plátano Hartón en estados tempranos del crecimiento.
El estudio se realizó en el vivero de la Universidad de Córdoba, Montería, Colombia, a 8° 48' N y 75° 58' O. Se evaluaron cepas nativas de géneros de micorrizas vesículo-arbusculares (MVA) en el Laboratorio de Fitopatología de la Universidad de Córdoba, procedentes de fincas productoras del clon de plátano Hartón (Musa AAB) en los municipios de Lorica, Los Córdobas y San Bernardo del Viento, que presentan abundancia de micorrizas, de acuerdo con estudios realizados por Barrera (2005) y Álvarez y Villadiego (2005).
La obtención de las esporas se realizó en dos fincas productoras de plátano en los municipios anteriormente mencionados. En cada una de ellas se tomaron 10 muestras de suelo rizosférico a 0.60 m de distancia del cormo de la planta y a una profundidad de 0.20 m, las cuales fueron homogeneizadas y empacadas en bolsas plásticas de 1 kg de capacidad con su respectiva etiqueta. En total se tomaron 40 muestras que fueron trasladadas en neveras de icopor para posterior aislamiento en el laboratorio, donde se procesó el sistema radical del hospedero y del sustrato, mediante el método modificado de Ohms y Jenkins (1964).
En las muestras de suelo con raíces fueron aisladas e identificadas las micorrizas a nivel morfológico, teniendo en cuenta la forma de la espora, la conexión hifal, número de paredes celulares y color, mediante la clave pictórica de Schenck y Pérez (1990). También se evaluó la colonización micorriza-raíz realizando montajes para observar en microscopio el grado de colonización interna por parte de las hifas en el tejido vegetal, así como la formación de arbúsculos y vesículas, de acuerdo con la metodología de Sieverding (1983).
Para la multiplicación de esporas se tomó 1 kg de inóculo del sustrato obtenido en c ada fi nca. L a m ultiplicación s e h izo en vivero, en tres parcelas de 1 x 1 m empleando como hospedero el pasto Brachiaria decumbens, que se estableció en una mezcla de suelo arena:limo (1:1). Este proceso de multiplicación se mantuvo por un periodo de 120 días para obtener los inóculos y evaluar la eficiencia de los géneros nativos de micorrizas, siendo seleccionados aquellos que presentaron una etapa de madurez avanzada y una mejor morfología.
Para el bioensayo se utilizó un diseño completamente al azar, con seis tratamientos y 10 repeticiones. Los tratamientos fueron: T1 = Glomus sp. (G), T2 = Acaullospora sp. (A), T3 = Scutellospora sp. (S), T4 = combinación de los géneros Glomus, Acaullospora y Scutellospora (G + A + S), T5 = químico o relativo (aplicación de 40 g/planta de fosfato diamónico (DAP), y T6 = control absoluto.
La unidad experimental consistió en un cormo de plátano Hartón sembrado a 10 cm de profundidad, en una bolsa plástica de 8 kg de capacidad, con suelo previamente esterilizado y analizado químicamente. A cada bolsa se le inocularon 60 esporas de micorrizas para los tratamientos T1, T2 y T3, y 20 esporas de cada género para el tratamiento T4. Se efectuaron mediciones de longitud y diámetro de las plantas cada 15 días después de la inoculación. Cuatro meses luego de la inoculación se hicieron mediciones del peso fresco y seco, longitud de la raíz, área foliar con integrador de área foliar Li-Cor Li-3100, cálculo de la relación de área foliar (área foliar/materia seca total), número de esporas de micorrizas en el suelo y la planta, y porcentaje de colonización de las micorrizas en las raíces. Los datos obtenidos fueron sometidos a un análisis de varianza (Anava) y una prueba de comparación de medias de Tukey (a = 0.05) implementado en software SAS univariate versión 9.1 (SAS Institute Inc., 2004).
Longitud del pseudotallo
Para esta característica no se encontraron diferencias (P > 0.05) entre los tratamientos T1, T2, T3, T4 y T5. En todos los casos, con excepción del control absoluto, T6, las plantas presentaron una longitud del pseudotallo similar a medida que transcurrió su ciclo vegetativo (Figura 1), lo que sugiere que las plantas y las micorrizas establecieron simbiosis permitiendo a estas últimas la absorción de nutrientes que contribuyeron a promover el crecimiento de las plantas, además, el efecto benéfico en el crecimiento y desarrollo vegetativo de las plantas inoculadas con las MVA, solas o combinadas, se expresa mejor a través del tiempo (Cano, 2001; González y Cuenca, 2008). En este caso, entre los principales nutrientes que fueron absorbidos por las plantas inoculadas, posiblemente se encuentran el fósforo y el nitrógeno ya que son componentes importantes del DAP (T5), que resultó estadísticamente igual a los tratamientos que recibieron la aplicación de MVA. Según Marschner y Dell (1994) y Smith y Read (1997) los resultados anteriores están basados en el traslado de carbohidratos de la planta hacia el hongo y de nutrientes absorbidos por el hongo hacia la planta (Figura 1).
Diámetro del pseudotallo
En el Cuadro 1 se observa que no se encontraron diferencias (P > 0.05) entre tratamientos. Sólo 30 días después de la inoculación con micorrizas en el tratamiento T4 (combinación de géneros de MVA) se presentó un mayor promedio para esta variable, seguido del tratamiento T1 (Glomus sp.). Lo anterior comprueba que la micorrización temprana contribuye, a través del aprovechamiento más eficiente de ciertos nutrientes, a un mejor desarrollo de la planta, lo que permite además la reducción del estrés vegetal con los consecuentes beneficios en la fase de vivero de plantas de plátano (Chagüezá, 2011) con diferentes procedencias (Jaizme y Rodríguez, 2004).
Es posible que la rápida adaptación de las plantas a las condiciones del sustrato, especialmente al pH de 5.63, favoreció el desarrollo de los géneros nativos de Glomus sp. y Scutellospora sp., ya que según Guerrero et al. (1996) los valores óptimos de éste varían entre 5.5 y 6.5.
En el periodo entre 45 y 120 días no se presentaron diferencias en el diámetro del pseudotallo entre tratamientos, no obstante los tratamientos inoculados con micorrizas, T1 (Glomus sp.), T2 (Acaullospora sp.), T3 (Scutellospora sp.), T4 (combinación de géneros de MVA) y T5 (aplicación de DAP) superaron al control absoluto sugiriendo la importancia de la MVA en el crecimiento del plátano. Resultados obtenidos en banano (Musa AAA) por Jaizme et al. (2004) demostraron que el efecto de la micorrización sobre el desarrollo vegetal se mantiene durante la fase de vivero, aún bajo régimen de fertilización comercial.
Pesos húmedo y seco de raíces
Los pesos húmedo y seco de las raíces presentaron diferencias (P < 0.05) entre tratamientos (Cuadro 2). Los tratamientos con inoculación de micorrizas superaron en general al tratamiento con aplicación de fertilizante (T5) y al control absoluto (T6), destacándose el tratamiento T4 (combinación de géneros de MVA) donde se registraron mayores valores. Los resultados demuestran la efectividad de las micorrizas arbusculares sobre el crecimiento radical y coinciden con los de Usuga-Osorio et al. (2008) quienes observaron la mayor asociación micorrícica de las plantas cuando se utilizó inóculo nativo procedente del mismo agroecosistema del cultivo de banano. Sánchez y Sieverding (1999) consideran que la absorción de iones menos móviles, como el fósforo, depende del volumen de suelo explorado por el sistema de raíces absorbentes. En este caso la raíz micorrizada tiene ventaja sobre la no micorrizada porque el micelio externo se extiende a mayor distancia que los pelos radicales absorbentes, lo cual favorece el crecimiento y la producción de materia seca.
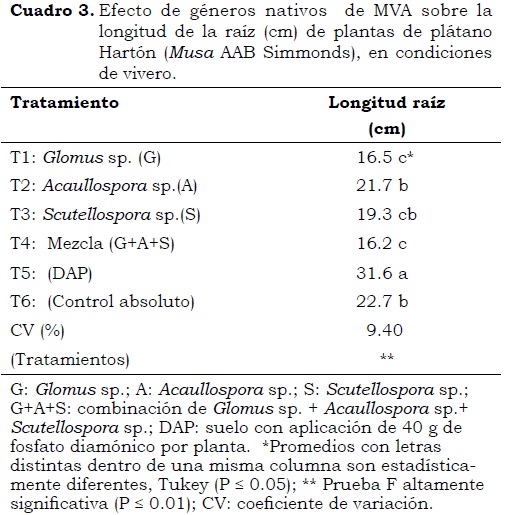
Longitud de raíces
Para esta característica se encontraron efectos significativos (P < 0.05) entre tratamientos. En el Cuadro 3 se observa que en el tratamiento T5 (aplicación de DAP) se presentaron los mayores crecimientos, seguido del tratamiento T6 (control absoluto), lo que sugiere una baja relación entre la micorrización y la longitud de raíz de las plantas de plátano. Elsen et al. (2001) observaron resultados similares en trabajos con banano e indicaron que en el establecimiento de la simbiosis, las micorrizas colonizan biotróficamente la corteza de las raíces y desarrollan un micelio por fuera de la matriz, lo que ayuda a la planta a absorber de manera más eficiente agua y nutrientes, sin extender su longitud radical. Estos mismos autores indican que cuando la colonización micorrízica no es eficiente, se presentan efectos negativos o neutrales sobre el crecimiento radical. Por el contrario, Jaizme y Rodríguez (2004) observaron efectos significativos en el incremento de la longitud de la raíz en Musa AAA clon Gran Enano, con respecto al control sin inoculación con MVA, lo que permitió raíces más densas, con mayor poder de absorción de nutrientes y capacidad de explorar horizontes fértiles, así como un mejor anclaje de la planta. Lo anterior, según Elsen et al. (2001) y Declerck et al. (1995) indica que la micorrización es más efectiva y no depende de especies, variedades y cultivares.
Área foliar
El valor más alto de área foliar (P < 0.05) se encontró en las plantas del tratamiento T5 (aplicación de DAP) (Cuadro 4), seguido del tratamiento T4 (combinación de esporas de micorrizas) Estos resultados muestran que este último tratamiento presentó mejor adaptación al sustrato en comparación con los demás géneros que se inocularon individualmente, por lo que son una buena alternativa para la obtención de mejores plantas de plátano en suelos con bajos contenidos de fósforo y materia orgánica, como es el caso de la región cafetera de Colombia, donde se recomienda aplicar mezclas de hongos micorrizógenos de los géneros Glomus, Acaulospora y Entrophosforase con la siembra del cultivo del plátano (Ruiz et al., 2006).
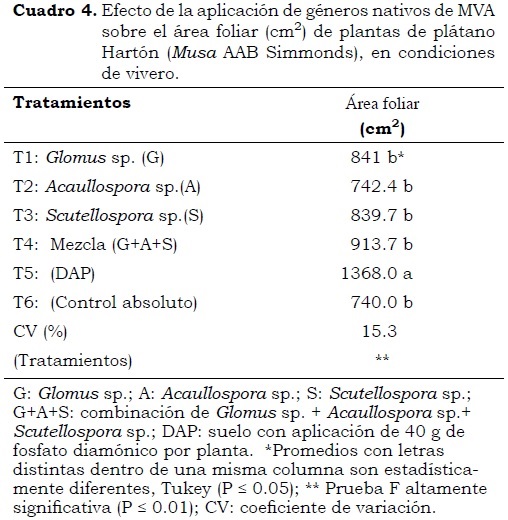
En el mismo Cuadro 4 se observa que las plantas inoculadas con los géneros Glomus (T1), Acaullospora (T2) y Scutellospora (T3) presentaron valores de área foliar superiores a las del control absoluto (T6), lo que indica que la simbiosis con micorrizas produce cambios físicos, bioquímicos y fisiológicos en las raíces colonizadas que conducen a un mejor estado general de las plantas y sus diferentes órganos (Barea et al., 1997). Esto es importante en el caso de las plantas de plátano por sus características especiales como especie perenne que debe pasar por una etapa inicial de desarrollo del sistema radicular necesario para los procesos de absorción, y hojas con adecuada superficie foliar para la fotosíntesis (Cayón et al., 1998). Como se sabe, la aplicación de hongos micorrícicos arbusculares favorece el desarrollo de esta superficie en cultivos micotróficos, como plátano y banano, lo que mejora la eficiencia fotosintética de las hojas y aumenta el crecimiento de las plantas.
Relación área foliar:peso foliar
La relación entre área (cm2) y peso (g) foliar fue diferente entre tratamientos (P < 0.05) (Cuadro 5). Esta relación fue más alta en plantas en el T4 (combinación de géneros de MVA) debido a que los hongos MVA, además de su efecto directo en la nutrición de las plantas, inducen cambios fisiológicos mediante los cuales aumenta la proporción de materia seca total de la planta que es convertida en lámina foliar (Jarma et al., 1999) y las tasas fotosintética y de fijación de carbono (Blanco y Salas, 1996).
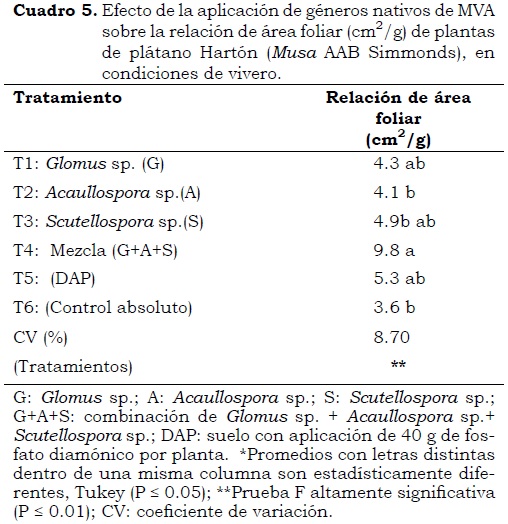
Es necesario resaltar que el desarrollo de las plantas en todos los tratamientos micorrizados superó a las plantas en el testigo absoluto e igualó a las que recibieron el tratamiento químico (Cuadro 5) lo cual, según Thaker y Jasrai (2002), se debe al mejoramiento del sistema fisiológico de la planta, especialmente en la fase de vivero. Leigh et al. (2009) consideran que los beneficios de los hongos micorrícicos en cultivos vegetales están estrechamente relacionados con un mejor aprovechamiento de los nutrientes y agua del suelo, mediante complejas interacciones que se establecen entre las estructuras de estos microorganismos y las raíces de las plantas hospederas.
Número de esporas de micorrizas
El mayor número de esporas se observó en plantas del T4 (Figura 2). En los tratamientos de aplicación individual de MVA se destacó el T1 (Glomus sp.) con un mayor número de esporas, lo que evidencia que este género se encuentra ampliamente distribuido en estos suelos, independientemente del grado de fertilidad (Guerrero et al., 1996). Este autor señala que Glomus tiene un amplio rango de adaptación a diferentes condiciones abióticas, entre ellas pH entre 5.0 y 6.5. Por su parte Sánchez y Sieverding (1999) y Sánchez (2007) encontraron resultados similares a los de la presente investigación y observaron que el género Glomus es altamente infectivo, con una alta adaptabilidad a diversas condiciones de suelo.
Porcentaje de colonización de las micorrizas
En esta característica, nuevamente las plantas en el tratamiento T4 mostraron el mayor valor promedio, 91.1% (Figura 3). El tratamiento con Glomus sp. (T1) presentó mayor capacidad infectiva y de formación de estructuras especiales de forma individual, con 90% de colonización. Los tratamientos con Acaullospora sp. (T2) y Scutellospora sp. (T3) mostraron porcentajes de colonización de 72.5 y 78.3%, respectivamente.
Lo anterior concuerda con la efectividad de las micorrizas y la adaptación de Glomus sp. a diferentes condiciones del sustrato (Barea, 1997). El alto porcentaje de colonización micorrícico demuestra que existe una simbiosis efectiva entre los tratamientos inoculados y las plantas de plátano Hartón. Los valores en este estudio son más altos que los hallados por Usuga-Osorio et al. (2008) quienes observaron una asociación general expresada en porcentaje de 37.76 ± 21.86% en diferentes tipos de plantas, incluyendo banano, cultivadas en diferentes sustratos. Por otra parte Jaizme y Azcón (1995) hallaron valores de 71% y 74% de colonización para Glomus manihotis y Glomusintra radices, respectivamente.
- Las plantas de plátano clon Hartón en estadios tempranos del crecimiento en fase de vivero presentaron simbiosis con la combinación de micorrizas vesículo arbusculares nativas de los géneros Glomus, Acaullospora y Scutellospora, lo que resultó en mayor número de esporas y mayor porcentaje de colonización de raíces.
- El porcentaje de colonización más alto con la inoculación de micorrizas nativas individuales se obtuvo con el género Glomus.
- La proporción de materia seca total de las plantas de plátano Hartón en fase de vivero que se convierte en hojas, medida a través de la relación de área foliar, es favorecida con la aplicación de micorrizas nativas. El área foliar de la planta es estimulada por la aplicación de fosfato diamónico (DAP), aunque la aplicación combinada de géneros nativos de MVA (T4) presentó mejor adaptación a las condiciones del sustrato en comparación con los demás géneros, que se inocularon individualmente, por tanto es una alternativa para la obtención de buenas plantas de plátano en suelos de baja fertilidad.
- Las variables longitud, pesos seco y húmedo de la raíz, fueron afectadas de forma positiva por las aplicaciones de micorrizas, en comparación con la aplicación de DAP y el control absoluto.
Los autores expresan sus agradecimientos a los Directores del proyecto de investigación: Evaluación e Implementación de Alternativas de Producción Orgánica en Plátano y Banano en Córdoba y Urabá; a los biólogos Henry Peinado, Elizabeth Regino y Elkin Agámez, por su valiosa colaboración en la toma y tabulación de los datos de la investigación.
Álvarez, A. y Villadiego, X. 2005.Aislamiento e identificación de micorrizas asociadas al cultivo del plátano en las zonas productoras del Alto Sinú (Tierralta y Valencia). Tesis de pregrado para optar al título de Biólogo, Facultad de Ciencias Básicas, Universidad de Córdoba. Colombia. 106 p. [ Links ]
Alvear, M.; López, R.; Rosas, A.; y Espinosa, N. 2006. Efecto de la aplicación de herbicidas en condiciones de campo sobre algunas actividades biológicas. Rev. Ciencia del Suelo y Nutrición Vegetal 6(1):64 - 76. [ Links ]
Barea, J. 1997. Mycorrhiza/bacteria interactions on plant growth promotion. En: Ogoshi, A.; Kabayashi, L.; Homma, Y.; Kodama, F.; Kondon, N.; y Akino, S. (eds.). Plant growth-promoting rhizobacteria, present status and future prospects. OECD. Paris. p. 150 - 158. [ Links ]
Barea, J.; Azcón, R.; y Azcón, C. 1997. Morfología, anatomía y citología de las micorrizas versículoarbusculares. En: Fijación y movilización biológica de nutrientes, volumen 2. En: Olivares, J. y Barea, J.M. (compiladores). Consejo Superior de Investigaciones Científicas, Madrid, España. p. 149 - 173. [ Links ]
Barrera, J. 2005. Especies de micorrizas asociadas al cultivo del plátano en el departamento de Córdoba. En: Evaluación e implementación de alternativas de producción orgánica en plátano y banano. Informe Final. Facultad de Ciencias Agrícolas. Universidad de Córdoba. Montería, Córdoba. p. 52 - 53. [ Links ]
Blanco, F. y Salas, E. 1996. Micorrizas en la agricultura: contexto mundial e investigación realizada en Costa Rica. Agron. Costarricense 2(1):55 - 67. [ Links ]
Cano, T. 2001. Efecto de Glomus fistulosum, Glomus manihotis y Glomus fasciculatum en el crecimiento, desarrollo y nutrición en plantas in vitro de plátano Dominico Hartón y banano Gran Enano. Tesis de grado Universidad Gran Colombiana. Facultad de Ciencias Agropecuarias. 200 p. [ Links ]
Cayón, G.; Belalcázar, S.; y Lozada, J. 1998. Ecofisiología del plátano (Musa AAB Simmonds). Seminario Internacional sobre Producción de Plátano. Armenia, Quindío, Colombia. Memorias. Universidad del Quindío. Comité de Cafeteros del Quindío, SENA, INIBAP, Corpoica. p. 221 - 236. [ Links ]
Corcho, S. y Urrea, L. 2008. Estimación de la diversidad de micorrizas arbusculares en suelos sulfatados ácidos en los municipios de Montería, San Carlos, Cereté y Cienaga de Oro, Departamento de Córdoba. Tesis de Pregrado para optar al título de Biólogo, Facultad de Ciencias Básicas, Universidad de Córdoba. Colombia. 101 p. [ Links ]
Chagüezá, Y. 2011. Alternativas biológicas para el control de nematodos fitoparásitos en el cultivo del plátano. Tesis Magister en Ciencias Agrarias. Línea de investigación Suelos. Universidad Nacional de Colombia, Facultad de Ciencias Agropecuarias. Palmira. 121 p. [ Links ]
Declerck, S.; Devos, B.; Delvaux, B.; y Plenchette, C. 1994.Growth response of micropropagated banana plants to VAM inoculations. Fruits 49(2):103 - 109. [ Links ]
Declerck, S.; Plenchette C.; y Strullu, D. 1995.Mycorrhizal dependency of banana (Musa acuminata AAA group) cultivar. Plant Soil 176:183 - 187. [ Links ]
Domínguez, J.; Planelles R.; Rodríguez, J.; Barreal, J.; y Saiz, A. 2004.Influencia de la micorrización con trufa negra (Tubermelanosporum) en el crecimiento, intercambio gaseoso y nutrición mineral de plántulas de Pinus halepensis. Invest. Agrar: Sist Recur For. 13(2):317 - 327. [ Links ]
Elsen, A.; Declerck, S.; y De Waele, D. 2001. Efecto de tres hongos micorriza arbusculares sobre la infección de Musa con el nematodo nodulador de las raíces (Meloidogyne spp.). Infomusa 11(1):21 - 23. [ Links ]
González, M. y Cuenca, G. 2008. Respuestas de plantas de plátano (Musa AAB cv. Hartón) a la inoculación con hongos micorrízogenos arbusculares nativos e introducidos, bajo condiciones de campo. Revista Fac. Agron. 25:470 - 495. [ Links ]
González, R. y Paternina, V. 2008. Relación de micorrizas arbusculares y nematodos presentes en la rizósfera de cultivos de plátano en los municipios de San Juan de Urabá (Antioquia) y los Córdobas (Córdoba). Tesis de pregrado para optar al título de Biólogo, Facultad de Ciencias Básicas, Universidad de Córdoba, Colombia. 112 p. [ Links ]
Guerrero, E.; Azcón, C. y Barea, J. 1996. Micorrizas: Recursos biológicos del suelo. Fondo FEN. Colombia, Bogotá. p. 130 - 132. [ Links ]
Jaizme, M. C. y Azcón, R. 1995.Response of some tropical and subtropical cultures to endomycorrhizal fungi. Mycorrhiza 5:213 - 217. [ Links ]
Jaizme, M. C. y Rodríguez, A. S. 2004. Uso de micorrizas en banano: logros y perspectivas. XVI Reunión Internacional Acorbat. Asociación para la Cooperación en Investigación y Desarrollo Integral de las Musáceas (bananos e plátanos). Publicación Especial. Oaxaca, México. p. 143 - 160. [ Links ]
Jaizme, M. C.; Rodríguez, A.; y Piñero, M. 2004. Potential use of rhizobacteria from the Bacillus genus to stimulate the plant growth of micropropagated banana. Fruits 59:83 - 90. [ Links ]
Janos, D. P. 1987. VA mycorrhizas in humid tropical ecosystem. En: Safir, G. R. (ed.). Ecophysiology of VAM plants. CRC Press, Inc., Boca Ratón, FL. p. 107 - 134. [ Links ]
Jarma, A.; Buitrago, C.; y Gutiérrez, S. 1999. Respuesta del crecimiento de la habichuela (Phaseolus vulgaris L. var. Blue Lake) a tres niveles de radiación incidente. Rev. Comalfi 26(1 - 3):62 - 73. [ Links ]
Leigh, J.; Hodge, A.; y Fitter, A. H. 2009.Arbuscular mycorrhizal fungi can transfer substantial amounts of nitrogen to their host plant from organic material. New Phytol. 181(1):199 - 207. [ Links ]
Marschner, H. y Dell, B. 1994.Nutrient uptake in mycorrhizal simbiosis. Plant Soil 154:89 -102. [ Links ]
Novoa, R.; Barrera J.; y Sánchez, M. 2006. Caracterización fisicoquímica de los suelos cultivados de plátano en el departamento de Córdoba. Trabajo de Grado para optar al título de Magíster en Ciencias Agrarias, Universidad Nacional de Colombia. Bogotá. 110 p. [ Links ]
Ohms, R. y Jenkins, W. 1964. A flotation method for collecting spores of a phycomycetous mycorrhizal parasite from soil. Phytopat. 47:751 - 752. [ Links ]
Rizzardi, V. 1990.Effect of inoculation with vesiculararbuscular mycorrhizal fungi on the growth of micropropagated Musa acuminate clone Grand Nain. Rev. Agric. Subtrop. e Trop. 84(3):473 - 484. [ Links ]
Ruiz, G.; Hernández, L.; Rodríguez, S.; Londoño, G.; Silva, S.; Alvarez, C.; y Estrada, A. 2006. Alianza productiva para la competitividad del cultivo de plátano en el departamento del Quindío. Producto: Plátano. Fundación Codesarrollo. Ministerio de Agricultura y Desarrollo Rural (MADR). Armenia, Quindío. 221 p. [ Links ]
Sánchez, M. y Sieverding, E. 1999. Efecto de G. mosseae en varios cultivos comerciales del Valle del Cauca. Universidad Nacional de Colombia, Palmira. 20 p. (n.p. [ Links ]).
Sánchez, M. 2007. Las endomicorrizas: Expresión bioedáfica de importancia en el trópico. Editorial Feriva S.A. Cali. 351 p. [ Links ]
SAS Institute Inc. 2004. Statistical Analysis System. The SAS© system 9.1.2 for Windows© The Power to Know. Cary, NC, 27513, USA. [ Links ]
Schenck, N. y Pérez, Y. 1990.Manual for the identification of VA mycorrhizal fungi. 3rd Edition. Gainesville. University of Florida. 286 p. [ Links ]
Sieverding, E. 1983. Manual de métodos para la investigación de la micorriza vesículoarbuscular en el laboratorio. Centro Internacional de Agricultura Tropical (CIAT), Proyecto micorriza. 356 p. [ Links ]
Smith, S. E. y Read, D. J. 1997. Mycorrhizal symbiosis. Academic Press, Cambridge. 605 p. [ Links ]
Thaker, M. y Jasrai, Y. 2002.Increased growth of micropropagated banana (Musa paradisiaca) with VAM symbiont. Plant Tissue Cult. 12(2):147 - 154. [ Links ]
Usuga-Osorio, C. E.; Castañeda-Sánchez, D. A.; y Franco-Molano, A. E. 2008.Multiplicación de hongos micorriza arbuscular (H.M.A) y efecto de la micorrización en plantas micropropagadas de banano (Musa AAA cv. Gran Enano) (Musaceae). Rev. Facultad Nacional de Agronomía, Medellín 61(1):4279 - 4290. [ Links ]
Yano-Melo, A. M.; Maia, L. C.; Saggin Jr., O. J.; Lima-Filho, J. M.; y Melo N. F. 1999. Effect of arbuscular mycorrhizal fungi on the aclimatization of micropropagated banana plantlets. Mycorrhiza 9(2):119 - 123. [ Links ]













