Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Colombian Journal of Anestesiology
Print version ISSN 0120-3347
Rev. colomb. anestesiol. vol.47 no.4 Bogotá Oct/Dec. 2019 Epub Oct 16, 2019
https://doi.org/10.1097/cj9.0000000000000129
INVESTIGACIÓN CIENTÍFICA Y TECNOLÓGICA
¿Es suficiente 1mg/kg de sugammadex para revertir el bloqueo neuromuscular moderado? Ensayo clínico aleatorizado
a Departamento de Anestesiología, Parc Salut Mar. Barcelona, España.
b Departamento de Cirugía, Parc Salut Mar. Barcelona, España.
Introducción:
El sugammadex permite revertir cualquier tipo de bloqueo inducido por rocuronio de forma rápida y segura. El bloqueo neuromuscular más frecuente es el moderado, en el cual dosis inferiores a las recomendadas por la industria podrían revertirlo completamente.
Objetivo:
Evaluar la efectividad de la mitad de la dosis de sugammadex recomendada por la industria para revertir un bloqueo neuromuscular moderado.
Métodos:
Ensayo clínico de fase IV en un unico centro que incluyó a 34 pacientes intervenidos de colecistectomía laparoscópica. Se realizó anestesia general intravenosa con monitoreo aceleromiográfico del bloqueo neuromuscular. Tras la intervención, el bloqueo se revirtió con la totalidad o con la mitad de la dosis de sugammadex recomendada para bloqueos moderados, utilizando una jeringa ciega.
Resultados:
Las características de los pacientes de los dos grupos fueron similares. La media de tiempo de recuperación fue de 3,6 ± 1,7 minutos para el grupo de estudio y de 3,1 ± 1,7 minutos para el grupo de control (p = 0,42). La reversión del bloqueo se completó con una dosis única de sugammadex en todos los pacientes. Hubo una correlación lineal importante entre la profundidad del bloqueo y el tiempo de recuperación.
Conclusión:
El monitoreo transquirúrgico es esencial para individualizar la dosis del agente de bloqueo neuromuscular. Para revertir un bloqueo moderado bajo monitoreo neuromuscular, una dosis de 1mg/kg es suficiente e igualmente segura y efectiva.
Palabras clave: Bloqueo neuromuscular; Bloqueo residual; Rocuronio; Sugammadex; Monitorización neuromuscular
Background:
Sugammadex has made it possible to reverse any type of rocuronium-induced block quickly and safely. The most frequent neuromuscular blockade is the moderate one where doses smaller than those recommended by the industry could get a full reversal.
Objective:
We aimed to evaluate the effectiveness of half the industry recommended dose of sugammadex to reverse a moderate neuromuscular block.
Methods:
Unicenter phase IV clinical trial that included 34 patients undergoing laparoscopic cholecystectomy. Intravenous general anesthesia was induced, with acceleromyographic monitoring of the neuromuscular block. After the intervention, the block was reversed with all or half the dose of sugammadex recommended for moderate blocks, using a blinded syringe.
Results:
Patient characteristics of the 2 groups were similar. Mean time to recovery was 3.6± 1.7minutes for the study group and 3.1 ± 1.7minutes for the control group (P=0.42). Reversal of the block was complete with a single dose of sugammadex in all patients. There was an important linear correlation between depth of block and time to recovery.
Conclusion:
Intraoperative monitoring is essential to allow us to individualize the dose of the neuromuscular blocking agent. To reverse a moderate block under neuromuscular monitoring, a dose of 1 mg/kg is sufficient in most cases and is equally safe and effective.
Keywords: Neuromuscular block; Residual block; Rocuronium; Sugammadex; Neuromuscular monitoring
Introducción
El bloqueo neuromuscular residual se observa al final de la anestesia y se confirma mediante monitoreo.1-3 Se define como el cociente del tren de cuatro (TOF, por sus siglas en inglés), o la relación entre la cuarta y la primera respuesta del tren de cuatro en el que un cociente < 90% es indeseable y se traduce en un peor pronóstico.4,5 Si bien el bloqueo neuromuscular es una variable continua que depende del equilibrio competitivo en la placa motora entre la acetilcolina y los bloqueadores neuromusculares no despolarizantes (como el rocuronio, el cual permite acceso rápido a la vía respiratoria y una adecuada relajación muscular para cada procedimiento),1,6 se han descrito cuatro etapas del bloqueo neuromuscular para fines de simplificación: bloqueo intenso, TOF = 0y recuento postetánico (RPT)=0; bloqueo profundo, TOF= 0 y RPT > 1; bloqueo moderado, conteo del TOF = 1-3; y recuperación, cociente TOF > 90%.7 Sin embargo, al contemplar la dosis de sugammadex, la mayoría de los autores consideran que el bloqueo moderado inicia con la reaparición de la segunda respuesta del TOF (T2).8,9
El sugammadex ha demostrado ser más efectivo que los agentes utilizados tradicionalmente para revertir el bloqueo neuromuscular (anticolinesterásicos) en lo que se refiere al tiempo de desaparición del bloqueo residual;10,11 permite revertir desde cualquier nivel de bloqueo, tiene un mejor perfil en cuanto a efectos secundarios y elimina la necesidad de administrar otros fármacos simultáneamente.12 La dosis recomendada de sugammadex para bloqueos moderados es de 2 mg/kg.13 La dosis para revertir es la misma en todos los casos, pese a la variabilidad considerable del efecto del rocuronio, las diferencias sustanciales de profundidad del bloqueo moderado (la cual puede variar entre un conteo de TOF de 1 y un cociente de TOF de 89%) y las discrepancias derivadas de los efectos del rocuronio y el sugammadex en función de sus pesos moleculares.13 Esto ha llevado a muchos autores a ajustar la dosis de sugammadex en casos de bloqueos neuromusculares moderados. Algunos estudios demuestran que la dosis recomendada por la industria puede ser excesiva, lo cual indica que cuando se utilizan dosis más bajas es esencial el monitoreo transquirúrgico, con el fin de evitar la recurarización.9,14,15
El hecho de disminuir la dosis de sugammadex en bloqueos moderados y utilizar monitoreo intraoperatorio para titularlo podría representar una ventaja económica que permita el uso generalizado de este fármaco. También se traduciría en mayor seguridad para los pacientes que requieren reintervención, puesto que la dosis menor de sugammadex permitiría usar una dosis normal de rocuronio. Se ha demostrado que el monitoreo tiene el beneficio de reducir las complicaciones posquirúrgicas16 y se recomienda incluso cuando se utiliza la dosis habitual de sugammadex.17
El objetivo de nuestro estudio fue determinar si la mitad de la dosis inicialmente recomendada de sugammadex (es decir, 1 mg/kg) es suficiente para revertir cualquier bloqueo moderado (ajustando la dosis mediante el monitoreo para revertir por completo), y si esta dosis reducida implica algún cambio significativo respecto al tiempo de recuperación y la seguridad del paciente.
Métodos
Se trató de un ensayo clínico de fase IV realizado en un solo centro bajo el rótulo EudraCT 2013-UU2362-39, aprobado por el comité de ética de nuestro hospital (informe del Comité Ético de Investigación Clínica del Parc de Salut Mar, 30 de mayo de 2013). El estudio se realizó entre diciembre de 2013 y septiembre de 2015. La Figura 1 muestra la distribución y la aleatorización, y también los pacientes que se perdieron al seguimiento. Los participantes ingresaron al estudio una vez firmado el consentimiento informado. Se necesitaron 40 pacientes aleatorizados para obtener los 34 casos válidos.
La aleatorización se realizó aplicando el modelo de bloques (MINSTD 1:1 en http://www.quantitativeskills.com/sisa/). El departamento de farmacia utilizó la lista generada de controles y casos de estudio, con el fin de preparar las jeringas ciegas, de acuerdo con las dosis asignadas por la aleatorización: dosis de 20mg/ml (grupo de controles) o de 10mg/ml (grupo de estudio) de sugammadex.
La dosis de sugammadex, aleatoria y ciega, se despachó a la sala de cirugía antes de la inducción de la anestesia, para uso posteriormente. Incluimos pacientes programados para colecistectomía laparoscópica bajo anestesia general y con intubación traqueal, realizada por el mismo equipo quirúrgico en todos los casos. Los criterios de exclusión fueron alergia o intolerancia a alguno de los fármacos utilizados en el estudio, consumo habitual de medicamentos que pudieran interferir con la acción de los bloqueadores neuromusculares, insuficiencia renal terminal que requiriera terapia de reemplazo, trastornos neurológicos y/o neuromusculares, edad < 18 años y negativa del paciente. La inducción estándar de la anestesia se realizó mediante administración intravenosa de midazolam (0,04 mg/kg), fentanil (2 μg/kg), propofol (2 mg/kg) y rocuronio (0,6mg/kg).
El monitoreo de la función neuromuscular se estableció por medio de aceleromiografía (TOF-Watch SX, Organon Ltd., Dublín, Irlanda), con estimulación del nervio cubital mediante electrodos de superficie y la colocación del cristal piezoeléctrico en el dedo índice antes de administrar el agente bloqueador. Se aplicó estimulación tetánica a 50Hz, y el estímulo supramáximo se calculó una vez estabilizada la señal. El monitoreo tuvo las siguientes características: duración de 0,2 segundos a una frecuencia de 2 Hz e intensidad supramáxima, repetida a intervalos de 15 segundos. La contracción resultante del músculo aductor del pulgar se registró electrónicamente mediante un programa específico (TOF-Watch SX, monitor v.1.1 INT, Organon Ltd., Dublín, Irlanda) para cálculos subsiguientes. La preparación y la selección de la secuencia de calibración de la aceleromiografía se realizaron de acuerdo con las recomendaciones para una correcta monitorización neuromuscular, según la definición contenida en las guías de buenas prácticas de investigación clínica para estudios farmacodinámicos de los bloqueadores neuromusculares, producto de una conferencia internacional de consenso celebrada en Copenhague, y actualizadas después de una segunda conferencia de consenso celebrada en Estocolmo en 2005.3 No hubo necesidad de normalización de los datos en ninguno de los casos.
Para el mantenimiento de la anestesia se utilizó una infusión continua de propofol junto con bolos de fentanil para obtener anestesia profunda a un valor de BIS de 4560. Tratamos de no exceder una presión intraabdominal de 12 mmHg en ningún momento. Se usaron bolos de rocuronio (0,15 mg/kg) para mantener el bloqueo neuromuscular con un TOF entre 1 y 2. El estado del bloqueo se registró antes de administrar la dosis. Después de la cirugía y antes de la extubación se revirtió el bloqueo usando la jeringa preparada de forma ciega y aleatorizada previamente por el departamento de farmacia, la cual podía contener o bien una dosis de 20mg/ml (grupo de control) o de 10 mg/ml (grupo de estudio) de sugammadex. La dosis por administrar se calculó como si todas las jeringas fueran de 20 mg/ml, de acuerdo con las recomendaciones de la ficha técnica; es decir, 2mg/kg para un bloqueo moderado. Si el bloqueo era intenso o profundo, el paciente se excluía antes de administrar la dosis. De esta forma, el anestesiólogo estaba cegado ante la dosis administrada. Recopilamos datos demográficos, de los tiempos de recuperación y la intensidad del bloqueo neuromuscular, las dosis de rocuronio y las dosis de sugammadex.
Análisis estadístico y tamaño de la muestra
De acuerdo con la ficha técnica, tras la reaparición de T2 después de un bloqueo inducido por rocuronio (bloqueo moderado), el tiempo promedio para recuperar el cociente de T4/T1 de 0,9 después de una dosis de sugammadex de 2 mg/kg es de aproximadamente dos minutos. El tamaño de la muestra se calculó al comparar medias independientes. Al aceptar un riesgo a de 0,05 y un riesgo β de 0,2 se obtuvo una muestra de 16 sujetos por grupo para detectar una diferencia igual o superior a dos minutos de tiempo de recuperación del bloqueo neuromuscular. Asumimos una desviación estándar de dos minutos. También se calculó una tasa del 5% de sujetos perdidos al seguimiento. Para el análisis estadístico utilizamos la prueba t de Student, la prueba de Fisher y correlaciones lineales. Se consideró significativo un valor de P <0,05.
Resultados
En la Tabla 1 aparecen las características de los 34 pacientes. Después de la aleatorización, 18 pacientes se asignaron al grupo de control (dosis usual de sugammadex) y 16 pacientes, al grupo de estudio (la mitad de la dosis de sugammadex). No se observaron diferencias entre los dos grupos respecto a las características de los pacientes.
Tabla 1 Características de los pacientes y datos demográficos.
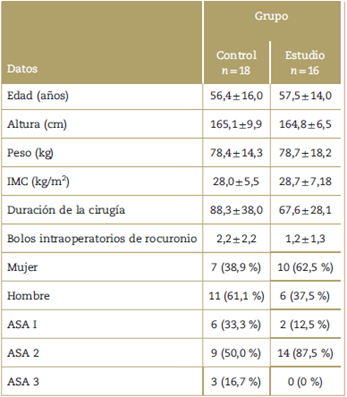
Datos expresados como medias ± desviación estándar para variables continuas y como porcentajes para variables categóricas. No se encontraron diferencias significativas entre los grupos. ASA: Puntuación de la Sociedad Americana de Anestesiología; IMC: índice de masa corporal.
Fuente: Autores.
Durante el periodo intraoperatorio, el 73% de los pacientes requirió una dosis en bolo de rocuronio para mantener el bloqueo por debajo de dos respuestas del TOF. La mayoría de los pacientes (50,8%) recibió entre 1 y 3 bolos de rocuronio: mediana = 2, percentil 50 = 2, y moda = 0. El 10,8% de los pacientes del grupo de control no requirió bolos suplementarios, como tampoco lo requirió el 16,2% de los pacientes del grupo de estudio. La dosis total de rocuronio fue de 64,2 ± 21,5 mg en el grupo de control, y de 59,7 ± 19,8 mg en el grupo de estudio.
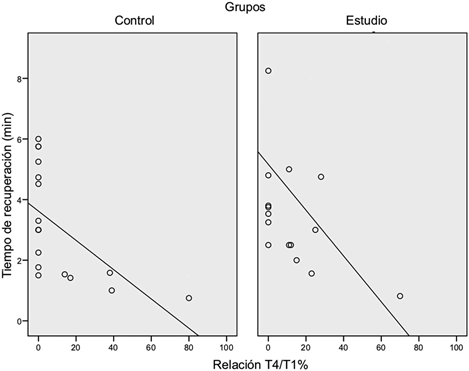
La intensidad de los bloqueos neuromusculares en cada grupo justo antes de la administración del sugammadex aparece en la Tabla 2.En la Figura 2 se ilustra el tiempo hasta la recuperación del bloqueo neuromuscular después de la administración del sugammadex, en el que se observa que no hubo diferencia entre los dos grupos. La media de tiempo de recuperación fue de 3,6 ± 1,7 minutos para el grupo de estudio y 3,1 ± 1,7 minutos para el grupo de control. La media de diferencia fue de 0,49 minutos, y el intervalo de confianza del 95% no fue significativo (p = 0,42). Se logró revertir por completo el bloqueo con una sola dosis de sugammadex en todos los pacientes. En la Figura 3 aparece la comparación entre los dos grupos de la relación entre la profundidad del bloqueo y el tiempo de recuperación después de administrar el sugammadex. No se encontraron diferencias en el tiempo transcurrido hasta la recuperación, pese a haber duplicado la dosis de sugammadex en el grupo de control. El coeficiente de variación del tiempo de recuperación después del sugammadex fue de 54,8% en el grupo de estudio y de 47,2% en el grupo de control.
Tabla 2 Intensidad del bloqueo neuromuscular justo antes de la administración de sugammadex.
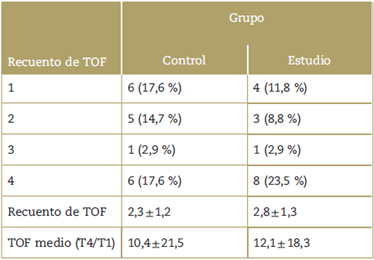
Valores de bloqueo neuromuscular antes de reversión con sugammadex. Datos expresados como número de casos y porcentajes para las variables cualitativas y media ± desviación estándar para las variables cuantitativas. Recuento de TOF: número de respuestas al tren de cuatro; Relación TOF (T4/ T1): como proporción TOF medio. No se encontraron diferencias significativas entre los 2 grupos.
Fuente: Autores.

Fuente: Autores.
Figura 2 Diagrama de caja que muestra el tiempo de recuperación después de la administración de sugammadex y el tiempo medio de recuperación para el grupo de estudio y control. Los diagramas representan la media, la desviación estándar y el intervalo de confianza del 95% del tiempo medio de recuperación en minutos.
Discusión
Este estudio demuestra que la dosis de sugammadex se puede reducir a la mitad para revertir un bloqueo moderado sin por ello perder efectividad ni prolongar el tiempo hasta la recuperación con repercusiones clínicas. Esto quiere decir que es igualmente efectivo revertir un bloqueo moderado (la mayoría de los bloqueos residuales al final de una intervención son moderados)18 con 1mg/kg de sugammadex que con 2 mg/kg. La diferencia en tiempo de recuperación de 0,49 minutos entre las dos dosis es clínicamente irrelevante.
Utilizar dosis elevadas de sugammadex puede tener efectos negativos que no deben perderse de vista. Entre estos posibles riesgos se cuentan la alergia, aumento del tiempo de eliminación, interacciones, dificultad para manejar bloqueadores neuromusculares en casos de reintervención y un incremento innecesario de los costos. Inicialmente se recomendó no utilizar rocuronio antes de transcurridas 24 horas desde la administración de sugammadex en pacientes sin disfunción renal, debido al mecanismo de eliminación del complejo rocuronio-sugammadex.8,19 Este tiempo se prolonga en casos de insuficiencia renal.20 Cammu y colaboradores21 concluyeron posteriormente que era posible obtener el bloqueo neuromuscular nuevamente antes de las 24 horas desde la administración de sugammadex, aunque en su estudio las dosis de rocuronio fueron más altas y se demostró que el monitoreo fue esencial.
En lo que se refiere a la farmacoeconomía, el monitoreo también permitiría ajustar la dosis de sugammadex, y reducir así su impacto económico. Además, al parecer el sugammadex es superior a otros anticolinesterásicos en lo que se refiere al tiempo de recuperación,12 la reversión de cualquier profundidad de bloqueo22 y el perfil de seguridad respecto a efectos adversos.23 Por otro lado, la neostigmina puede contribuir al colapso de la vía aérea24,25 y producir taquicardia cuando se utilizan fármacos adyuvantes como la atropina. Además, algunos autores concluyen que, si bien algunos estudios han demostrado que el sugammadex tiene ventajas en términos de tiempo de recuperación y efectos adversos,24,25 otros no han logrado demostrar esas diferencias.26 Tampoco hay acuerdo sobre sus ventajas económicas. Aunque algunos autores han encontrado esa ventaja, derivada principalmente del menor tiempo de recuperación en algunas circunstancias,27 ha sido difícil su uso sistemático por razones económicas.
Al analizar los estudios de farmacoeconomía que comparan el sugammadex con fármacos tradicionales, es preciso tener presente que sus enfoques metodológicos no siempre son concordantes y que las pruebas utilizadas para la evaluación económica no siempre son las apropiadas. Mientras los datos disponibles actualmente sugieren que el uso rutinario de sugammadex podría mejorar los tiempos de recuperación, es importante señalar algunas advertencias: (1) el sugammadex parece ser efectivo en términos de costos cuando el menor tiempo hasta la recuperación se obtiene en la sala de cirugía en lugar de la unidad de cuidados posanestésicos; (2) la reducción del tiempo de recuperación no necesariamente es garantía de mayor tiempo disponible para aumentar la actividad quirúrgica; (3) la efectividad en materia de costos observada en los ensayos podría no obtenerse en la práctica clínica diaria y de manera constante.28 Estudios farmacoeconómicos semejantes en los que se ha comparado el rocuronio-sugammadex con succinilcolina en casos de vía aérea difícil han llevado a la conclusión de que el sugammadex es viable económicamente para uso rutinario.28
Ajustar la dosis de sugammadex podría entrañar un mayor riesgo de recurarización y, además, una mayor variabilidad de la respuesta. La monitorización intraoperatoria del bloqueo neuromuscular es esencial y extremadamente útil para evitar la recurarización. Se encontró una gran variabilidad entre los sujetos de nuestro estudio en relación con el efecto del rocuronio debido a la variación del número de bolos administrados. Por ello, recomendamos monitorización transoperatoria para una dosificación correcta, como lo han hecho la mayoría de los autores,7,15,16 con el fin de reducir las complicaciones posquirúrgicas asociadas con la presencia de un bloqueo residual.25 Kaufhold y colaboradores,15 en un estudio reciente de ajustes en la dosis de sugammadex, encontraron que la neostigmina no era efectiva para revertir un efecto moderado. En cuanto al sugammadex, concluyeron que en el 95% de los pacientes, la administración de una dosis muy reducida (0,5mg/kg) era suficiente para revertir un bloqueo moderado en menos de cinco minutos. No encontraron evidencia de reaparición del bloqueo neuromuscular, pero proponen que monitorear el bloqueo es esencial para garantizar la seguridad del paciente. Estos resultados concuerdan con los hallazgos del presente estudio.
Es claro que la profundidad del bloqueo es clave para determinar la dosis óptima de sugammadex. Parecería que la estrategia actual de reversión basada en el peso del paciente no es la más apropiada, puesto que es posible lograrla reversión completa con dosis menores. El bloqueo neuromuscular es un espectro continuo y su estratificación cualitativa puede hacer que se pierda información. Por ejemplo, un bloqueo moderado con un cociente T4/T1 del 70% es diferente de un bloqueo moderado con un TOF de 2, y no es lógico administrar la misma dosis (2mg/kg) para revertir ambas condiciones. Por esta razón, en el estudio incluimos pacientes con bloqueo moderado de acuerdo con la actualización de Estocolmo (3) y a quienes se encontraban en la fase de recuperación inicial. A pesar de la heterogeneidad del grado de bloqueo, se recomienda la misma dosis de sugammadex en la práctica diaria. Sin embargo, creemos que esta heterogeneidad de la muestra se debe reflejar en diferencias de dosificación, y que es preferible monitorear el bloqueo neuromuscular, con el fin de poder ajustar la dosis de sugammadex a su efecto.
La pérdida de información derivada de la estratificación cualitativa nos lleva a tratar los bloqueos superficiales y casi profundos de la misma manera. Mediante el monitoreo sería posible administrar una dosis menor (por ejemplo, 1 mg/kg) y, dependiendo de su efecto, continuar o suspender la administración si el bloqueo residual persiste. También, se podrían ajustar las dosis de rocuronio y sugammadex, y además asegurar que no haya bloqueo residual en los casos en los que se utilice rocuronio nuevamente después de revertir con sugammadex, tal como proponen algunos autores.21
Entre las limitaciones de este estudio se encuentra el hecho de no haber evaluado los bloqueos profundos o intensos. Por extrapolación, podría plantearse que en esos casos también se requeriría el monitoreo, aunque esto no se analizó en el presente estudio. Otra limitación es que analizamos los bloqueos en un solo tipo de cirugía (laparoscópica), y no sabemos si en un tipo diferente de cirugía pudiera estar indicado otro tipo de monitoreo, análisis o reversión.
Aunque el tamaño de la muestra no fue lo suficientemente grande para justificar cambios directos en la dosis de sugammadex, sugerimos ajustar la dosis de acuerdo con la variabilidad demostrada durante el monitoreo transquirúrgico para evitar dosis excesivas innecesarias.
Conclusión
En la mayoría de los casos, una dosis de 1 mg/kg es suficiente, segura y efectiva para revertir un bloqueo moderado. La monitorización intraoperatoria es esencial para poder individualizar la dosis del agente de bloqueo neuromuscular.
REFERENCIAS
1. Tafur BL, Lema Flórez E. General anesthesia for C-section. The role of sugammadex in the quality and safety of anesthesia. Case report. Colombian Journal of Anesthesiology 2012;40:75-78. [ Links ]
2. Fabregat JCC, Castillo C. Neuromuscular monitoring and its importance in neuromuscular blockade. Colombian Journal of Anesthesiology 2012;40:293-303. [ Links ]
3. Viby-Mogensen J, Jorgensen BC, Ording H. Residual curarization in the recovery room. Anesthesiology 1979;50:539-541. [ Links ]
4. Murphy GS, Szokol JW, Marymont JH, et al. Residual neuromus-cular blockade and critical respiratory events in the postanesthesia care unit. Anesth Analg 2008;107:130-137. [ Links ]
5. Murphy GS. Residual neuromuscular blockade: incidence, assessment, and relevance in the postoperative period. Minerva Anestesiol 2006;72:97-109. [ Links ]
6. Errando CL, Mazzinari G, Diaz-Cambronero O, et al. Grupo español de estudio del bloqueo neuromuscularResidual neuro-muscular blockade in the postanesthesia care unit. A secondary analysis of the ReCuSS. Observational cross-sectional study of a multicenter cohort. Rev Esp Anestesiol Reanim 2017;64: 419-422. [ Links ]
7. Fuchs-Buder T, Claudius C, Skovgaard LT, et al. Good clinical research practice in pharmacodynamic studies of neuromuscular blocking agents II: the Stockholm revision. Acta Anaesthesiol Scand 2007;51:789-808. [ Links ]
8. Srivastava A, Hunter JM. Reversal of neuromuscular block. Br J Anaesth 2009;103:115-129. [ Links ]
9. Shields M, Giovannelli M, Mirakhur RK, et al. Org 25969 (sugammadex), a selective relaxant binding agent for antagonism of prolonged rocuronium-induced neuromuscular block. Br J Anaesth 2006;96:36-43. [ Links ]
10. Khuenl-Brady KS, Wattwil M, Vanacker BF, et al. Sugammadex provides faster reversal of vecuronium-induced neuromuscular blockade compared with neostigmine: a multicenter, randomized, controlled trial. Anesth Analg 2010;110:64-73. [ Links ]
11. Puhringer FK, Gordon M, Demeyer I, et al. Sugammadex rapidly reverses moderate rocuronium- or vecuronium-induced neuro-muscular block during sevoflurane anaesthesia: a dose-response relationship. Br J Anaesth 2010;105:610-619. [ Links ]
12. Gijsenbergh F, Ramael S, Houwing N, et al. First human exposure of Org 25969, a novel agent to reverse the action of rocuronium bromide. Anesthesiology 2005;103:695-703. [ Links ]
13. Sorgenfrei IF, Norrild K, Larsen PB, et al. Reversal of rocuronium-induced neuromuscular block by the selective relaxant binding agent sugammadex: a dose-finding and safety study. Anesthesiology 2006;104:667-674. [ Links ]
14. Suy K, Morias K, Cammu G, et al. Effective reversal of moderate rocuronium- or vecuronium-induced neuromuscular block with sugammadex, a selective relaxant binding agent. Anesthesiology 2007;106:283-288. [ Links ]
15. Kaufhold N, Schaller SJ, Stauble CG, et al. Sugammadex and neostigmine dose-finding study for reversal of residual neuromuscular block at a train-of-four ratio of 0.2 (SUNDRO20) dagger. Br J Anaesth 2016;116:233-240. [ Links ]
16. Murphy GS, Szokol JW, Marymont JH, et al. Intraoperative acceleromyographic monitoring reduces the risk of residual neuromuscular blockade and adverse respiratory events in the postanesthesia care unit. Anesthesiology 2008;109:389-398. [ Links ]
17. Kotake Y, Ochiai R, Suzuki T, et al. Reversal with sugammadex in the absence of monitoring did not preclude residual neuromuscular block. Anesth Analg 2013;117:345-351. [ Links ]
18. Martinez-Ubieto J, Ortega-Lucea S, Pascual-Bellosta A, et al. Prospective study of residual neuromuscular block and postoper-ative respiratory complications in patients reversed with neostigmine versus sugammadex. Minerva Anestesiol 2016;82:735-742. [ Links ]
19. Sparr HJ, Vermeyen KM, Beaufort AM, et al. Early reversal of profound rocuronium-induced neuromuscular blockade by sugammadex in a randomized multicenter study: efficacy, safety, and pharmacokinetics. Anesthesiology 2007;106:935-943. [ Links ]
20. Staals LM, Snoeck MM, Driessen JJ, et al. Reduced clearance of rocuronium and sugammadex in patients with severe to end-stage renal failure: a pharmacokinetic study. Br J Anaesth 2010;104:31-39. [ Links ]
21. Cammu G, de Kam PJ, De Graeve K, et al. Repeat dosing of rocuronium 1.2mgkg-1 after reversal of neuromuscular block by sugammadex 4.0mgkg-1 in anaesthetized healthy volunteers: a modelling-based pilot study. Br J Anaesth 2010;105:487-492. [ Links ]
22. Duvaldestin P, Kuizenga K, Saldien V, et al. A randomized, dose-response study of sugammadex given for the reversal of deep rocuronium- or vecuronium-induced neuromuscular blockade under sevoflurane anesthesia. Anesth Analg 2010;110:74-82. [ Links ]
23. Ledowski T, Falke L, Johnston F, et al. Retrospective investigation of postoperative outcome after reversal of residual neuromuscular blockade: sugammadex, neostigmine or no reversal. Eur J Anaesthesiol 2014;31:423-429. [ Links ]
24. Eikermann M, Zaremba S, Malhotra A, et al. Neostigmine but not sugammadex impairs upper airway dilator muscle activity and breathing. Br J Anaesth 2008;101:344-349. [ Links ]
25. Herbstreit F, Zigrahn D, Ochterbeck C, et al. Neostigmine/ glycopyrrolate administered after recovery from neuromuscular block increases upper airway collapsibility by decreasing genioglossus muscle activity in response to negative pharyngeal pressure. Anesthesiology 2010;113:1280-1288. [ Links ]
26. Abad-Gurumeta A, Ripolles-Melchor J, Casans-Frances R, et al. A systematic review of sugammadex vs neostigmine for reversal of neuromuscular blockade. Anaesthesia 2015;70:1441-1452. [ Links ]
27. Chambers D, Paulden M, Paton F, et al. Sugammadex for reversal of neuromuscular block after rapid sequence intubation: a systematic review and economic assessment. Br J Anaesth 2010;105:568-575. [ Links ]
28. Fuchs-Buder T, Meistelman C, Schreiber JU. Is sugammadex economically viable for routine use. Curr Opin Anaesthesiol 2012;25:217-220. [ Links ]
Cómo citar este artículo: Moltó L, Fernández-Candil JL, López-Argüello E, Benítez-Cano A, Poves I, Santiveri X. Is 1mg/kg of sugammadex sufficient to reverse moderate neuromuscular block? A randomized clinical trial. Colombian Journal of Anesthesiology. 2019;47:211-218.
Copyright © 2019 Sociedad Colombiana de Anestesiología y Reanimación (S.C.A.R.E.). Published by Wolters Kluwer. This is an open access article under the CC BY-NC-ND license (https://creativecommons.org/licenses/by-nc-nd/4.0/).











 text in
text in