INTRODUCCIÓN
Los pseudoescorpiones son pequeños y crípticos arácnidos, presentes en todos los ecosistemas alrededor del mundo (excepto las regiones polares), comúnmente pueden ser encontrados en la hojarasca, debajo de rocas y piedras, o en la corteza de árboles y troncos en descomposición, además en ambientes marinos, subterráneos (edáficos, cuevas, MSS), en nidos de hormigas, abejas, roedores, aves y también asociados sobre plantas (Weygoldt, 1969; Cole et al., 1995; Andrade y Gnaspini, 2002; Aguiar y Bührnheim, 2003; Francke y Villegas-Guzmán, 2006; González et al., 2007; Del-Claro y Tizo-Pedroso, 2009; Harvey, 2009;Judson, 2016; Bedoya-Roqueme et al., 2017a). Estos arácnidos son considerados de poca dispersión, sin embargo, se les conocen siendo foréticos en aves, insectos y mamíferos (Weygoldt, 1969; Poinar et al., 1998; Aguiar y Bührnheim, 2003; Francke y Villegas-Guzmán, 2006; Del-Claro y Tizo-Pedroso, 2009).
La región insular de Colombia está compuesta por una serie de islas y cayos de diferente origen y composición que emergen en el océano Pacifico y el mar Caribe (IDEAM, 2010). Entre los cuales se encuentran los archipiélagos del Rosario y el complejo de Islas de San Bernardo, así como formaciones discontinuas: Isla Fuerte y Tortuguilla (López-Victoria y Díaz, 2000; Estela, 2006; IDEAM, 2010). Isla Fuerte es una formación calcárea e Isla Tortuguilla se encuentra formada por una terraza coralina subfósil emergida, localizadas sobre la plataforma continental del Caribe colombiano, las cuales han quedado emergidas por la orogenia durante el Holoceno y su edad estimada oscila entre 5000 a 10000 años (Anderson, 1975; Díaz et al., 1996; López-Victoria y Díaz, 2000; IDEAM, 2010). De acuerdo con los rasgos morfológicos, las islas hacen parte del cinturón diapírico que se extiende a lo largo de la costa y sobre la plataforma Continental, y se evidencia por la presencia de lodolita o fangolita influenciados por los volcanes de lodo en la zona continental y coincide con el origen de otras formaciones como Islas del Rosario e Islas de San Bernardo frente a las costas colombianas (Anderson, 1975; Díaz et al., 1996; López-Victoria y Díaz, 2000).
El conocimiento actual de este orden mesodiverso de arácnidos (Harvey, 2002), es escaso y fragmentario para América del Sur (Mahnert y Adis, 2002). Colombia es uno de los países con mayor expresión de diversidad biológica y se considera dentro del grupo de los países megadiversos (Rangel-Ch., 2006; Andrade-C., 2011; Rangel-Ch., 2015); actualmente, se han hecho esfuerzos para conocer la fauna de pseudoescorpiones en los diferentes ecosistemas del país, de lo que resulta un total de 38 especies descritas y reportadas de Colombia; en su mayoría, los registros corresponden a zonas de bosque seco tropical, bosque húmedo, áreas de sabana, boques de ribera y bosques de mangle (Ceballos y Flórez, 2007; Murienne et al., 2008; Harvey y Muchmore, 2013; Bedoya-Roqueme et al., 2014; Bedoya-Roqueme, 2015; Bedoya-Roqueme et al., 2015; Quirós et al., 2015; Bedoya-Roqueme et al., 2017a; Bedoya-Roqueme et al., 2017b; Romero-Ortiz, 2017). En el Caribe colombiano, son escasas las investigaciones, los primeros reportes fueron por Banks (1909) quien describió la especie Garypus viridans de Santa Marta (Magdalena). Posteriormente, Muchmore (1982; 1993) describió las especies Ideoblothrus colombiae e I. kochalkai en Santa Marta y Dasychernes inquilinus para las localidades de Rio Frio y Sevilla (Magdalena). Actualmente, se conoce el reporte de Parachernes melanopygusBeier, 1959, en zonas de bosque seco, y los reportes de pseudoscorpiones en áreas de manglar para el departamento de Córdoba, áreas sabanizadas y de bosque seco para el departamento de Sucre (Bedoya-Roqueme et al., 2014; 2016; Bedoya-Roqueme, 2015; Bedoya-Roqueme et al., 2017a; 2017b). A pesar de lo anterior, el conocimiento en las zonas insulares de Colombia es nulo, por lo tanto, se considera fundamental iniciar estudios que permitan conocer las especies de pseudoescorpiones presentes en las zonas insulares del suroccidente de la región Caribe de Colombia, siendo la presente contribución objeto de esta investigación.
MATERIALES Y MÉTODOS
Área de estudio
El estudio se realizó entre julio de 2013 y abril de 2016 en dos zonas insulares (Figura 1): Isla Fuerte e Isla Tortuguilla. Isla Fuerte (departamento de Bolívar) (Fig. 2A), localizada entre los 9° 23' N y 76° 10' W al sur del golfo de Morrosquillo y a 11 km de la costa continental del departamento de Córdoba frente a la población de Paso nuevo, es una formación calcárea discontinua con una elevación de 12 m.s.n.m. y un área emergida de 2,9 km2; se encuentra habitada, su vegetación está dominada por especies de mangle (Avicennia germinans Linneo, Rhizophora mangle Linneo, Laguncularia racemosa Gaetner y Conocarpus erectus Linneo), cultivos de frutales y palmas (Díaz et al., 2000; Estela, 2006; IDEAM, 2010). El otro punto de muestreo es Isla Tortuguilla (departamento de Córdoba) (Fig. 2B), localizada entre los 9° 1' N y 76° 20' W a 9 Km de la costa del municipio de Puerto Escondido, está formada por un arrecife coralino subfósil sumergido y un área emergida de 0,1 km2; la vegetación predominante consiste en palmas de Cocos nucifera Linneo, árboles frutales y un cinturón de C. erectus en su mitad sur (Díaz et al., 2000; Estela 2006; IDEAM, 2010). La selección de las islas obedece a su estado de conservación, estructura vegetal y fácil acceso.
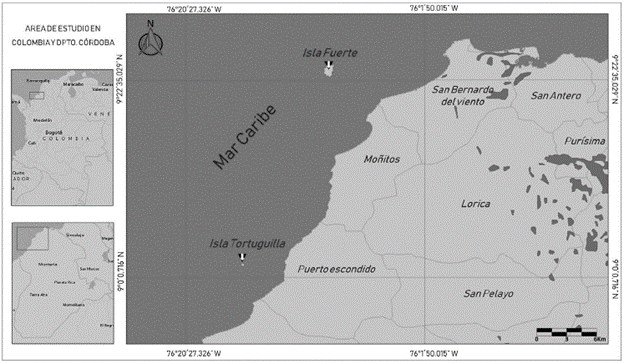
Figura 1 Localización de las Islas continentales frente a la costa del departamento de Córdoba, Caribe Colombiano.

Figura 2 Islas continentales. a. Isla Fuerte, Bolívar: Bosque de mangle. b. Isla Tortuguilla, Puerto Escondido: bosque de mangle.
Colecta de individuos
En cada sector de estudio se adaptaron las metodologías propuestas por Gabbutt (1970), Mahnert y Adís (2002) y se siguieron las recomendaciones realizadas por Adis et al., (1988). Para la recolecta de la hojarasca se utilizó un cuadrante delimitando un área de 1 m2 con seis repeticiones al azar y una duración de 12 horas, para un total de 24 muestras, la hojarasca recolectada fue depositada en bolsas selladas para, posteriormente, ser examinada en laboratorio; la extracción los especímenes se realizó a través del procesamiento por embudo de Berlese de la hojarasca colectada (Gabbutt, 1970). Teniendo en cuenta que los microhábitats ofrecieran el potencial de encontrar pseudoescorpiones, se empleó la búsqueda libre sin restricción de los ejemplares a través de la colecta manual en la corteza de árboles, debajo de piedras, troncos en descomposición, en hojarasca y suelo, por un tiempo efectivo de 60 min/colector (Mahnert y Adis, 2002).
Trabajo de gabinete
Los ejemplares inicialmente fueron depositados en viales, conservados en alcohol 70 %, almacenados en frascos de boca ancha y etiquetados con información que incluía código de la muestra, sector y fecha para su posterior exanimación en laboratorio (Chamberlin, 1931; Harvey, 1992; Mahnert y Adis, 2002). Los especímenes fueron sometidos a procesos de aclaramiento por difusión lenta con ácido láctico 70 % por un tiempo aproximado de 24 horas (previa disección de los apéndices), donde se les ha separado la pata I y IV, un quelícero y un pedipalpo izquierdo, de este último se le ha separado también la pinza (Judson, 1992). Posteriormente, se realizaron preparaciones temporales en glicerina para su estudio con la ayuda de un microscopio Carl Zeiss, plus Axiostar, Alemania. Para la identificación de los ejemplares se utilizaron las claves taxonómicas para familia y género de Harvey (1992), Mahnert y Adis (2002) y Buddle (2010). Después del estudio, los especímenes fueron enjuagados en agua destilada y conservados en alcohol 70 %, los artejos sueltos se han guardado en un microvial, en el mismo vial que el resto del espécimen. Los ejemplares identificados, fueron depositados en la colección del Laboratorio de Entomología de la Universidad de Córdoba, Montería, Colombia (LEUC) con códigos de registro LEUC-Ps-IF-001 a LEUC-Ps-IF-015 y LEUC-Ps-IT-001 a LEUC-Ps-IT-011. Las especies que representan nuevos registros para Colombia son marcadas con un asterisco (*).
RESULTADOS
Familia Atemnidae
Paratemnoides nidificator (Balzan, 1888)
Fig. 3A-3B

Figura 3 Especies de Pseudoscorpiones colectados en Isla Fuerte y Tortuguilla, Caribe Colombiano. Habitus: a. Paratemnoides nidificator (Macho). b. Paratemnoides nidificator (Hembra). c. Epactiochernes insularum (Macho). d. Serianus gratus (Hembra y Macho). e. Solinus corticola (Macho). f. Lechytia chthoniiformis (Macho). g. Pachyolpium sp.1 (Hembra y Macho). h. Pachyolpium sp.2 (Macho).
Material examinado. COLOMBIA, Bolívar, Isla Fuerte, sectores: El inglés, Latal, San Diego, [9°23'13'' N; 76°10'51.999'' W, 12 m.s.n.m.] 16 abr. 2016. E. Bedoya-Roqueme, 8♂ 12♀ (Depositados en LEUC; Ps-IF-005). COLOMBIA, Córdoba, Puerto Escondido, Isla Tortuguilla, [9°1'42.091'' N; 76°20'26.719'' W, 2 m.s.n.m.] 28 nov. 2015. E. Bedoya-Roqueme, ♂, ♀, (Depositados en LEUC; PS-IT-008).
Distribución: Amplia distribución en el nuevo mundo (Harvey, 2013); Argentina, Brasil, Colombia, Costa Rica, Ecuador, Guatemala, Guyana, Haití, México, Panamá, Paraguay, Perú, San Vicente y las granadinas, Venezuela.
Observación: Los ejemplares recolectados presentan diferencias en cuanto a longitud corporal: ♂, 2,50-2,57 mm (♀, 2,84-2,96 mm); pinza del pedipalpo: ♂, 1,25-1,33/0,520,53 mm (♀,1,30-1,33/0,50-0,54 mm); mano sin pedicelo: ♂, 0,80-0,83/0,52-0,53 mm (♀, 0,83/0,54 mm); longitud del dedo móvil: ♂, 0,58 0,56-0,58/0,05-0,06 mm (♀, 0,580,60/0,05-0,06 mm); atribuidas a la variación geográfica de las especies.
Familia Chernetidae
Epactiochernes insularumMuchmore, 1974
Material examinado. COLOMBIA, Bolívar, Isla Fuerte, Sectores El inglés, Latal, San Diego, [9°23'13'' N; 76°10'51.999'' W, 12 m.s.n.m.] 31 may. 2014. E. Bedoya-Roqueme, (Depositados en LEUC; Ps-IF-010). COLOMBIA, Córdoba, Puerto Escondido, Isla Tortuguilla, [9°1'42.091'' N; 76°20'26.719'' W, 2 m.s.n.m.] 6 jul. 2013. E. Bedoya-Roqueme, 1♀, (Depositados en LEUC; Ps-IT-010).
Distribución: Colombia, Cuba, Jamaica, Puerto Rico (Harvey, 2013; Bedoya-Roqueme et al., 2017a).
Observación: Los ejemplares recolectados pertenecen a esta especie por las medidas y la proporción del pedipalpo, trocánter ♂, 0,24/0,18 mm (♀, 0,23/0,17 mm); fémur: ♂, 0,43/0,15 mm (♀, 0,45/0,15 mm); patela: ♂,0,5/0,20 mm (♀, 0,42/0,18 mm); pinza sin pedicelo: ♂, 0,75/0,27 mm (♀, 0,73/0,25 mm); dedo móvil: ♂, 0,50/0,03 mm (♀, 0,53/0,02 mm); el aspecto de las espermatecas en forma de forma de microtubos, difíciles de observar, que corresponden a la descripción de E. insularum efectuada por Muchmore (1974).
Familia Chthoniidae
Paraliochthonius sp.
Material examinado. COLOMBIA, Córdoba, Puerto Escondido, Isla Tortuguilla, [9°1'42.091'' N; 76°20'26.719'' W, 2 m.s.n.m.] 6 jul. 2013. E. Bedoya-Roqueme, una Tritoninfa (Depositada en LEUC; Ps-IT-011). Distribución: Bahamas, Colombia, Ecuador, Estados Unidos, Jamaica, México, Puerto Rico; fuera del nuevo mundo: Australia, España, Francia, Grecia, Croacia, Italia, Japón, Kenia, Nueva Caledonia, Portugal, Turquía (Harvey, 2013).
Observación: Teniendo en cuenta la presencia de tres sedas espiniformes en el margen interno de la mano, pertenece a las especies P. carpenteriMuchmore, 1984, P. weygoldti Muchmore, 1967, P. mexicanus Muchmore, 1972, sin embargo, el número de sedas espiniformes puede variar en la etapa adulta, especies como P. puertoricensis Muchmore, 1967 y P. insulaeHoff, 1963 presentan cuatro sedas espiniformes en el margen prolateral de la pinza. De igual forma, es a fin a las especies P. johnstoni (Chamberlin, 1923), P. litoralisMahnert, 2014 y P. quirosiBedoya-Roqueme, 2015 por presentar una corta longitud en la pinza del pedipalpo (inferior a 0,95 mm). Finalmente, por la forma de los dientes triangulares e inclinados en el dedo fijo y los dientes basales, más pequeños y un poco aplanados en el dedo móvil es a fin a la especie P. quirosi Bedoya-Roqueme, 2015. Debido a que el espécimen es una tritoninfa, no se pudo llegar al nivel de especie, presenta notables diferencias y se necesita un adecuado número de especímenes adultos para establecer diferencias y validar su estatus taxonómico.
Familia Garypinidae
Serianus gratusHoff, 1964
Material examinado. COLOMBIA. Córdoba, Puerto Escondido, Isla Tortuguilla, [9°1' N; 76° W, 2 m.s.n.m.] 6 jul. 2013. E. Bedoya-Roqueme, 7♂, 9♀, (Depositados en LEUC; Ps-IT-006). COLOMBIA, Córdoba, Puerto Escondido, Isla Tortuguilla, [9°1'42.091'' N; 76°20'26.719'' W, 2 m.s.n.m.] 28 nov. 2015, E. Bedoya-Roqueme, 6♂, 5♀ (Depositados en LEUC; Ps-IT-007).
Distribución: Aruba, Belice, Bonaire, Colombia, Curazao, Estados Unidos, Jamaica, Venezuela (Harvey, 2013; Bedoya-Roqueme et al., 2017a).
Observación: Los ejemplares recolectados comparten con la especie la quetotaxia de los terguitos ♂, 4:4:4:4:4:8:8:8:8:8:4(2T):2; . ,4:4:4:4: 4:4:6:6:8:8:4(2T):2; el aspecto de la gálea con pocas ramificaciones bipinnadas y una rama lateral proximal a la base; la distribución de los tricobotrios it, ist, e isb formando un grupo cerca de la base del dedo y distales de ib, tricobotrios it e ist más cercanos al nivel de esb que al nivel de est, tricobotrio ib solitario y en posición basal distal de los otros tricobotrios, tricobotrios st y sb cercanos y pareados, sin presentar diferencias morfológicas evidentes.
Solinus corticola (Chamberlin, 1923)
Material examinado. COLOMBIA, Bolívar, Isla Fuerte, Sectores: El inglés, Latal, San Diego, [9°23'13'' N; 76°10'51.999'' W, 12 m.s.n.m.] 31may. 2014, E. Bedoya-Roqueme, 9♂, 5♀ (Depositados en LEUC; Ps-IF-001, Ps-IF-003). COLOMBIA, Bolívar, Isla Fuerte, Sectores: El inglés, Latal, San Diego, [9°23'13'' N; 76°10'51.999'' W, 12 m.s.n.m.] 16 abr. 2016, E. Bedoya-Roqueme, 8♂, 12♀ , (Depositados en LEUC; Ps-IF-006, Ps-IF-009).
Distribución: Colombia*, México (Harvey, 2013; Este estudio).
Observación: Todos los ejemplares examinados de Solinus corticola, poseen una corta seda táctil sobre el fémur del pedipalpo, ausente en los ejemplares tipo de las descripciones realizadas por Chamberlin (1923; 1930); sin embargo, los ejemplares comparten con la especie tipo la quetotaxia de los terguitos I-XII: ♂, 4:4:4:4:4:4:4:4:4:(4T):4(6T):2; ♀ ,4:4:4:4:4:4:6:6:4:(4T):4(6T):2; las medidas y la proporción del pedipalpo: trocánter 0,15-0,17/0,090,1 mm (♀, 0,17-0,18/0,12-0,13 mm), fémur ♂, 0,280,33/0,12-0,15 mm (♀ , 0,35-0,38/0,15-0,17 mm), patela ♂, 0,27-0,30/0,14-0,17 mm (♀, 0,31-0,34/0,17-0,19 mm); pinza ♂, 0,49-0,52/0,16-0,18 (♀, 0,62-0,68/0,2-0,22 mm); las distribución de los tricobotrios en los dedos de la pinza del pedipalpo y algunos otros caracteres taxonómicos que corresponden a la descripción de S. corticola efectuada por Chamberlin (1923; 1930).
Familia Lechytiidae
Lechytia chthoniiformis (Balzan, 1887).
Material examinado. COLOMBIA, Bolívar, Isla Fuerte, Sectores: El inglés, Latal, San Diego, [9°23'13'' N; 76°10'51.999'' W, 12 m.s.n.m.] 31 may. 2014, E. Bedoya-Roqueme, 4♂, 6♀ (Depositados en LEUC; Ps-IF-007).
COLOMBIA, Bolívar, Isla Fuerte, Sectores: El inglés, Latal, San Diego, [9°23'13'' N; 76°10'51.999'' W, 12 m.s.n.m.] 16 abr. 2016, 3♂, 5♀, (Depositados en LEUC; Ps-IF-011, Ps-IF-012). COLOMBIA, Córdoba, Puerto Escondido, Isla Tortuguilla, [9°1'42.091'' Norte y 76°20'26.719'' Oeste, 2 m.s.n.m.] 6 jul. 2013, E. Bedoya-Roqueme. 5♂, 7♀ , (Depositados en LEUC; PS-IT-001).
Distribución: Amplia distribución en Suramérica: Argentina, Brasil, Colombia, Chile, Ecuador, Jamaica, Paraguay, Perú (Harvey, 2013; Bedoya-Roqueme et al., 2014).
Observación: Los ejemplares recolectados tanto en Isla Fuerte como en Isla Tortuguilla pertenecen a esta especie, sin embargo, las diferencias en cuanto las medidas y proporciones pedipalpo: fémur ♂ 0,22/0,08 mm (♀ , 0,23/0,06 mm); patela: ♂ 0,15/0,07 mm (♀ , 0,2/0,06); pinza: ♂ 0,4/0,09 mm (♀, 0,41/0,13 mm); mano: ♂ 0,2/0,09 mm (♀, 0,22/0,13 mm); dedo móvil: ♀♂ 0,22/0,06; pueden atribuirse a la variación geográfica de las especies, sin presentar otras diferencias morfológicas evidentes.
Familia Olpiidae
Pachyolpium sp.1 Figuras 3G.
Material examinado. COLOMBIA, Bolívar, Isla Fuerte, Sectores: El inglés, Latal, San Diego, [9°23'13'' N; 76°10'51.999'' W, 12 m.s.n.m.] 31 may. 2014, E. Bedoya-Roqueme, 12♂, 17♀ (Depositados en LEUC; Ps-IF-007). COLOMBIA, Bolívar, Isla Fuerte, Sectores: El inglés, Latal, San Diego, [9°23'13'' N; 76°10'51.999'' W, 12 m.s.n.m.] 16 abr. 2016, E. Bedoya-Roqueme, 13♂, 18♀ (Depositados en LEUC: Ps-IF-013, Ps-IF-014, Ps-IF-015).
Pachyolpium sp.2
Material examinado. COLOMBIA, Córdoba, Puerto Escondido, Isla Tortuguilla, [9°1'42.091'' Norte y 76°20'26.719'' Oeste, 2 m.s.n.m.] 6 jul. 2013, E. Bedoya-Roqueme, 8♂, 15♀ (Depositados en LEUC; Ps-IT-002, Ps-IT-003, Ps-IT-004, Ps-IT-005).
Distribución: Amplia distribución en el nuevo mundo: Antigua y Barbuda, Argentina, Bermuda, Brasil, Belice, Colombia, Costa Rica, Estados Unidos, Republica Dominicana, Jamaica, Islas Caimán, Islas Vírgenes de Estados Unidos, Martinica, México, Panamá, Perú, Puerto Rico, Paraguay, San Vicente y las granadinas, Surinam, Venezuela (Harvey, 2013).
Observación: De acuerdo con la clave elaborada por Tooren (2011), los ejemplares recolectados no pueden asignarse fácilmente a un nivel especifico; Pachyolpium sp.1, se caracteriza por la proporción del pedipalpo: dedo móvil de la pinza ♂, 0,41-0,42 mm (♀, 0,46-0,50 mm); longitud/ anchura del fémur ♂, 3,4 veces (♀ , 2,4 veces), longitud/ anchura de la patela ♂, 2,11 veces (♀, 2,3 veces); longitud de la patela ♂, 0,21-0,23 mm (♀, 0,25-0,27 mm). Pachyolpium sp.2, se caracteriza por presentar un amplio radio ocular ♂, 0,08-0,09 mm (♀, 0,09-1,0 mm); longitud corporal ♂, 2,63-2,64 mm (♀ , 3,3-3,4 mm); proporción del pedipalpo: dedo móvil de la pinza S, 0,52-0,54 mm (♀, 0,56-0,57 mm); longitud/anchura del fémur ♂, 2,4 veces (♀ , 3,1 veces), longitud/anchura de la patela ♂, 1,92 veces (♀ , 2,5 veces); longitud de la patela ♂, 0,57-0,58 mm (♀, 0,65-0,67 mm). Debido a la complejidad de las especies y la variación presente en cada uno de los caracteres evaluados, parecen pertenecer a un grupo de especies no descritas, sin embargo, para establecer diferencias y validar su estatus taxonómico es necesario una mayor revisión.
Planctolpium arboreumHoff, 1964
Material examinado. COLOMBIA, Bolívar, Isla Fuerte, Sectores: El inglés, Latal, San Diego, [9°23'13'' N; 76°10'51.999'' W, 12 m.s.n.m.] 16 abr. 2016, E. Bedoya-Roqueme, 1 ♂, 2♀ (Depositados en LEUC; Ps-IF-002).
Distribución: Colombia, Jamaica, México, República Dominicana (Harvey, 2013; Bedoya-Roqueme et al., 2016).
Observación: Los ejemplares recolectados presentan diferencias con la descripción realizada para la especie en las medidas y proporciones pedipalpo: trocánter: ♂♀ , 0,19/0,12 mm; fémur: ♂, 0,42/0,13 mm (♀, 0,5/0,13); patela: ♂♀ , 0,42/0,13-0,16; pinza: ♂ 0,74/0,25 mm (♀ 0,79/0,25 mm); mano: ♂, 0,33/0,25 (♀ , 0,38/0,25); mano con pedicelo: ♂♀ 0,4 mm; sin embargo, comparte el radio ocular de ♂♀ , 0,05-0,06 mm siendo los anteriores más pequeños que los posteriores, sedas del cuerpo extremadamente cortas en forma de espinas muy difíciles de observar, la forma de la gálea no trífida, el rallum con dos laminas y la posición del Nodus ramosus al nivel del tricobotrio st en el dedo móvil y en el dedo fijo distal del tricobotrio et y al mismo nivel que el tricobotrio it y algunos otros caracteres taxonómicos.
DISCUSIÓN
La región insular de Colombia abarca una serie de islas ubicadas al norte y el occidente en el mar Caribe y Océano pacifico, cuyo origen y composición es diferente (IDEAM, 2010). Según su estructura y localización, pueden ser oceánicas o continentales; Isla Fuerte y Tortuguilla son islas continentales cercanas a la costa (IDEAM, 2010). Los pseudoescorpiones, son un grupo de arácnidos cuyo registro fósil más antiguo data de mediados del Devónico hace aproximadamente 390 millones de años (Schawaller et al., 1991; Judson, 2012; 2016 Harms y Dunlop, 2017). Durante la última glaciación el nivel del mar era más bajo que el actual, hubo una mayor amplitud del territorio continental y el área insular, es decir que Isla Fuerte y Tortuguilla hacían parte de los espacios continentales (IDEAM, 2010); los registros fósiles documentados del Caribe sugieren que varias familias (e.g. Chthoniidae, Cheiridiidae, Chernetidae, Lechytiidae, Pseudochiridiidae) han estado presentes en las zonas del Caribe al menos los últimos 20 millones de años (Judson, 1998; Cosgrove et al., 2016; Harms y Dunlop, 2017). Teniendo en cuenta la edad geológica estimada de las Islas, entre 5000 a 10000 años aproximadamente, localizadas cerca de la línea de costa en el Caribe Colombiano, emergidas por la orogenia y el glacioeutatismo durante el Holoceno (López-Victoria y Díaz, 2000; IDEAM, 2010); no se puede descartar una dispersión temprana de la fauna de pseudoescorpiones al separarse el territorio continental del área insular en la región Caribe de Colombia.
Actualmente hay 147 especies existentes de pseudoscorpiones, distribuidas en 47 géneros y 17 familias presentes en regiones y zonas insulares del Caribe (Harvey, 2013, Cosgrove et al., 2016). Las especies registradas en este estudio se convierten en la única fauna conocida de pseudoescorpiones en zonas insulares de Colombia, la cual incluye a nueve especies distribuidas en ocho géneros y seis familias. Isla fuerte presenta un área emergida de 2,9 km2 e Isla Tortuguilla de 0,1 km2 (Díaz et al., 2000, Estela, 2006); en este sentido, una mayor diversificación de hábitats, así como el tamaño de una isla representan el factor más importante para la riqueza de especies (Weygoldt, 1969; Mahnert, 2014; Cosgrove et al., 2016; Zaragoza, 2017).
La mayoría de las especies registradas, se distribuyen ampliamente por el Caribe y están presentes en ambientes marinos de la zona continental de Colombia (Weygoldt, 1969; Harvey, 2013; Bedoya et al., 2016; Cosgrove et al., 2016), lo que podría indicar una dispersión temprana, teniendo en cuenta la edad geológica estimada de las Islas, entre 5000 y 10000 años aproximadamente durante el Holoceno. Solo dos especies de las nueve reportadas tienen su distribución original en la zona continental de Suramérica y están presentes en Centroamérica y el Caribe, Lechytia chthoniiformis y Paratemnoides nidificator. Por tanto, se puede considerar que han sido introducidas por transporte de material (restos vegetales) por aves o por intervención humana en Isla Fuerte e Isla Tortuguilla, debido a que, en la zona continental de Colombia, L. chthoniiformis (excluida de la fauna de ambientes marinos por su amplia distribución en Suramérica) y P. nidificator han sido reportadas en ambientes marinos y zonas de bosques (Ceballos y Flores, 2007; Bedoya-Roqueme et al., 2014; Romero-Ortiz, 2015; Bedoya-Roqueme et al., 2016).
Cabe resaltar, que las especies L. chthoniiformis y P. nidificator presentan una amplia distribución en el continente americano (Aguiar y Bührnheim, 1992, Turienzo et al., 2010; Harvey, 2013). Sin embargo, presentaron un comportamiento particular; L. chthoniiformis se encontró asociada al suelo del bosque de mangle y cascajo de coral, mientras que P. nidificator se localizó presente en arboles de R. mangle, L. racemosa y C. erectus, lo cual sugiere, que se encuentran bien adaptadas y han colonizado los diferentes microhábitat tanto en Isla Fuerte como Isla Tortuguilla; en contraste, Mahnert (2014) registró para las Islas Galápagos (Ecuador) a L. chthoniiformis bien adaptada al archipiélago, presente en ocho islas y P. nidificator subsistiendo pero sin colonizar el archipiélago, lo cual se puede atribuir al origen y composición de las islas.
En Colombia, solo se conocen ocho especies presentes en ambientes marinos de las cuales, Epactiochernes insularum y Paraliochthonius quirosi se consideran halófilas y exclusiva de estos ambientes (Harvey, 2009; Bedoya-Roqueme et al., 2016; Bedoya-Roqueme et al., 2017a). Tanto en Isla Fuerte como en Isla Tortuguilla, E. insularum se encontró asociada al cascajo de coral, comportamiento similar al exhibido en bosques de mangle del departamento de Córdoba, siendo críptico y asociado a los restos de coral (Bedoya-Roqueme et al., 2016). Sin embargo, no se pude descartar la dispersión por foresia registrada en otros géneros y especies de Chernetidae (Muchmore, 1971; Aguiar y Bührnheim, 1998; 2011; Poinar et al., 1998). Mientras que Paraliochthonius sp., solo se encontró en Isla Tortuguilla asociada al suelo y al cascajo de coral en la duna de arena; el género halófilo Paraliochthonius Beier, se encuentra bien extendido en la línea de costa de diferentes regiones y zonas del caribe, tanto continentales como zonas insulares (Weygoldt, 1969; Harvey, 2009; 2013; Cosgrove etal., 2016). Por tanto, teniendo en cuenta la cercanía de la isla a la costa continental, puede estar utilizando como mecanismo de dispersión el transporte marítimo (rafting) por troncos y maleza a la deriva tras tormentas o arrastre fluvial.
Los otros géneros y especies se han registrado en diferentes microhábitats desde la zona litoral al interior de las zonas insulares, en hojarasca, corteza de A. germinans, R. mangle, L. racemosa, C. erectus y troncos en descomposición, lo cual, parece indicar que se encuentran bien adaptadas a la zona litoral y los ambientes marinos, para el caso de las especies de Garypinidae Serianus gratus presenta una amplía distribución en la región costera; sin embargo, nunca se había registrado en ambientes marinos y costeros (Hoff, 1964; Muchmore, 1977; 1979; Tooren, 2002; 2004). Sin embargo, recientemente se registró a esta especie, asociada de la corteza de árboles de R. mangle en las zonas inundables del manglar (Bedoya-Roqueme et al., 2016; Bedoya-Roqueme et al., 2017a), comportamiento similar observado para esta especie en Isla Tortuguilla. En contraste, Serianus litoralis (Chamberlin, 1923) y Serianus carolinensis Muchmore, 1968, se ubican en la zona de duna de arena y supralitoral de la costa (Weygoldt, 1969; Lee, 1979). Representantes del género Solinus Chamberlin, se encuentran distribuidos en varias regiones (Harvey, 2013); en el nuevo mundo, solo se conoce la especie S. corticola (Chamberlin, 1923) que ha sido registrada para la costa oeste de Baja California Sur (México), asociado a corteza de árboles, en Isla Fuerte se encontró asociada a corteza de R. mangle en la zona litoral, siendo reportada por primera vez en Colombia, la cual parece estar bien adaptada a los ambientes marinos y ecosistemas de manglar.
La familia Olpiidae, es un grupo de pseudoscorpiones en su mayoría neotropicales, que han penetrado a desiertos y otras zonas áridas de las regiones neárticas y paleárticas (Weygoldt, 1969; Lee, 1979; Harvey, 2013). De igual forma, se encuentran bien distribuidos con una alta diversidad en las zonas continentales e insulares del Caribe presentes en ambientes xéricos (Weygoldt, 1969; Harvey, 2013; Cosgrove et al., 2016). Estudios recientes han demostrado grupos de islas polifiléticas en especies del género Pachyolpium, es decir, múltiples eventos de dispersión (Cosgrove et al., 2016). En Colombia, solo se conocen las especies P. granulatum Beier, 1954 y P. isolatum (R.V. Chamberlin, 1925), esta última reportada en la hojarasca de bosques de manglar y reportes aislados de la presencia del género (Ceballos y Flórez, 2007; Romero-Ortiz, 2015; Bedoya-Roqueme et al., 2016, Bedoya-Roqueme et al., 2017b). Se registran dos especies en zonas insulares una en Isla Fuerte y la otra en Isla Tortuguilla, las cuales, están a 43,3 Km de distancia entre sí y a 11 y 9 Km respectivamente de la costa continental, por tanto, se puede considerar la foresia el factor que facilitó la dispersión y diversificación de este género y su presencia en zonas insulares, el único vector probable sería las aves migratorias endémicas de cada zona, sin embargo, no pueden descartarse los insectos, que constituyen los principales vectores en la foresia (Poinar et al., 1998; Turienzo et al., 2010). En este sentido, el limitado número de especies de pseudoescorpiones presentes en las dos islas evaluadas y la oferta de alimento, pudo haber asegurado el éxito de colonización de estos microhábitats y se pude considerar la tolerancia a los cambios de ambiente reportados en especies de Pachyolpium (Aguiar et al., 2006). Sin embargo, muestreos más completos permitirán inferir la verdadera historia biogeográfica de los olpiidos en el Caribe (Cosgrove et al., 2016).
En contraste, Planctolpium es un género que se encuentra distribuido desde México hasta algunas zonas insulares del Caribe y su rango altitudinal, va desde el nivel del mar hasta los 3200 m.s.n.m. (Hoff, 1964; Muchmore, 1979). Recientemente, se detectó la presencia de la especie P. arboreum asociado a bosques de manglar, la cual, nunca se había registrado en ambientes marinos y costeros (Bedoya-Roqueme et al., 2016). En Isla Fuerte, P. arboreum exhibió un comportamiento similar asociada a corteza de troncos en descomposición, a pesar de esto, el bajo número de registros y la poca frecuencia de colecta sugiere que esta especie no se encuentran bien adaptada y las condiciones del microhábitat son insuficientes, por tanto, su presencia se puede asociar con una dispersión por intervención antrópica, asimismo, por las cercanías de la Isla con la costa continental del departamento de Córdoba, una dispersión por transporte marítimo y arrastre fluvial de material vegetal (rafting) no puede ser descartada para esta especie.
CONCLUSIONES
Los presentes resultados, sugieren una alta diversidad y una gran riqueza de especies de pseudoscorpiones presentes en el sistema insular de Colombia, se reporta por primera vez el género Solinus y se amplía la distribución conocida de S. corticola hacia Colombia; de igual forma, se puede considerar la adaptación de las especies a los diferentes microhábitats que ofrecen las dos Islas evaluadas (excepto P. arboreum), es decir, la oferta de alimento, la tolerancia a los cambio de ambientes, han permitido colonizar estas zonas; asimismo, se sugiere que el transporte marítimo o arrastre fluvial de material vegetal, así como, la foresia permitieron la dispersión de estos géneros y especies hacia las zonas insulares; por tanto, mayor intensidad de muestreo en las diferentes zonas insulares del Caribe colombiano, permitirá conocer la fauna de pseudoscorpiones presentes y dilucidar como se distribuyeron de la zona continental a los sistemas insulares frente a la costa colombiana.















