Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Agronomía Colombiana
Print version ISSN 0120-9965
Agron. colomb. vol.26 no.1 Bogotá Jan./June 2008
Luz Yineth Ortiz1 y Víctor Julio Flórez2
1 Programa de Maestría en Ciencias Agrarias, Facultad de Agronomía, Universidad Nacional de Colombia, Bogotá. luzyinethortiz@yahoo.com.es
2 Profesor asociado, Facultad de Agronomía, Universidad Nacional de Colombia, Bogotá. vjflorezr@unal.edu.co
Fecha de recepción: diciembre 22 de 2007. Aceptado para publicación: abril 9 de 2008
RESUMEN
De las 30 variedades de papa cultivadas en Colombia tan solo 10 poseen importancia comercial. Entre otros factores, este número es limitado por la acción de hormonas endógenas que aceleran diferentes fases del proceso de tuberización, especialmente en las especies más precoces. En este trabajo fueron recolectadas muestras de tubérculos de diferentes especies de papa (Solanum tuberosum L. var. ICA-Única y Tuquerreña, y Solanum phureja Juz. et Buk. var. Yema de Huevo), en los estadios fenológicos de desarrollo 03, 10 y 40. Posteriormente, las concentraciones de ácido abscísico (ABA) presentes en la fracción ácida y de citoquininas presentes en la fracción orgánica de los extractos fueron determinadas a través de Cromatografía Líquida de Alta Eficiencia. Los resultados en las variedades estudiadas relacionan la precocidad de la tuberización con la ausencia de ABA y los periodos de mayor latencia con su presencia; por otro lado, las concentraciones de citoquininas fueron evidentes en las variedades con mayor precocidad. Es decir, en S. phureja Juz. et Buk. var. Yema de Huevo se encontraron concentraciones bajas de ABA y altas de citoquininas; mientras que en ICA-Única y, en especial, en Tuquerreña, variedades con periodos de latencia mayor, las concentraciones de ABA fueron altas y las de citoquininas menos significativas.
Palabras clave: fitorreguladores, papa, Clae.
ABSTRACT
Of all 30 potato varieties cultivated in Colombia only 10 possess a commercial importance. Among other factors, this number is limited by the action of endogenous hormones that accelerate different phases of tuberization process, especially in the earliest species. In this work, the samples of tubers from different potato species Solanum tuberosum L. vars. ICA-Unica, Tuquerreña and Solanum phureja Juz. et Buk. var. Yema de Huevo were collected at the phenological stages of development 03, 10 and 40. Later, the concentrations of abscisic acid in the acid fraction and ones of cytokinins in the organic fraction of the extracts were determined by high performance liquid chromatography. The results in studied varieties show a relationship between the early tuberization and ABA absence, while the periods of deep latency were related with ABA presence; otherwise, the cytokinin levels were high in the varieties with early tuberization. That is to say, it was found in S. phureja Juz. et Buk. var. Yema de Huevo, characterized by early tuberization, low ABA concentrations and considerable levels of cytokinins, whereas, in varieties with periods of prolonged latency, such as ICA-Unica and, especially, Tuquerreña, ABA concentrations were considerable, but those of cytokinin not.
Key words: phytoregulators, potato, HPLC.
Introducción
Entre las etapas de desarrollo del ciclo de la papa se encuentra el proceso de tuberización. Este es regulado por las características propias de la variedad, la edad de la semilla, la temperatura del suelo, la humedad, la nutrición, la intensidad y duración de la luz (favorecido en días cortos), la acción de fitorreguladores y por la incidencia de plagas y enfermedades. Todos estos factores, además de afectar el cultivo, influyen directamente en su rentabilidad.
Ghassan et al. (2000) consideran el inicio de la tuberización a partir del ensanchamiento de los estolones. Este proceso ocurre, dependiendo de la precocidad de la variedad, entre 5 y 7 semanas después de la siembra. Durante esta etapa, los asimilados producidos por el follaje son utilizados para el crecimiento del estolón e iniciación de la tuberización. Inicialmente una planta puede formar entre 20 y 30 tubérculos, de los cuales, entre 5 y 15 estarán maduros al momento de la cosecha.
El ácido abscísico (ABA) es un fitorregulador tradicionalmente asociado con el desarrollo de semillas, adaptación a condiciones de estrés y con el metabolismo de azúcares (Schwartz y Zeevaart, 2004). Suttle y Hulstrand (1994) demostraron que el ABA endógeno es esencial para la iniciación y conservación del tubérculo. Al respecto, Coleman y King (1984) y Suttle (1996) mostraron que las concentraciones de ABA disminuyen al final de la dormancia, sin embargo, se desconocen las concentraciones de ABA necesarias para el inicio del crecimiento del brote.
El proceso de la tuberización puede controlarse modificando el aporte de nitrógeno a la planta. Se sabe que este nutriente no afecta la inducción de la tuberización, pero sí inhibe la formación del tubérculo después de que la inducción se ha producido. Se desconocen los mecanismos de esta inhibición, sin embargo, no se descarta la participación de las relaciones entre giberelinas (GAs/ABA) y entre nitrógeno/carbohidratos. De esta última, se señala que niveles altos de carbohidratos con relación al contenido de nitrógeno promoverían el proceso. Otro factor determinante para la tuberización es la temperatura: condiciones entre los 15 y los 18 ºC favorecen el proceso, mientras que en condiciones con valores mayores se presenta un alto grado de inhibición, aun más en fotoperiodos largos. El efecto negativo de la temperatura sobre la tuberización es diferente de acuerdo al lugar de recepción del estímulo; así, cuando el dosel se somete al aumento de temperatura, la tuberización se afecta severamente, fenómeno quizás asociado con el aumento de las concentraciones de GAs en las zonas meristemáticas. Por otro lado, si el estímulo se aplica en el sustrato, no se previene la acción de la señal inductora de tuberización, pero sí se atrasa la formación del tubérculo (Jackson, 1999).
Con relación a los fitorreguladores, se sabe que el contenido de GA4/7 promueve la elongación del estolón e inhibe la formación del tubérculo; contrariamente, el ABA exógeno reduce la longitud del estolón. Por su parte, el ácido indol-3- acético (AIA) inhibe la elongación de los estolones estimulando la formación de tubérculos pequeños, mientras que las concentraciones endógenas de ABA disminuyen durante la formación del estolón y el desarrollo del tubérculo. Finalmente, las citoquininas exógenas parecen no afectar ni la elongación ni la formación del tubérculo (Xu et al., 1998); sin embargo, la rapidez del proceso de tuberización en especies precoces estaría relacionada con sus concentraciones endógenas (García-Flórez et al., 2007).
Con base en estudios locales previos (Flórez-Roncancio et al., 2000a y Flórez-Roncancio et al., 2000b) y de otras latitudes (Ewing, 1995; Xu et al., 1998; Suttle y Hulstrand, 1994; Coleman y King, 1984; Suttle, 1996; Suttle, 2001; Suttle y Banowez, 2000, y Kannangara et al., 1978) se puede aseverar que uno o más fitorreguladores están involucrados en el proceso de tuberización. Se ha determinado la posible presencia de auxinas, giberelinas, citoquininas y ácido abscísico por bioensayos utilizando la técnica de cromatografía de capa fina. Sin embargo, en nuestras condiciones y en las variedades objeto del presente estudio no se tienen reportes precisos de las concentraciones de estos compuestos. La cuantificación de dichos fitorreguladores por cromatografía líquida de alta eficiencia (Clae) en especies precoces y tardías permitirá confirmar la información previa obtenida por bioensayos y conocer de forma más precisa la participación de ABA y de citoquininas en la formación del tubérculo.
El objetivo de este trabajo fue cuantificar las concentraciones de ABA y de citoquininas por Clae en estadios predeterminados, durante el proceso de la tuberización en especies de papa con precocidad opuesta Solanum phureja Juz. et Buk. variedad Yema de Huevo y Solanum tuberosum L. variedades ICA-Única y Tuquerreña.
Material y métodos
El trabajo de campo se realizó en condiciones de invernadero de casa de mallas del Centro de Investigaciones Tibaitatá de Corpoica, ubicado en el municipio de Mosquera (Cundinamarca), a 2.550 msnm, con temperatura promedio anual de 14 ºC, 675 mm anuales de precipitación y una humedad relativa del 80%. Su ubicación geográfica es de 4º 42' latitud norte y 72º 12' longitud oeste. La parte analítica se desarrolló en el Laboratorio de Nutrición Animal de Corpoica.
Se utilizaron plantas de S. phureja Juz. et Buk. var. Yema de Huevo y de S. tuberosum L. vars. ICA-Única y Tuquerreña, en los siguientes estadios, según Hack et al. (1993): 03 - tubérculos en final de latencia y con brotes 2 a 3 mm de longitud; 10 - expansión foliar de las primeras hojas; y 40 - inicio de la tuberización: hinchamiento de las puntas de los primeros estolones al doble del diámetro inicial.
Extracción de fitohormonas
Para la extracción y fraccionamiento del extracto se utilizó la metodología previamente establecida por Flórez-Roncancio et al. (2000a). Se colectaron 2,5 g de masa fresca vegetal para luego macerarlas con una solución acuosa de MeOH 80% acidificado + BTH (hidroxitolueno butilado). Después de 24 horas en la oscuridad a 4 ºC y con agitación continua, se procedió a la remoción del metanol en evaporador rotativo a temperatura de 40 ºC; posteriormente, se retomó el filtrado en volumen conocido de tampón fosfato pH 8,0 para luego ser lavado con una solución de acetato de plomo 4% más ácido acético 0,5%. Después de cada lavado se filtró la solución, recolectándose la fracción orgánica de esta y se lavó tres veces con igual volumen de carbonato de sodio 5%. Al filtrado obtenido se le adicionó polivinilpirrolidona (PVP) 50 mg·L-1 de volumen original de la muestra y se filtró nuevamente. La solución obtenida fue ajustada a pH de 2,5 a 3,0 con ácido clorhídrico y se procedió a lavar la muestra tres veces con acetato de etilo. Por último se recolectaron las fracciones orgánica y acuosa.
Para la detección del ácido abscísico, contenido dentro de la fracción orgánica, se procedió a lavar esta fracción tres veces con bicarbonato de sodio 5% y se recolectó la fracción acuosa (Flórez et al., 2000b). Esta fracción fue acidificada a pH 3 y posteriormente lavada tres veces con acetato de etilo; se concentró hasta sequedad en un rotavapor y se retomó en volumen conocido de 2 mL de metanol grado Clae.
Para la detección de citoquininas, la fracción acuosa se llevó a pH 7 con bicarbonato de sodio 5% y se lavó tres veces con n-butanol, y se concentró en un rotavapor retomando a volumen conocido de 2 mL en metanol grado Clae (Flórez et al., 2000a).
Cromatografía líquida de alta eficiencia (Clae)
Para la cuantificación de trans zeatina ribósido (ZR), trans zeatina (Z), 6-dimetil aminopurina ribósido (iPA), 6-dimetilaminopurina (iP), kinetina (K), 6- benzilaminopurina (6BAP) y de ABA por Clae en las variedades de papa en estudio se adaptó un protocolo producto de metodologías descritas por Rodríguez et al. (1997), Flórez-Roncancio y Pereira (2008), Andersen y Kemp, (1998), Sweetser y Vatvars (1975) y Guinn et al. (1986). La separación se logró con una columna RP C-18, fase móvil de metanol-agua (40:60, v/v) acidulada (ácido acético 5%) y velocidad de flujo de 0,8 mL·min-1. La fase móvil se desgasificó y se filtró (0,22 μm) antes de su uso. El volumen de inyección fue de 20 μL con detección en λ=280 nm y λ=254 nm para citoquininas y ácido abscísico, respectivamente. Se utilizó un cromatógrafo para Clae marca Hittachi con controlador L5000LC, integrador 833A y detector UV, y una columna C18 250 mm x 4 mm (5 µm).
Se realizaron las curvas de calibración de 20 μM a 100 μM detectando los picos con sus respectivos tiempos y áreas en cada concentración para las fitohormonas antes mencionadas. Los extractos obtenidos se pasaron por microfiltros de 0,40 µm, 0,2 µm y a través de un Sep-Pak C18 (3 µm para 3 mL), para su posterior inyección en el cromatógrafo.
Los datos obtenidos fueron analizados estadísticamente con la prueba t, a una significancia de 5%.
Resultados y discusión
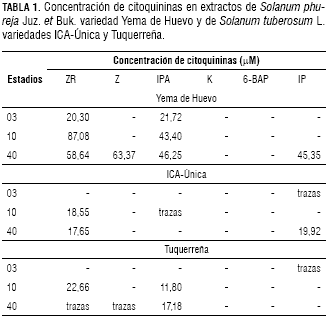
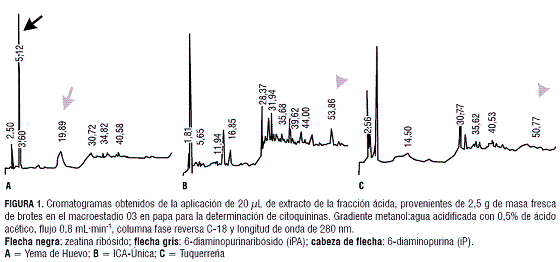
Macroestadio 03

Macroestadio 10
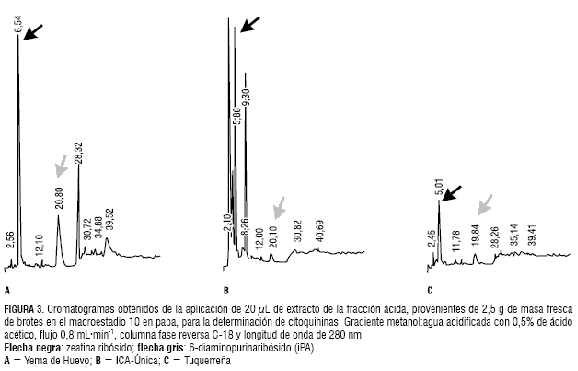
En el macroestadio 10, caracterizado por la expansión de las primeras hojas, se observan en el cromatograma correspondiente al extracto de la var. Yema de Huevo picos que corresponden a las citoquininas ZR e iPA (figura 3a). De forma similar, se observan los picos de ZR e iPA en las variedades ICA-Única y Tuquerreña (figura 3). Con respecto al estadio 03, se constató un aumento en las concentraciones de ZR e iPA en S. phureja Juz. et Buk. y en S. tuberosum L.; presentándose en orden decreciente en las variedades Yema de Huevo, ICA-Única y Tuquerreña (tabla 1).
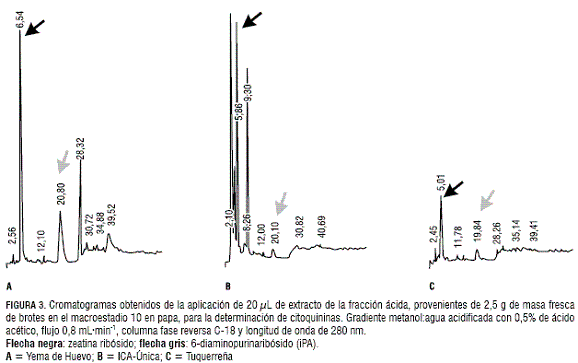
Por otro lado, la mayor concentración de ABA fue detectada en los extractos de Tuquerreña (figura 4); y, en menor concentración, en la var. ICA-Única (figura 4). Por el contrario, Yema de Huevo (figura 4) no presentó picos que indiquen la presencia de este fitorregulador. La tabla 2 muestra las concentraciones de ABA en las diferentes variedades.
Macroestadio 40
En el macroestadio 40, cuando se inicia el llenado de los tubérculos, la concentración de citoquininas (ZR, Z, iP e iPA) aumenta en Yema de Huevo (figura 5 y tabla 1). En ICA-Única también aumenta esta clase hormonal, evidenciándose Z e iP (figura 5). Así mismo, Tuquerreña presenta un cromatograma con picos de ZR, Z e iPA (figura 5).
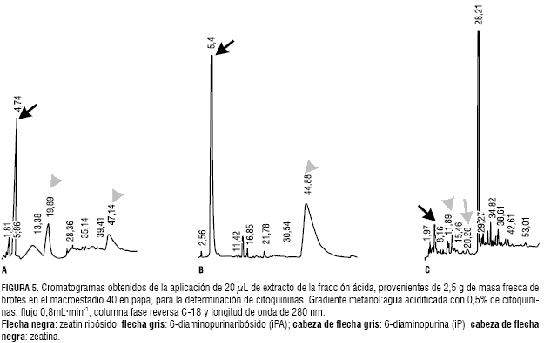
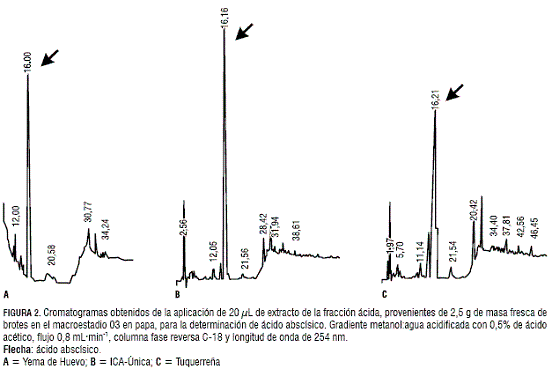
Las concentraciones de ABA fueron representativas en la variedad Tuquerreña (figura 6), mientras que en las otras variedades esta fitohormona no fue detectada (figura 6 y tabla 2).
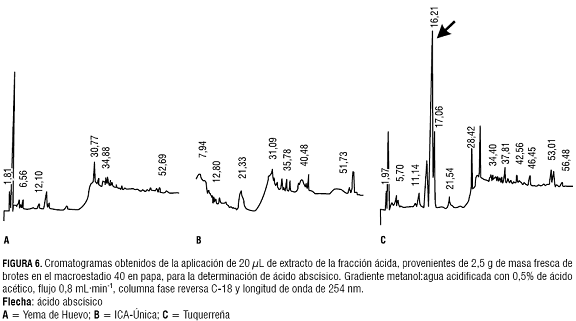
El ABA se encuentra presente en el estadio de latencia, definida por Jackson (1999) como la ausencia de germinación en condiciones ambientales que la promueven. En plantas de papa, al iniciarse la formación de brotes los niveles de ABA disminuyen; sin embargo, en la variedad Tuquerreña todavía se presentan concentraciones altas de ABA, posiblemente por tratarse de una variedad tardía. Esta variedad presenta un lento desarrollo de las primeras hojas, en contraste con lo que ocurre en la var. Yema de Huevo. Dentro de los factores más influyentes que afectan la tuberización se encuentra: el nivel de nitrógeno, la acción de fitorreguladores, la temperatura y la radiación fotosintéticamente activa. A pesar de que estos factores muestran consistencia en sus efectos, es importante considerar también que la variación en la respuesta a dichos estímulos depende del genotipo, edad y estadio fisiológico de la planta (Jackson, 1999).
El estudio del control hormonal del proceso de tuberización ha demostrado la participación de las GAs en el crecimiento y desarrollo morfológico del tubérculo. Se estableció claramente la relación entre inducción de la tuberización y disminución de actividad de GAs, al retardar el inicio de la tuberización después de la aplicación de ácido giberélico a brotes, estolones y tubérculos de papa (Xu et al., 1998). Por otro lado, las citoquininas también participan en el proceso y se conoce que la razón entre las concentraciones de citoquininas:auxinas es importante para promover la tuberización (Guivarc et al., 2002; Rosin et al., 2003; Sergeeva et al., 2000), que se ve claramente favorecida con el aumento de la concentración de citoquininas en especies precoces (García-Flórez et al., 2007).
La acción del ABA por lo general está relacionada con procesos inhibitorios; no obstante, recientemente se evidenció su presencia en tejidos en desarrollo, donde tendría una acción promotora (Peng et al., 2006). En el proceso de tuberización participa en la latencia de yemas o inhibe la formación de estolones.
El estudio realizado permite visualizar que el ABA participa en el proceso de tuberización inhibiendo el crecimiento de yemas y retardando la formación de estolones dependiendo de la variedad de S. tuberosum.
La presencia de ABA en la variedad Yema de Huevo se constató sólo en el estadio 03 y en la var. ICA-Única en los estadios 03 y 10. La variedad Tuquerreña, además de presentar ABA en los tres estadios analizados, mostró las concentraciones más altas (tabla 1). Este orden de concentraciones decrecientes de ABA entre las tres variedades ratifican la hipótesis hormonal citoquininas:ABA en relación con la dormancia en las yemas del tubérculo de papa. Así, las concentraciones altas de ABA serían las responsables de que las variedades ICA-Única y Tuquerreña sean de precocidad medianamente tardía y tardía, respectivamente.
En el presente estudio, las concentraciones de ABA en el proceso de tuberización de papa relacionan la inhibición o la no formación temprana de brotes y estolones con las características tardías y precoces de las respectivas variedades.
Este trabajo proporciona nuevos indicios de la relación citoquininas:ABA con la tuberización. Se sugiere que además de la participación de las citoquininas en el inicio del proceso, donde el crecimiento longitudinal de los estolones continúa con el desarrollo de la planta, el ABA puede controlar la longitud de los estolones impidiendo un desarrollo rápido. Así, la duración de este proceso inicial de desarrollo es dependiente de las características de precocidad de cada variedad.
Literatura citada
Andersen, R.A. y T.R. Kemp. 1998. Reversed-phase high performance liquid chromatography of several plant cell division factors (cytokinins) and their cis and trans isomers. J. Chromatogr. 172, 509-512. [ Links ]
Coleman, W.K. y R.R. King. 1984. Changes in endogenous abscisic acid soluble sugar and proline levels during tuber dormancy in Solanum tuberosum L. Amer. Potato J. 61, 437-449. [ Links ]
Ewing, E.E. 1995. The role of hormones in potato (Solanum tuberosum L.) tuberization. pp. 698-720. En: Davies, P.J. (ed.). Plant hormones, physiology, biochemistry and molecular biology. Second edition, Kluwer Academic Publishers, Dordrecht. [ Links ]
Flórez-Roncancio, V.J. y M.F. Aleixo Pereira. 2008. Concentraciones opuestas de AIA-ABA aceleran el desarrollo floral de Solidago x luteus. Agron. Colomb. 26(2) (en imprenta). [ Links ]
Flórez-Roncancio, V.J., L.Y. Ortiz-Rojas, M. García-Flórez y A. Pórtela-Ramírez. 2000a. Análisis de citoquininas en la tuberización de dos especies de papa (Solanum tuberosum L. y Solanum phureja Juz. et Buk.). Memorias XXX Congreso Anual Comalfi, Ibagué. 71 p. [ Links ]
Flórez-Roncancio, V.J., L.Y. Ortiz-Rojas, J.A. Machett's P. y M.H. Casas-Aldana. 2000b. Cuantificación de ácido abscísico (ABA) en el proceso de tuberización en dos especies de papa (Solanum tuberosum L. y Solanum phureja Juz. et Buk.). Memorias XXX Congreso Anual Comalfi, Ibagué. 71p. [ Links ]
García-Flórez, M., A. Portela-Ramírez y V.J. Flórez-Roncancio. 2007. Sustancias con actividad citoquinínica estimulan la brotación de yemas en tubérculos de papa. (sometido para publicación en Bragantia). [ Links ]
Ghassan, Al S., R. Sully y H. Hopkins. 2000. Ways to increase tuber number. Australian Potato Research. Development and Technology Transfer Conference. Adelaide. [ Links ]
Guinn, G., D.L. Brummett y R.C. Beier. 1986. Purification and measurement of abscisic acid and indoleacetic acid by high performance liquid chromatography. Plant Physiol. 81, 997-1002. [ Links ]
Guivarc, H.A., J. Rembur, M. Goetz, T. Roitsch, M. Noin, T. Scnmulling y D. Chriqui. 2002. Local expression of the ipt gene in transgenic tobacco (Nicotiana tabacum L. cv. SR1) axillary buds establishes a role for cytokinins in tuberization and sink formation. J. Exp. Bot. 53, 621-629. [ Links ]
Hack, V.H., H. Gall, T.H. Klemke, R. Klose, U. Meier, R. Staub y A. Witzenberger. 1993. Phänologische Entwicklungsstadien der Kartoffel (Solanum tuberosum L.). Nachrichtenblatt Deutscher Pflanzenschutzdienst (Stuttgart) 45, 11-19. [ Links ]
Jackson, S.D. 1999. Multiple signalling pathways control tuber induction in potato. Plant Physiol. 119, 1-8. [ Links ]
Kannangara, T., R.C. Durley y G.M. Simpson. 1978. High performance liquid chromatographic analysis of cytokinins in Sorghum bicolor leaves. Physiol. Plant. 44 (3), 295-299. [ Links ]
Peng Y.B., C. Zou, D.H. Wang, H.Q. Gong, Z.H. Xu y S.N Bai. 2006. Preferential localization of abscisic acid in primordial and nursing cells of reproductive organs of Arabidopsis and cucumber. New Phytol. 170, 459-66. [ Links ]
Rodríguez, R., J. Sánchez y O. González. 1997. Empleo de reguladores del crecimiento en la adaptación de vitroplantas y estacas de Ixora Coccinea cv. Guillermina. Agrícola Verge 190, 555-558. [ Links ]
Rosin, F.M., J.K. Hart, H. Van Onckelen y D.J. Hannapel. 2003. Suppression of a vegetative MADS box gene of potato activates axillary meristem development. Plant Physiol. 131, 1613-1622. [ Links ]
Schwartz S.H y J.A.D. Zevevaart. 2004. Abscisic acid biosynthesis and metabolism. pp. 137-155. En: Davies P.J. (ed.). Plant hormones biosynthesis, signal transduction, action! Kluwer Academic Publ., Dordrecht. [ Links ]
Sergeeva L.I., S.M. de Bruy'n, K. Eam-Gronsveld, O. Navratil, y D. Vreugdenhil. 2000. Tuber morphology and starch accumulation are independent phenomena: Evidence from ipi-transgenic potato lines. Physiol. Plant. 108, 435-443. [ Links ]
Suttle J.C. 1996. Dormancy in tuberous organs: problems and perspectives. pp. 133-143. En: G.A. Lang (ed.). Plant dormancy: physiology, biochemistry and molecular biology, CAB International, Wallingford. [ Links ]
Suttle, J.C. 1998. Postharvest changes in endogenous cytokinins and cytokinin efficacy in potato tubers in relation to bud endodormancy. Physiol. Plant. 103, 59-69. [ Links ]
Suttle, J.C. 2001. Dormancy related changes in cytokinin efficacy and metabolism in potato tubers during postharvest storage. J. Plant Growth Regul. 35, 199-206. [ Links ]
Suttle, J.C. y G.M. Banowez. 2000. Changes in cis-zeatin and cis-zeatin riboside levels and biological activity during potato tuber dormancy. Physiol. Plant. 109, 68-74. [ Links ]
Suttle, J.C. y J.F. Hulstrand. 1994. Role the endogenous abscisic acid in potato microtuber dormancy. Plant Physiol. 105, 891-896. [ Links ]
Sweetser, P.B. y A. Vatvars. 1975. High-performance liquid chromatographic analysis of abscisic acid in plant extracts. Ann. Biochem. 71, 68-78. [ Links ]
Xu, X., A. Van Lammeren, E. Vermeer y D. Vreugdenhil. 1998. The role of gibberellin, abscisic acid, and sucrose in the regulation of potato tuber formation in vitro. Plant Physiol. 117, 575-584. [ Links ]














